扩展功能
文章信息
- 王春萌, 李贺, 张志鹰, 李男男, 赵聪, 洪丽华, 张志民
- WANG Chunmeng, LI He, ZHANG Zhiying, LI Nannan, ZHAO Cong, HONG Lihua, ZHANG Zhimin
- 不同粘结条件下健康成人牙本质中MMP-2和MMP-9表达水平及其意义
- Expression levels of MMP-2 and MMP-9 in dentin of healthy adults under different bonding conditions and their significances
- 吉林大学学报(医学版), 2018, 44(06): 1179-1184
- Journal of Jilin University (Medicine Edition), 2018, 44(06): 1179-1184
- 10.13481/j.1671-587x.20180612
-
文章历史
- 收稿日期: 2018-05-05
2. 吉林大学口腔医院口腔预防科, 吉林 长春 130021
2. Department of Preventive Dentistry, Stomatology Hospital, Jilin University, Changchun 130021, China
在牙体疾病的治疗中,将粘结树脂在处理过的牙体组织上粘结修复成形或者将修复体粘结固定是最常见的治疗方法之一。然而,由于牙本质自身结构和口腔环境的复杂性,如牙体本身所承担的应力、口腔内温度、口腔内菌群的影响以及酶的作用等,随着修复时间的延长,牙本质-树脂粘结界面所形成的混合层被破坏,导致牙本质粘结失败[1-2]。研究[3]表明:在牙本质的有机质形成过程中,基质金属蛋白酶(matrix metalloproteinases, MMPs)起重要的调节作用。在人牙本质基质中主要包含MMP-2、MMP-3、MMP-8、MMP-9和MMP-20等, 其中MMP-2和MMP-9在人健康牙本质以及伴有龋坏的牙本质中以不同形式广泛存在且水平较高[3-6],研究[7]表明:在自酸蚀粘结以及全酸蚀粘结中,MMP-2和MMP-9可能参与了粘结界面混合层中裸露胶原的降解,从而减弱了粘结效果。因而使用MMPs抑制剂保护混合层的完整性和维持粘结强度成为牙本质粘结研究的热点[8-9]。
氯己定(chlorhexidine,CHX)是目前研究最为广泛的MMPs抑制剂[10],CHX能通过螯合作用结合钙、锌离子,抑制MMPs催化区域的活性,避免其降解胶原[11]。四环素类作为一种有效的MMPs抑制剂,不仅具有针对锌离子的螯合作用,还能降低MMP mRNA的表达[12]。本课题组前期实验[13]结果也表明:CHX和四环素半合成类似物米诺环素(minocycline,MI)对于牙本质粘结的预处理均能够使牙本质粘结界面形成更加均匀、致密、稳定的混合层,改善牙本质粘结的耐久性。目前国内外关于牙本质粘结中MMPs抑制剂的研究[14-16]大多局限于牙本质的形态表现和力学方面,尚无研究应用抑制剂后牙本质粘结中MMP-2和MMP-9的活性变化。本实验利用明胶酶谱法,探讨CHX和MI抑制剂作用后以及不同粘结方法下MMPs在牙本质中的表达情况。
1 材料与方法 1.1 实验材料和主要试剂收集本院新鲜拔除的成人健康第三磨牙20颗,无龋坏,无牙体缺损,无充填物,无牙周病,无釉质发育不良,根尖孔闭合完全。拔除后以生理盐水冲洗,-80℃保存并在1个月内使用。所有实验用牙齿均经患者知情同意并获吉林大学口腔医学会伦理委员会批准。MMPs抑制剂CHX购自武汉远程共创科技有限公司,MI购自美国Sigma公司。自酸蚀粘结剂:3M通用粘结剂即Single Bond Universal(美国3M公司);全酸蚀粘结系统:35%磷酸凝胶(美国SCI-PHARM公司)+ Adpter Single Bond 2(美国3M公司)。
1.2 实验分组 1.2.1 自酸蚀粘结剂实验分组以未处理的矿化牙本质粉作为阴性对照组,以10%磷酸溶液处理的牙本质粉为作为阳性对照组,以仅使用Single Bond Universal处理的牙本质粉作为空白对照组;分别加入CHX和MI作为CHX预处理组和MI预处理组;在Single Bond Universal粘结牙本质后使用10%次氯酸钠老化处理,作为空白老化对照组,并在此基础上加入CHX和MI作为CHX预处理老化组和MI预处理老化组。
1.2.2 全酸蚀粘结剂实验分组以未处理的矿化牙本质粉作为阴性对照组,以10%磷酸溶液和35%磷酸凝胶处理的脱矿牙本质粉分别作为阳性对照1组和阳性对照2组,以仅使用35%磷酸凝胶+ Adper Single Bond 2处理的牙本质粉作为空白对照组;牙本质粉分别加入CHX及MI作为CHX预处理组和MI预处理组;牙本质粉进行全酸蚀粘结剂粘结后采用10%次氯酸钠老化处理,作为空白老化对照组,并在此基础上加入CHX和MI作为CHX预处理老化组和MI预处理老化组。
1.3 试剂配制蛋白萃取液:50 mmol·L-1 Tris-HCL(pH 6),5 mmol·L-1 CaCl2,100 mmol·L-1 NaCl, 0.1% Triton X-100,0.1%离子去除剂P-40,0.1 mmol·L-1、0.02% NaN3。洗脱液:2.5% Triton X-100,50 mmol·L-1Tris -HCl,5 mmol·L-1 CaCl2,1μmol·L-1ZnCl2。漂洗液:50 mmol·L-1 Tris-HCl,5 mmol·L-1CaCl2,1μmol·L-1ZnCl2。孵育液:0.02%Brij-35,50 mmol·L-1 Tris-HCl,5 mmol·L-1 CaCl2,1μmol·L-1 ZnCl2。制胶:与普通的聚丙烯酰胺凝胶的制胶过程相同, 只在分离胶中加入1%明胶, 使明胶的终浓度为0.1%。染色液:0.25%考马斯亮兰R-250,30%甲醇,10%乙酸。脱色液A、B、C:甲醇浓度分别为30%、20%和10 %, 乙酸浓度分别为10 %、10 %和5%。
1.4 明胶-聚丙烯酰胺凝胶酶谱法测定不同粘结条件下人健康牙本质中MMP-2和MMP-9表达水平参照Mazzoni等[3]的方法,首先采用慢速切割机在流水冷却条件下去除牙釉质、牙骨质和牙髓,余留牙本质块。研钵中液氮研磨成粉末。丙酮冲洗5次,离心,5次蒸馏水冲洗,采用配置好的蛋白萃取液萃取24 h。以20%TCA等体积加入,4℃冰浴2 h进行蛋白沉淀。然后-20℃下采用预冷的丙酮洗涤沉淀,加入丙酮后,10 000 g×5 min, 洗涤2次。将获得的蛋白样本采用上样液溶解,2×loading buffer混合,在已经制好的以明胶为底物的凝胶上上样后进行电泳,样本跑至分离胶前为80 V,至分离胶后改为100 V。电泳结束后, 将凝胶置于洗脱液中振荡洗脱、漂洗, 然后将凝胶置于孵育液中37℃恒温摇床振荡20 h。孵育结束后经考马斯亮蓝染色液染色3 h, 脱色液A、B和C分别脱色0.5、1.0和2.0h后,显示出MMP-2和MMP-9位于蓝色背景上的透亮带,采用凝胶图像分析系统分析读取条带面积、宽度和灰度值。阴性对照组条带相对灰度值定义为1,计算各组牙本质粉中MMP-2和MMP-9表达水平。MMP-2表达水平= MMP-2条带灰度值/对照组条带的灰度值,MMP-9表达水平= MMP-9条带灰度值/对照组条带的灰度值。
1.5 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组牙本质中MMP-2和MMP-9表达水平以x±s表示,组间样本均数比较采用t检验。以P<0.05为差异有统计学意义。
2 结果 2.1 自酸蚀粘结剂粘结后各组牙本质中MMP-2和MMP-9表达水平与空白对照组比较,CHX预处理组牙本质中MMP-2和MMP-9表达水平降低(P<0.05),MI预处理组牙本质粉中MMP-2和MMP-9表达水平降低(P<0.05)。与空白对照组比较,空白老化对照组牙本质中MMP-2表达水平差异无统计学意义(P>0.05),MMP-9表达水平升高(P<0.05)。与空白老化对照组比较,CHX预处理老化组牙本质中MMP-2和MMP-9表达水平降低(P<0.05);MI预处理老化组牙本质中MMP-2和MMP-9的表达水平降低(P<0.05)。见图 1和表 1。
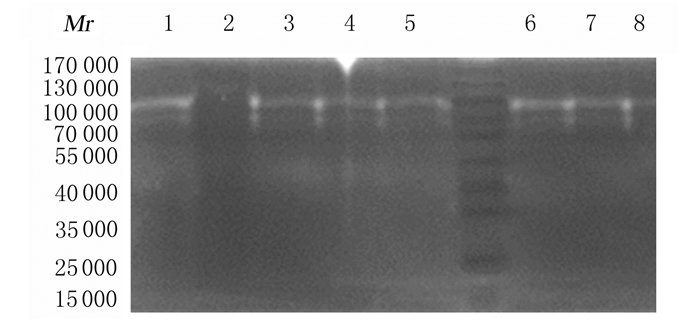
|
| Lane 1:Positive control group; Lane 2: Blank control group; Lane 3: Negative control group: Lane 4: CHX group; Lane 5:MI group; Lane 6: Aging blank group; Lane 7: CHX aging group; Lane 8: MI aging group. 图 1 自酸蚀粘结剂粘结后各组牙本质中MMP-2和MMP-9表达电泳图 Figure 1 Electrophoregram of expressions of MMP-2 and MMP-9 in dentin in various groupsafter bonding of self-etching adhesives |
|
|
| (n=3, x±s) | ||
| Group | MMP-2 | MMP-9 |
| Negative control | 1.00±0.00 | 1.00±0.00 |
| Positive control | 3.05±0.03* | 6.57±0.80* |
| Blank control | 2.61±0.11* | 4.22±0.01* |
| CHX | 1.23±0.19△ | 2.25±0.45△ |
| MI | 1.19±0.03△ | 2.44±0.04△ |
| Aging blank control | 2.36±0.13 | 5.76±0.03△ |
| CHX aging | 1.37±0.03# | 3.60±0.14# |
| MI aging | 0.90±0.03# | 2.42±0.04# |
| * P<0.05 compared with negative control group; △ P<0.05 compared with blank control group; # P<0.05 compared with aging blank control group. | ||
牙本质粉进行全酸蚀粘结(35%磷酸凝胶+Adpter Single Bond 2)处理后,凝胶成像系统成像,可见该阴性对照组中有2种MMP-2形式的表达(即proMMP-2和MMP-2),MMP-9位置处可在深色背景上见微弱的透明条带,但由于激活数量较少,ImageJ2×软件未能测量其灰度值。与空白对照组比较,CHX预处理组牙本质中MMP-2表达水平降低(P<0.05), Pro MMP-2表达水平差异无统计学意义(P>0.05);与空白对照组比较,MI预处理组牙本质中MMP-2表达水平降低(P<0.05), Pro MMP-2表达水平差异无统计学意义(P>0.05)。与空白老化对照组比较,CHX预处理老化组牙本质粉中MMP-2表达水平降低(P<0.05),MI预处理老化组牙本质粉中MMP-2表达水平也降低(P<0.05)。见图 2和表 2。
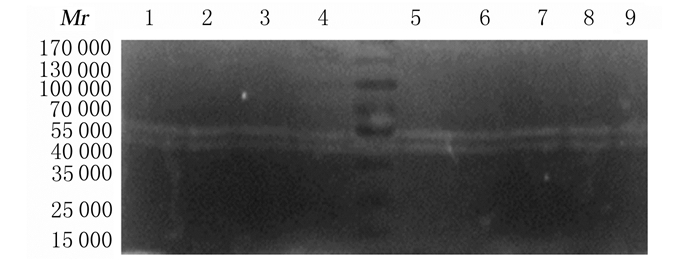
|
| Lane 1:Negative control group; Lane 2:Positive control 1group; Lane 3:Positive control 2group; Lane 4:Blank control group; Lane 5:CHX group; Lane 6:MI group; Lane 7: Aging blank group; Lane 8:CHX aging group; Lane 9:MI aging group. 图 2 全酸蚀粘结剂粘结后各组牙本质中MMP-2和MMP-9表达电泳图 Figure 2 Electrophoretogram of expressions of MMP-2 and MMP-9 in dentin in various groupsafter bonding of total-etching adhesives |
|
|
| (n=3, x±s) | ||
| Group | Pro MMP-2 | MMP-2 |
| Negative control | 1.00±0.00 | 1.00±0.00 |
| Positive control 1 | 1.19±0.03 | 2.17±0.28* |
| Positive control 2 | 1.39±0.04* | 2.31±0.30* |
| Blank control | 1.79±0.22* | 2.89±0.23* |
| CHX | 1.45±0.02 | 1.90±0.11△ |
| MI | 1.23±0.12 | 1.75±0.10△ |
| Aging blank control | 1.48±0.05 | 2.25±0.32 |
| CHX aging | 1.33±0.01 | 2.08±0.29# |
| MI aging | 1.48±0.14 | 1.77±0.16# |
| * P<0.05 compared with negative control group; △ P<0.05 compared with blank control group; # P<0.05 compared with aging blank group. | ||
牙本质中含有约20%有机基质,其中90%由Ⅰ型胶原纤维组成,而这种胶原纤维是各种牙本质源性MMPs的作用底物。在牙本质粘结中,混合层的破坏很大程度上是因为粘结界面的胶原在长期老化过程中被活化的MMPs降解[17]。MMP-2和MMP-9又称明胶酶, 是MMPs作为细胞外基质降解酶系中最重要的一种, 二者在健康牙本质、伴有龋坏的牙本质以及进行粘结修复后的牙本质中的表达情况往往可以显示出牙本质的破坏与修复情况。采用以明胶为底物的聚丙烯酰胺凝脉电泳为基础的酶谱法是一种敏感性高且实用的检测牙本质粘结中MMP-2和MMP-9表达水平及其抑制剂功效的技术[18]。
在粘结过程中,未被树脂聚合物完全包裹的胶原纤维易随着时间的推移被酶水解,而树脂聚合物的降解导致更多胶原的暴露。不再受保护的胶原纤维在混合层的基础上被蛋白酶破坏,导致混合层失去其锚定功能,降低粘结强度[19]。以上实验证实了Single Bond Universal自酸蚀粘结剂及Adper Single Bond2全酸蚀粘接剂在使用过程中均能够不同程度地激活牙本质中的MMP-2和MMP-9,从而降低粘结强度[20], 且在自酸蚀粘结过程中,MMP-2与MMP-9表达水平明显升高,在全酸蚀粘结过程中,MMP-2表达水平明显升高。而这可能与MMP-2与MMP-9的作用方式有关,MMP-2的主要作用方式是降解结缔组织中的胶原,将胶原纤维分解为肽碎片,而MMP-9不能直接溶解Ⅰ型胶原,而是通过分解低相对分子质量肽键等Ⅰ型胶原水解后的产物使酶解作用继续进行[21]。在全酸蚀粘结过程中,酸蚀后进行了冲洗过程,此时相当一部分Ⅰ型胶原水解产物可能被除掉,并由此减弱了MMP-9的作用。
研究[22]显示:牙本质的粘结强度在1年的储存时间内会下降36%~70%,因此抑制酶活性是延长树脂牙本质粘结强度的关键。本实验证明MMPs抑制剂CHX和MI能够在一定程度上减少MMP-2和MMP-9的激活, 这与已有研究[23]结果相符。且在进行老化处理后,CHX与MI可降低自酸蚀粘结后牙本质中MMP-2与MMP-9表达水平,说明CHX和MI预处理能够对自酸蚀粘结起到维持其耐久性的作用。利用外源性抑制剂来减少粘结过程中MMPs的活化对于混合层的稳定性能起一定作用,然而单一抑制剂的抑制作用却有限,难以真正维持其耐久性,因此在未来的基础研究和应用中,应逐渐进行多种抑制剂的联合应用,以发挥对MMPs活性最大程度的抑制作用。
本实验模拟体外临床上使用MMPs抑制剂的方式,即作用1 min后用去离子水冲洗去除、再进行自酸蚀粘结的湿粘结过程,结果表明:临床上应用这种底涂-冲洗的方法能够减少MMPs的激活量,从而在短期甚至是粘结修复后一段时间内提高粘结性能。但由于全酸蚀粘结时需要在酸蚀后进行大量冲洗,抑制剂的作用是否能够远期维持仍值得深入研究,单纯的明胶酶谱实验对于牙本质粘结中MMP-2与MMP-9表达所进行的半定量研究并不能完全精确而有效证明2种粘接剂在使用过程中激活酶的数量以及CHX和MI对其的抑制程度;在研磨过程中,研磨的机械作用可能会造成酶的激活,虽然采用了冷却研磨方式,但由于研磨时冷却能力有限,所产生的热也可能造成牙本质粉中酶的激活[3]。因此,对于不同牙本质粘结方式下MMPs抑制剂MMP-2和MMP-9的作用仍值得深入研究。
| [1] | Balalaie A, Rezvani MB, Mohammadi Basir M. Dual function of proanthocyanidins as both MMP inhibitor and crosslinker in dentin biomodification:A literature review[J]. Dent Mater J, 2018, 37(2): 173–182. DOI:10.4012/dmj.2017-062 |
| [2] | Zhang SC, Kern M. The role of host-derived dentinal matrix metalloproteinases in reducing dentin bonding of resin adhesives[J]. Int J Oral Sci, 2009, 1(4): 163–176. DOI:10.4248/IJOS.09044 |
| [3] | Mazzoni A, Mannello F, Tay FR, et al. Zymographic analysis and characterization of MMP-2 and -9 forms in human sound dentin[J]. J Dent Res, 2007, 86(5): 436–440. DOI:10.1177/154405910708600509 |
| [4] | Mazzoni A, Papa V, Nato F, et al. Immunohistochemical and biochemical assay of MMP-3 in human dentine[J]. J Dent, 2011, 39(3): 231–237. DOI:10.1016/j.jdent.2011.01.001 |
| [5] | Sulkala M, Tervahartiala T, Sorsa T, et al. Matrix metalloproteinase-8(MMP-8) is the major collagenase in human dentin[J]. Arch Oral Biol, 2007, 52(2): 121–127. DOI:10.1016/j.archoralbio.2006.08.009 |
| [6] | Sulkala M, Larmas M, Sorsa T, et al. The localization of matrix metalloproteinase-20(MMP-20, enamelysin) in mature human teeth[J]. J Dent Res, 2002, 81(9): 603–607. DOI:10.1177/154405910208100905 |
| [7] | 王丹杨, 张凌, 李芳, 等. 参与不同牙本质粘接界面退变过程中基质金属蛋白酶种类的研究[J]. 华西口腔医学杂志, 2014, 32(4): 394–399. |
| [8] | Montagner AF, Sarkis-Onofre R, Pereira-Cenci T, et al. MMP inhibitors on dentin stability:A systematic review and meta-analysis[J]. J Dent Res, 2014, 93(8): 733–743. DOI:10.1177/0022034514538046 |
| [9] | 贾玲玲, 万乾炳. 基质金属蛋白酶抑制剂的研究进展[J]. 华西口腔医学杂志, 2017, 35(2): 208–214. |
| [10] | Bravo C, Sampaio CS, Hirata R, et al. Effect of 2% chlorhexidine on dentin shear bond strength of different adhesive systems:A 6 months evaluation[J]. Int J Morphol, 2017, 35(3): 1140–1146. DOI:10.4067/S0717-95022017000300052 |
| [11] | Tezvergil-Mutluay A, Agee KA, Hoshika T, et al. The requirement of zinc and calcium ions for functional MMP activity in demineralized dentin matrices[J]. Dent Mater, 2010, 26(11): 1059–1067. DOI:10.1016/j.dental.2010.07.006 |
| [12] | Griffin MO, Ceballos G, Villarreal FJ. Tetracycline compounds with non-antimicrobial organ protective properties:Possible mechanisms of action[J]. Pharmacol Res, 2011, 63(2): 102–107. |
| [13] | Li H, Li T, Li X, et al. Morphological effects of MMPs inhibitors on the dentin bonding[J]. Int J Clin Exp Med, 2015, 8(7): 10793–10803. |
| [14] | Serkies KB, Garcha R, Tam LE, et al. Matrix metalloproteinase inhibitor modulates esterase-catalyzed degradation of resin-dentin interfaces[J]. Dent Mater, 2016, 32(12): 1513–1523. DOI:10.1016/j.dental.2016.09.007 |
| [15] | Singh P, Nagpal R, Singh UP. Effect of dentin biomodifiers on the immediate and long-term bond strengths of a simplified etch and rinse adhesive to dentin[J]. Restor Dent Endod, 2017, 42(3): 188–199. DOI:10.5395/rde.2017.42.3.188 |
| [16] | Loguercio AD, Stanislawczuk R, Malaquias P, et al. Effect of minocycline on the durability of dentin bonding produced with Etch-and-Rinse adhesives[J]. Oper Dent, 2016, 41(5): 511–519. DOI:10.2341/15-023-L |
| [17] | Liu Y, Tjäderhane L, Breschi L, et al. Limitations in bonding to dentin and experimental strategies to prevent bond degradation[J]. J Dent Res, 2011, 90(8): 953. DOI:10.1177/0022034510391799 |
| [18] | Snoekvan Beurden PA, Von den Hoff JW. Zymographic techniques for the analysis of matrix metalloproteinases and their inhibitors[J]. BioTechniques, 2005, 38(1): 73–83. DOI:10.2144/05381RV01 |
| [19] | Mazzoni A, Angeloni V, Comba A, et al. Cross-linking effect on dentin bond strength and MMPs activity[J]. Dent Mater, 2018, 34(2): 288–295. DOI:10.1016/j.dental.2017.11.009 |
| [20] | Mazzoni A, Scaffa P, Carrilho M, et al. Effects of etch-and-rinse and self-etch adhesives on dentin MMP-2 and MMP-9[J]. J Dent Res, 2013, 92(1): 82–86. DOI:10.1177/0022034512467034 |
| [21] | Tay FR, Pashley DH, Loushine RJ, et al. Self-etching adhesives increase collagenolytic activity in radicular dentin[J]. J Endod, 2006, 32(9): 862–868. DOI:10.1016/j.joen.2006.04.005 |
| [22] | Hashimoto M, Ohno H, Kaga M, et al. In vivo degradation of resin-dentin bonds in humans over 1 to 3 years[J]. J Dent Res, 2000, 79(6): 1385–1391. DOI:10.1177/00220345000790060601 |
| [23] | Mazzoni A, Nascimento FD, Carrilho M, et al. MMP activity in the hybrid layer detected with in situ zymography[J]. J Dent Res, 2012, 91(5): 467–472. DOI:10.1177/0022034512439210 |
 2018, Vol. 44
2018, Vol. 44


