扩展功能
文章信息
- 杨巍, 李明成
- YANG Wei, LI Mingcheng
- 人口腔鳞状细胞癌Tca8113细胞过表达WWOX基因的基因表达谱分析及WWOX基因的抑癌作用机制
- Analysis on gene profile of over-expression WWOX gene in human oral squamous cell carcinoma Tca8113 cells and tumor inhibition mechanism of WWOX gene
- 吉林大学学报(医学版), 2018, 44(06): 1169-1173
- Journal of Jilin University (Medicine Edition), 2018, 44(06): 1169-1173
- 10.13481/j.1671-587x.20180610
-
文章历史
- 收稿日期: 2018-02-26
口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)是一种较常见的头颈部恶性肿瘤,严重影响人们的健康和生活[1]。病理分析结果显示:含WW结构域的氧化还原酶(WW domain-containing oxidoreductase,WWOX)在OSCC和口腔黏膜白斑组织中表达缺失,而在正常口腔黏膜中则表达正常,提示WWOX基因可能与OSCC的发生发展有关[2]。本课题组前期研究[3]显示:WWOX基因能够抑制人OSCC Tca8113细胞生长,促进Tca8113细胞凋亡并影响细胞中肿瘤相关基因的表达,但其具体机制尚未明确。本研究利用基因芯片技术分析人OSCC Tca8113细胞过表达WWOX基因的基因表达谱变化,探讨WWOX基因对Tca8113细胞的抑癌作用机制。
1 材料与方法 1.1 细胞和主要试剂Tca8113细胞由本实验室保存。包含WWOX基因的慢病毒载体pGV287-LV-WWOX由上海吉凯基因化学技术有限公司合成,其病毒液滴度为1×109 TU·mL-1。Agilent RNA 6000 Nano Kit购自美国Agilent公司,GeneChip 3’IVT Express Kit和GeneChip Hybridization Wash and Stain Kit购自美国Affymetrix公司,Trizol购自美国Invitrogen公司,Affymetrix人全基因组表达谱芯片购自上海吉凯基因化学技术有限公司,FastQuant RT Kit购自北京生化科技有限公司,兔抗WWOX单抗购自美国Santa公司,SYBR Premix Ex TaqTM为日本TaKaRa公司产品,小鼠抗GAPDH单克隆抗体、HRP标记的山羊抗小鼠和山羊抗兔IgG均购自北京中杉金桥有限公司,其他试剂均为国产分析纯。
1.2 慢病毒载体pGV287-LV-WWOX感染Tca8113细胞Tca8113细胞分为2组,第1组为WWOX基因过表达组:将处于对数生长期的Tca8113细胞制成细胞密度为5×104 mL-1的细胞悬液,接种于6孔板中,置于37℃、5%CO2培养箱中培养,待细胞融合度达到约60%时,将携带WWOX基因的慢病毒液[感染复数(multiplicity of infection,MOI)=8]加入至Tca8113细胞培养液中继续培养。每隔12 h在荧光显微镜下观察载体上绿色荧光蛋白的表达,当荧光率大于80%时,将细胞分成2份,分别接种于培养皿中,待细胞长满后用于收集细胞的总RNA和蛋白质。第2组为对照组:将含有空载体pGV287-LV的慢病毒液(病毒滴度为1×109 TU·mL-1,MOI=2)感染Tca8113细胞,其余处理同第1组。
1.3 RNA提取、质检和基因芯片检测采用Trizol法提取2组细胞总RNA,采用紫外分光光度计测定260和280 nm处吸光度(A)值,计算RNA的浓度和纯度。所得总RNA经Nanodrop2000和Agilent Bioanalyzer 2100质检,质控标准:Nanodrop2000,A(260)/A(280)为1.7~2.2;Agilent Bioanalyzer 2100,RNA完整数(RNA Integrity Number,RIN)≥7.0,且28S/18S>0.7。质检合格样本方可进行芯片检测。质检合格的总RNA样品采用GeneChip 3’IVT Express Kit,按照说明依次合成cDNA、双链DNA模板和带生物素标记的扩增RNA(amplified RNA,aRNA)。将纯化的aRNA采用Nanodrop 2000测定浓度并进行片段化处理后,与人GeneChip Primeview human(Affymetrix)基因表达谱芯片进行杂交。杂交完成后,对芯片进行洗染。采用GeneChipScanner3000扫描仪进行芯片扫描。采集的数据使用在线整合分析软件IPA(www.ingenuity.com)进行生物信息分析。
1.4 实时荧光定量PCR(qRT-PCR)Trizol法分别提取2组细胞总RNA,采用FastQuant RT Kit反转录成cDNA,利用SYBR Premix Ex Taq进行qRT-PCR检测。采用Primer 5.0软件设计引物,引物由上海生工技术有限公司合成。WWOX:F,5′-CCAACCACCCGGCAAAGATA-3′;R:5′-AATGCTGCACGCTACGGAG-3′。丝裂原活化蛋白激酶2(mitogen-activated protein2 kinase,MAP2K):F,5′-ACTGACGAGCGGTGGAC-3′:R,5′-GTCGGAAGGTTCTGGA-3′。孤核受体4A1(nuclear receptor subfamily 4 group A member 1,NR4A1):F,5′-TCATGGACGGCTACACAG-3′;R,5′-GTGGCTGAGGACGAGGATG-3′。双特异性磷酸酶5(dual specificity phosphatase,DUSP5):F,5′-TCCTCACCTCGCTACTCG-3′;R,5′-ACATCCACGCAACACTCAG-3′;双特异性磷酸酶6(dual specificity phosphatase,DUSP 6):F,5′-GAACTGTGGTGTCTTGGTACATT-3′;R,5′-GTTCATCGACAGATTGAGCTTCT-3′。成纤维生长因子受体2(fibroblast growth factor receptor 2,FGFR2):F,5′-GGTGGCTGAAAAACGGGAAG-3′;R,5′-AGATGGGACCACACTTTCCATA-3′。qRT-PCR反应条件:95℃、30 s;95℃、5 s,60℃、30 s,72℃、15 s,共40个循环;荧光信号采集设在延伸步骤中的72℃。绘制熔解曲线,设置为60℃、30 s。每组样本重复检测3次,记录Ct值,采用2-ΔΔCt法进行分析。
1.5 Western blotting法检测Tca8113细胞中WWOX蛋白表达采用RIPA裂解液提取WWOX基因过表达组和对照组细胞总蛋白,测定蛋白浓度后,取50μg总蛋白经10%SDS-PAGE分离,再转移至PVDF膜,采用5%脱脂奶粉封闭1 h后,加入兔抗WWOX单抗(1:200)和小鼠抗GAPDH单抗(1:1 000),4℃孵育过夜,采用PBST洗涤3次,每次5 min。再分别加入HRP标记的山羊抗兔IgG和山羊抗鼠IgG(1:500),室温孵育1 h,ECL法显影。
1.6 差异基因筛选和分析根据WWOX基因过表达组和对照组的基因芯片检测数据的差异倍数(fold change, FC),进行差异表达基因筛选,筛选标准:|FC|>1.5,且P<0.05。根据京都基因和基因组数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG)和贝尔卡特数据库(BIOCARTA)中所有pathway的基因信息,对筛选出的差异基因进行pathway富集分析,所有信号通路使用-Log(P)进行排序。
1.7 统计学分析采用SPSS16.0统计软件进行统计学分析。2组细胞中WWOX、MAP2K、NR4A1、DUSP5、DUSP6和FGFR2mRNA相对表达水平以x±s表示,组间样本均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 2组Tca8113细胞中WWOX基因的表达慢病毒载体感染Tca8113细胞48 h后,qRT-PCR法检测结果显示:WWOX基因过表达组WWOX基因mRNA相对表达水平(1.00±0.04)高于对照组(0.57±0.01)(P<0.05)。免疫印迹检测结果显示:WWOX基因过表达组检测到WWOX蛋白的表达,而对照组WWOX蛋白的表达条带不明显。见图 1。

|
| Lane 1:WWOX over-expression group; Lane 2:Control group. 图 1 慢病毒载体感染后2组Tca8113细胞中WWOX蛋白表达电泳图 Figure 1 Electrophoregram of expressions of WWOX protein in Tca8113 cells in two groups after infected with lentiviral plasmid |
|
|
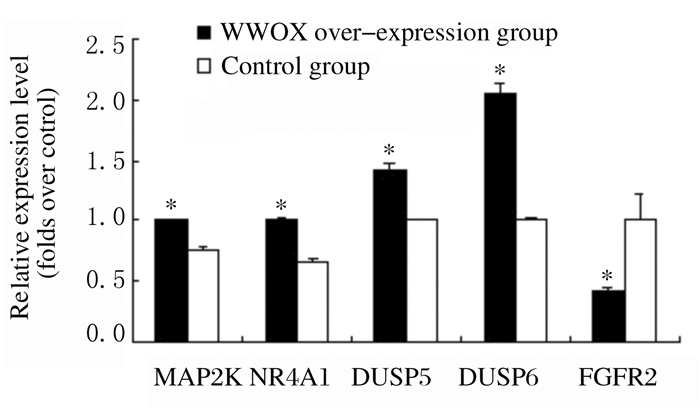
WWOX基因过表达组细胞中MAP2K(1.01±0.02)、NR4A1(1.04±0.02)、DUSP5(1.42±0.06)和DUSP6(2.05±0.09)mRNA相对表达水平明显高于对照组(MAP2K: 0.67±0.01,NR4A1: 0.77±0.03,DUSP5: 1.01±0.01、DUSP6: 1.01±0.03)(P<0.05),而FGFR2mRNA相对表达水平(0.41±0.05)低于对照组(1.02±0.02)(P<0.05)。见图 2。
|
| *P<0.05 vs control group. 图 2 2组细胞中差异表达基因mRNA相对表达水平 Figure 2 Relative mRNA expression levels of differentially expressed genes in cells in two groups |
|
|
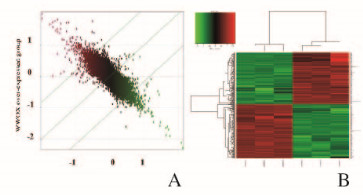
对WWOX基因过表达组和对照组基因芯片数据进行差异表达基因筛选,筛选标准:|FC|>1.5且P<0.05,结果显示:WWOX过表达后,共有347个基因在Tca8113细胞中出现差异表达,其中表达上调基因171个,表达下调基因176个。对347个差异基因进行散点分析和聚类分析,见图 3A(插页三)。散点图中,2组表达差异不明显或表达无差异的基因位于图像中心,而表达差异较大的基因则靠近边缘。聚类图展示了所有差异基因的聚集情况,红色表示差异基因表达上调,绿色表示差异基因表达下调,黑色表示信号值适中,灰色表示基因的信号值未检出。见图 3B(插页三)。
|
| A:Scatter plot of signal to noise ratio; B: Comparison of cluster results. 图 3 WWOX过表达后差异表达基因筛选图 Figure 3 Screening diagram of differential expression genes after WWOX over-expression |
|
|
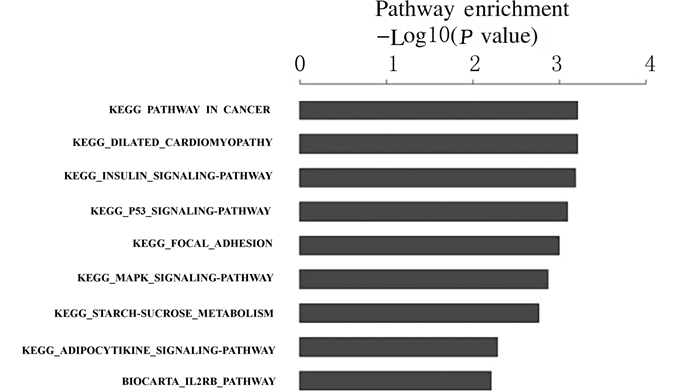
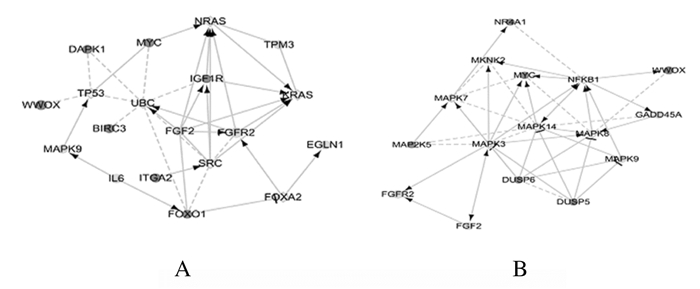
经典信号通路中差异表达基因主要分布于癌症、P53、MAPK和白细胞介素(interleukin-2, IL-2)等信号传导通路上。根据pathway分析结果预测可能与WWOX基因相互作用的基因,绘制基因关系网络图。见图 4。WWOX基因在癌症和MAPK信号途径中与其他基因可能存在相互作用关系。见图 5。
|
| 图 4 Tca8113细胞中差异基因pathway富集分析图 Figure 4 Functional pathway analysis diagram of differentially expressed genes in Tca8113 cells |
|
|
|
| A: KEGG pathway in cancer; B: KEGG MAPK signaling pathway. 图 5 WWOX基因和信号通路的关系网络图 Figure 5 Network diagram of WWOX gene and signal pathways |
|
|
WWOX基因是位于染色体脆性位点的一个抑癌基因,在包括OSCC等多种肿瘤中表达降低或缺失[4-6]。WWOX基因的表达降低能够导致肿瘤的发生发展;而外源过表达WWOX基因则能够明显抑制肿瘤生长[7-9]。
WWOX基因能够抑制Tca8113细胞生长,诱导Tca8113细胞凋亡。本研究采用基因芯片技术检测了WWOX基因过表达后Tca8113细胞中基因的表达差异以及这些基因涉及的相关信号通路,并选择MAPK这一经典通路中的5个基因进行了验证,结果显示WWOX基因过表达后,Tca8113细胞中共有347个基因的表达发生了变化,其中上调基因171个,下调基因176个;这些基因分布于P53、MAPK、IL-2以及与癌症相关的多条信号通路中。MAPK是一条经典信号传导通路,广泛参与细胞生长、分化和发育等过程[10]。本研究结果显示:在MAPK信号通路中,MAP2K、NR4A1、DUSP5和DUSP6 mRNA表达水平升高,而FGFR2mRNA表达水平降低。NR4A1是核受体超家族的一员,可依赖ERK/MAPK通路以MAP2K5-MAPK7-NR4A1级联方式被活化。在OSCC中,活化的NR4A1能够通过诱导细胞色素C释放引起细胞凋亡[11-12]。而另一研究[13]显示WWOX基因过表达同样能够诱导细胞色素C的释放。因此本文作者推测:WWOX基因过表达诱导Tca8113细胞凋亡与调节MAP2K和NR4A1的表达及干扰细胞色素C的释放有关。DUSP5和DUSP6是MAPK磷酸激酶家族一员,是ERK磷酸化的负调节因子,对肿瘤细胞生长起到抑制作用[14-15]。而FGFR2则是一种酪氨酸激酶受体,对肿瘤细胞的增殖、分化和转移起到促进作用[16]。本研究结果显示:WWOX基因过表达引起DUSP5和DUSP6mRNA表达水平升高和FGFR2 mRNA表达水平降低。本课题组前期研究[3]显示:WWOX基因过表达可抑制Tca8113细胞的生长,本文作者推测:WWOX基因对Tca8113细胞的抑制作用可能是通过调节DUSP5、DUSP6和FGFR2的表达,进而影响ERK/MAPK信号通路的传导。
生物信息学是近年来广泛应用于基因、蛋白质、代谢和疾病发生等多个生物学领域的重要研究工具。生物信息学能够帮助研究者解读庞大的数据,解释生命或疾病过程中潜在的分子变化,促进对复杂疾病发生机制的认识从传统的生物医学研究逐步转向精准医学研究。本研究利用基因芯片技术检测了在Tca8113细胞中过表达WWOX基因所导致的细胞基因谱的变化,并对差异基因进行了信号通路分析和基因相互作用关系分析,发现WWOX基因的抑癌作用与调节MAPK通路上的重要蛋白表达有关。本研究结果为探索WWOX基因的抑癌作用机制提供了实验依据,并为深入了解WWOX基因的生物学功能提供了研究方向。
| [1] | Shao T, Huang J, Zheng Z, et al. SCCA, TSGF, and the long non-coding RNA AC007271.3 are effective biomarkers for diagnosing oral squamous cellcarcinoma[J]. Cell Physiol Biochem, 2018, 47(1): 26–38. DOI:10.1159/000489741 |
| [2] | Bunai K, Okubo H, Hano K, et al. TMEM207 hinders the tumour suppressor function of WWOX in oral squamous cell carcinoma[J]. J Cell Mol Med, 2018, 22(2): 1026–1033. |
| [3] | 王晓明, 杨巍. WWOX基因对Tca8113细胞生长的影响及其机制[J]. 中国生物制品学杂志, 2018, 31(6): 603–606. |
| [4] | Bunai K, Okubo H, Hano K, et al. TMEM207 hinders the tumour suppressor function of WWOX in oral squamous cell carcinoma[J]. J Cell Mol Med, 2018, 22(2): 1026–1033. |
| [5] | Yu K, Fan J, Ding X, et al. Association study of a functional copy number variation in the WWOX gene with risk of gliomas among Chinese people[J]. Int J Cancer, 2014, 135(7): 1687–1691. DOI:10.1002/ijc.28815 |
| [6] | Huang D, Qiu F, Yang L, et al. The polymorphisms and haplotypes of WWOX gene are associated with the risk of lung cancer in southern and eastern Chinese populations[J]. Mol Carcinog, 2013, 52(1): E19–E27. |
| [7] | Abu-Remaileh M, Khalaileh A, Pikarsky E, et al. WWOX controls hepatic HIF1α to suppress hepatocyte proliferation and neoplasia[J]. Cell Death Dis, 2018, 9(5): 511. DOI:10.1038/s41419-018-0510-4 |
| [8] | Hu CY, Wu HT, Su YC, et al. Evodiamine exerts an anti-hepatocellular carcinoma activity through a WWOX-dependent pathway[J]. Molecules, 2017, 22(7): 1175–1183. DOI:10.3390/molecules22071175 |
| [9] | Gao K, Yin J, Dong J. Deregulated WWOX is involved in a negative feedback loop with microRNA-214-3p in osteosarcoma[J]. Int J Mol Med, 2016, 38(6): 1850–1856. DOI:10.3892/ijmm.2016.2800 |
| [10] | Meng X, Qiu L, Song H, et al. MAPK pathway involved in epidermal terminal differentiation of normal human epidermal keratinocytes[J]. Open Med (Wars), 2018, 13: 189–195. DOI:10.1515/med-2018-0029 |
| [11] | Liu PY, Sheu JJ, Lin PC, et al. Expression of Nur77 induced by an n-butylidenephthalide derivative promotes apoptosis and inhibits cell growth in oral squamous cell carcinoma[J]. Invest New Drugs, 2012, 30(1): 79–89. DOI:10.1007/s10637-010-9518-z |
| [12] | Yan H, Xiao F, Zou J, et al. NR4A1-induced increase in the sensitivity of a human gastric cancer line to TNFα-mediated apoptosis is associated with the inhibition of JNK/Parkin-dependent mitophagy[J]. Int J Oncol, 2018, 52(2): 367–378. |
| [13] | Zhang P, Jia R, Ying L, et al. WWOX-mediated apoptosis in A549 cells mainly involves the mitochondrial pathway[J]. Mol Med Rep, 2012, 6(1): 121–124. |
| [14] | Nakanishi Y, Mizuno H, Sase H, et al. ERK signal suppression and sensitivity to CH5183284/Debio 1347, a selective FGFR inhibitor[J]. Mol Cancer Ther, 2015, 14(12): 2831–2839. DOI:10.1158/1535-7163.MCT-15-0497 |
| [15] | Buffet C, Hecale-Perlemoine K, Bricaire L, et al. DUSP5 and DUSP6, two ERK specific phosphatases, are markers of a higher MAPK signaling activation in BRAF mutated thyroid cancers[J]. PLoS One, 2017, 12(9): e0184861. DOI:10.1371/journal.pone.0184861 |
| [16] | Xu Y, Yang X, Li Z, et al. Sprouty2 correlates with favorable prognosis of gastric adenocarcinoma via suppressing FGFR2-induced ERK phosphorylation and cancer progression[J]. Oncotarget, 2017, 8(3): 4888–4900. |
 2018, Vol. 44
2018, Vol. 44


