扩展功能
文章信息
- 崔奇, 王曼伊, 农琳琳, 翟晓雅, 冯乐平
- CUI Qi, WANG Manyi, NONG Linlin, ZHAI Xiaoya, FENG Leping
- NMN在糖尿病肾病大鼠肾脏纤维化中的作用及其机制
- Effect of NMN on renal fibrosis of diabetic nephropathy rats and its mechanism
- 吉林大学学报(医学版), 2018, 44(06): 1156-1162
- Journal of Jilin University (Medicine Edition), 2018, 44(06): 1156-1162
- 10.13481/j.1671-587x.20180608
-
文章历史
- 收稿日期: 2018-07-16
2. 桂林医学院第一附属临床医院 优生优育科, 广西桂林 541004;
3. 桂林医学院基础医学院实验教学中心, 广西 桂林 541004
2. Department of Eugenic and Superior Nuture, First Affiliated Clinical Hospital, Guilin Medical University, Guilin 541004, China;
3. Experimental Teaching Center, School of Basic Medical Sciences, Guilin Medical University, Guilin 541004, China
叉头转录因子3a(Forkhead box O3a,FoxO3a)作为FoxO家族成员之一,通过调控下游靶基因,在细胞凋亡、自噬、氧化应激、细胞分化和细胞代谢等过程中发挥重要作用[1-4]。p-FoxO3a能够通过细胞凋亡和细胞自噬作用[5]促进成纤维细胞凋亡和自噬,以及抑制上皮-间质转化(epithelial mesenchymal transformation, EMT)基因表达[6],从而减缓组织纤维化进程。研究显示:沉默信息调节因子1(silent information regulator, Sirt1)能够导致p-FoxO3a去乙酰化,上调p-FoxO3a表达,进而阻止氧化应激对组织细胞带来的损伤;p-FoxO3a也同样受到蛋白激酶B(AKT)在不同位点的磷酸化调控,从而在调节细胞凋亡和抵抗氧化应激等方面发挥作用。本文作者采用动物模型和高糖浓度培养肾小球系膜细胞(HBZY-1)对糖尿病引起的肾实质细胞炎性-纤维化进行研究,通过烟酰胺单核苷酸(NMN)调控Sirt1和AKT,间接影响p-FoxO3a和小窝蛋白(caveolin-1, Cav-1)表达,阐明NMN减缓糖尿病肾病(diabetic nephropathy, DN)大鼠肾脏纤维化的作用机制。
1 材料与方法 1.1 主要试剂和仪器0.56 mmol·L -1 DMEM培养基(Dulbecco公司,美国),10%胎牛血清(Gemini公司,美国),胰蛋白酶(工作液浓度0.25%)、青霉素和链霉素(终浓度分别为100 U·L-1和100 kg·L-1)(Solarbio公司,中国),链脲佐菌素(streptozotocin, STZ)(Sigma-Aldrich公司,德国),烟酰胺和NMN(Sigma公司,美国), Sirt1单抗(Abcam公司,英国),兔抗大鼠(Cav-1)单抗(Santa公司,美国),抗大鼠AKT单抗(Bioword公司,美国),FoxO3a和p-FoxO3a单抗(Abcam公司,英国),FITC标记的羊抗兔多抗和Cy3标记的羊抗兔多抗(LIFE公司,美国)。血糖诊断试剂盒(Omron公司,日本),GT-1640血糖检测仪(ARKRAY有限公司,日本),Cobas111全自动生化分析仪(Roche公司,美国),LSM700激光共聚焦扫描显微镜(Zeiss公司,德国),Mini-PROTEAN 3 CELL 165-3301电泳系统和小型垂直电泳转印系统(Bio-Rad公司,美国)。
1.2 动物分组和给药SD大鼠50只,雄性,体质量200~250 g,由桂林医学院实验动物中心提供。大鼠于标准聚丙烯鼠笼中饲养,室温(23±1)℃,湿度50%~60%,12 h光/暗光照周期,1周后随机分为对照组(n=10,采用正常饮食,常规食物包括:脂肪5%、碳水化合物63%、蛋白质23%、总热值25 kJ·kg-1)和实验组(n=30,采用高脂肪饮食,高脂肪食物包括:脂肪32%、碳水化合物48%、蛋白质20%,总热值54.3 kJ·kg -1)。2组大鼠均采用灭菌的自来水作为饮用水。实验组大鼠平均体质量为(300±20)g,注射50 mg·kg-1STZ,以0.01 mmol·L-1冰镇柠檬酸缓冲液(pH 4.5)溶解,在30 min内通过腹腔注射。对照组大鼠使用柠檬酸盐缓冲液注射。随后从尾静脉中采集血液样本,用于葡萄糖水平测定,当空腹血糖水平持续达到16.7 mmol·L-1时,SD大鼠被认为是糖尿病模型大鼠。30只实验组糖尿病大鼠进一步随机分为糖尿病+NMN组和糖尿病+PBS组(每组15只);糖尿病+NMN组大鼠静脉注射NMN(120 mg·kg-1)(NMN应用200 μL无菌磷酸盐缓冲液稀释),每隔1 d在颈部和肩部松散组织皮下注射,持续20 d;糖尿病+PBS组大鼠皮下注射接种200 μL无菌PBS,每隔1 d在颈部和肩部松散组织皮下注射,持续20 d,之后断头处死大鼠,摘取肾脏进行组织切片和蛋白提取,分别用于目的蛋白免疫印迹分析及免疫共聚焦分析。本研究经桂林医学院实验动物伦理审查委员会批准。
1.3 细胞培养大鼠肾小球系膜HBZY-1细胞系购自中国医学科学院基础医学研究所。细胞保存于正常浓度葡萄糖(5.6 mmol·L-1)条件下,置于含10%胎牛血清的DMEM培养基中,于体外37℃、5% CO2条件下适应性培养24 h,之后在高浓度葡萄糖(200 mmol·L-1)氧化应激条件下继续培养1~6 d,并隔天更换相同条件培养基。高浓度葡萄糖培养细胞按照给予NMN浓度的不同,随机分为0、50、100和200 μmol·L-1NMN组,并设对照组(未加入高浓度葡萄糖),继续培养24 h后收集细胞,提取蛋白用于相关目的蛋白的免疫印迹分析。
1.4 免疫共聚焦法检测大鼠肾小球细胞中Sirt1、AKT、p-FoxO3a和Cav-1蛋白表达水平4%多聚甲醛固定大鼠肾组织,脱水后石蜡包埋并切片,组织切片经脱蜡和乙醇梯度脱水,枸橼酸微波修复后,加待检蛋白一抗:抗Sirt1(1:500)、AKT(1:1 000)、p-FoxO3a(1:1 000)和Cav-1(1:400)单抗进行孵育,4℃冰箱静置过夜,加入相应荧光标记的二抗(1:1 000),37℃避光孵育1 h;采用PBS洗涤3次,DAPI避光染色5 min,N-丙基没食子酸盐(N-propyl gallate,NPG)(抗荧光淬灭剂)处理后树脂胶封片,共聚焦显微镜下检测大鼠肾小球细胞质和细胞核中Sirt1、AKT、p-FoxO3a和Cav-1蛋白表达水平。绿色荧光代表肾小球细胞中AKT和p-FoxO3a表达,红色荧光代表肾小球细胞中Sirt1和Cav-1蛋白表达,采用ImageJ 2×软件计算10个视野的平均荧光强度,以荧光强度表示单位面积蛋白表达水平。
1.5 Western blotting法检测HBZY-1细胞中Sirt1、AKT、p-FoxO3a和Cav-1蛋白表达水平将1 mL含1×106 mL HBZY-1细胞悬液移至直径为35 cm的培养皿中,增加葡萄糖浓度至200 mmol·L-1,培养6 d后分别加入NMN,浓度分别为0、50、100和200 μmol·L-1,继续培养细胞24 h后,收集并裂解细胞提取蛋白,采用Western blotting法检测高浓度葡萄糖条件下HBZY-1细胞中Sirt1、AKT和p-FoxO3表达水平。取出培养细胞加入细胞裂解液置于Eppendorf离心管中,超声波粉碎仪裂解蛋白,经4℃低温12 000g、15 min离心取上清液;蛋白定量后行SDS-PAGE电泳,电压120 V,PVDF半干式转膜(电压150 V、60 min),牛血清白蛋白封闭滤膜,加入待检蛋白一抗[Sirt1(1:500)、AKT(1:200)、p-FoxO3a(1:1 000)和Cav-1(1:600)],4℃孵育过夜,次日加入相应二抗(1:2 000)后孵育1 h,将PVDF膜置于凝胶成像系统中获取相应蛋白条带的积分吸光度(integrated absorbance,IA)值,计算蛋白相对表达水平。蛋白相对表达水平=目标蛋白的IA值/β-actin的IA值。
1.6 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组大鼠肾实质细胞中Sirt1和AKT、Sirt1和p-FoxO3a蛋白表达水平以x±s表示,组间均数比较采用t检验,多组间均数比较采用方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 2组大鼠肾实质细胞中Sirt1和AKT蛋白表达水平免疫共聚焦检测结果显示:与糖尿病+PBS组比较,糖尿病+NMN组大鼠肾小球体积相对较小,细胞排列比较密集,且杂乱无章。糖尿病+NMN组大鼠肾脏实质细胞中Sirt1(红色荧光)表达水平明显高于糖尿病+PBS组(P<0.01),糖尿病+NMN组大鼠肾实质细胞中AKT(绿色荧光)表达水平亦高于糖尿病+PBS组(P<0.01)。见图 1(插页二)和2。
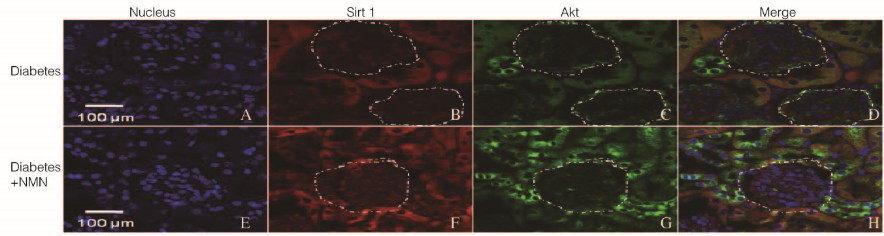
|
| 图 1 2组大鼠肾实质细胞中Sirt1和AKT蛋白的表达(×64) Figure 1 Expressions of Sirt1 and AKT proteins in renal parenchymal cells of rats in two groups (×64) |
|
|
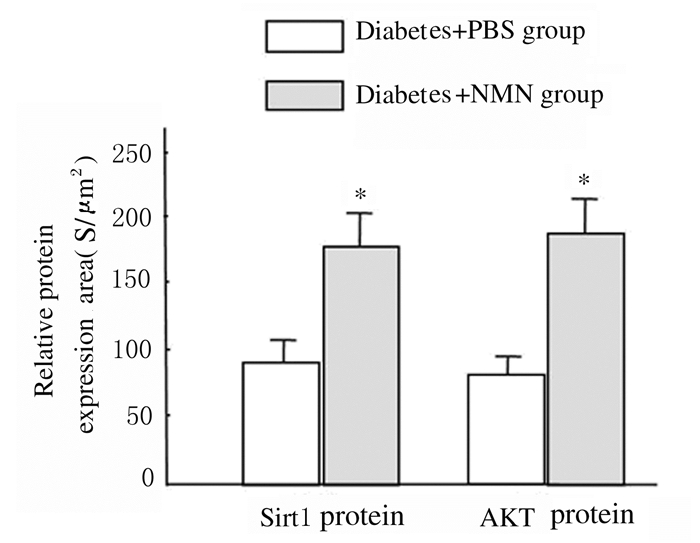
|
| *P<0.01compared with diabetes+PBS group. 图 2 2组大鼠肾实质细胞中Sirt1和AKT蛋白表达水平 Figure 2 Expression levels of Sirt1 and AKT proteins in renal parenchymal cells of rats in two groups |
|
|
与糖尿病+PBS组比较,糖尿病+NMN组大鼠肾实质细胞中Sirt1(红色荧光)蛋白表达水平明显升高(P<0.01), 且大鼠肾实质细胞中p-FoxO3a表达(绿色荧光)水平亦明显升高(P<0.01)。免疫共聚焦检测结果显示:肾小管细胞中p-FoxO3a蛋白表达(绿色荧光)在肾小管细胞中的分布多于肾小球细胞,说明肾小管细胞中p-FoxO3a蛋白表达多于肾小球细胞。见图 3(插页三)和4。
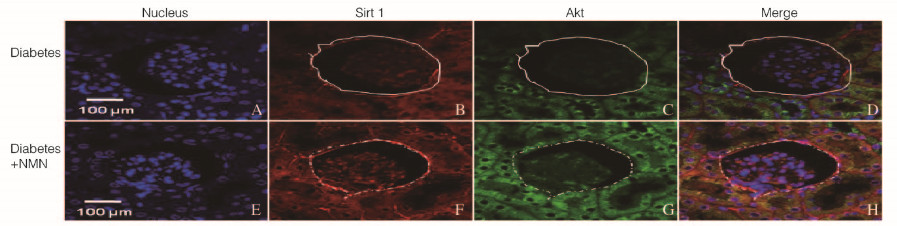
|
| 图 3 2组大鼠肾实质细胞中Sirt1和p-FoxO3a蛋白的表达(×64) Figure 3 Expressions of Sirt1 and p-FoxO3a proteins in renal parenchymal cells of rats in two groups (×64) |
|
|
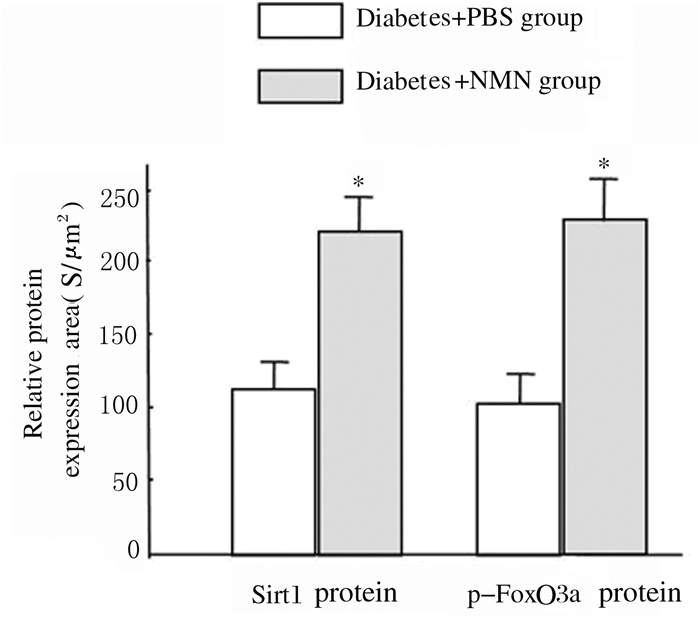
|
| *P<0.01compared with diabetes+PBS group. 图 4 2组大鼠肾实质细胞中Sirt1和p-FoxO3a蛋白表达水平 Figure 4 Expression levels of Sirt1 and p-FoxO3a proteins in renal parenchyma cells of rats in two groups |
|
|
免疫共聚焦检测结果显示:与糖尿病+ PBS组比较,糖尿病+NMN组大鼠肾小管和肾小球细胞中p-FoxO3a蛋白(绿色荧光)表达水平明显升高(P<0.01),肾小管和肾小球细胞中Cav-1蛋白表达水平亦明显升高(P<0.01)。见图 5(插页三)和6。
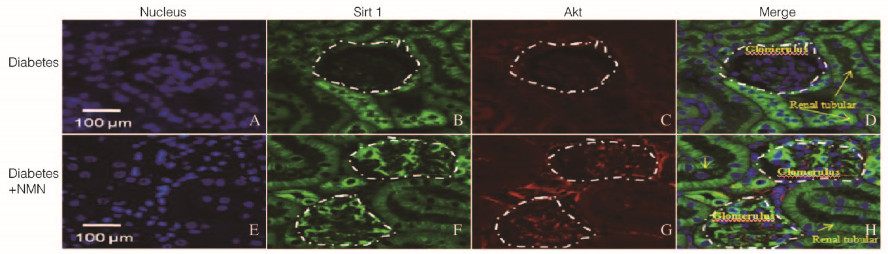
|
| 图 5 2组大鼠肾实质细胞中p-FoxO3a和Cav-1蛋白的表达(×64) Figure 5 Expressions of p-FoxO3a and Cav-1 proteins in renal parenchymal cells of rats in two groups (×64) |
|
|
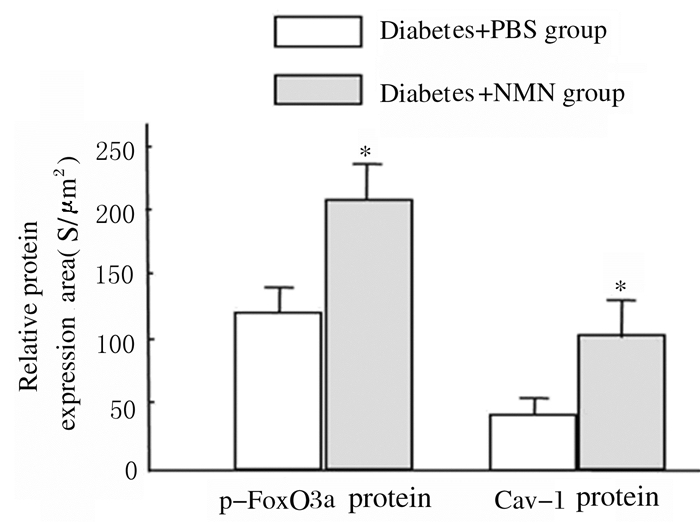
|
| *P<0.01 compared with diatetes+PBS group. 图 6 2组大鼠肾脏实质细胞中p-FoxO3a和Cav-1蛋白表达水平 Figure 6 Expression levels of p-FoxO3a and Cav-1 proteins in renal parenchyma cells of rats in two groups |
|
|
Western blotting检测结果显示:200 mmol·L-1葡萄糖处理HBZY-1细胞72 h后,分别加入不同浓度(0、50、100和200 μmol·L-1)NMN处理24 h,与对照组(未经200 mmol·L-1葡萄糖处理)比较,50 μmol·L-1NMN组HBZY-1细胞中Sirt1和AKT蛋白表达水平升高(P<0.05),100和200 μmol·L-1NMN组HBZY-1细胞中Sirt1和AKT蛋白表达水平明显升高(P<0.01)。与对照组比较,50 μmol·L-1NMN组HBZY-1细胞中p-FoxO3a蛋白表达水平差异无统计学意义(P>0.05),但100和200 μmol·L-1NMN组HBZY-1细胞中p-FoxO3a蛋白表达水平明显升高(P<0.05)。见图 7和8。
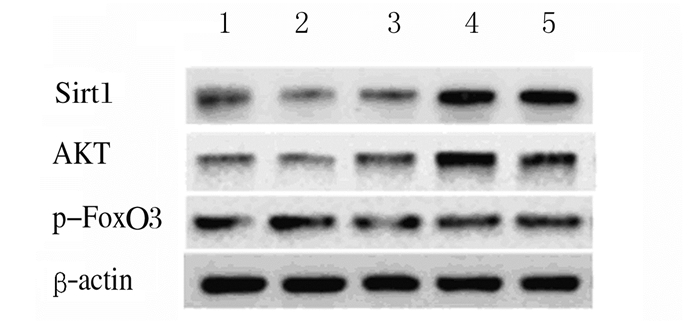
|
| Lane 1:Control group; Lane 2-5:50, 100,and 200 μmol·L-1 NMN groups. 图 7 各组HBZY-1细胞中Sirt1、AKT和p-FoxO3a蛋白表达电泳图 Figure 7 Electrophoregram of expressions of Sirt1, AKT, and p-FoxO3a proteins in HBZY-1 cells in various groups |
|
|
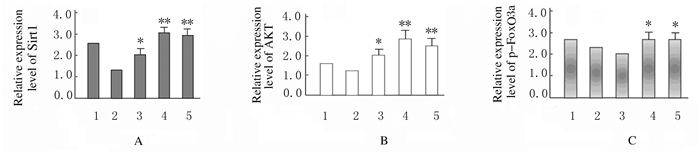
|
| A:Sirt1;B:AKT; C:p-FoxO3a.1:Control group; 2-5:50, 100, and 200 μmol·L-1 groups.*P<0.05, * *P<0.01 compared with control group. 图 8 各组HBZY-1细胞中Sirt1、AKT和p-FoxO3a蛋白表达水平 Figure 8 Expression levels of Sirt1, AKT, and p-FoxO3a proteins in HBZY-1 cells in various groups |
|
|
采用正常浓度葡萄糖(5.6 mmol·L-1)和高浓度葡萄糖(200 mmol·L-1)分别处理HBZY-1细胞,随后应用NMN分别干预24 h。在正常葡萄糖浓度或高浓度葡萄糖培养条件下,细胞中AKT与Sirt1蛋白表达水平均较对照组(5.6 mmol·L-1葡萄糖+0μmol·L-1NMN)明显升高(P<0.01),说明NMN在调节细胞表达内源性AKT与Sirt1过程中发挥重要作用。见图 9和10。
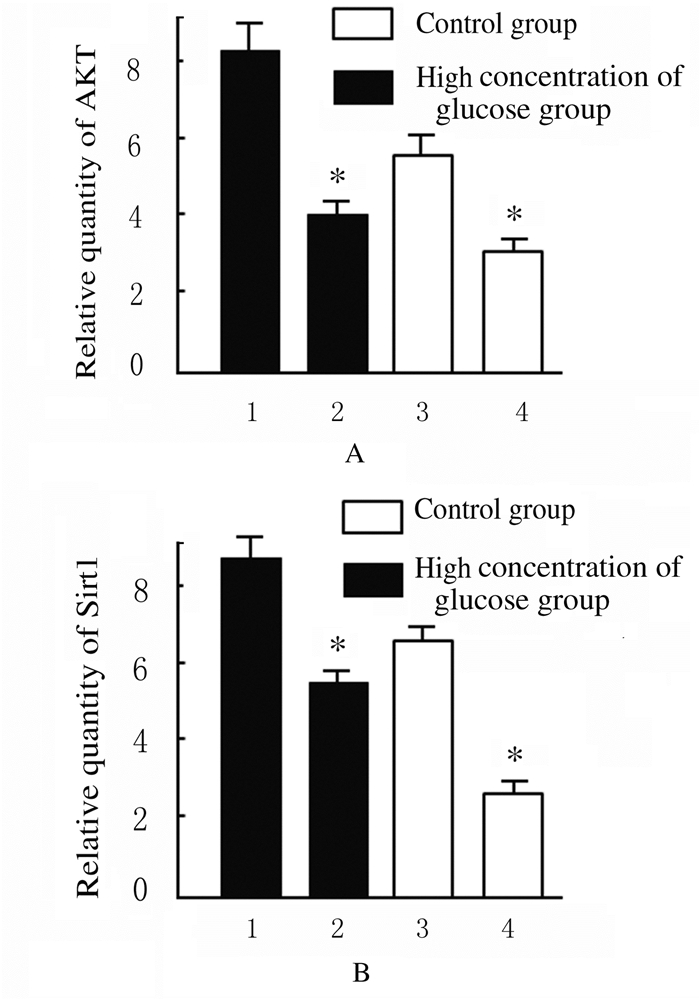
|
| A: AKT; B: HBZY-1.1,2:Before NMN treatment; 3,4:After NMN treatment; *P<0.01 compared with control group. 图 9 对照组和高浓度葡萄糖组HBZY-1细胞中AKT和Sirt1蛋白表达水平 Figure 9 Expression levels of AKT and Sirt1 proteins in HBZY-1 cells in control group and high concentrations of glucose group |
|
|
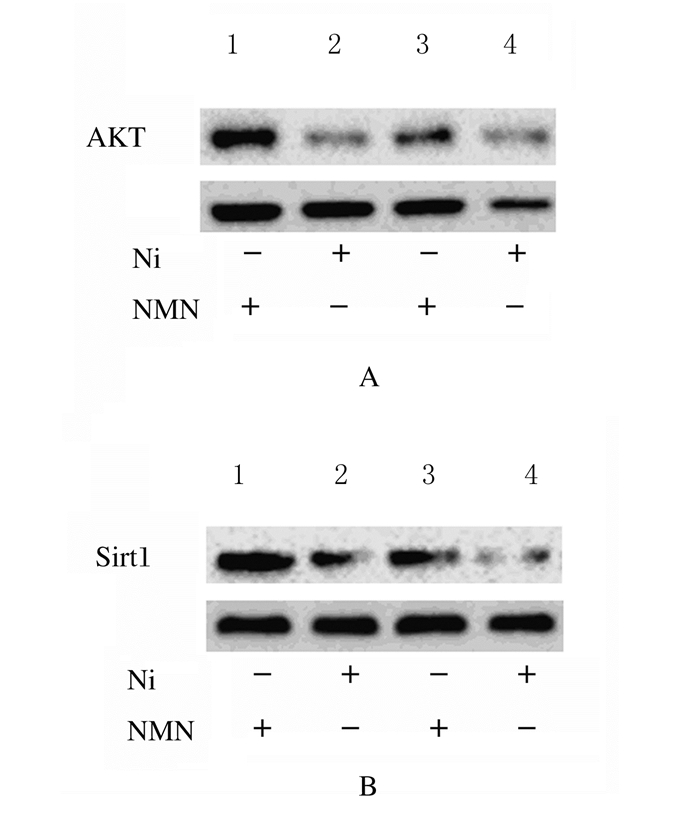
|
| Lane 1, 2:High concentration of glucose group; Lane 3, 4:Control group. 图 10 各组HBZY-1细胞中AKT(A)和Sirt1(B)蛋白表达电泳图 Figure 10 Electrophoregram of expression levels of AKT(A) and Sirt1(B) prioteins in HBZY-1 cells in various groups |
|
|
p-FoxO3a蛋白在应对氧化应激时具有双重作用,当细胞发生氧化应激时,细胞处于胰岛素抵抗状态,细胞中的PI3K/AKT信号传导途径受阻,细胞质中大量p-FoxO3a蛋白集聚到细胞核,参与诱导细胞凋亡[7]。p-FoxO3a蛋白是AKT分子下游能够启动自噬基因转录的主要分子,其过度表达能够启动细胞自噬,并且能够促使成纤维细胞分泌胶原明显减少,从而改善细胞炎症-纤维化过程[8-9]。有学者在基因序列分析时发现:Cav-1启动子基因内包含了几个p-FoxO3a结合位点,使p-FoxO3a牢固地绑定到Cav-1启动子区域,p-FoxO3a转录表达增加了Cav-1 mRNA和蛋白表达。研究[11]显示:通过改变AKT通路能够使p-FoxO3a蛋白激活,进而增强成纤维细胞自噬活性,促进胶原蛋白降解,可以促进肺部纤维化形成。而具有去乙酰化酶活性的沉默信息调节因子Sirt1能够使p-FoxO3a蛋白发生去乙酰化作用,并促使其进入细胞核进而调节细胞生长阻滞。然而,在氧化应激状态下,随着p-FoxO3a蛋白去乙酰化作用增强,p27kip1、Bim和MnSOD等基因表达水平升高,从而降低细胞中的活性氧水平,发挥抗凋亡作用。激活AKT轴能够通过抑制细胞自噬,促进特发性肺纤维化的成纤维细胞维持胶原蛋白形成的病理状态[12],说明细胞凋亡是细胞纤维化形成的重要因素[6, 13-14]。但p-FoxO3a蛋白在DN肾脏纤维化方面的调控作用尚不清楚。本研究结果表明:在机体处于糖尿病肾脏逐步纤维化过程中,肾小球和肾小管细胞中内源性Sirt1和AKT蛋白表达水平均明显降低。本课题组应用NAMPT的代谢产物NMN通过负反馈调节,在改善作为前炎症因子NAMPT表达的前提下,试图提高Sirt1蛋白的表达和活性,通过Sirt1-p-FoxO3a和AKT-p-FoxO3a对DN肾脏纤维化的相关基因发挥作用。本研究结果表明:SD糖尿病大鼠在应用一定量NMN后,肾小管和肾小球细胞中Sirt1和AKT蛋白表达水平均较未施加NMN的对照组明显升高。与此同时,糖尿病+NMN组大鼠肾细胞中p-FoxO3a和Cav-1蛋白表达水平也明显高于对照组。体外实验中,应用高浓度葡萄糖(200mmol·L-1)处理HBZY-1细胞后,再应用不同浓度NMN处理,细胞中AKT与Sirt1也均较未施加NMN组增加。本研究结果显示:当NMN浓度达100μmol·L-1时,Sirt1与AKT蛋白表达水平均达到峰值,且均明显高于对照组,在相同高浓度葡萄糖糖浓度培养条件下,当NMN浓度进一步加大到200 μmol·L-1时,细胞中Sirt1与AKT蛋白表达水平均未见明显升高,说明NMN能够使糖尿病状态下大鼠肾小球和肾小管细胞中Sirt1与AKT蛋白表达水平升高,即NMN能够在高浓度葡萄糖氧化应激状态下使HBZY-1细胞中Sirt1与AKT蛋白表达水平明显升高。在此过程中,经NMN处理的细胞中p-FoxO3a和Cav-1蛋白表达水平也出现明显升高趋势。共聚焦显微镜下显示:糖尿病大鼠肾小球明显变小,且肾小球内细胞排列杂乱无章,呈明显的纤维化状态,但给予NMN后大鼠肾小球形状明显比未施加NMN时规整,肾小球内细胞排列有序,说明NMN通过增加肾脏细胞表达Sirt1与AKT蛋白,间接激活了p-FoxO3a和Cav-1蛋白表达,从而在一定条件下改善了DN肾脏炎性纤维化过程。本实验结果充分说明了NMN能够通过Sirt1-p-FoxO3a和AKT-p-FoxO3a对DN肾脏纤维化的相关基因发挥作用。NMN既是烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD+)前体物质,又是Nampt合成的底物。在正常情况下,Nampt是细胞合成DNA的关键限速酶[15]。然而,在机体处于氧化应激状态下,Nampt能够作为前炎症因子激活典型的炎症通路因子转录因子κB(NF-κB),启动炎症-纤维化通路[16-17]。离体实验[18-19]结果表明:在200 mmol·L-1葡萄糖氧化应激条件下,50μmol·L-1以上NMN即能够通过负反馈抑制内源性Nampt表达,同时在不影响NAD+形成的基础上,促进Sirt1和AKT蛋白表达水平升高[18-19]。本研究结果提示:NMN能够提高糖尿病大鼠肾小球细胞中内源性Sirt1与AKT的表达水平,并改善p-FoxO3a蛋白的表达和磷酸化状态,从而通过Cav-1改善肾脏细胞的炎症纤维化状态,提示NMN及其类似物可能在预防和治疗DN肾小球纤维化中发挥作用。有研究[20-21]进一步证明:在NMN的作用过程中,Sirt1蛋白能使p-FoxO3a的乙酰基迁移,使p-FoxO3a蛋白发生去乙酰化反应,从而上调p-FoxO3a蛋白与特定靶基因的DNA结合能力并增加其转录活性。Sirtuins是一种NAD+依赖性的去乙酰化酶,即Sirtuins的去乙酰化反应需要氧化性的NAD+参与[22]。内源性Sirt1蛋白通过加强p-FoxO3a蛋白诱导细胞周期阻滞,允许细胞具有更多时间来修复损伤的DNA,并消除自由基的危害[23]。本研究结果显示:在糖尿病大鼠肾脏实质细胞中, p-FoxO3a蛋白能够同时受到Sirt1和AKT蛋白的共同调控,这一结果提示NMN可能在DN肾小球炎症纤维化过程中发挥作用。
| [1] | Nho RS, Hergert P. FoxO3a and disease progression[J]. World J Biol Chem, 2014, 5(3): 346–354. DOI:10.4331/wjbc.v5.i3.346 |
| [2] | van Grevenynghe J, Cubas RA, DaFonseca S, et al. FoxO3a:an integrator of immune dysfunction during HIV infection[J]. Cytokine Growth Factor Rev, 2012, 23(4/5): 215–221. |
| [3] | Karadedou CT, Gomes AR, Chen J, et al. FOXO3a represses VEGF expression through FOXM1 dependent and independent mechanisms in breast cancer[J]. Oncogene, 2012, 31(14): 1845–1858. DOI:10.1038/onc.2011.368 |
| [4] | Zheng T, Lu Y. Changes in SIRT1 expression and its downstream pathways in age-related cataract in humans[J]. Curr Eye Res, 2011, 36(5): 449–455. DOI:10.3109/02713683.2011.559301 |
| [5] | Kim BC. FoxO3a mediates transforming growth factor-beta1-induced apoptosis in FaO rat hepatoma cells[J]. BMB Rep, 2008, 41(10): 728–732. DOI:10.5483/BMBRep.2008.41.10.728 |
| [6] | Ozaki I, Hamajima H, Matsuhashi S, et al. Regulation of TGF-β1 induced Pro-apoptotic signaling by growth factor receptors and extracellular matrix receptor integrins in the liver[J]. Front Physil, 2011, 2: 78. |
| [7] | Behzad H, Jamil S, Denny TA, et al. Cytokine-mediated FOXO3a phosphorylation suppresses FasL expression in hemopoietic cell lines:investigations of the role of Fasin apoptosis due to cytokine starvation[J]. Cytokine, 2007, 38(2): 74–83. DOI:10.1016/j.cyto.2007.05.004 |
| [8] | Yoon HE, Kim SJ, Kim SJ, et al. Tempol attenuates renal fibrosis in mice with unilateral ureteral obstruction:the role of PI3K-Akt-FoxO3a signaling[J]. J Korean Med Sci, 2014, 29(2): 230–237. DOI:10.3346/jkms.2014.29.2.230 |
| [9] | Im J, Hergert P, Nho RS. Reduced FoxO3a expression causes low autophagy in idiopathic pulmonary fibrosis fibroblasts on collagen matrices[J]. Am J Physiol Lung Cell Mol Physiol, 2015, 309(6): L552–L561. DOI:10.1152/ajplung.00079.2015 |
| [10] | Nho RS, Peterson M, Hergert P, et al. FoxO3a(Forkhead BoxO3a) deficiency protects idiopathic pulmonary fibrosis(IPF) fibroblasts from type Ⅰ polymerized collagen matrix-induced apoptosis via caveolin-1(cav-1) and Fas[J]. PLoS One, 2013, 8(4): e61017. DOI:10.1371/journal.pone.0061017 |
| [11] | Zhang M, Lee SJ, An C, et al. Caveolin-1 mediates Fas-BID signaling in hyperoxia-induced apoptosis[J]. Free Radic Biol Med, 2011, 50(10): 1252–1262. DOI:10.1016/j.freeradbiomed.2011.02.031 |
| [12] | Chuang PY, Cai W, Li X, et al. Reduction in podocyte SIRT1 accelerates kidney injury in aging mice[J]. Am J Physiol Renal Physiol, 2017, 313(3): F621–F628. DOI:10.1152/ajprenal.00255.2017 |
| [13] | Oellerich MF, Potente M. FOXOs and sirtuins in vascular growth, maintenance, and aging[J]. Circ Res, 2012, 110(9): 1238–1251. DOI:10.1161/CIRCRESAHA.111.246488 |
| [14] | Yang C, C ao, Zhang Y, et al. Cyclic helix B peptide inhibits ischemia reperfusion-induced renal fibrosis via the PI3K/Akt/FoxO3a pathway[J]. J Transl Med, 2015, 13: 355. DOI:10.1186/s12967-015-0699-2 |
| [15] | Yaku K, Okabe K, Nakagawa T. NAD metabolism:Implications in aging and longevity[J]. Ageing Res Rev, 2018, 47: 1–17. DOI:10.1016/j.arr.2018.05.006 |
| [16] | Lu Q, Zhai Y, Cheng Q, et al. The Akt-FoxO3a-manganese superoxide dismutase pathway is involved in the regulation of oxidative stress in diabetic nephropathy[J]. Exp Physiol, 2013, 98(8): 934–945. |
| [17] | Busso N, Karababa M, Nobile M, et al. Pharmacological inhibition of nicotinamide phosphoribosyltransferase/visfatin enzymatic activity identifies a new inflammatory pathway linked to NAD[J]. PLoS One, 2008, 3(5): e2267. DOI:10.1371/journal.pone.0002267 |
| [18] | Jin X, Wei Y, Xu F, et al. SIRT1 promotes formation of breast cancer through modulating Akt activity[J]. J Cancer, 2018, 9(11): 2012–2023. DOI:10.7150/jca.24275 |
| [19] | Sun W, Li Y, Wei S. miR-4262 regulates chondrocyte viability, apoptosis, autophagy by targeting SIRT1 and activating PI3K/AKT/mTOR signaling pathway in rats with osteoarthritis[J]. Exp Ther Med, 2018, 15(1): 1119–1128. |
| [20] | Frazzi R, Valli R, Tamagnini I, et al. Resveratrol-mediated apoptosis of hodgkin lymphoma cells involves SIRT1 inhibition and FOXO3a hyperacetylation[J]. Int J Cancer, 2013, 132(5): 1013–1021. DOI:10.1002/ijc.v132.5 |
| [21] | Lalmansingh AS, Karmakar S, Jin Y, et al. Multiple modes of chromatin remodeling by Forkhead box proteins[J]. Biochim Biophys Acta, 2012, 1819(7): 707–715. DOI:10.1016/j.bbagrm.2012.02.018 |
| [22] | Logan RW, Parekh PK, Kaplan GN. NAD+ cellular redox and SIRT1 regulate the diurnal rhythms of tyrosine hydroxylase and conditioned cocaine reward[J]. Mol Psychiatry, 2018. DOI:10.1038/s41380-018-0061-1 |
| [23] | Hu Q, Wang G, Peng J, et al. Knockdown of SIRT1 suppresses bladder cancer cell proliferation and migration and induces cell cycle arrest and antioxidant response through FOXO3a-mediated pathways[J]. Biomed Res Int, 2017, 2017: 3781904. |
 2018, Vol. 44
2018, Vol. 44


