扩展功能
文章信息
- 赵丹, 曹东慧, 金美善, 吴孟辉, 王玥琦, 杨娜, 周天宇, 张厚君, 姜晶, 曹雪源
- ZHAO Dan, CAO Donghui, JIN Meishan, WU Menghui, WANG Yueqi, YANG Na, ZHOU Tianyu, ZHANG Houjun, JIANG Jing, CAO Xueyuan
- β-甘草次酸对炎症相关胃癌的抑制作用及其机制
- Inhibitory effect of 18β-glycyrrhetinic acid on inflammation-related gastric cancer and its mechanism
- 吉林大学学报(医学版), 2018, 44(06): 1150-1155
- Journal of Jilin University (Medicine Edition), 2018, 44(06): 1150-1155
- 10.13481/j.1671-587x.20180607
-
文章历史
- 收稿日期: 2018-02-06
2. 吉林大学第一医院病理诊断中心, 吉林 长春 130021;
3. 吉林大学第一医院胃结直肠外科, 吉林 长春 130021
2. Center of Pathological Diagnosis, First Hospital, Jilin University, Changchun 130021, China;
3. Department of Gastric and Colorectal Surgery, First Hospital, Jilin University, Changchun 130021, China
胃癌是常见恶性肿瘤之一,2012年全球有95.2万新发胃癌病例,死亡72.3万例[1]。2013年中国胃癌新发病例42.7万,死亡30.1万例[2]。探索胃癌发病机制,降低胃癌发病率是当务之急。炎症反应与胃癌发生有密切关联,通过调节和抑制胃黏膜炎症反应从而降低胃癌发病是化学预防胃癌研究的热点之一。研究[3]显示:一些植物多酚类活性物质对胃炎和胃癌发病具有抑制作用,包括茶多酚和姜黄素等,然而目前对这些天然活性物质的抑癌机制尚有待深入研究。胃癌动物模型K19-C2mE转基因鼠的胃黏膜高表达前列素内环氧化物合成酶2(prostaglandin endoperoxide synthase 2, PTGS2)和前列素E合成酶(prostaglandin E synthase, PTGES),环氧化酶2(cyclooxygenase-2, COX-2)/前列腺素E2(prostaglandin E2, PGE2)信号通路激活,胃黏膜自发出现明显的炎症反应和肿瘤[4-5]。在此基础上,Oshima等[6]建立了另一种新型胃肿瘤动物模型—K19-Wnt/C2mE转基因鼠模型,该动物胃黏膜内同时过表达COX-2/PGE2和Wnt信号通路,组织结构形态与人胃癌中的管状腺癌相似,且与炎症有密切关联[7],该模型是研究胃癌发病机制和化学预防的重要模型之一。
18β甘草次酸(18β-glycyrrhetinic acid, 18β-GA)具有抗炎、抗溃疡、抗肿瘤以及调节免疫功能等广泛的生理活性。本课题组既往研究[8-10]显示:18β-GA可明显降低K19-C2mE转基因鼠胃癌的发生率,同时可有效减轻胃黏膜炎症反应,其机制可能是通过下调COX-2和白细胞介素1β(interleukin-1β,IL-1β)表达而实现。目前,同类研究大多局限于细胞系体外实验,而本研究利用更接近人类胃癌的K19-Wnt/C2mE模型小鼠(简称Gan小鼠),通过体内实验研究18β-GA的抑癌作用,探讨18β-GA是否通过降低炎症反应、影响细胞分化从而抑制胃癌发生,为18β-GA化学预防胃癌提供理论依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器K19-Wnt/C2mE转基因小鼠(雄性小鼠3只,雌性小鼠5只,购自日本熊本大学实验动物中心,动物合格证号:OS150CARDID:709)和C57BL/6N野生小鼠(雄性小鼠2只,雌性小鼠15只, 购自维通利华实验动物技术有限公司,动物合格证号:1140070018832)均为6周龄,体质量12~20 g,均在吉林大学SPF动物实验室繁殖饲养。K19-Wnt/C2mE与C57BL/6N野生型小鼠交配,获得子代小鼠。4周龄时剪取鼠尾检测基因序列。将72只转基因小鼠随机分为18β-GA给药组(n=36)和对照组(n=36)。投药方法:从动物6周龄开始,18β-GA给药组小鼠给予质量浓度为0.1%的18β-GA水溶液作为饮水,对照组小鼠给予正常饮水。2组小鼠饮水均新鲜配制,每周更换3次,2组小鼠均自由饮用。温度(23℃±2℃)、湿度(50%±8%)、昼夜交替(12 h白昼交替)、饲料(SPF级)等均保持一致。52周后对小鼠进行麻醉解剖,取胃并沿胃大弯剖开,观察记录肿瘤形态,测量肿瘤直径。兔抗Wnt-1、COX-2、Ki-67、F4/80和KCNE2多克隆抗体购自美国Abcam公司(货号:ab15251、ab15191、ab15580、ab15580、ab69376),兔抗β-catenin单克隆抗体购自美国Cell Signaling Technology公司(货号:0582s),兔抗ATP4a和胃蛋白酶原C(pepsinogen C, PGC)多克隆抗体购自德国Sigma公司(货号:Merck 119102、HPA031718),柠檬酸钠、PBS、山羊血清和二氨基联苯胺(DAB)购自福建省福州市迈新生物技术开发有限公司,中性甲醛购自长春赛默瑞特科技有限公司,石蜡购自上海器械厂华灵康复有限公司,乙醇和二甲苯购自北京化工厂,中性树脂封片剂购自中国上海标本模型厂。切片机购自德国莱卡公司,烘箱购自上海一恒科学仪器有限公司,显微镜购自日本奥林巴斯公司,冰箱购自中国海尔集团。
1.2 标本取材和形态观察标本离体后按照癌组织和癌旁组织、胃近端和远端划分分别取材。部分组织置于液氮冷冻,然后于-80℃深低温保存。另一部分组织标本置于10%中性甲醛中固定、常规石蜡包埋切片。观察2组小鼠胃组织形态表现。
1.3 HE染色切片经65℃烘箱烘烤10 min后,常规采用二甲苯脱蜡,经各级乙醇梯度脱水至水洗:二甲苯2次,每次10 min;无水乙醇洗涤2次,90%乙醇和80%乙醇各1次,自来水洗涤后盐酸酒精分化,氨水溶液洗涤30 s,伊红染色1 min,自来水洗后脱水封片:80%乙醇和90%乙醇各1次,无水乙醇2次,二甲苯2次。中性树脂封片。
1.4 免疫组织化学染色切片经65℃烘干后,常规脱蜡,梯度水化,柠檬酸钠高温高压抗原修复1.5 min,PBS洗涤3次各5 min;内源性过氧化酶阻断剂5 min;蒸馏水浸泡后,正常山羊血清室温封闭10 min;PBS洗涤3次各5 min;滴加一抗Wnt-1、COX-2、β-catenin、Ki-67、F4/80、ATP4a、KCNE2和PGC100 μ L,室温静置1.5 h;PBS洗涤3次,各5 min;滴加HRP标记羊抗兔IgG抗体室温静置30 min;PBS洗涤3次,各5 min;DAB显色,苏木精复染3 min脱水封片。
结果判定采用组织化学评分(histochemistry score, H-score)系统评估染色强度及特定强度范围内细胞染色百分比:H-score=Σpi(i)(i=0,1,2,3,pi=0~100%)。i代表肿瘤细胞的染色强度(无染色=0,弱染色=1,中度染色=2,强染色=3),pi是每一个强度下肿瘤细胞染色的百分比,范围0~100%。H-score的总分为各强度得分之和,结果为0~300。
1.5 肿瘤组织病理学检查结果的判定标准病理学检查结果分为轻度、中度和重度不典型增生。轻度不典型增生:细胞变圆上皮增厚,但细胞仍靠近基底膜一侧,存在核分裂相,但细胞异型性所占比例不大;中度不典型增生:癌细胞核浆比增高,核异形性高,多见核分裂相,可见癌细胞以单层或多层排列成腺管状,但细胞极性发生改变,且核大深染;重度不典型增生:细胞排列紊乱,腺管结构不规则,有的相互融合,呈分支状或折叠状,细胞极性丧失,细胞原形态彻底消失,呈柱状或立方形,异型细胞较多。
1.6 统计学分析采用GraphPad Prism 5.0软件制作图表,采用SPSS 18.0统计软件进行统计学分析。各组小鼠肿瘤直径以x±s表示,组间样本均数比较采用t检验。各种蛋白的H-score(呈非正态分布)以M(P25,P75)表示,组间比较采用秩和检验。胃癌发病率组间比较采用χ2检验或Fisher精确概率法。以P<0.05为差异有统计学意义。
2 结果 2.1 各组小鼠胃癌组织大体及镜下形态表现大体形态观察显示:野生型小鼠的胃黏膜光滑,未见糜烂、溃疡或息肉增生等病变(图 1A,见插页一);对照组小鼠的胃黏膜明显肥厚,表面粗糙,呈颗粒状,肿瘤呈菜花或息肉状隆起(图 1B,见插页一);18β-GA给药组小鼠的胃肿瘤体积变小,虽然仍存在隆起,但瘤旁组织变光滑,并可见正常胃黏膜皱襞(图 1C,见插页一)。

|
| A: Wild type; B: Control group; C: 18β-GA treatment group. 图 1 各组小鼠胃肿瘤组织大体外观 Figure 1 General appearances of gastric tumor tissue of mice in various groups |
|
|
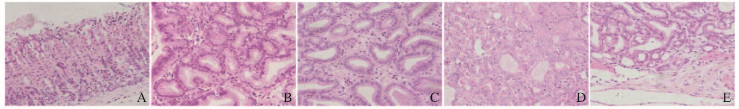
镜下观察:野生型小鼠胃黏膜呈现正常的组织学形态表现,黏膜及黏膜下层无炎性细胞浸润,各层组织结构明显、排列有序;对照组小鼠胃黏膜出现不同程度的不典型增生,根据病理学检查结果分为轻度、中度和重度不典型增生。本模型胃肿瘤的特征是癌细胞局限于上皮层内而未突破基底膜向下浸润,无侵袭或转移。见图 2(插页二)。
|
| A: Normal gastric mucosa; B: Mild dysplasia; C: Moderate dysplasia; D: Severe dysplasia; E: Gastric carcinoma in situ. 图 2 各组小鼠肿瘤组织形态表现(HE, ×200) Figure 2 Morphology of gastric tumor tissue of mice in various groups(HE, ×200) |
|
|
对照组小鼠胃黏膜轻度不典型增生2例,中重度不典型增生10只,胃癌24只;18β-GA给药组小鼠轻度不典型增生1只,中重度不典型增生21例,胃癌14只。与对照组(38.9%)比较,18β-GA给药组小鼠胃癌发病率(66.6%)明显降低(P=0.019)。见表 1。18β-GA给药组小鼠肿瘤直径[(1.28±0.51)cm]明显小于对照组[(2.16±1.15)cm](P<0.01)。
| (n=36, η/%) | |||||
| Group | Incidence of mild dysplasia |
Incidence of moderate and severe dysplasia |
Incidence of gastric cancer |
χ2 | P |
| Control 18β-GA treatment |
5.6(2/36) 2.8(1/36) |
27.8(10/36) 58.3(21/36) |
66.6(24/36) 38.9(14/36) |
6.88 | 0.019 |
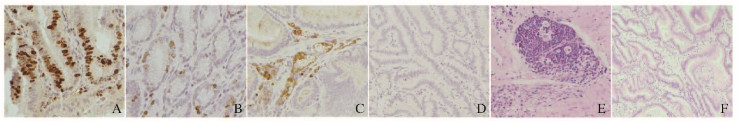
免疫组织化学染色结果显示:细胞增殖标志Ki-67阳性表达定位于胃黏膜上皮细胞核,呈浅棕或深棕色。对照组中有12只(32%)H-score为3分,15只(39%)H-score为2分,11只(29%)H-score为1分;18β-GA给药组中有13只(37%)H-score为3分,16只(46%)H-score为2分,6只(17%)H-score为1分。2组小鼠H-score比较差异有统计学意义[92.5(85.0,96.5)vs 55.0(40.0,62.5),P<0.01)]。
巨噬细胞F4/80染色结果显示:对照组小鼠胃黏膜内和黏膜下存在大量巨噬细胞,18β-GA给药组小鼠胃黏膜上皮大部分细胞为阴性染色,间质存在少量巨噬细胞浸润;对照组和18β-GA给药组小鼠H-score[180(120,210)vs 90(60, 150)]比较差异有统计学意义(P<0.01)。对照组小鼠胃黏膜上皮细胞间及固有层可见大量淋巴细胞及中性粒细胞浸润,以淋巴细胞浸润为主。18β-GA给药组小鼠炎症反应明显减轻,可见部分细胞排列紊乱。见图 3(插页二)。
|
| A, B: Ki-67 staining; C, D: F4/80 staining; E, F: HE staining; A, C, E: Control group; B, D, F: 18β-GA treatment group. 图 3 2组小鼠胃黏膜上皮细胞增殖和炎性反应形态表现(×200) Figure 3 Morphology of proliferation and inflammatory response of gastric epithelial cells of mice in two groups (×200) |
|
|
ATP4a表达阳性染色主要集中于胃壁细胞的细胞膜。KCNE2蛋白阳性表达集中在细胞质,PGC阳性表达主要集中在胃腺体部位,18β-GA组小鼠胃黏膜大部分细胞的细胞膜为深棕色的ATP4a阳性染色,KCNE2和PGC的阳性表达升高。见图 4(插页二)。2组小鼠ATP4a、KCNE2和PGC阳性表达率比较差异有统计学意义(P=0.045, P=0.007,P=0.021)。见图 5。

|
| A, B: ATP4a; C, D: KCNE2; E, F: PGC; A, C, E: Control group; B, D, F: 18β-GA treatment group. 图 4 2组小鼠胃黏膜上皮细胞分化反应形态表现(×200) Figure 4 Morphology of differentiation response of gastric epithelial cells of mice in two groups (×200) |
|
|

|
| A: ATP4a;B: KCNE2; C: PGC. 图 5 2组小鼠ATP4a、KCNE2和PGC的H-scores Figure 5 H-scores of ATP4a, KCNE2, and PGC of mice in two groups |
|
|
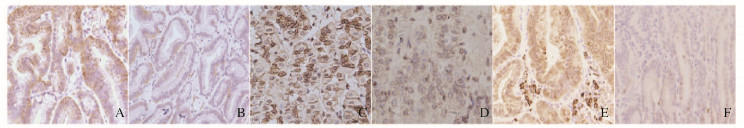
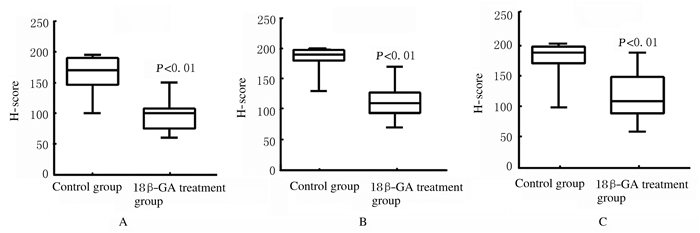
对照组小鼠Wnt-1和COX-2蛋白主要表达于细胞质中,对照组较18β-GA给药组小鼠Wnt-1和COX-2的H-score降低(P<0.01)。对照组小鼠β-catenin在细胞质或细胞核中表达,18β-GA给药组小鼠β-catenin在细胞质或细胞核中少量表达,见图 6(插页二)。2组小鼠Wnt-1、β-catenin和COX-2的H-score比较差异有统计学意义(P<0.01)。见图 7。
|
| A, B: Wnt-1; C, D: β-catenin; E, F: COX-2; A, C, E: Control group; B, D, F: 18β-GA treatment group. 图 6 2组小鼠胃黏膜上皮细胞中Wnt-1、β-catenin和COX-2的表达(×200) Figure 6 Expressions of Wnt-1, β-catenin, and COX-2 in gastric epithelial cells of mice in two groups (×200) |
|
|
|
| A: Wnt-1;B: β-catenin; C: COX-2. 图 7 2组小鼠Wnt-1、β-catenin和COX-2的H-scores Figure 7 H-scores of Wnt-1, β-catenin, and COX-2 of mice in two groups |
|
|
现代研究[11-12]证实:药食两用植物甘草的主要成分之一18β-GA是由三萜类化合物甘草甜素水解后脱去两分子萄糖醛酸的产物,具有较强的抗炎、抗溃疡、抗肿瘤及增强免疫功能等作用[13-14]。迄今,虽然一些研究[15-16]显示18β-GA对胃癌细胞系生长具有抑制作用,但是缺乏体内实验证据。Gan小鼠作为炎症相关的胃癌模型,在小鼠近端胃黏膜出现局部隆起型肿瘤,能近似模拟人胃癌的发病过程。本研究体内实验证实18β-GA可以有效抑制胃黏膜细胞增殖,降低炎症反应,促进细胞分化,减少癌前病变,降低胃癌发病率。肿瘤发生涉及细胞增殖、分化、黏附、迁移和细胞凋亡等多个步骤。H+-K+-ATP酶的分子结构包括α和β蛋白质亚基[17],H+-K+-ATP酶的α亚基(即ATP4a)在胃壁细胞中表达,特别是在分泌性小管的细胞质囊泡或顶端血浆膜中,ATP4a催化ATP水解,与血浆膜上的H+和K+离子交换相结合,负责胃酸分泌。Judd等[18]报道:H+-K+-ATP敲除的小鼠,胃上皮壁细胞的细胞膜完成性受到破坏,8个月后胃腺管增厚2倍。12和20个月后出现胃黏膜增生,1年后发现肠化生,黏蛋白实现从中性到酸性的转变,CD44表达水平上调,最终出现胃肿瘤。本研究结果证实:18β-GA给药后,小鼠胃组织中ATP4a表达水平升高,细胞进一步分化,泌酸能力增强。
PGC主要由胃底腺的主细胞和颈黏液细胞等分泌,在酸性条件下可转化为具有消化功能的胃蛋白酶,PGC标志着胃黏膜细胞的分化成熟[17]。研究[19]表明:PGC在肿瘤中广泛表达,其可能与肿瘤细胞增殖、分化、浸润和迁移过程中激素水平变化有关。PGC水平的变化可以反映胃黏膜病变和分化程度,与萎缩性胃炎、不典型增生及癌变等有关。Fernandez等[20]发现:PGC在高、中和低分化胃癌组织中阳性表达率依次降低。本研究结果显示:18β-GA可以提高PGC水平,说明18β-GA能够促进胃黏膜上皮细胞分化,改善胃黏膜功能。
Wnt/β-catenin信号通路在胃癌发生发展过程中起关键作用。Wnt/β-catenin异常激活与肿瘤的发生发展有密切关系[21],肿瘤干细胞分化通常伴有Wnt/β-catenin通路的激活以及β-catenin水平升高。当Wnt信号通路被激活时,胞浆内活化的Dishevelled蛋白介导PGC磷酸化GSK-3β,使GSK-3β失去活性不能磷酸化β-catenin,致使β-catenin不被降解而蓄积在胞浆,并转移入细胞核内与核转录因子中的T细胞转录因子(T-cell factor,TCF)/淋巴增强因子(lymphoid enhancer factor, LEF)结合,形成β-catenin /TCF/LEF转录复合物并启动Wnt靶基因转录,从而导致肿瘤干细胞分化成肿瘤[22],Wnt/β-catenin参与了炎症微环境下细胞的分化,Wnt通路激活可促进COX-2/PGE2信号通路的表达使机体产生炎症微环境。COX-2 /PGE2是胃癌发生过程中的重要途径之一[23-25]。COX-2表达与IL-1β诱导的NF-κB转录活性激活有密切关联,COX-2基因于转录水平被激活,进而引起蛋白表达导致炎症反应的发生。
综上所述,18β-GA处理后小鼠胃组织中Ki-67和F4/80的H-score明显降低,ATP4a、KCNE2和PGC的H-score明显升高,Wnt/β-catenin和COX-2信号通路被抑制,表明18β-GA可能通过调控Wnt和COX-2信号通路抑制细胞增殖,降低炎症反应,促进细胞分化,进而抑制了胃癌的发生发展。
| [1] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87–108. DOI:10.3322/caac.21262 |
| [2] | 陈万青, 郑荣寿, 张思维, 等. 2013年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2017(1): 1–7. |
| [3] | Jiang J, Cao D, Jia Z, et al. The green tea polyphenol epigallocatechin-3-gallate effectively inhibits helicobacter pylori-induced gastritis in Mongolian gerbils[J]. Int J Clin Exp Med, 2016, 9(2): 2479–2485. |
| [4] | Oshima H, Oshima M, Inaba K, et al. Hyperplastic gastric tumors induced by activated macrophages in COX-2/mPGES-1 transgenic mice[J]. EMBO J, 2004, 23(7): 1669–1678. DOI:10.1038/sj.emboj.7600170 |
| [5] | 尤丽丽, 曹东慧, 姜晶, 等. 原发胃癌转基因小鼠模型的病理特征及应用新进展[J]. 世界华人消化杂志, 2015, 23(17): 2754–2760. |
| [6] | Oshima H, Matsunaga A, Fujimura T, et al. Carcinogenesis in mouse stomach by simultaneous activation of the Wnt signaling and prostaglandin E2 pathway[J]. Gastroenterology, 2006, 131(4): 1086–1095. DOI:10.1053/j.gastro.2006.07.014 |
| [7] | Echizen K, Hirose O, Maeda Y, et al. Inflammation in gastric cancer:Interplay of the COX-2/prostaglandin E2 and Toll-like receptor/MyD88 pathways[J]. Cancer Sci, 2016, 107(4): 391–397. DOI:10.1111/cas.2016.107.issue-4 |
| [8] | Cao D, Jiang J, Tsukamoto T, et al. Canolol inhibits gastric tumors initiation and progression through COX-2/PGE2 pathway in K19-C2mE transgenic mice[J]. PLoS One, 2015, 10(3): e0120938. DOI:10.1371/journal.pone.0120938 |
| [9] | Cao D, Jiang J, You L, et al. The protective effects of 18β-glycyrrhetinic acid on Helicobacter pylori-infected gastric mucosa in Mongolian gerbils[J]. Biomed Res Int, 2016, 2016(5): 494373. |
| [10] | 尤丽丽, 曹东慧, 姜晶, 等. 18β-甘草次酸对K19-C2mE转基因鼠胃肿瘤的抑制作用及其机制[J]. 吉林大学学报:医学版, 2016, 42(2): 221–225. |
| [11] | Wu X, Zhang L, Gurley E, et al. Prevention of free fatty acid-induced hepatic lipotoxicity by 18 beta-glycyrrhetinic acid through lysosomal and mitochondrial pathways[J]. Hepatology, 2008, 47(6): 1905–1915. DOI:10.1002/hep.v47:6 |
| [12] | Hasan SK, Siddiqi A, Nafees S, et al. Chemopreventive effect of 18β-glycyrrhetinic acid via modulation of inflammatory markers and induction of apoptosis in human hepatoma cell line (HepG2)[J]. Mol Cell Biochem, 2016, 416(1-2): 169–177. DOI:10.1007/s11010-016-2705-2 |
| [13] | Parida PK, Sau A, Ghosh T, et al. Synthesis and evaluation of triazole linked glycosylated 18β-glycyrrhetinic acid derivatives as anticancer agents[J]. Bioorg Med Chem Lett, 2014, 24(16): 3865–3868. DOI:10.1016/j.bmcl.2014.06.054 |
| [14] | Gao C, Dai FJ, Cui HW, et al. Synthesis of novel heterocyclic ring-fused 18β-glycyrrhetinic acid derivatives with antitumor and antimetastatic activity[J]. Chem Biol Drug Des, 2014, 84(2): 223–233. DOI:10.1111/cbdd.2014.84.issue-2 |
| [15] | 王银环, 范钰, 张尤历, 等. 18β-甘草次酸对人胃癌细胞BGC823增殖的抑制[J]. 江苏大学学报:医学版, 2007, 17(3): 251–253. |
| [16] | 贾洪岩, 林芳, 王立敏, 等. 甘草次酸对人胃癌HGC-27的抑制增殖和诱导凋亡作用[J]. 黑龙江医药科学, 2016, 39(2): 88–92. DOI:10.3969/j.issn.1008-0104.2016.02.040 |
| [17] | 李凤斐, 杜维桓, 杨桂彬, 等. ATP4B在不同程度胃黏膜病变中的表达及其与幽门螺杆菌感染的关系[J]. 北京医学, 2014, 36(1): 12–14. DOI:10.3969/j.issn.1671-167X.2014.01.003 |
| [18] | Judd LM, Andringa A, Rubio CA, et al. Gastric achlorhydria in H/K-ATPase-deficient (Atp4a(-/-)) mice causes severe hyperplasia, mucocystic metaplasia and upregulation of growth factors[J]. J Gastroenterol Hepatol, 2005, 20(8): 1266–1278. DOI:10.1111/jgh.2005.20.issue-8 |
| [19] | Rojo JV, Merino AM, González LO, et al. Expression and clinical significance of pepsinogen C in epithelial ovarian carcinomas[J]. Eur J Obstet Gynecol Reprod Biol, 104(1): 58–63. DOI:10.1016/S0301-2115(01)00610-8 |
| [20] | Fernández R, Vizoso F, Rodríguez JC, et al. Expression and prognostic significance of pepsinogen C in gastric carcinoma[J]. Ann Surg Oncol, 2000, 7(7): 508–514. DOI:10.1007/s10434-000-0508-9 |
| [21] | Li G, Su Q, Liu H, et al. Frizzled7 promotes epithelial-to-mesenchymal transition and stemness via activating canonical Wnt/β-catenin pathway in gastric cancer[J]. Int J Biol Sci, 2018, 14(3): 280–293. DOI:10.7150/ijbs.23756 |
| [22] | Xu H, Posner GH, Stevenson M, et al. Apc MIN modulation of vitamin D secosteroid growth control[J]. Carcinogenesis, 2010, 31(8): 1434–1441. DOI:10.1093/carcin/bgq098 |
| [23] | Molaei F, Forghanifard MM, Fahim Y, et al. Molecular signaling in tumorigenesis of gastric cancer[J]. Iran Biomed J, 2018, 22(4): 217–230. DOI:10.29252/ibj.22.4.217 |
| [24] | 和水祥, 张丹, 禄韶英. 胃癌的分子机制及靶向诊断研究进展[J]. 西安交通大学学报:医学版, 2016, 37(4): 461–472. |
| [25] | 师阿盟, 史海涛, 董蕾, 等. SDF-1/CXCR7对胃癌SGC-7901细胞合成及分泌炎症因子的影响[J]. 西安交通大学学报:医学版, 2017, 38(1): 34–38, 43. |
 2018, Vol. 44
2018, Vol. 44


