扩展功能
文章信息
- 朱旭蓉, 燕玉娥, 狄政莉, 王天仲, 何芳, 王新来, 高晓宇, 郑雪娇
- ZHU Xurong, YAN Yue, DI Zhengli, WANG Tianzhong, HE Fang, WANG Xinlai, GAO Xiaoyu, ZHENG Xuejiao
- miRNA-155在大鼠脑缺血/再灌注损伤早期大脑皮层组织中的表达及其意义
- Expression of miRNA-155 in cerebral cortex tissue of rats with cerebral ischemia-reperfusion injury and its significance
- 吉林大学学报(医学版), 2018, 44(06): 1144-1149
- Journal of Jilin University (Medicine Edition), 2018, 44(06): 1144-1149
- 10.13481/j.1671-587x.20180606
-
文章历史
- 收稿日期: 2018-02-06
2. 延安大学医学院临床医学系, 陕西 延安 716000
2. Depentment of Clinical Medicine, School of Medical Sciences, Yan'an University, Yan'an 716000, China
卒中引起的死亡占全世界死亡原因的9%,是仅次于心脏疾病的第二大死亡原因,是造成永久性残疾的主要因素[1-2]。随着我国人口老龄化的不断加剧,卒中发病率也日益增多。卒中分为缺血性卒中和出血性卒中,其中缺血性卒中占卒中总数的85%以上。既往研究[3]显示:缺血/再灌注损伤是其损伤机制之一,但其具体机制及干预靶点尚不清楚,因此探讨卒中确切分子机制及有效的治疗靶点已成为国内外面临的重大挑战。微小RNA(microRNA,miRNA)是近年来发现的一种非编码RNA,其长度为20 ~ 22 bp,通过与其靶mRNA分子的3′端非编码区域互补配对, 从而使靶mRNA分子在翻译水平受到抑制或直接导致其降解,进而参与调控细胞生长分化、能量代谢和细胞凋亡等各个重要而基本的细胞生理过程[4]。miRNA与多种疾病有关,其与脑血管疾病也密不可分。miR-155是miRNA家族的一员,具有miRNA功能,参与了肿瘤、炎症反应和心肌梗死等疾病的发生发展。既往研究[5]提示脑缺血后miR-155表达可能存在变化,但其在脑缺血/再灌注损伤中确切变化情况尚未得到证实。本研究观察在急性脑缺血/再灌注损伤大鼠大脑皮层组织中miRNA-155表达的变化,为进一步探讨miRNA-155在脑缺血/再灌注损伤中的作用提供理论依据。
1 材料与方法 1.1 动物、主要试剂和仪器48只健康成年雄性SD大鼠,体质量250 ~ 280 g,由西安交通大学医学院实验动物中心提供,动物合格证号:SCHK(陕)2018-001。2, 3, 5-氯化三苯基四氮唑(TTC)购自美国Sigma公司,Trizol试剂购自美国Invitrogen公司, TaqMan® MicroRNA Reverse Transcription Kit、TaqMan探针TaqMan® MicroRNA Assays和TaqMan® Universal PCR Master Mix Ⅱ with UNG购自美国Applied Biosystems公司。NanoDrop ®ND-1000紫外分光光度仪购自美国Thermo公司,qRT-PCR仪购自美国Bio-Rad公司。
1.2 动物分组和给药48只大鼠随机分为假手术组(大鼠只分离血管)和脑缺血/再灌注组(大鼠缺血90 min后再进行复灌注);将2组大鼠分别再分为3个亚组,即再灌注24、48和72 h组,每组8只。
1.3 大鼠脑缺血/再灌注模型建立所有SD大鼠在恒温动物房中适应3 d,12 h昼夜交替,自由饮食,避免不良刺激。术前禁食12 h, 自由饮水,采用10%水合氯醛350 mg·kg-1腹腔注射麻醉后固定在实验台上。参照Ji等[6]改良线栓法栓塞大鼠右侧大脑中动脉制作脑缺血/再灌注模型。在大鼠颈正中部做切口,暴露右侧颈总动脉、颈外动脉和颈内动脉,在动脉分叉处结扎颈外动脉,在颈总动脉分叉处下方做1个“V”形切口,轻轻插入前段包被多聚赖氨酸的尼龙线栓;当栓线插入距颈总动脉分叉1.8 ~ 2.0 cm处并有阻力感时,说明一起结扎栓在中动脉起始部位阻塞动脉,即停止插栓线,将线栓与颈总动脉一起结扎并固定,缝合皮肤。在阻断血流90 min后轻轻拔出栓线,此时开始计算再灌注时间,于24、48和72 h后观察各项指标。假手术组大鼠只分离血管,不结扎动脉,不插入线栓。
1.4 各组大鼠行为学评分的检测观察大鼠肢体瘫痪、站立、肢体屈曲和行走情况。采用Ji [6]的5级4分法进行神经功能评分:无明显神经功能缺损记为0分;左前肢伸展障碍记为1分;行走时向左侧旋转打圈记为2分;行走时向左侧倾倒记为3分;不能自发行走,意识丧失,昏迷记为4分;动物死亡记为5分。评分为0、4和5分的大鼠均被剔除,剔除的大鼠在后续实验中得到补充。
1.5 TTC染色大鼠脑缺血90 min后分别再灌注24、48和72 h时采用10%水合氯醛350 mg·kg-1腹腔注射麻醉大鼠后断头取脑,切除嗅球、小脑及部分低位脑干后,将剩余脑组织放入-20℃冰箱速冻20 min,每隔2 mm切1片, 然后置于盛有2% TTC溶液的缓冲液中,37℃避光恒温孵育15 min, 期间翻动脑片使染色均匀避免粘连。待脑组织染色后将其转移至10%甲醛溶液中固定30 min,采用数码相机对染色后的脑组织切片照相。
1.6 大鼠脑缺血梗死体积的计算将数码相机拍摄的图片输入计算机,采用Image J软件测量大鼠每个脑片的缺血区域体积、缺血侧半球体积和缺血对侧半球体积。为了减少脑水肿对脑梗死体积计算的影响,采用矫正后脑梗死体积计算公式:脑梗死体积=[缺血区域体积-(缺血侧半球体积-缺血对侧半球体积)]/缺血对侧半球体积×100%。
1.7 大鼠脑组织RNA的提取和质量检测大鼠脑缺血/再灌注24、48和72 h后以10%水合氯醛350 mg·kg-1腹腔注射麻醉后置于冰上快速断头取出脑组织,剥离大脑皮层后取大脑皮层梗死中心区域、缺血半暗带区域及缺血对侧皮层区域组织称质量。假手术组大鼠均取出相应皮层区域。将100 mg组织样本加入1 mL Trizol试剂,快速匀浆,依据Trizol试剂说明书提取总RNA。采用美国Thermo公司生产的NanoDrop ®ND-1000紫外分光光度仪检测波长260和280nm处吸光度(A)值,计算RNA浓度和纯度,A(260)/A(280)比值为1.8 ~ 2.1时表示RNA纯度较纯,采用变性琼脂糖电泳检测RNA的完整性。
1.8 qRT-PCR法检测大鼠脑组织中miR-155表达水平将上述质量检测良好的总RNA样本采用TaqMan® MicroRNA Reverse Transcription Kit逆转出miR-155和U6 snRNA(做内参)的cDNA。采用TaqMan® MicroRNA Assays和TaqMan® Universal PCR Master Mix Ⅱwith UNG试剂盒按照说明书进行qRT-PCR, 所有反应均设立3个复孔。记录每个反应管中标本的CT值。本研究结果采用qRT-PCR中的相对定量法进行分析,采用2-△△CT法表示大鼠脑缺血/再灌注组织中miR-155表达水平相对于假手术组表达水平的变化倍数。
1.9 统计学分析采用SPSS 21.0统计软件进行统计学分析。各组大鼠总RNA浓度和纯度以x±s表示,各组大鼠脑缺血梗死体积和miR-155表达水平组间比较采用两组间样本均数t检验。以P<0.05表示差异有统计学意义。
2 结果 2.1 大鼠脑缺血/再灌注模型的建立脑缺血/再灌注模型建立24 h后根据Ji等[6]的5级4分法评估大鼠神经缺损程度,评分为2 ~ 3分的大鼠进行入组观察,评分为2分的大鼠见图 1(插页一)。大鼠全脑切片TTC染色结果显示:假手术组大鼠脑组织TTC染色表现为均匀一致的红色,脑缺血/再灌注组大鼠脑缺血侧脑组织TTC染色后出现大范围未染色区域,见图 2(插页一),表明大鼠脑缺血/再灌注模型建立成功。

|
| 图 1 神经功能评分为2分的脑缺血/再灌注大鼠大体外观 Figure 1 General appearance of cerebral ischemia reperfusion rat with 2 scores in neurological function score |
|
|

|
| A:Sham operation group; B-D:I/R group(24, 48, and 72 h). 图 2 TTC染色检测各组大鼠脑梗死组织大体外观 Figure 2 General appearances of cerebral infarction of rats in various groupsdetected by TTC staining |
|
|
脑缺血/再灌注后24、48和72 h,TTC染色可见脑缺血/再灌注组大鼠右侧大脑的缺血灶,并且在脑缺血/再灌注24 h时大鼠脑缺血梗死体积最大,在48 h时大鼠脑缺血梗死体积开始减少,脑缺血/再灌注72 h时脑缺血梗死体积继续缩小。与假手术组比较,再灌24、48和72h时脑缺血/再灌注组大鼠脑缺血梗死体积明显增大(P<0.05)。见图 3。
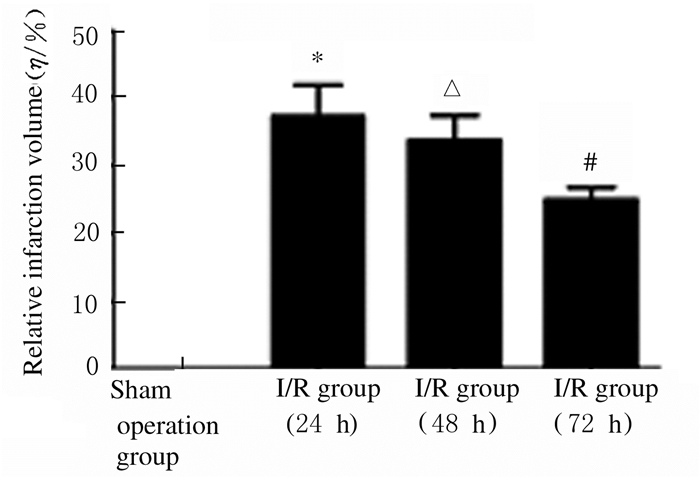
|
| *P<0.05 vs sham operation group; △P<0.05 vs I/R group (24 h); #P<0.05 vs I/R group (48 h). 图 3 各组大鼠脑梗死体积直条图 Figure 3 Histogram of cerebral infarction volumes of rats in various groups |
|
|
采用紫外吸收测定法测定大鼠脑组织样品总RNA浓度和纯度,总RNA浓度为150 ~ 700 g·L-1,A(260)/A(280)比值均为1.8~2.1。见表 1。琼脂糖凝胶电泳可见清晰的28S核糖体和18S核糖体条带,同时还可以观察到1条更小的稍微扩散的条带,其由低相对分子质量的RNA (tRNA和5S核糖体RNA)组成。见图 4。
| Group | A(230) | A(260) | A(280) | A(260)/A(280) | A(260)/A(230) | |
| Sham operation | ||||||
| 24h | Contralateral | 7.335±1.035 | 15.626±1.532 | 7.819±0.729 | 2.00±0.02 | 2.14±0.13 |
| Peri-infarction area | 7.383±1.184 | 15.639±2.053 | 7.764±1.083 | 2.02±0.02 | 2.14±0.21 | |
| Ischemic core | 7.330±1.322 | 17.871±1.002 | 8.079±1.463 | 2.02±0.05 | 2.23±0.06 | |
| 48 h | Contralateral | 5.980±1.070 | 12.212±3.249 | 6.207±1.676 | 1.97±0.01 | 2.12±0.20 |
| Peri-infarction area | 5.632±1.153 | 11.481±3.661 | 5.810±1.813 | 1.97±0.04 | 2.00±0.34 | |
| Ischemic core | 7.797±1.290 | 16.386±2.439 | 8.225±1.134 | 1.99±0.03 | 2.13±0.17 | |
| 72 h | Contralateral | 6.822±0.647 | 14.170±0.513 | 7.211±0.350 | 1.97±0.03 | 2.09±0.13 |
| Peri-infarction area | 7.649±0.658 | 15.367±1.622 | 7.722±0.742 | 1.99±0.04 | 2.02±0.18 | |
| Ischemic core | 7.216±0.760 | 16.122±1.774 | 8.135±0.814 | 1.98±0.03 | 2.24±0.04 | |
| I/R | ||||||
| 24 h | Contralateral | 7.198±0.707 | 15.032±1.443 | 7.457±0.571 | 2.02±0.04 | 2.09±0.13 |
| Peri-infarction area | 7.652±2.162 | 15.604±3.334 | 7.672±1.482 | 2.03±0.06 | 2.07±0.22 | |
| Ischemic core | 6.109±3.589 | 9.199±3.311 | 4.590±1.649 | 2.00±0.03 | 2.00±0.09 | |
| 48 h | Contralateral | 7.781±1.793 | 14.957±3.797 | 7.404±1.883 | 2.02±0.01 | 1.94±0.36 |
| Peri-infarction area | 7.120±1.073 | 15.005±2.829 | 7.554±1.266 | 1.98±0.04 | 2.10±0.09 | |
| Ischemic core | 3.836±1.487 | 7.768±3.436 | 3.899±1.700 | 1.99±0.03 | 2.05±0.37 | |
| 72 h | Contralateral | 7.957±0.527 | 16.373±1.556 | 8.101±0.689 | 2.02±0.03 | 2.06±0.07 |
| Peri-infarction area | 7.315±1.918 | 13.168±1.926 | 6.554±0.888 | 2.01±0.02 | 1.83±0.20 | |
| Ischemic core | 6.904±0.807 | 11.437±1.516 | 5.748±0.802 | 1.99±0.03 | 1.66±0.21 |
|
| A:Sham operation goup; B:I/R group;M:Marker; Lane 1:Ischemic core; Lane 2:Peri-infarction area; Lane 3:Contralateral area. 图 4 各组大鼠脑组织总RNA表达电泳图 Figure 4 Electrophoregram of total RNA in brain tissue of rats in various groups |
|
|
与假手术组比较,脑缺血/再灌注组大鼠大脑皮层梗死中心区域及缺血半暗带区域miR-155表达水平明显升高(P<0.05),在缺血半暗带区域内miR-155表达水平在24 h最高,之后逐渐降低,72 h仍未降至正常水平,而在梗死中心区域24和48 h均持续在最高状态,之后开始降低。见图 5。
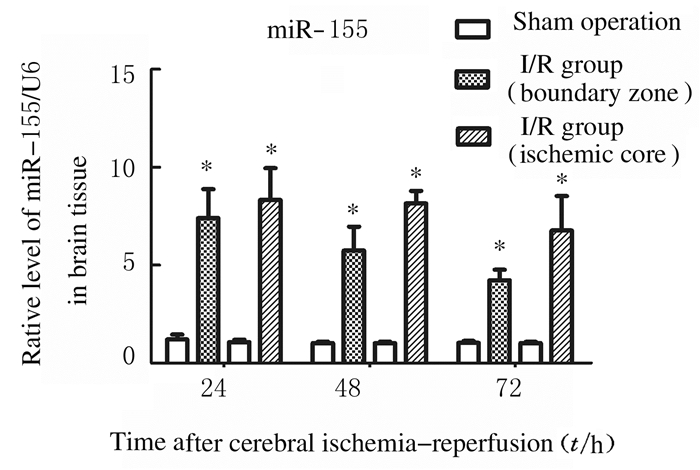
|
| *P<0.05 vs sham operation group at the same time point. 图 5 各组大鼠脑皮层组织中miR-155表达水平 Figure 5 Expression levels of miR-155 in cortex tissue of rats in various groups |
|
|
缺血性脑损伤是一类由于血栓或者栓子阻断了脑血管的血流从而导致相应供血区脑组织缺血缺氧造成局灶性脑组织损伤的中枢神经疾病。目前缺血半暗带是缺血性脑损伤功能恢复治疗的主要靶区[7-8]。缺血半暗带是梗死中心区周围环形区域,该区域的细胞虽然神经功能丧失但其结构仍保留完整性[9]。缺血半暗带可以通过侧支循环的建立恢复血液供应从而恢复其功能,但同时会造成再灌注损伤,导致神经元不可逆性死亡。脑缺血/再灌注损伤机制十分复杂,过量氧自由基的生成及炎症反应是其重要原因[10-11]。研究[12]表明miR-155在大鼠心肌缺血/再灌注损伤组织中表达水平明显升高,并且可以通过调节炎症细胞聚集及活性氧爆发从而加重心肌细胞的缺血/再灌注损伤。因此,探讨miR-155在脑缺血/再灌注损伤中的表达变化十分必要。
本研究采用qRT-PCR法检测大鼠脑组织中miR-155表达水平,结果显示:脑缺血/再灌注组大鼠梗死中心区及半暗带区域的脑皮层组织中miR-155表达水平表达明显高于假手术组,且在半暗带区域中miR-155表达水平在24 h最高,之后逐渐降低,72 h仍未降至正常水平;而在梗死中心区域中miR-155表达水平在24 ~ 48 h时维持在最高值,之后开始降低,miR-155表达水平与再灌注时间有关联,随着再灌注时间的延长,miR-155表达水平逐渐降低,提示在脑缺血/再灌注损伤早期脑皮层组织中miR-155表达水平升高,说明miR-155参与了缺血/再灌注损伤过程,并可能起到促进脑缺血/再灌注损伤的作用。这一结果与既往研究[5, 12-13]一致。Hunsberger等[5]在脑缺血后24 h大鼠脑皮质组织中检测了miRNA表达谱,其中miR-155表达水平存在差异,采用qRT-PCR技术验证结果显示:脑缺血后24 h大鼠脑皮质组织中miR-155表达水平明显升高。但Hunsberger等[5]只检测了缺血后24 h时miR-155表达水平,并未进一步观察其在脑缺血/再灌注后一段时间内的动态变化。研究[12]显示:miR-155在大鼠心肌缺血/再灌注组织中表达水平明显升高,并且加重心肌缺血/再灌注损伤,因而认为心肌缺血/再灌注可以诱导miR-155表达。Wan等[13]研究显示:细胞在低氧状态下可诱导miR-155表达水平升高,并在48 h内逐渐升高。但少数研究[14]显示:在缺血性脑损伤后miR-155表达水平降低。Liu等[14]使用TaqMan rodent miRNA arrays检测脑缺血后脑损伤miRNA表达谱发现miR-155表达水平明显降低。
有关miR-155对缺血/再灌注损伤的作用及其病理机制目前报道甚少。研究[12]显示:miR-155通过介导炎症细胞聚集及活性氧爆发加重心肌缺血/再灌注损伤。miR-155已被证实参与各种病理炎症反应过程[15-17]。miR-155可以促进组织炎症反应,下调miR-155可以减轻炎症反应[18-20]。特异性抑制miR-155可增加内皮一氧化氮合酶(endothelial nitric oxide synthase,eNOS)表达和一氧化氮(nitric oxide,NO)产生从而减少血管炎症反应[21-23]。研究[24-25]显示:小鼠脑缺血后抑制miR-155可以改变主要细胞因子及炎症反应相关分子的表达时间,从而影响炎症反应进展和组织修复,因此推断miR-155可能加重脑缺血/再灌注损伤,并可能通过介导炎症反应参与脑缺血/再灌注损伤过程。关于miR-155是否加重脑缺血/再灌注损伤以及是否通过调节炎症反应加重缺血/再灌注损伤有待进一步研究。
| [1] | Velimirovic M, dozudic GJ, Selakovic V, et al. Effects of vitamin D3 on the NADPH oxidase and matrix metalloproteinase 9 in an animal model of global cerebral ischemia[J]. Oxid Med Cell Longev, 2018, 2018(1): 1–14. |
| [2] | Wang P, Xu TY, Guan YF, et al. Nicotinamide phosphoribosyltransferase protects against ischemic stroke through SIRT1-dependent adenosine monophosphate-activated kinase pathway[J]. Ann Neurol, 2011, 69(2): 360–374. DOI:10.1002/ana.22236 |
| [3] | Hong P, Li FX, Gu RN, et al. Inhibition of NLRP3 inflammasome ameliorates cerebral ischemia-reperfusion injury in diabetic mice[J]. Neural Plast, 2018, 2018: 9163521. |
| [4] | Huang C, Yu M, Yao X. MicroRNA-17 and the prognosis of human carcinomas:a systematic review and meta-analysis[J]. BMJ Open, 2018, 8(5): e018070. DOI:10.1136/bmjopen-2017-018070 |
| [5] | Hunsberger JG, Fessler EB, Wang Z, et al. Post-insult valproic acid-regulated microRNAs:potential targets for cerebral ischemia[J]. Am Transl Res, 2012, 4(3): 316–332. |
| [6] | Ji Y, Yan X, Hu Y, et al. DhHP-6 attenuates cerebral ischemia-reperfusion injury in rats through the inhibition of apoptosis[J]. Mol Med Rep, 2017, 16(5): 7229–7236. DOI:10.3892/mmr.2017.7569 |
| [7] | Caballero-Garrido E, Penaphilippides JC, Lordkipanidze T, et al. In vivo inhibition of miR-155 promotes recovery after experimental mouse stroke[J]. J Neurosci, 2015, 35(36): 12446–12464. DOI:10.1523/JNEUROSCI.1641-15.2015 |
| [8] | Wang W, Wang Q, Yu W, et al. Efficacy of phosphocreatine pre-administration on XIAP and Smac in ischemic penumbra of rats with focal cerebral ischemia reperfusion injury[J]. Acta Cir Bras, 2018, 33(2): 117–124. DOI:10.1590/s0102-865020180020000003 |
| [9] | Ran YC, Zhu M, Li SJ, et al. Related research and recent progress of ischemic penumbra[J]. World Neurosurg, 2018, 116: 5–13. DOI:10.1016/j.wneu.2018.04.193 |
| [10] | Zhao Q, Wang X, Chen A, et al. Rhein protects against cerebral ischemic-reperfusion-induced oxidative stress and apoptosis in rats[J]. Int Mol Med, 2018, 41(5): 2802–2812. |
| [11] | Ismael S, Zhao L, Nasoohi S, et al. Inhibition of the NLRP3-inflammasome as a potential approach for neuroprotection after stroke[J]. Sci Rep, 2018, 8(1): 5971. |
| [12] | Eisenhardt SU, Weiss JB, Smolka C, et al. MicroRNA-155 aggravates ischemia-reperfusion injury by modulation of inflammatory cell recruitment and the respiratory oxidative burst[J]. Basic Res Cardiol, 2015, 110(3): 32. DOI:10.1007/s00395-015-0490-9 |
| [13] | Wan G, Xie W, Liu Z, et al. Hypoxia-induced MIR155 is a potent autophagy inducer by targeting multiple players in the MTOR pathway[J]. Autophagy, 2014, 10(1): 70–79. DOI:10.4161/auto.26534 |
| [14] | Liu DZ, Tian Y, Ander BP, et al. Brain and blood microRNA expression profiling of ischemic stroke, intracerebral hemorrhage, and kainate seizures[J]. J Cereb Blood Flow Metab, 2010, 30(1): 92–101. DOI:10.1038/jcbfm.2009.186 |
| [15] | Liu Y, Pan Q, Zhao Y, et al. MicroRNA-155 regulates ROS production, NO generation, apoptosis and multiple functions of human brain microvessel endothelial cells under physiological and pathological conditions[J]. J Cell Biochem, 2015, 116(12): 2870–2881. DOI:10.1002/jcb.v116.12 |
| [16] | Zheng X, Huang H, Liu J, et al. Propofol attenuates inflammatory response in LPS-activated microglia by regulating the miR-155/SOCS1 pathway[J]. Inflammation, 2018, 41(1): 11–19. DOI:10.1007/s10753-017-0658-6 |
| [17] | Blaya D, Aguilarbravo B, Hao F, et al. Expression of microRNA-155 in inflammatory cells modulates liver injury[J]. Hepatology, 2018, 68(2): 691–706. DOI:10.1002/hep.v68.2 |
| [18] | Kurowska-Stolarska M, Alivernini S, Ballantine LE, et al. MicroRNA-155 as a proinflammatory regulator in clinical and experimental arthritis[J]. Proc Natl Acad Sci U S A, 2011, 108(27): 11193–11198. DOI:10.1073/pnas.1019536108 |
| [19] | Murugaiyan G, Beynon V, Mittal A, et al. Silencing microRNA-155 ameliorates experimental autoimmune encephalomyelitis[J]. J Immunol, 2011, 187(5): 2213–2221. DOI:10.4049/jimmunol.1003952 |
| [20] | Billeter AT, Hellmann J, Roberts H, et al. MicroRNA-155 potentiates the inflammatory response in hypothermia by suppressing IL-10 production[J]. FASEB J, 2014, 28(12): 5322–5336. DOI:10.1096/fj.14-258335 |
| [21] | Sun HX, Zeng DY, Li RT, et al. Essential role of microRNA-155 in regulating endothelium-dependent vasorelaxation by targeting endothelial nitric oxide synthase[J]. Hypertension, 2012, 60(6): 1407–1414. DOI:10.1161/HYPERTENSIONAHA.112.197301 |
| [22] | Weber M, Kim S, Patterson N, et al. MiRNA-155 targets myosin light chain kinase and modulates actin cytoskeleton organization in endothelial cells[J]. Am J Physiol Heart Circ Physiol, 2014, 306(8): H1192–H1203. DOI:10.1152/ajpheart.00521.2013 |
| [23] | Jing C, Guo M, Bao X, et al. Pitavastatin up-regulates eNOS production by suppressing miR-155 expression in lipopolysaccharide-stimulated human umbilical vein endothelial cells[J]. Cardiovasc Ther, 2017, 35(5): e12282. DOI:10.1111/cdr.2017.35.issue-5 |
| [24] | Pena-Philippides JC, Caballero-Garrido E, Lordkipanidze T, et al. In vivo inhibition of miR-155 significantly alters post-stroke inflammatory response[J]. J Neuroinflammat, 2016, 13(1): 287. DOI:10.1186/s12974-016-0753-x |
| [25] | 黄真锋, 法宪恩, 朱方涛, 等. 二氧化铈纳米颗粒预处理对大鼠缺血再灌注损伤心肌细胞Nrf2信号通路的影响[J]. 郑州大学学报:医学版, 2018, 53(2): 206–209. |
 2018, Vol. 44
2018, Vol. 44


