扩展功能
文章信息
- 刘丹, 杨晓波, 王颖, 于丽红, 石焱, 张英杰, 周琳, 石磊
- LIU Dan, YANG Xiaobo, WANG Ying, YU Lihong, SHI Yan, ZHANG Yingjie, ZHOU Lin, SHI Lei
- 四物汤对小鼠化疗所致贫血的恢复作用及其机制
- Effect of Siwutang on recovery of anemia induced by chemotherapy in mice and its mechanism
- 吉林大学学报(医学版), 2018, 44(06): 1115-1119
- Journal of Jilin University (Medicine Edition), 2018, 44(06): 1115-1119
- 10.13481/j.1671-587x.20180601
-
文章历史
- 收稿日期: 2018-03-22
2. 大连医科大学药学院药理教研室, 辽宁 大连 116021
2. Department of Pharmacology, School of Pharmacy, Dalian Medical University, Dalian 116021, China
红细胞数量巨大,具有天然免疫功能,是重要的固有免疫细胞,具有识别、黏附、浓缩和杀伤抗原的能力[1]。化疗贫血是化疗后常见的副作用之一,会使患者感到气短、虚弱、眩晕、眼花和明显的乏力[2]。沈颖等[3]研究生三七对IgA肾病患者红细胞免疫的调节作用的结果表明:IgA肾病患者存在红细胞免疫功能低下,生三七对改善IgA肾病红细胞免疫有积极作用。四物汤是常用的补血方剂,具有补血活血作用,四物汤对红细胞免疫影响的研究[4-5]结果显示四物汤有较明显的增强红细胞免疫功能的作用。但目前未见对红细胞免疫机制进行研究的相关报道。本研究采用5-氟尿嘧啶诱导的C57小鼠作为贫血动物模型,探讨四物汤对红细胞数量、血红蛋白水平以及红细胞表面抗体的影响,为四物汤治疗化疗贫血提供实验依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器24只C57BL/6N小鼠,雄性,11周龄,SPF级(北京维通利华实验动物技术有限公司),动物许可证编号:SCXK京2016-0006。FITC-CD71(Biolegend,美国),PE-Ter119抗体(上海润成生物科技有限公司,中国),红细胞裂解液(苏州赛特生物医药科技有限公司,中国),肝素(北京亚米生物科技有限公司,中国),5-氟尿嘧啶注射液(解放军第210医院,中国),当归、白芍、熟地和川芎(同仁堂药店,中国)。FACS Calibur型流式细胞仪(Becton-Dickinson公司,美国),全自动血细胞计数仪(琪摩上海电子科技有限公司,中国)。
1.2 四物汤的制备[6-8]四物汤由当归、白芍、熟地和川芎组成,处方为:当归10 g,白芍12 g,熟地12 g,川芎8 g。熬制汤药,减压蒸发制成干浸膏。采用生理盐水溶解制成浓度为300 g·L-1四物汤样品,备用。
1.3 动物饲养、分组和给药健康灵活C57小鼠在SPF级无菌条件下饲养。实验期间控制室温为(20±2)℃,12 h交替照明。C57小鼠饮用水以及其饲料均为无菌,实验操作均在超净台内完成,保证环境处于无菌状态。小鼠饲养在1个笼子适应环境1周后,将小鼠随机分为对照组、模型组和四物汤组,每组8只。对照组:未给药;模型组:5-氟尿嘧啶(150 mg·kg-1)静脉注射,注射15 d,每天注射1次,每次0.2 mL,于第3、7、9、12和15天尾静脉取血,加入含有抗凝剂的试管中,用于细胞计数。四物汤组:5-氟尿嘧啶(150 mg·kg-1)静脉注射,注射7 d,每天注射1次,每次0.2 mL,于第3和7天尾静脉取血,加入含有抗凝剂的试管中用于细胞计数;然后灌胃四物汤(300 g·L-1)每天1次,每次0.5 mL,于第9、12和15天尾静脉取血,加入含有抗凝剂的试管中,用于细胞计数。15 d后,收集血液并采取安乐死方法处死小鼠,行尸体解剖,收集脾脏,备用。
1.4 显微镜观察各组小鼠红细胞形态表现给药第15天时取各组小鼠外周血1滴,滴于载玻片上,制成血涂片,染色,显微镜观察各组小鼠红细胞形态表现。
1.5 各组小鼠外周血红细胞计数和血红蛋白水平给药第15天时取各组小鼠外周血60 μL,加入含有肝素的试管中,充分混合后,采用全自动血细胞计数仪检测小鼠外周血中红细胞数量和血红蛋白水平。计算各组小鼠单位体积内红细胞数和血红蛋白水平。C=A(540)HiCN×367.7,A(540)HiCN为测定管的吸光度(A)值。
1.6 流式细胞术检测各组小鼠外周血标记的红细胞数取外周血,加入含有抗凝剂的试管中,红细胞裂解液进行裂解,离心,弃上清,加入PBS洗涤2次,离心,弃上清,收集细胞。参照说明书加入FITC-Ter119标记抗体和PE-CD71抗体[9],室温避光孵育20 min,1 000 r·min-1离心5 min,弃上清,加入2 mL PBS洗涤2次,加入250 μL PBS上机检测,采用流式细胞仪分析各组小鼠外周血标记的红细胞数。
1.7 流式细胞术检测各组小鼠脾脏标记的红细胞数取小鼠脾脏,迅速磨碎,获取单细胞悬液,加入红细胞裂解液进行裂解,离心,弃上清,加入PBS洗涤2次,离心,弃上清,收集细胞。参照说明书[9]加入FITC-Ter119标记抗体和PE-CD71抗体,室温避光孵育20 min,1 000 r·min-1离心5 min,弃上清,加入2 mL PBS洗涤2次,加入250 μL PBS上机检测,采用流式细胞仪分析各组小鼠脾脏标记的红细胞数。
1.8 统计学分析采用Graphpad Prism 5.0统计软件进行统计学分析。各组小鼠外周血红细胞数、外周血血红蛋白水平、外周血标记的红细胞数和脾脏标记的红细胞数均以x±s表示,多组间样本均数比较采用单因素方差分析。以P<0.05表示差异有统计学意义。
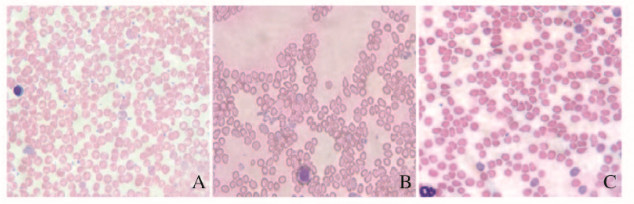
2 结果 2.1 各组小鼠红细胞形态表现与对照组比较,模型组小鼠红细胞数量明显减少,细胞皱缩;与模型组比较,四物汤组小鼠红细胞数量明显增加,细胞变圆。见图 1(插页一)。
|
| A:Control group;B:Model group;C:Siwutang group. 图 1 各组小鼠外周血红细胞形态表现(HE, ×40) Figure 1 Morphology of peripheral blood red cells of rats in various groups(HE, ×40) |
|
|
与对照组比较,给药第9、12和15天模型组小鼠外周血红细胞计数明显降低(P<0.05);与模型组比较,给药第15天四物汤组小鼠外周血红细胞计数明显升高(P<0.05)。见表 1。
| (n=8, x±s, ×106μL-1) | ||||||
| Group | Count of red cells in peripheral blood | |||||
| (t/d) 0 | 3 | 7 | 9 | 12 | 15 | |
| Control | 8.19±1.24 | 8.23±1.23 | 8.15±1.09 | 8.16±1.25 | 8.18±1.16 | 8.25±1.56 |
| Model | 8.26±1.16 | 7.95±0.98 | 7.19±1.12 | 6.79±0.89* | 6.58±0.86* | 6.43±0.98 |
| Siwutang | 8.21±1.13 | 7.86±1.15 | 7.08±1.03 | 7.15±0.98 | 7.68±0.96 | 7.99±1.07*△ |
| * P<0.05 vs control group; △ P<0.05 vs model group. | ||||||
与对照组比较,给药第15天模型组小鼠血红蛋白水平明显降低(P<0.01);与模型组比较,给药第15天四物汤组小鼠血红蛋白水平明显升高(P<0.01)。见表 2。
| [n=8, x±s, ρB/(g·L-1)] | ||||||
| Group | Hemoglobin level | |||||
| (t/d) 0 | 3 | 7 | 9 | 12 | 15 | |
| Control | 154.9±19.8 | 155.3±20.6 | 145.3±19.5 | 146.8±18.6 | 154.3±18.3 | 155.8±20.8 |
| Model | 152.3±19.5 | 144.8±20.4 | 135.9±18.5 | 128.4±17.6 | 124.6±16.8* | 119.6±15.6* |
| Siwutang | 153.5±20.3 | 145.6±20.8 | 137.8±19.6 | 140.5±18.5 | 142.6±19.5 | 145.3±17.2△ |
| * P<0.01 vs control group; △ P<0.05 vs model group. | ||||||
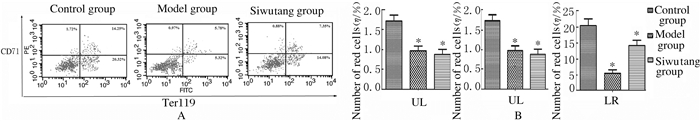
与对照组比较,模型组小鼠外周血CD71/Ter119表达水平明显降低(P<0.01)。模型组UL象限红细胞数量(2.15%)低于对照组(6.95%)(P<0.01),UR象限红细胞数量(0.97%)低于对照组(11.34%)(P<0.01),LR象限红细胞数量(2.64%)低于对照组(21.32%)(P<0.01)。与模型组比较,四物汤组小鼠外周血CD71/Ter119表达水平明显升高(P<0.01);四物汤组UL象限红细胞数量(3.72%)高于模型组(2.15%)(P<0.01),UR象限红细胞数量(8.95%)高于模型组(0.97%)(P<0.01),LR象限红细胞数量(16.31%)高于模型组(2.64%)(P<0.01)。见图 2。

|
| A:Diagram of flow cytometry; B:Histogram. 图 2 流式细胞术检测各组小鼠外周血标记的红细胞数 Figure 2 Number of peripheral blood-labelled red cells of mice in various groups detected by flow cytometry |
|
|
与对照组比较,模型组小鼠脾脏血CD71/Ter119表达水平明显降低(P<0.01),UL、UR和LR象限红细胞数量低于对照组(P<0.01);与模型组比较,四物汤组小鼠脾脏血CD71/Ter119表达水平明显升高(P<0.01),UL象限红细胞数量降低(P<0.01),UR和LR象限红细胞数量升高(P<0.01)。见图 3。
|
| A:Diagram of flow cytometry; B:Histogram. 图 3 流式细胞术检测各组小鼠脾脏标记的红细胞数 Figure 3 Number of spleen-labelled red cells of mice in various groups detected by flow cytometry |
|
|
红细胞是人体中最多的一类细胞,主要生理功能是通过细胞中所含的血红蛋白进行氧与二氧化碳交换。每天都有许多红细胞因衰老而死亡,另外又有许多新生的红细胞取代衰老的红细胞,使红细胞数量保持动态平衡,以保持身体新陈代谢的正常需要,但是化疗会造成红细胞生成和破坏的平衡失调,使红细胞数量减少,从而引起贫血[10-11]。
本研究采用全自动血细胞计数仪检测外周血红细胞数量变化的结果表明:与对照组比较,模型组小鼠外周血红细胞数量明显降低;与模型组比较,四物汤组小鼠红细胞数量明显升高。采用全自动血细胞计数仪检测外周血血红蛋白水平的结果表明:与对照组比较,模型组小鼠外周血血红蛋白水平明显降低;与模型组比较,四物汤组小鼠外周血红蛋白水平明显升高。红细胞膜表面存在大量的免疫相关分子[12-14],CD71/Ter119是红细胞表面抗原标志物[15],本研究采用荧光标记的CD71/Ter119抗体,进行红细胞标记,采用流式细胞仪进行红细胞计数。本研究结果表明:与对照组比较,模型组小鼠外周血CD71/Ter119表达水平明显降低;与模型组比较,四物汤组小鼠外周血CD71/Ter119表达水平明显升高。取小鼠脾脏进行脾脏血CD71/Ter119表达水平检测的结果表明:与对照组比较,模型组小鼠脾脏血CD71/Ter119表达水平明显降低;与模型组比较,四物汤组小鼠脾脏血CD71/Ter119表达水平明显升高。红细胞来源于骨髓造血干细胞,与骨髓干细胞的增殖分化有密切关联[16-18]。本研究结果显示四物汤对化疗所致贫血有恢复作用,提示四物汤对造血功能恢复有重要作用,可用于癌症患者放化疗之后骨髓造血功能恢复的辅助治疗,四物汤也可通过增加红细胞数目增强患者的红细胞免疫功能。
综上所述,四物汤对化疗后贫血小鼠红细胞结构及免疫功能有较好的调节作用,可以改善并恢复化疗贫血小鼠红细胞数量和血红蛋白水平,同时通过双标记抗体CD71/Ter119染色确定了四物汤增加红细胞数量的机制。本研究结果提示四物汤可以作为治疗化疗贫血的中药应用。
| [1] | 郭峰. 红细胞免疫的研究和意义[J]. 科技进展, 2015, 24(5): 268–273. |
| [2] | 樊慧婷, 林洪生. 扶正中药治疗肿瘤的基础研究现状[J]. 世界中医药, 2014, 9(7): 825–832. DOI:10.3969/j.issn.1673-7202.2014.07.001 |
| [3] | 沈颖, 刘华, 陈飞. 生三七对IgA肾病红细胞免疫的调节作用[J]. 实用医学杂志, 2010, 26(23): 4421–4422. DOI:10.3969/j.issn.1006-5725.2010.23.072 |
| [4] | 章亭, 谭允有, 潘彦舒. 四物汤对红细胞免疫及骨髓干细胞增殖能力的影响[J]. 北京中医药大学学报, 2000, 23(1): 36–38. DOI:10.3321/j.issn:1006-2157.2000.01.011 |
| [5] | 崔运浩, 范颖. 当归补血汤干预化疗贫血模型小鼠药效学研究[J]. 辽宁中医药大学学报, 2011, 13(8): 103–105. |
| [6] | 季宇彬, 汲晨锋. 黄芪多糖对肿瘤模型小鼠红细胞免疫功能的影响[J]. 现代食品科技, 2013, 29(9): 2042–2052. |
| [7] | 梁可, 马进, 曲怡, 等. 黄芪皂苷对小鼠化疗贫血模型白介素-2、白介素-4和白介素-6的影响[J]. 中国医药导报, 2015, 12(18): 16–18. |
| [8] | 时静, 陈海生, 段存贤, 等. 5-氟尿嘧啶治疗药物监测的研究现状[J]. 中国临床药理学杂志, 2016, 32(11): 1053–1056. |
| [9] | 江亚军, 李秀梅, 韩秀华, 等. 缺铁性贫血患者血清Hepcidin和红细胞CD71的变化[J]. 医学研究杂志, 2013, 42(8): 126–129. DOI:10.3969/j.issn.1673-548X.2013.08.040 |
| [10] | 熊扬眉, 丁国华, 石明, 等. 慢性肾脏病患者24h尿蛋白定量与贫血的关系研究[J]. 中国全科医学, 2017, 20(22): 2739–2745. DOI:10.3969/j.issn.1007-9572.2017.22.011 |
| [11] | 刘春燕, 邵宗鸿. 再生障碍性贫血发病机制研究进展[J]. 中国实用内科杂志, 2016, 36(5): 345–349. |
| [12] | 魏园玉, 张晓飓, 张帆, 等. CD71作为增殖指标在血液中肿瘤中的表达及与Ki-67的相关性分析[J]. 中国实验血液学杂志, 2015, 23(1): 234–240. |
| [13] | 冯婷婷, 冀林华, 刘芳, 等. 慢性高原病患者骨髓CD71+、CD235a+有核红细胞增殖及凋亡变化[J]. 山东医药, 2016, 56(37): 56–58. DOI:10.3969/j.issn.1002-266X.2016.37.018 |
| [14] | 王生艳, 崔森, 李占全, 等. 慢性高原病患者骨髓CD71+有核红细胞凋亡和细胞色素C及线粒体膜电位的变化[J]. 中华医学杂志, 2018, 98(7): 514–518. DOI:10.3760/cma.j.issn.0376-2491.2018.07.006 |
| [15] | 周帆, 李专, 刘冰. 小鼠胚胎AGM区Flk-1+细胞的造血特性[J]. 中国实验血液学杂志, 2013, 21(2): 446–450. |
| [16] | 孙伟正, 李志侠, 王金环. 补髓生血颗粒对造血负调控因子IL-6和TGF-β1的影响[J]. 中医药信息, 2004, 21(5): 25–27. DOI:10.3969/j.issn.1002-2406.2004.05.010 |
| [17] | 余树民, 甘梦, 左之才, 等. 中药复方对免疫抑制模型小鼠细胞因子、免疫球蛋白及红细胞免疫黏附功能的影响[J]. 西北农林科技大学学报:自然科学版, 2014, 42(4): 27–40. |
| [18] | 刘景田, 党小军, 王惠萍, 等. 中药多糖对红细胞膜相CD35免疫活性的调节作用[J]. 中国现代医学杂志, 2002, 12(1): 7–9. DOI:10.3969/j.issn.1005-8982.2002.01.003 |
 2018, Vol. 44
2018, Vol. 44


