扩展功能
文章信息
- 袁虎勤, 李强
- YUAN Huqin, LI Qiang
- 水飞蓟素对人胃癌SGC 7901细胞增殖、迁移和侵袭的抑制作用及其机制
- Inhibitory effects of silymarin on proliferation, migration and invasion of human gastric cancer SGC 7901 cells and their mechanisms
- 吉林大学学报(医学版), 2018, 44(05): 988-993
- Journal of Jilin University (Medicine Edition), 2018, 44(05): 988-993
- 10.13481/j.1671-587x.20180518
-
文章历史
- 收稿日期: 2018-01-30
2. 兰州大学第一医院肠胃外科, 甘肃 兰州 730000
2. Department of Gastrointestinal Surgery, First Hospital, Lanzhou University, Lanzhou 730000, China
胃癌的发生率呈逐年上升的趋势,患者死亡率高,在我国高发性消化系肿瘤中占第1位,且就诊患者多数已进入晚期。诱导肿瘤细胞凋亡是抗癌药物治疗肿瘤的重要机制之一。对于胃癌患者,目前临床治疗仍以化疗为主,但不良反应大,疗效差,故开发新药以提高疗效及减轻患者痛苦尤为重要。水飞蓟素是一种黄酮木脂素类化合物,具有抗癌、抗氧化、抗炎、降血脂和神经保护等作用,其发挥主要活性作用的是水飞蓟素及其复合物[1]。水飞蓟素主要作用于细胞增殖旺盛的组织或器官,其抗癌机制呈现多靶点、多步骤和全方位等特点,因此在肿瘤治疗中展现了潜在的应用价值[2]。国内外相关研究[3-4]表明:水飞蓟素可明显抑制某些肿瘤细胞的增殖、诱导肿瘤细胞分化以及抑制肿瘤血管生成等。Chen等[5]发现:水飞蓟素能抑制乳腺癌细胞的增殖和DNA合成。刘志刚等[6]研究证明:水飞蓟素可抑制人膀胱癌细胞增殖,使细胞周期阻滞在G1期。Cheung等[7]研究显示:水飞蓟素具有抑制肺癌SHP-77细胞的生长及加速细胞凋亡的作用。然而,水飞蓟素对人胃癌细胞的影响及机制尚不清楚。本研究以不同浓度水飞蓟素干预人胃癌SGC 7901细胞,初步探讨水飞蓟素对细胞增殖、迁移和侵袭的影响及机制,为其临床应用奠定基础。
1 材料与方法 1.1 细胞、主要试剂和仪器人胃癌SGC 7901细胞(中国医科大学细胞生物教研室)。水飞蓟素(西安小草植物科技有限责任公司),RPMI 1640培养基和胰蛋白酶(美国Hycone公司),胎牛血清(杭州四季青生物工程材料有限公司),二甲基亚砜(美国Sigma公司),2,5-二苯基四氮唑溴盐(MTT)(百奥生物公司)。Transwell小室(中国Coming公司),转膜夹(北京君意东方电泳设备有限公司),TGL-168高速台式离心机(上海安亭科学仪器厂),二氧化碳培养箱(日本三洋公司),IX51-A12PH型倒置显微镜(日本Olympus公司),流式细胞仪(美国Becton Dickinson公司)。
1.2 细胞培养和形态表现观察人胃癌SGC 7901细胞培养在含10%小牛血清、100 U·mL-1青霉素和100 g·L-1链霉素的RPMI 1640培养基中,置于饱和温度、5%CO2的细胞培养箱中37℃孵育。倒置显微镜下观察水飞蓟素作用前后SGC 7901细胞形态表现和生长状况。
1.3 MTT法检测各组SGC 7901细胞增殖抑制率取对数生长期SGC 7901细胞消化后稀释成1×105 mL-1,每孔200 μL加入96孔培养板中。24 h后,加入含不同浓度(0、15、30和60 mg·L-1)水飞蓟素的培养基(每样设5个复孔),置于培养箱中孵育24 h,每孔加入MTT溶液100 μL,37℃再培养4 h,充去液体,每孔再加入二甲基亚砜150 μL,振荡10 min。利用酶标仪于490 nm波长处检测吸光度(A)值,利用公式计算细胞增殖抑制率。细胞增殖抑制率=(1-实验组A值/对照组A值)×100%。
1.4 流式细胞术检测各组细胞周期和细胞凋亡率取对数生长期SGC 7901细胞消化后稀释成1×105 mL-1接种于培养瓶内,置于培养箱中孵育24 h后,加入含不同浓度水飞蓟素(0、15、30和60mg·L-1)的培养基;培养24 h后,消化,低温、1 500 r·min-1离心10 min,用PBS洗涤3次,加入70%冷乙醇中,-20℃固定24 h,低温、1 500 r·min-1离心10 min,用PBS洗涤3次,样品上机加入0.5 mL碘化丙啶染色液,避光4℃染色30 min。利用ModFit分析软件进行细胞DNA含量分析,检测各组细胞周期。利用以下公式计算各组细胞凋亡率,细胞凋亡率=凋亡细胞数/(凋亡细胞数+正常细胞数)×100%。
1.5 划痕实验检测各组SGC 7901细胞迁移能力将密度为1×105mL-1的SGC 7901细胞接种于96孔培养板(包被Matrigel)中,培养于含10%小牛血清的RPMI1640培养液中,形成细胞单层后,沿培养板底部划“一”字划痕,测定划痕区相对距离,PBS洗涤3次,对照组加含10%小牛血清的RPMI 1640培养液,水飞蓟素组分别加入含15、30和60mg·L-1水飞蓟素的培养基,培养24 h后更换新的RPMI 1640培养液,继续培养24 h。倒置显微镜下测量SGC 7901细胞向致伤区迁移的相对距离,记录0和48 h相对距离,利用公式计算出细胞实际迁移距离。迁移距离=划痕后0 h宽度-划痕后48 h宽度。
1.6 Transwell小室法检测各组SGC 7901细胞侵袭抑制率将Transwell小室(包被Matrigel)每孔加入含10 g·L-1BSA的无血清培养液50 μL,37℃放置30 min,置入24孔培养板中,于上室每孔加入含有1×105 mL-1细胞的悬液200 μL,于下室加入含10%小牛血清的RPMI1640培养液600 μL,对照组加含10%小牛血清的RPMI 1640培养液,水飞蓟素组分别加入含15、30和60 mg·L-1水飞蓟素的培养基,培养24 h,每组重复4个样本,常规培养24~48 h。取出小室,PBS洗3次,4%多聚甲醛固定30 min,PBS洗3次,台盼蓝溶液染色。倒置显微镜下计数移至微孔膜下层的细胞。
1.7 统计学分析采用SPSS 16.0统计软件进行统计学分析。各组SGC 7901细胞增殖抑制率、凋亡率、不同细胞周期细胞百分率、细胞迁移距离和穿膜细胞数均以x±s表示,组间比较采用单因素方差分析。以P < 0.05表示差异有统计学意义。
2 结果 2.1 各组SGC 7901细胞形态表现与对照组比较,30和60 mg·L-1水飞蓟素组细胞贴壁密度变小,细胞形态不规则、体积变小,产生大量细胞碎片,部分细胞漂浮,且60 mg·L-1水飞蓟素组较30 mg·L-1水飞蓟素组变化更为明显,15 mg·L-1水飞蓟素组变化不明显。见图 1。
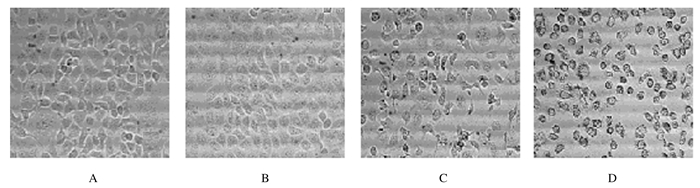
|
| A:Control group; B-D:15, 30, and 60 mg·L-1 silymarin groups. 图 1 倒置显微镜下各组SGC 7901细胞形态(×300) Figure 1 Morphology of SGC 7901 cells in various groups under inverted microscope (×300) |
|
|
与对照组比较,15、30和60 mg·L-1水飞蓟素组SGC 7901细胞增殖抑制率明显升高(P < 0.05),且60 mg·L-1水飞蓟素组增殖抑制率升高最明显。与对照组比较,不同浓度水飞蓟素组细胞主要出现早期凋亡,凋亡率明显升高(P<0.05)。见表 1。
| (n=5, x±s, η/%) | |||
| Group | Dose(mg·L-1) | Inhibiory rate of proliferation | Apoptotic rate |
| Control | 0 | 0 | 3.15±0.86 |
| Silymarin | |||
| 15 | 29.3±3.7* | 10.71±0.94* | |
| 30 | 65.8±5.2* | 16.05±1.18* | |
| 60 | 83.1±4.6* | 25.21±1.63* | |
| * P < 0.05 compared with control group. | |||
与对照组比较, 不同浓度水飞蓟素组G0/G1期细胞百分率明显升高(P < 0.05),而S期和G2/M期细胞比例明显降低(P<0.05)。见表 2。
| (n=5, x±s, η/%) | ||||
| Group | Dose(mg·L-1) | Percentage of SGC 7901 cells | ||
| G0/G1 | S | G2/M | ||
| Control | 0 | 55.21±3.43 | 24.5±2.19 | 18.17±1.36 |
| Silymarin | ||||
| 15 | 69.92±7.10* | 19.39±2.98* | 11.44±1.27* | |
| 30 | 75.32±8.37* | 17.24±2.01* | 8.38±0.99* | |
| 60 | 81.27±9.11* | 14.71±1.13* | 6.61±0.74* | |
| * P < 0.05 compared with control group. | ||||
划痕48 h后,对照组划痕变窄,SGC 7901细胞向划痕内部迁移至划痕区中部;与对照组比较,水飞蓟素15、30和60 mg·L-1组划痕间隙明显加宽,细胞迁移距离明显缩短(P < 0.05)。Transwell穿膜实验结果显示:与对照组比较,15、30和60 mg·L-1水飞蓟素组穿膜细胞数量明显减少(P < 0.05)。见图 2、3和表 3。

|
| A-D:0 h; E-H:24h;A, E:Control group; B, F:15 mg·L-1 silymarin group; C, G:30 mg·L-1 silymarin group; D, H:60 mg·L-1 silymarin group. 图 2 划痕实验检测各组SGC 7901细胞迁移能力 Figure 2 Migration abilities of SGC 7901 cells in various groups detected by scratch test |
|
|
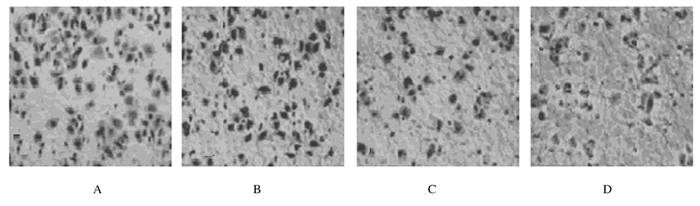
|
| A:Control group; B-D:15, 30, and 60 mg·L-1 silymarin groups. 图 3 Transwell小室法检测各组SGC 7901细胞侵袭能力 Figure 3 Invasion abilities of SGC 7901 cells in various groups detected by Transwell chamber assay |
|
|
| (n=5, x±s) | |||
| Group | Dose(mg·L-1) | Migration distance(l/μm) | Number of transmembrane cells |
| Control | 0 | 126.7±9.5 | 138.3±6.1 |
| Silymarin | |||
| 15 | 46.6±3.7* | 108.2±5.7* | |
| 30 | 33.2±4.4* | 77.4±6.0* | |
| 60 | 28.5±3.1* | 54.2±3.3* | |
| * P < 0.05 compared with control group. | |||
胃癌的发生率呈逐年上升趋势,患者死亡率高,在我国高发性消化系肿瘤中占第1位,且就诊患者多数已进入晚期[8-10]。诱导肿瘤细胞凋亡是抗癌药物治疗肿瘤的重要机制之一[11-13],临床抗肿瘤药物存在不良反应多等缺点。目前探寻治疗效果好、不良反应小或无毒的抗胃癌药物是一个难点。水飞蓟素是一种从天然植物水飞蓟果实种皮中提取的黄酮木脂素类物质[14-15]。研究[16-18]显示:水飞蓟素对多种肿瘤细胞具有较强的抑制作用,但其作用机制仍待进一步研究。因此,本研究以人胃癌SGC 7901细胞作为研究对象,探讨水飞蓟素抑制人胃癌细胞增殖、迁移及侵袭的作用。
细胞大量增殖是肿瘤发生的一个重要原因,因此,干扰肿瘤细胞生长代谢及增殖过程,诱发癌细胞凋亡对治疗肿瘤具有重要意义[19-20]。本研究结果表明:不同浓度水飞蓟素作用于人胃癌SGC 7901细胞后,细胞贴壁密度变小,细胞形态不规则、体积变小,细胞数量明显减少,产生大量细胞碎片,SGC 7901细胞增殖活性受到明显抑制,表明水飞蓟素对人胃癌SGC 7901细胞增殖具有抑制作用;人胃癌SGC 7901细胞经不同浓度水飞蓟素作用24 h后,G0/G1期细胞百分率明显升高,表明水飞蓟素对SGC 7901细胞有周期阻滞作用,周期阻滞于G1期。目前,尚未见有关水飞蓟素对人胃癌SGC 7901细胞迁移、侵袭能力影响的研究,本研究结果显示:水飞蓟素对人胃癌SGC 7901细胞迁移和侵袭能力具有明显的抑制作用,并呈明显的量效关系。
综上所述,水飞蓟素对人胃癌SGC 7901细胞具有明显的增殖抑制作用,可诱导细胞凋亡,进而影响人胃癌SGC 7901细胞的迁移和侵袭能力。本研究仅探讨了水飞蓟素在体外对人胃癌SGC 7901细胞的作用,但水飞蓟素通过何种途径、何种靶点抑制人胃癌SGC 7901细胞的增殖、迁移、侵袭能力和细胞周期仍待进一步深入研究。
| [1] | 李青权, 周强, 牛俊奇, 等. 水飞蓟素药理机制新进展及临床价值再探讨[J]. 临床肝胆病杂志, 2015, 31(2): 315–317. DOI:10.3969/j.issn.1001-5256.2015.02.044 |
| [2] | 陆一丹, 徐良额, 裘嘉琪, 等. 水飞蓟素逆转人乳腺癌耐药细胞株MCF-7/ADM耐药性实验研究[J]. 浙江中西医结合杂志, 2016, 26(2): 117–119. DOI:10.3969/j.issn.1005-4561.2016.02.007 |
| [3] | Sadava D, Kane SE. Silibinin reverses drug resistance inhuman small-cell lung carcinoma cells[J]. Cancer Lett, 2013, 339(1): 102–106. DOI:10.1016/j.canlet.2013.07.017 |
| [4] | Soria EA, Bongiovanni GA, Luján CD, et al. Effect of arsenite on nitrosative stress in human breast cancer cells andits modulation by flavonoids[J]. Nutr Cancer, 2015, 67(4): 659–663. DOI:10.1080/01635581.2015.1019637 |
| [5] | Chen PN, Hsieh YS, Chiou HL, et al. Silibinin inhibits cell invasion through inactivation of both PI3K-Akt and MAPK signaling pathways[J]. Chem Biol Interact, 2005, 156(2/3): 141–150. |
| [6] | 刘志刚, 李雪玲, 翁立冬, 等. 水飞蓟素药理作用研究进展[J]. 辽宁中医药大学学报, 2012, 17(10): 91–93. |
| [7] | Cheung CW, Vesey DA, Nicol DL, et al. Silibinin inhibits renal cell carcinoma via mechanisms that are independent of insulin-like growth factor-binding protein 3[J]. BJUInt, 2007, 99(2): 454–460. |
| [8] | 左婷婷, 郑荣寿, 曾红梅, 等. 中国胃癌流行病学现状[J]. 中国肿瘤临床, 2017, 44(1): 52–58. DOI:10.3969/j.issn.1000-8179.2017.01.881 |
| [9] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87–108. DOI:10.3322/caac.21262 |
| [10] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [11] | Zhu Y, Li M, Wang X, et al. Caspase cleavage of cytochrome c1 disrupts mitochondrial function and enhances cytochrome c release[J]. Cell Res, 2012, 22(3): 127–141. |
| [12] | 刘金坤, 应敏, 王琴, 等. 中药成分诱导肿瘤细胞自噬的研究进展[J]. 中国实验方剂学杂志, 2017, 5(3): 207–215. |
| [13] | 曹慧娟, 贾永森, 闫昕, 等. 黄芩素诱导肿瘤细胞凋亡的研究进展[J]. 中华中医药学刊, 2017, 2(4): 946–948. |
| [14] | 马星海. 水飞蓟化学成分和药理作用研究进展[J]. 亚太传统医药, 2015, 11(19): 62–65. |
| [15] | 夏启水, 殷明. 水飞蓟素对人骨肉瘤Saos-2细胞的作用及机制研究[J]. 现代诊断与治疗, 2017, 28(90): 1577–1579. |
| [16] | Raina K, Rajamanickam S, Singh RP, et al. Stage-specific inhibitory effects and associated mechanisms of silibinin on tumorprogression and metastasis in transgenic adenocarcinoma of the mouse prostate model[J]. Cancer Res, 2008, 68(16): 6822–6830. DOI:10.1158/0008-5472.CAN-08-1332 |
| [17] | Singh RP, Tyagi A, Sharma G, et al. Oral silibinin inhibitsin vivo human bladder tumor xenograft growth involving down-regulation of survivin[J]. Clin Cancer Res, 2008, 14(1): 300–308. DOI:10.1158/1078-0432.CCR-07-1565 |
| [18] | Singh RP, Mallikarjuna GU, Sharma G, et al. Oral silibinin inhibits lung tumor growth in athymic nude mice and forms a novel chemocombination with doxorubicin targeting nuclear factor kappaB-mediated inducible chemoresistance[J]. Clin Cancer Res, 2004, 10(24): 8641–8647. DOI:10.1158/1078-0432.CCR-04-1435 |
| [19] | 刘奇章, 龚兴国. 穿心莲内酯诱导胃癌细胞周期抑制和内源性凋亡[J]. 浙江大学学报, 2017, 44(4): 456–463. |
| [20] | 符兆英. 胃癌多药耐药在ABC转运蛋白、细胞凋亡和长链非编码RNA方面的研究进展[J]. 世界华人消化杂志, 2017(32): 2838–2850. |
 2018, Vol. 44
2018, Vol. 44


