扩展功能
文章信息
- 尹芳蕊, 庞春艳, 耿立霞, 王永福
- YIN Fangrui, PANG Chunyan, GENG Lixia, WANG Yongfu
- 过表达miR-124a对J774.1细胞中TNF-α和IL-6表达水平及细胞周期的影响
- Effects of miR-124a overexpression on expression levels of TNF-α and IL-6 and cell cycle of J774.1 cells
- 吉林大学学报(医学版), 2018, 44(05): 983-987
- Journal of Jilin University (Medicine Edition), 2018, 44(05): 983-987
- 10.13481/j.1671-587x.20180517
-
文章历史
- 收稿日期: 2018-01-06
类风湿性关节炎(rheumatid arthritis, RA)是慢性炎症性自身免疫性疾病,影响约世界1%人口,是造成伤残的最普遍原因之一,但迄今为止RA病因和发病机制尚未完全明确,被认为是遗传、免疫和环境相互作用的结果[1-2]。免疫系统中巨噬细胞、树突状细胞、肥大细胞和NK细胞失调发生在RA的不同阶段,在其发展过程中具有重要意义,早期RA可无典型症状或仅呈现出单一临床症状,且缺乏特异性诊断方法,探寻灵敏度高、特异度好的早期诊断标志物和特异的治疗靶点是RA诊断治疗的最终目标[3]。微小RNA(microRNA, miRNA)是非编码小分子RNA,miRNA与机体的免疫调节密切相关,多种miRNA在RA中异常表达[4-6],与RA的发生、发展、预后和转归关系密切,检测与RA有关的miRNA谱,可为RA的早期诊断提供新的依据,为RA的治疗提供新的选择[7]。人类miR-124的3个编码基因位于8q12.3、8p23.1和20q13.33,miR-124的表达异常可诱发多种疾病产生及发展。miR-124高度保守,在脑和脊髓神经元中大量表达,目前研究多集中在其与神经和脑疾病的相关性方面。miR-124a可促进神经元的分化[8],是一种脑神经保护和脑功能恢复的新的生物标志物[9]。研究[10-11]表明:miR-124可抑制肿瘤细胞的增殖、侵袭和转移,促进肿瘤细胞的凋亡。
miR-124与风湿病的相关研究国内外少见报道。Nakamachi等[12]研究发现:miR-124可抑制佐剂性关节炎鼠模型的关节炎症状,减少滑膜细胞增殖、白细胞浸润、软骨或骨破坏,用pre-miR-124处理后佐剂性关节炎鼠模型的破骨细胞计数及核因子κB受体激活因子配体(receptor activator of nuclear factor κB ligand,RANKL)、整合素β1(integrin β1,ITGB1)和核因子活化的T细胞的细胞质(activated T cells cytoplasmic 1,ATc1)表达水平均降低。
以上研究在动物水平验证了miR-124可改善佐剂性关节炎鼠模型临床症状,抑制关节炎的发展,但miR-124与RA细胞水平的研究尚未见报道。本研究从细胞水平设计通过miRNA-124a的过表达腺病毒载体,感染RA细胞模型小鼠巨噬细胞J774.1,探讨miRNA-124a对小鼠巨噬细胞J774.1的可能作用机制,以期为RA的治疗提供细胞水平的实验依据。
1 材料与方法 1.1 细胞株、主要试剂和仪器J774.1细胞株购自上海轩研生物科技有限公司,过表达miR-124a的腺病毒液和miR-124a腺病毒阴性对照液购自武汉淅玛公司,白细胞介素6(IL-6)及肿瘤坏死因子α(TNF-α) ELISA试剂盒购自上海生物工程有限责任公司,胎牛血清、胰蛋白酶和DMEM培养液购自美国Gibco公司,反转录试剂盒、Trizol和荧光定量试剂盒购自日本TaKaRa公司,荧光显微镜购自日本Olympus公司,酶标分析仪购自深圳雷杜生命科学股份有限公司,荧光定量PCR仪购自中国BIOER公司,FACSCantoⅡ流式细胞仪购自美国BD公司。
1.2 细胞培养及miRNA转染J774.1巨噬细胞用含100 mL·L-1 FBS的DMEM/F12培养基培养。将生长状态良好的J774.1细胞,胰酶消化培养,取对数生长期细胞,以每毫升1×106个细胞均匀接种于培养皿,当细胞融合度达到60%时进行转染,细胞实验分为3组,即miR-124a过表达组(感染miR-124a腺病毒载体)、空载腺病毒组(感染阴性病毒液)和空白对照组(不做任何处理),设置3个复皿,感染48 h后在倒置显微镜的荧光视野和明视野下观察细胞感染状态,流式细胞仪检测感染效率,感染效率=感染阳性细胞数/检测总细胞数×100%。
1.3 ELISA法检测细胞上清液中IL-6和TNF-α水平上述3组感染48 h后的细胞上清液按IL-6和TNF-α检测试剂盒的说明书进行操作,检测IL-6和TNF-α的表达水平。加样,37℃温育30 min,洗涤5次,加酶标抗体50 μL,温育、洗涤,加显色液显色,检测其吸光度(A)值,根据标准曲线计算出IL-6和TNF-α的水平。
1.4 RT-PCR法检测细胞中IL-6和TNF-α mRNA表达水平3组细胞感染48 h后,弃除培养液,PBS清洗2次,用Trizol法提取上述3组细胞的总RNA,反转录试剂盒将RNA反转录合成cDNA,RT-PCR法检测IL-6和TNF-α mRNA的相对表达水平,引物由上海生工生物有限公司合成。根据Ct值采用2-ΔΔCt法计算目的基因的相对表达水平,ΔCt=目的基因Ct值-内参基因Ct值,ΔΔCt=实验组Ct值-对照组Ct值。
1.5 流式细胞术检测细胞周期收集3组样本细胞制成单细胞悬液,细胞数量为每毫升2×106个细胞,75%冰冻乙醇4 ℃过夜,重悬细胞后加入20 μL RNA酶,37℃水浴30 min,加入400 μL碘化丙啶(PI)进行DNA染色,轻轻混匀后4℃避光孵育60 min,使用BD流式细胞仪检测,每组进行3次独立重复实验,实验数据用ModFit LT软件进行分析。
1.6 统计学分析采用SPSS 17. 0统计软件进行统计学分析。各组细胞上清中TNF-α和IL-6水平、细胞中TNF-α和IL-6 mRNA表达水平及细胞周期G1、S和G2期细胞所占百分率均以x±s表示,多组间样本均数比较采用单因素方差分析(LSD法)。以ɑ=0.05为检验水准。
2 结果 2.1 荧光显微镜下观察miR-124a过表达腺病毒感染J774.1细胞miR-124a过表达腺病毒感染J774.1细胞48 h后,应用荧光显微镜观察可见细胞发出绿色荧光,表明腺病毒成功有效地感染J774.1细胞(图 1,见插页三)。
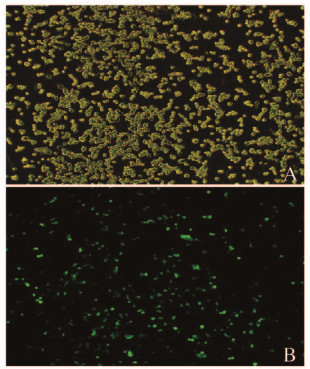
|
| A:Bright field; B:Fluorescence photo corresponding to A. 图 1 miR-124a腺病毒感染48 h后的J774.1细胞(×100) Figure 1 J774.1 cells transfected by miR-124a for 48 h(×100) |
|
|
3组细胞感染48 h后,胰酶消化并收集,流式细胞仪分析腺病毒感染J774.1细胞的效率,结果显示:空白对照组、miR-124a过表达组和空载腺病毒组感染效率分别为42.8%和45.1%。见图 2。
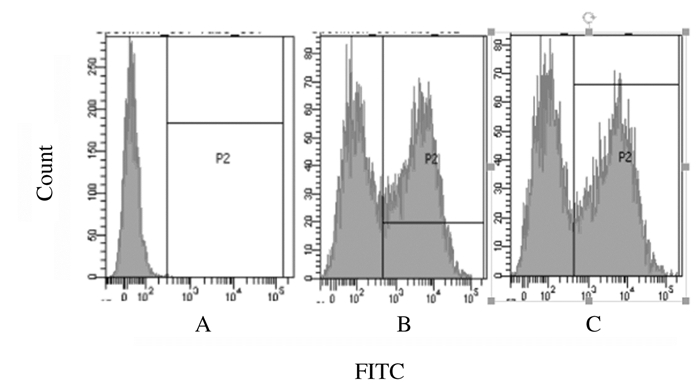
|
| A: Blank control group B:Empty vector group C:miR-124a group. 图 2 流式细胞术检测各组J774.1细胞感染效率 Figure 2 Infection efficiencies of J774.1 cells in various groups detected by flow cytometry |
|
|
3组细胞感染48 h后,ELISA法检测结果显示:miR-124a过表组细胞上清中TNF-α和IL-6水平明显低于空白对照组和空载腺病毒组(P=0.038,P=0.042;P=0.043,P=0.044)。见表 1。
| [n=3, x±s, ρB/(ng·L-1)] | ||
| Group | TNF-α | IL-6 |
| Blank control | 12.41±3.76 | 3.12±0.92 |
| Empty vector | 11.36±3.29 | 3.13±0.79 |
| MiR-124a | 8.22±1.96*△ | 2.23±0.66*△ |
| * P < 0.05 vs blank control group; △ P < 0.05 vs empty vector group. | ||
3组细胞感染48 h后,RT-PCR法检测TNF-α和IL-6 mRNA表达水平:miR-124a过表达组细胞中TNF-α和IL-6mRNA表达水平明显低于空白对照组和空载腺病毒组(P=0.001,P=0.002;P=0.001,P=0.003)。见表 2。
| (n=3, x±s) | ||
| Group | TNF-α mRNA | IL-6 mRNA |
| Blank control | 1.00±0.00 | 1.00±0.00 |
| Empty vector | 0.98±0.13 | 0.89±0.11 |
| MiR-124a | 0.70±0.18*△ | 0.56±0.12*△ |
| * P < 0.05 vs blank control group; △ P < 0.05 vs empty vector group. | ||
miR-124a腺病毒转染J774.1细胞48 h,与空白对照组和空载腺病毒组比较,miR-124a过表达组G1期细胞百分率明显升高(P < 0.01),S和G2期细胞百分率明显降低(P < 0.01),表明miR-124a感染小鼠巨噬细胞J774.1细胞后可以阻滞细胞周期于G1期。见表 3。
| (n=3, x±s, η/%) | |||
| Group | Percentage of cells | ||
| G0G1 | S | G2/M | |
| Blank control | 44.24±1.08 | 47.57±0.30 | 8.19±0.78 |
| Empty vector | 45.81±0.57 | 46.84±0.81 | 7.35±0.50 |
| MiR-124a | 52.45±0.96 *△ | 43.31±0.72 *△ | 4.24±0.30 *△ |
| * P < 0.05 vs blank control group; △ P < 0.05 vs empty vector group. | |||
RA是慢性侵蚀性关节炎为特征的全身性自身免疫病,病变特点为关节滑膜炎症、骨侵蚀和关节破坏日益严重,最后导致程度不等的功能障碍和畸形,病因至今仍未阐明,免疫失衡和过度炎症可能是RA发病的核心环节。近年来研究[13-14]显示:辅助性T淋巴细胞和巨噬细胞及其分泌的细胞因子可侵蚀破坏关节,巨噬细胞作为一种炎症细胞,能够产生高浓度的细胞因子和促炎介质,从而加重炎症反应,最终导致关节破坏; 巨噬细胞为RA的起始细胞,巨噬细胞的损伤和激活会引起机体炎症性反应。小鼠巨噬细胞J774.1具有正常巨噬细胞功能,可以产生TNF-α和IL-6[15]。因此本研究选择小鼠巨噬细胞J774.1作为RA研究的载体。体内的Th1/Th2辅助T细胞及其分泌的细胞因子在体内维持机体的免疫自稳,Th1细胞主要分泌IFN-γ和TNF-α等细胞因子,Th2细胞分泌IL-4和IL-6等细胞因子,然而在RA发生发展过程中这种平衡被破坏[16]。其中IL-6和TNF-α等重要促炎性细胞因子参与RA多种致病机制,人源化IL-6受体拮抗剂可以改善RA患者症状[17-18]。
miRNAs可通过调节炎性细胞因子表达而减缓RA临床症状,Yang等[19]研究显示:miR-124参与胆碱能抗炎通路,对全身和局部炎症有明显的抑制作用,α7烟碱型乙酰胆碱受体(alph α7 nicotinic acetylcholine receptors, α7nAChR)通过调节miR-124的表达,减少了IL-6和TNF-α的产生和释放,miR-124通过靶蛋白STAT3来减弱IL-6的产生,通过降低TNF-α转化酶稳定性来调节TNF-α蛋白表达。Qiu等[20]发现:miR-124是1个重要的炎症相关miRNA,miR-124可抑制TLR通路中IL-1受体相关激酶1 (IL-1 receptor-associated kinase 1)和TNF受体相关因子6(TNF receptor associated factor 6),发挥抗炎作用。王易林等[21]发现:在脂多糖诱导的小鼠急性肺损伤模型上,活化的过氧化物酶增殖体激活受体γ(peroxisome proliferators activated receptor γ,PPARγ)通过上调miR-124抑制小鼠肺组织炎性因子IL-6和TNF-α的表达,具有保护和防御急性肺损伤的作用。本研究结果显示:小鼠巨噬细胞J774.1细胞感染48 h后,miR-124a过表达组细胞上清中TNF-α和IL-6表达水平明显低于空白对照组和空载腺病毒组,细胞中TNF-α和IL-6 mRNA表达水平明显低于空白对照组和空载腺病毒组, 提示过表达的miR-124可以抑制RA细胞模型J774.1细胞炎性因子TNF-α和IL-6的释放, 从而减缓RA的病情迅速进展。
本实验采用腺病毒感染J774.1细胞48 h后,采用流式细胞术检测miR-124a腺病毒转染J774.1细胞48 h后各组细胞的周期分布:miR-124a过表达组G1期细胞百分率与空载腺病毒组和空白对照组比较明显升高,S和G2期细胞百分率明显降低,提示miR-124a转染小鼠巨噬细胞J774.1细胞后可以阻滞细胞周期于G1期,miR-124a可能通过影响细胞周期的方式影响J774.1细胞的增殖。Nakamachi等[22]将miR-124a的前体转染RA患者滑膜细胞后可以抑制其增殖,并阻滞细胞周期于G1期,miR-124a结合在细胞周期激酶2(cyclin-dependent kinase 2,CDK-2)和单核细胞趋化蛋白1(monocyte chemoattractant protein 1,MCP-1)的3′端的非编码区,抑制CDK-2和MCP-1的表达。
综上所述,miR-124a抑制RA致病过程中重要炎症介质IL-6和TNF-α的分泌,并影响RA常用的细胞模型J774.1细胞的增殖,在此推测miR-124a在RA发病中可能起着正调控作用,可能成为RA新的治疗靶点,但目前对其作用机制了解尚少,还需进一步深入探讨。
| [1] | Bellucci E, Terenzi R, La Paglia GM, et al. One year in review 2016:pathogenesis of rheumatoid arthritis[J]. Clin Exp Rheumatol, 2016, 34(5): 793–801. |
| [2] | Angelotti F, Parma A, Cafaro G, et al. One year in review 2017:pathogenesis of rheumatoid arthritis[J]. Clin Exp Rheumatol, 2017, 35(3): 368–378. |
| [3] | Picerno V, Ferro F, Adinolfi A, et al. One year in review:the pathogenesis of rheumatoid arthritis[J]. Clin Exp Rheumatol, 2015, 33(4): 551–558. |
| [4] | Wei XJ, Li XW, Lu JL, et al. MiR-20a regulates fibroblast-like synoviocyte proliferation and apoptosis in rheumatoid arthritis[J]. Eur Rev Med Pharmacol Sci, 2017, 21(17): 3886–3893. |
| [5] | Hong BK, You S, Yoo SA, et al. MicroRNA-143 and-145 modulate the phenotype of synovial fibroblasts in rheumatoid arthritis[J]. Exp Mol Med, 2017, 49(8): e363. DOI:10.1038/emm.2017.108 |
| [6] | Liu J, Fei D, Xing J, et al. MicroRNA-29a inhibits proliferation and induces apoptosis in rheumatoid arthritis fibroblast-like synoviocytes by repressing STAT3[J]. Biomed Pharmacother, 2017, 96: 173–181. DOI:10.1016/j.biopha.2017.09.120 |
| [7] | Churov AV, Oleinik EK, Knip M. MicroRNAs in rheumatoid arthritis:altered expression and diagnostic potential[J]. Autoimmun Rev, 2015, 14(11): 1029–1037. DOI:10.1016/j.autrev.2015.07.005 |
| [8] | Wang Y, Wang D, Guo D. MiR-124 promote neurogenic transdifferentiation of adipose derived mesenchymal stromal cells partly through RhoA/ROCK1, but Not ROCK2 signaling pathway[J]. PLoS One, 2016, 11(1): e0146646. DOI:10.1371/journal.pone.0146646 |
| [9] | Sun Y, Luo Z M, Guo X M, et al. An updated role of microRNA-124 in central nervous system disorders:a review[J]. Front Cell neurosci, 2015, 9(193): 1–8. |
| [10] | Zhang J, Lu Y, Yue X, et al. MiR-124 suppresses growth of human colorectal cancer by inhibiting STAT3[J]. PLoS One, 2013, 8(8): e70300. DOI:10.1371/journal.pone.0070300 |
| [11] | Feng T, Xu D, Tu C, et al. miR-124 inhibits cell proliferation in breast cancer through downregulation of CDK4[J]. Tumour Biol, 2015, 36(8): 5987–5997. DOI:10.1007/s13277-015-3275-8 |
| [12] | Nakamachi Y, Ohnuma K, Uto K, et al. MicroRNA-124 inhibits the progression of adjuvant-induced arthritis in rats[J]. Ann Rheum Dis, 2016, 75(3): 601–608. DOI:10.1136/annrheumdis-2014-206417 |
| [13] | Haringman JJ, Gerlag DM, Zwinderman AH, et al. Synovial tissue macrophages:a sensitive biomarker for response to treatment in patients with rheumatoid arthritis[J]. Ann Rheumatic Dis, 2005, 64(6): 834–838. DOI:10.1136/ard.2004.029751 |
| [14] | Kinne RW, Stuhlmüller B, Burmester GR. Cells of the synovium in rheumatoid arthritis. Macrophages[J]. Arthritis Res Ther, 2007, 9(6): 224. DOI:10.1186/ar2333 |
| [15] | Khoury M, Louis-Plence P, Escriou V, et al. Efficient new cationic liposome formulation for systemic delivery of small interfering RNA silencing tumor necrosis factor in experimental arthritis[J]. Arthritis Rheum, 2006, 54(6): 1867–1877. DOI:10.1002/(ISSN)1529-0131 |
| [16] | Lubberts E. Role of T lymphocytes in the development of rheumatoid arthritis Implications for treatment[J]. Curr Pharm Des, 2015, 21(2): 142–146. |
| [17] | Yokota S, Tanaka T, Kishimoto T. Efficacy, safety and tolerability of tocilizumab in patients with systemic juvenile idiopathic arthritis[J]. Ther Adv Musculoskel Dis, 2012, 4(6): 387–397. DOI:10.1177/1759720X12455960 |
| [18] | Mcinnes IB, Buckley CD, Isaacs JD. Cytokines in rheumatoid arthritis-shaping the immunological landscape[J]. Nat Rev Rheumatol, 2016, 12(1): 63–68. DOI:10.1038/nrrheum.2015.171 |
| [19] | Sun Y, Li Q, Gui H, et al. MicroRNA-124 mediates the cholinergic anti-inflammatory action through inhibiting the production of pro-inflammatory cytokines[J]. Cell Res, 2013, 23(11): 1270–1283. DOI:10.1038/cr.2013.116 |
| [20] | Qiu S, Feng Y, LeSage G, et al. Chronic morphine-induced microrna-124 promotes microglial immunosuppression by modulating P65 and TRAF6[J]. J Immunol, 2015, 194(3): 1021–1030. DOI:10.4049/jimmunol.1400106 |
| [21] | 王易林, 胡明冬. 过氧化物酶增殖体激活受体γ通过上调miR-124表达抑制急性肺损伤肺泡巨噬细胞炎症反应[J]. 中华肺部疾病杂志电子版, 2015, 8(2): 19–23. |
| [22] | Nakamachi Y, Kawano S, Takenokuchi M, et al. MicroRNA-124a is a key regulator of proliferation and monocyte chemoattractant protein 1 secretion in fibroblast-like synoviocytes from patients with rheumatoid arthritis[J]. Arthritis Rheum, 2009, 60(5): 1294–1304. DOI:10.1002/art.v60:5 |
 2018, Vol. 44
2018, Vol. 44


