扩展功能
文章信息
- 王天月, 崔晓燕, 吴骁, 王丹
- WANG Tianyue, CUI Xiaoyan, WU Xiao, WANG Dan
- 磷酸化胞外信号调节激酶在小鼠海马发育过程中的表达及其意义
- Expression of phosphorylated extracellular signal-regulated kinase during development of hippocampus in mice
- 吉林大学学报(医学版), 2018, 44(05): 979-982
- Journal of Jilin University (Medicine Edition), 2018, 44(05): 979-982
- 10.13481/j.1671-587x.20180516
-
文章历史
- 收稿日期: 2017-11-28
2. 河北省药品检验研究院药理毒理室, 河北 石家庄 050011;
3. 辽宁何氏医学院实验动物中心, 辽宁 沈阳 110163;
4. 锦州医科大学人体解剖与组织胚胎学教研室, 辽宁 锦州 121001
2. Pharmacology and Toxiology Office, Hebei Institute for Pharmaceutical Testing, Shijiazhuang 050011, China;
3. Experimental Animal Center, Liaoning Ho's Medical College, Shenyang 110163, China;
4. Department of Human Anatomy, Histology and Embryology, Jinzhou Medical University, Jinzhou 121001, China
海马属边缘系统,主要包括阿蒙角(Ammon’ s horn,CA)和齿状回(dentate gyrus, DG)等结构,在空间定位、学习记忆和控制情绪等过程中发挥着重要作用[1-2],成为神经科学研究的热点之一。胞外信号调节激酶(extracellularsignal-regulated kinase,ERK)是一种丝氨酸/苏氨酸蛋白激酶,属于MAPK(mitogen activated protein kinase,MAPK)家族下游成员。无活性的ERK位于细胞质中,当胞外信号引起ERK磷酸化(pERK)激活后,则从细胞质转位进入细胞核中,从而触动一系列下游基因的活化[3]。研究[4-6]表明:ERK信号通路激活可直接参与细胞增殖,促进细胞存活,抑制细胞凋亡,促进海马神经细胞增殖, 是细胞生长周期环中不可或缺的过程。近年来,有关ERK的研究多集中在促进细胞增殖及其介导的信号转导具体机制、建立在各种动物和细胞模型基础上的关于ERK在神经系统退行性与功能失调性疾病以及孤独症模型、神经毒性和母婴分离等方面[7-10];但ERK表达在脑发育不同阶段的变化规律及其机制研究较少。因此,本研究利用免疫组织化学和免疫印迹法、结合图像分析技术观察胚胎(embryo, E) 18 d以及生后(postnatal, P) 1、3、7、14、21和28 d时小鼠海马组织中pERK表达变化,为在分子水平探究海马发育机制提供基础实验依据。
1 材料与方法 1.1 实验动物及标本制备[11]8周龄昆明小鼠由锦州医科大学动物中心提供,动物合格证号:SCXK(辽)2014-0004,以雌雄比例1:2饲养,按日观察,见阴道栓出现为E 0 d,仔鼠出生的最早时间为P 0 d。取E 18 d的胎鼠和P 1、3、7、14、21和28 d的小鼠海马组织,4%多聚甲醛固定,常规制备光镜标本,连续切片,切片厚度5 μm,用于免疫组织化学显色。另低温下取各时间点的小鼠海马组织,-80℃保存,用于免疫印迹检测。
1.2 主要试剂S-P超敏试剂盒和DAB试剂盒购自北京中杉金桥生物技术有限公司,兔抗小鼠多克隆pCREB抗体购自美国Santa Cruz公司,ECL试剂盒购自上海BestBio公司,蛋白Marker和PVDF膜购自福州迈新生物技术开发有限公司,BCA试剂盒购自碧云天生物技术研究所,β-actin购自亚太恒信生物工程有限公司。
1.3 免疫组织化学染色石蜡切片经脱蜡、透明至水化后,滴加过氧化物酶,室温15 min;高压修复3 min,室温冷却,非免疫动物血清封闭15 min;兔抗小鼠pERK抗体(1:100) 4℃孵育过夜;生物素标记的羊抗兔IgG (1:200),37℃孵育20 min;链霉素抗生物素-过氧化物酶工作液37℃孵育10 min;DAB-H2O2显色;苏木精复染;常规脱水、透明、封片,显微镜下观察。用PBS代替一抗作阴性对照。
1.4 免疫印迹法检测小鼠海马组织中pERK蛋白表达水平按1:5比例于海马组织加入蛋白裂解液,充分反应后离心10 min,采用BCA试剂盒检测上清液蛋白浓度。各泳道加入50 μg的蛋白量, 电泳分离;冰浴转膜。转膜后加入pERK抗体(1:1 000),4℃孵育过夜;TBST漂洗;加入辣根过氧化物酶标记二抗(1:5 000),室温震荡孵育2 h,增强化学发光法(ECL)检测蛋白条带,将条带扫描后用Photoshop 7.0软件进行处理。内参β-actin。扫描X射线片,计算机处理,应用公式计算A值,A值=-lgT,T为透光率,A值越大,表示密度越大,表达水平越高。
1.5 图像分析各取5张不同样本切片,系统、随机选择400倍光镜视野3个,所得图像结果利用图像分析软件(Image-Pro Plus 6.0)进行分析,应用公式计算A值,A=-lgT,T为透光率,A值越大,表示密度越大,表达越强。
1.6 统计学分析采用SPSS 20.0统计软件进行数据处理。不同时间点小鼠海马组织中pERK表达水平以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。检验水准α=0.05。
2 结果 2.1 免疫组织化学染色检测不同时间点小鼠海马组织中pERK蛋白表达水平免疫组织化学检测结果显示:pERK阳性产物呈棕黄色颗粒状,主要在海马DG颗粒细胞层和CA锥体细胞层神经元的细胞核中表达。E 18 d,海马DG和CA区pERK表达染色浅,排列稀疏,吸光度很低;E 18 d~P 7 d,pERK染色逐渐加深、密集,吸光度逐渐增加,与其他6个时间点比较,P 7 d吸光度最高(F=34.537, P < 0.01)。P 14 d~P 21 d,pERK染色逐渐变浅,密集程度逐渐降低,吸光度逐渐下降(F=28.754, P < 0.01);P 28 d处于稳定的较低水平(F=6.075, P>0.05)(图 1,见插页三)。
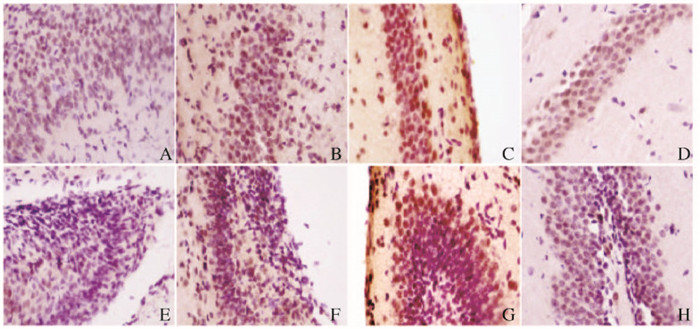
|
| A-D: CA; E-H:DG; A, E: E 18 d; B, F: P 3 d; C, G: P 7 d; D, H: P 21 d. 图 1 pERK在不同发育时期小鼠海马组织中的表达(免疫组织化学,×400) Figure 1 Expressions of pERK in hippocampus tissue at different development stages of mice(Immunohistochemistry, ×400) |
|
|
免疫印迹法检测图像分析结果:各时间点均有pERK表达,E 18 d~P 7 d,pERK表达水平逐渐升高,P 7 d时pERK表达水平最高,与其他6个时间点比较差异有统计学意义(F=33.856, P < 0.01);P 14~21 d时pERK表达水平逐渐降低,与P 7 d比较差异有统计学意义(F=22.627, P < 0.01);P 28 d时PE RK表达处于稳定的较低水平(F=7.421, P>0.05)。见表 1。
| (n=6, x±s) | ||
| Stage | Expression level of pERK | |
| DG | CA | |
| E 18 d | 0.070 1±0.016 5 | 0.070 2±0.003 9 |
| P 1 d | 0.107 2±0.010 5* | 0.097 8±0.009 4* |
| P 3 d | 0.197 8±0.009 4* | 0.200 8±0.011 2* |
| P 7 d | 0.243 0±0.008 7* | 0.262 5±0.007 9* |
| P 14 d | 0.197 4±0.009 9* | 0.184 1±0.008 9* |
| P 21 d | 0.109 8±0.008 5* | 0.132 0±0.008 4* |
| P 28 d | 0.087 2±0.009 2 | 0.121 5±0.008 8 |
| * P < 0.01 vs the pre-time point. | ||
海马结构于胚胎时期发生,起自位于端脑泡背内侧,呈“S”形结构的海马原基。大鼠海马原基于E14 d形成,小鼠则为E 12 d,此后进入海马的有序发育过程,即胚胎早、中期速度较慢,于末期和生后早期阶段发育明显增速,表现为海马体积以及各层的厚度明显增加,海马变成C字形,能区分CA和DG结构正常大小[12], 海马的这些显著变化均离不开活跃的细胞增殖活动。
ERK是与细胞增殖有关的重要基因之一,卢瑛等[13]研究发现:抵抗素能通过上调人血管平滑肌细胞ERK的磷酸化水平,促进平滑肌细胞增殖,应用ERK特异性抑制剂能显著降低ERK的磷酸化水平,细胞增殖受抑。研究[14-15]显示:ERK磷酸化后进入细胞核,激活相关转录因子,增强转录的活性,进而调节促进细胞周期由G1期向S期过渡的基因表达,包括即刻早期基因和迟发反应基因,参与细胞分化与增殖的调控。Oliveros等[6]和佟雷等[16]研究发现:新生大鼠海马神经干细胞增殖与ERK有关。ERK信号通路抑制剂可以抑制神经细胞自噬,加重蛛网膜下腔出血的早期脑损伤和急性缺血性脑梗死再灌注损伤[17-19]。
Palmer等[20]认为:成体海马结构中的神经发生源于齿状回的亚颗粒细胞层, 其位于颗粒细胞层和门区间的一个狭窄区域,大多数神经细胞增殖发生于此。本研究中免疫组织化学结果显示:pERK主要在DG颗粒细胞层和CA锥体细胞层神经元的细胞核中表达,与上述研究结论一致,即pERK主要位于细胞核并参与细胞增殖。
Bayer[21]研究表明:大鼠生后1周为DG增殖分化迁移高峰,P14d ~ 2月呈下降趋势,推测生后1周为大鼠海马细胞增殖、细胞凋亡和结构构建的关键时期。本研究结果显示:表达pERK的阳性细胞变化趋势是在E 18 d~P 7 d逐阶段增加,P 7 d时达高峰,随后的P 14~21 d阶段pERK阳性细胞逐渐稀疏,A值降低,P 28 d时处于稳定的较低水平。本研究结果表明:pERK的变化趋势与以往报道的海马神经细胞增殖的变化趋势的文献相符[12, 21]。出现这种变化趋势的原因在于:小鼠出生是机体的一大转折, 外界环境的声和光等刺激可能使ERK自身活化,转入细胞核,进而激活下游转录因子,产生细胞增殖效应。发育早期,即E 18 d~P 7 d,是海马塑型的关键时期,海马首先形成了DG和CA区雏形,并且各区开始分层,为了满足海马结构在形态及体积上出现的巨大改变,必然引起海马神经细胞大量增殖,因此,pERK阳性细胞表达在P 7 d达到最高峰。在海马结构发育晚期,即P 14~21 d及以后阶段,海马结构和功能日趋成熟,此时不再需要细胞的大量增殖分化,促使与细胞快速增殖有关的ERK表达逐渐下降,细胞增殖速度放慢,新生细胞数量逐渐减少,直至P 28 d达稳态。
综上所述,pERK参与了海马神经元的增殖,与海马发育有关联,本研究结果为从分子水平阐明海马发育的机制提供了较为详实的实验资料。但海马神经细胞增殖受多种因素和多途径动态调节,因此海马发育的具体机制还需要进一步的研究。
| [1] | Chen H, Iinuma M, Onozuka M, et al. Chewing maintains hippocampus-dependent cognitive function[J]. Int J Med Sci, 2015, 12(6): 502–509. DOI:10.7150/ijms.11911 |
| [2] | Serkova VV, Nikolskaya KA, Eremina LV. Hippocampus as an organizer of resent attention[J]. Ross Fiziol Zh Im IM Sechenova, 2015, 101(6): 678–688. |
| [3] | Chowdhury I, Thompson WE, Thomas K. Prohibitins role in cellular survival through Ras-Raf-MEK-ERK pathway[J]. Cell Physiol, 2014, 229(8): 998–1004. DOI:10.1002/jcp.v229.8 |
| [4] | Miller CR, Oliver KE, Farley JH. MEK1/2 inhibitors in the treatment of gynecologic malignancies[J]. Gynecol Oncol, 2014, 133(1): 128–137. DOI:10.1016/j.ygyno.2014.01.008 |
| [5] | Deschênes-Simard X, Kottakis F, Meloche S, et al. ERKs in cancer:friends or foes[J]. Cancer Res, 2014, 74(2): 412–419. DOI:10.1158/0008-5472.CAN-13-2381 |
| [6] | Oliveros A, Cho CH, Cui A, et al. Adenosine A2A receptor and ERK-driven impulsivity potentiates hippocampal neuroblast proliferation[J]. Transl Psychiatry, 2017, 7(4): e1095. DOI:10.1038/tp.2017.64 |
| [7] | Zhu YP, Xi SH, Li MY, et al. Fluoride and arsenic exposure affects spatial memory and activates the ERK/CREB signaling pathway in offspring rats[J]. Neurotoxicology, 2017, 59: 56–64. DOI:10.1016/j.neuro.2017.01.006 |
| [8] | 孙艳秋, 姜志梅, 聂颖, 等. 孤独症鼠模型脑组织CaMK Ⅱ和ERK表达的相关研究[J]. 中国儿童保健杂志, 2017, 25(7): 679–682. |
| [9] | Ha S, Radmond L. ERK mediates activity dependent neuronal complexity via sustained activity and CREB-mediated signaling[J]. Dev Neurobiol, 2018, 68(14): 1565–1579. |
| [10] | Ohta KI, Suzuki S, Warita K, et al. Prolonged maternal separation attenuates BDNF-ERK signaling correlated with spine formation in the hippocampus during early brain development[J]. J Neurochem, 2017, 141(2): 179–194. DOI:10.1111/jnc.2017.141.issue-2 |
| [11] | 邵姝元, 李潮, 张敬坤, 等. 凋亡相关蛋白在小鼠海马发育和老化中的表达[J]. 解剖学杂志, 2012, 35(1): 56–58. DOI:10.3969/j.issn.1001-1633.2012.01.020 |
| [12] | 席刚明, 汪华侨, 唐廷勇, 等. 胚胎时期大鼠海马结构的发育[J]. 四川解剖学杂志, 1999, 7(1): 16–21. |
| [13] | 卢瑛. 抵抗素通过ERK1/2信号途径诱导人血管平滑肌细胞增殖[J]. 中国医药指南, 2012, 10(22): 112–114. DOI:10.3969/j.issn.1671-8194.2012.22.068 |
| [14] | Chowdhury I, Thompson WE, Thomas K. Prohibitins role in cellular survival through Ras-Raf-MEK-ERK pathway[J]. Cell Physiol, 2014, 229(8): 998–1004. DOI:10.1002/jcp.v229.8 |
| [15] | Formosa R, Vassallo J. cAMP signalling in the normal and tumorigenic pituitary gland[J]. Mol Cell Endocrinol, 2014, 392(1/2): 37–50. |
| [16] | 佟雷, 王振宇, 季丽莉, 等. ERK信号转导通路对新生大鼠海马神经干细胞增殖的影响[J]. 解剖科学进展, 2011, 17(3): 232–235. |
| [17] | 刘俊杰, 赵雅宁, 陈禹廷, 等. ERK信号通路抑制剂U0126对蛛网膜下腔出血大鼠早期脑损伤及神经元自噬的影响[J]. 西安交通大学学报:医学版, 2017, 38(1): 18–23, 28. |
| [18] | 安朝旺, 刘瑶, 赵晓云, 等. ERK1/2和PI3-K通路抑制剂对蛛网膜下腔出血大鼠海马区神经细胞自噬的协同作用[J]. 中国医科大学学报, 2017, 46(11): 995–1000. |
| [19] | 谭慧敏, 郑兴荣, 谭盛. ERK1/2信号通路对缺血后适应大鼠皮层的作用[J]. 中国实用神经疾病杂志, 2017, 20(15): 1–5. DOI:10.3969/j.issn.1673-5110.2017.15.001 |
| [20] | Palmer TD, Markakis EA, Willhoite AR, et al. Fibroblast growth factor-2 activates a latent neurogenic program in neural stem cells from diverse regions of the adult CNS[J]. J Neurosci, 1999, 19(19): 8487–8497. DOI:10.1523/JNEUROSCI.19-19-08487.1999 |
| [21] | Bayer SA. Development of the hippocampal region in the rat. Ⅰ. Neurogenesis examined with 3H-thymidine autoradiography[J]. Comp Neurol, 1980, 190(1): 87–114. DOI:10.1002/(ISSN)1096-9861 |
 2018, Vol. 44
2018, Vol. 44


