扩展功能
文章信息
- 陈雪, 沈楠, 安英, 徐博, 赵丽晶
- CHEN Xue, SHEN Nan, AN Ying, XU Bo, ZHAO Lijing
- 丹酚酸B对氧化应激损伤乳鼠心肌细胞的保护作用及其机制
- Protective effect of salvianolic acid B on cardiomyocytes of suckling rats with oxidative stress injuryand its mechanism
- 吉林大学学报(医学版), 2018, 44(05): 974-978
- Journal of Jilin University (Medicine Edition), 2018, 44(05): 974-978
- 10.13481/j.1671-587x.20180515
-
文章历史
- 收稿日期: 2018-01-11
丹参为唇形科鼠尾草属植物丹参(Salvia miltiorrhiza Bunge)的干燥根及根茎,是最常用的活血化瘀中药之一,具有祛瘀止痛和养血安神的功效。现代药理研究[1-3]显示:丹参具有扩张冠状动脉、防治心肌缺血和心肌梗死、改善微循环及降低心肌耗氧量等作用,被广泛应用于心血管系统疾病的治疗。目前,已经从丹参中提取的化学成分主要包括脂溶性的二萜类醌类化合物和水溶性的酚酸类成分[4-6]。丹酚酸B是丹参的水溶性成分,是三分子丹参素与一分子咖啡酸缩合而成[7-9],有关丹酚酸B的研究主要集中在其提取工艺和其对血管内皮细胞的保护作用[10-12],而其对心肌细胞的影响未见报道。因此,本实验采用过氧化氢(hydrogen peroxide, H2O2)建立体外乳鼠心肌氧化应激损伤模型,观察丹酚酸B对心肌细胞的保护作用并探讨其相关机制,为丹酚酸B在保护心肌中的应用提供理论依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器Wistar乳鼠20只,清洁级,2 d龄,雌雄各半,购自吉林大学实验动物中心,动物合格证号:SCXK(吉)2008-0005。丹酚酸B购自陕西森弗高科实业有限公司(批号20130903),H2O2美国购自Sigma公司(批号3135-1),谷胱甘肽(glutathione, GSH)、超氧化物歧化酶(superoxide Dismutase, SOD)和丙二醛(malondialdehyde, MDA)试剂盒购自南京建成生物工程公司(批号20140428),乳酸脱氢酶(lactate dehydrogenase, LDH)和肌酸激酶(creatine kinase, CK)ELISA试剂盒购自上海信然生物科技有限公司(批号20131125)。
1.2 乳鼠心肌细胞的原代培养及分组乳鼠心肌细胞的培养方法参照文献[7]。75%乙醇常规消毒乳鼠,迅速分离心脏,并用组织剪将心肌彻底剪碎,加入约10倍心脏体积的0.125%胰酶, 于37℃水浴、震荡消化5~7 min。向所得的消化液中加入等量的含20%新生牛血清的DMEM培养液以终止胰酶作用。收集细胞悬液, 1 200 r·min-1离心5 min, 弃去上清, 细胞沉淀用含20%血清的DMEM培养液重悬, 接种于培养瓶中, 用差速贴壁法去除成纤维细胞等非心肌细胞。心肌细胞悬液计数, 用含20%新生牛血清的DMEM培养液稀释至所需的细胞密度, 同时加入0.1 mmol·L-1 5-溴脱氧尿苷抑制成纤维细胞的生长, 接种到6孔培养板(细胞密度为每毫升3×105个细胞)中, 于37℃、5%CO2条件培养。48 h后更换新鲜的含20%新生牛血清的DMEM培养液,72 h时, 培养的心肌细胞均伸出伪足, 且大部分已经汇合成片, 自主搏动良好。将原代培养的心肌细胞随机分为正常对照组、模型组、低和高剂量丹酚酸B组,除正常对照组外,其余各组培养液中加入终浓度为100 μmoL·L-1的H2O2造成心肌细胞氧化损伤,低和高剂量丹酚酸B组同时分别加入终浓度为20和40 μmol·L-1丹酚酸B, 正常对照组加入等体积含20%新生牛血清的DMEM培养液,培养4h后,光学显微镜下观察细胞形态表现,并收集细胞和培养液上清,进行相关检测。
1.3 倒置显微镜观察心肌细胞形态表现各组心肌细胞经相应处理后,于倒置显微镜下观察细胞形态学表现并拍照。
1.4 MTT法检测心肌细胞存活率各组心肌细胞经相应处理后,向各孔中加入100μL MTT,继续培养4 h,弃去培养液,加入400μL DMSO溶液,震荡10 min,采用酶标仪测定570 nm处吸光度(A)值,计算心肌细胞存活率。细胞存活率=(各组细胞A值/正常组细胞A值)×100%。
1.5 心肌细胞中GSH和MDA水平及SOD活性测定各组细胞经相应处理后,用0.1%胰蛋白酶消化,1 000 r·min-1离心5min收集细胞,严格按照试剂盒说明采用分光光度计测定GSH和MDA水平及SOD活性。
1.6 心肌细胞培养液中LDH和CK水平测定收集各组细胞培养液,4 000 r·min-1离心10 min,小心吸取上清,严格按照试剂盒说明采用酶标仪测定上清中LDH和CK水平。
1.7 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组心肌细胞中GSH和MDA水平及SOD活性、心肌细胞培养液中LDH和CK水平均以x±s表示,多组间样本均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 光镜下各组心肌细胞形态表现和特征与正常对照组比较,模型组心肌细胞部分悬浮在培养液中,贴壁细胞数量减少,心肌细胞伪足回缩,体积变小,心肌细胞自律搏动明显缓慢。与模型组比较,低和高剂量丹酚酸B组心肌细胞数目明显增多,伪足回缩少,自律搏动增强,其中高剂量丹酚酸B组对心肌形态改善程度优于低剂量丹酚酸B组。见图 1。
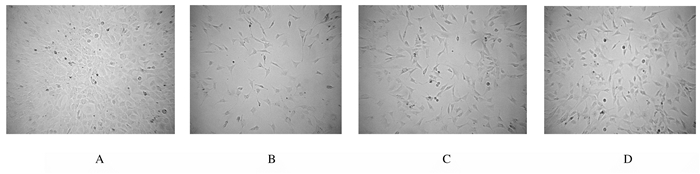
|
| A: Control group; B: Model group; C: 20 μmol·L-1salvianolic acid B group; D: 40 μmol·L-1 salvianolic acid B group. 图 1 各组乳鼠心肌细胞形态学表现(×200) Figure 1 Morphology of cardiomyocytes of suckling rats in various groups(×200) |
|
|
与正常对照组比较,模型组24和48 h心肌细胞存活率明显降低(P<0.01)。与模型组比较,高剂量丹酚酸B组心肌细胞存活率明显升高(P<0.05或P<0.01)。见表 1。
| (n=4, x±s, η/%) | |||
| Group | Dose(μmol·L-1) | Survival rate | |
| (t/h) 24 | 48 | ||
| Normal control | 0 | 0.80±0.04 | 1.01±0.06 |
| Model | 100 | 0.49±0.03* | 0.38±0.02* |
| Salvianolic acid B | |||
| Low dose | 20 | 0.55±0.03△ | 0.06±0.03 |
| High dose | 40 | 0.63±0.02△△ | 0.79±0.03△△ |
| * P < 0.01 compared with normal control group; △ P < 0.05, △△ P < 0.01 compared with model group. | |||
与正常对照组比较,模型组心肌细胞中GSH水平明显降低(P<0.01),MDA水平明显升高(P<0.01),SOD活性降低(P<0.01)。与模型组比较,低和高剂量丹酚酸B组GSH水平升高(P<0.05或P<0.01),而MDA水平降低(P<0.01),SOD活性升高(P<0.05或P<0.01)。见表 2。
| (n=4, x±s) | ||||
| Group | Does(μmol·L-1) | GSH[mB/(mmol·g-1)] | MDA[cB/(μmol·L-1)] | SOD[λB/(U·mg-1)] |
| Normal control | 0 | 12.56±0.87 | 6.55±0.23 | 1.65±1.24 |
| Model | 100 | 6.23±1.22* | 12.11±2.12* | 0.86±0.06* |
| Salvianolic acid B | ||||
| Low dose | 20 | 7.14±0.58△ | 7.57±1.31△△ | 1.03±0.68△ |
| High dose | 40 | 8.46±2.14△△ | 7.03±1.18△△ | 1.24±0.82△△ |
| * P < 0.01 compared with normal control group, △ P < 0.05,△△ P < 0.01compared with model group. | ||||
与正常对照组比较,模型组心肌细胞培养液中LDH和CK水平明显升高(P < 0.01)。与模型组比较,低和高剂量丹酚酸B组心肌细胞培养液中LDH和CK水平均明显降低(P < 0.05或P < 0.01)。见表 3。
| [n=4, x±s, λB/(U·mL-1)] | |||
| Group | Dose(μmol·L-1) | LDH | CK |
| Normal control | 0 | 1 224.35±117.62 | 52.54±6.87 |
| Model | 100 | 1 985.32±108.87* | 94.33±4.82* |
| Salvianolic acid B | |||
| Low dose | 20 | 1 642.38±122.94△ | 76.21±4.23△ |
| High dose | 40 | 1 354.32±164.66△△ | 60.12±3.57△△ |
| * P < 0.01 compared with normal control group; △ P < 0.05, △△ P < 0.01compared with model group. | |||
活性氧(reactive oxygen species, ROS)是细胞内多种氧化还原反应的代谢产物,其生成和清除处于动态平衡中。在各种损伤因素的作用下,ROS生成增多,出现氧化应激,ROS在体内增多并参与氧化生物大分子的形成,诱发基因突变、蛋白质变性和脂质过氧化,进而损伤溶酶体和线粒体等,最终导致细胞的氧化损伤[13-16]。氧化应激损伤在心肌缺血、心肌再灌注损伤及心力衰竭等病理变化中起到重要作用[17-19]。心肌细胞损伤过程中会出现脂质过氧化产物MDA水平升高以及GSH和SOD酶活性降低,同时会引起心肌细胞内LDH及CK释放,引起血清内其水平的升高[20-21],如何有效降低氧化应激对心肌细胞的损伤已成为心血管病领域的研究重点。
丹酚酸B是丹参水溶性酚酸类成分的主要活性物质,目前有关其在抗氧化应激损伤心肌细胞的保护作用相关文献未见报道。本研究利用H2O2制备体外培养心肌细胞氧化损伤模型,研究丹酚酸B对H2O2致氧化应激损伤心肌细胞的保护作用,结果显示:与正常对照组比较,模型组心肌细胞出现贴壁细胞减少、伪足回缩等细胞损伤性变化,同时细胞存活率也明显降低;心肌细胞中GSH水平降低,MDA水平升高,SOD活性降低;由于心肌细胞损伤,心肌细胞培养液中释放的LDH和CK水平增多。脂质过氧化产物MDA水平及SOD活性可直接反映心肌细胞膜脂质过氧化的速度与程度,并间接反映细胞损伤的程度,且与氧自由基的生成情况也有必然联系。本研究结果显示:心肌细胞经丹酚酸B处理后,细胞形态学损伤变化减轻,细胞存活率增加;同时细胞中心肌细胞中GSH水平增多,MDA水平降低,SOD活性升高、心肌细胞培养液中LDH和CK水平降低,提示丹酚酸B能够减轻心肌细胞氧化应激损伤的程度,增强心肌细胞抗氧化防御的能力。
综上所述,丹酚酸B对氧化应激损伤心肌细胞具有保护作用,其机制可能与其通过增加清除氧自由基、发挥抗脂质过氧化作用、进而提高心肌细胞的抗氧化损伤能力有关。本研究结果对临床上心肌病的预防与治疗具有一定的参考价值,也为丹酚酸B在防治与氧化应激性损伤有关的心脏疾病的应用提供了理论依据。
| [1] | 李宣怡. 丹参的化学成份分离及其抗氧化活性分析[J]. 科技资讯, 2017(31): 213–214. |
| [2] | 李易强. 丹参化学成分与药理作用的研究进展[J]. 科技视界, 2017(9): 265–266. DOI:10.3969/j.issn.2095-2457.2017.09.210 |
| [3] | 黄海亮. 丹参的化学成分分离及其抗氧化活性研究[J]. 中国现代药物应用, 2015, 9(21): 277–278. |
| [4] | 俞年军, 彭代银, 陈卫东, 等. 丹参药材含量测定方法的优化[J]. 中国中药杂志, 2015(11): 2128–2131. |
| [5] | 肖作奇, 潘涛, 欧阳波, 等. 响应面优化丹参乙醇提取工艺[J]. 中医药导报, 2015, 40(23): 43–46. |
| [6] | 王雨华, 周学谦, 李德坤, 等. 丹参多酚酸类分析方法及制备工艺的研究进展[J]. 药物评价研究, 2017, 40(7): 1013–1018. |
| [7] | 赵国欣, 刘萌, 李领川, 等. 超高效液相色谱-质谱联用同时测定丹参中7种成分含量[J]. 中国实验方剂学杂志, 2017, 23(1): 60–63. |
| [8] | 高秀蓉, 许小红, 李望, 等. 丹参水溶性提取物缓释微丸的制备及体外释放度研究[J]. 中药材, 2016, 39(9): 2068–2071. |
| [9] | 申琳, 许桂玲, 郝福, 等. 一测多评法测定丹酚酸A原料药中迷迭香酸、紫草酸、丹酚酸B和丹酚酸C[J]. 现代药物与临床, 2018, 33(1): 32–36. |
| [10] | 封亚丽, 张倩倩, 何红涛, 等. 丹酚酸B对人血管内皮祖细胞分化与旁分泌功能的影响[J]. 山东医药, 2017, 57(21): 36–38. DOI:10.3969/j.issn.1002-266X.2017.21.011 |
| [11] | 罗红, 王春花, 赵玲璐, 等. 丹酚酸B抗心肌纤维化的机制研究[J]. 中国药房, 2017, 28(28): 3900–3903. DOI:10.6039/j.issn.1001-0408.2017.28.04 |
| [12] | 任尤楠, 陶善珺, 赵梦秋, 等. 丹酚酸B对波动高糖诱导人脐静脉内皮细胞凋亡的影响[J]. 中药材, 2016, 39(8): 1843–1848. |
| [13] | 王雪芬, 陈树杰, 王磊, 等. 苦参素对H2O2诱导乳鼠心肌细胞氧化应激损伤保护作用的研究[J]. 医学研究杂志, 2016, 45(8): 85–89. |
| [14] | 霍魁媛, 常宏, 王勇, 等. 槲皮素保护H2O2诱导的H9C2心肌细胞氧化损伤的作用机制[J]. 中国实验方剂学杂志, 2016, 22(15): 122–127. |
| [15] | 李兵. 丹参多酚酸盐对过氧化氢所致乳鼠心肌细胞氧化应激损伤影响及其机制[J]. 辽宁中医药大学学报, 2016, 18(12): 28–31. |
| [16] | 杨洋, 刘亭, 王文华, 等. 参芎葡萄糖注射液对H2O2诱导的H9C2细胞氧化损伤的保护作用[J]. 中国实验方剂学杂志, 2016, 22(8): 153–158. |
| [17] | 蒋有琴, 刘剑, 张冬颖, 等. 京尼平对缺氧/复氧心肌细胞氧化应激损伤的影响[J]. 中国药学杂志, 2016, 51(1): 28–34. |
| [18] | 姜岩, 王宏, 邵甜甜, 等. 槲皮素对H2O2诱导大鼠H9C2心肌细胞氧化应激损伤的保护作用[J]. 哈尔滨医科大学学报, 2017, 51(5): 387–390. DOI:10.3969/j.issn.1000-1905.2017.05.001 |
| [19] | 郝帅林, 张媛, 魏艳杰, 等. 天麻素抗心肌氧化应激损伤的作用机制研究[J]. 中国现代医学杂志, 2017, 27(9): 1–7. DOI:10.3969/j.issn.1005-8982.2017.09.001 |
| [20] | 肖玲芳, 张卫芳, 龚志成, 等. 丹酚酸B的心血管药理研究进展[J]. 中南医学科学杂志, 2015, 43(1): 90–94. |
| [21] | 林超, 刘兆国, 钱星, 等. 丹酚酸B在心血管疾病中药理作用研究进展[J]. 中国药理学通报, 2015, 31(4): 449–452. DOI:10.3969/j.issn.1001-1978.2015.04.002 |
 2018, Vol. 44
2018, Vol. 44


