扩展功能
文章信息
- 邢树刚, 张丽红, 金明华, 李百慧, 武则馨, 房波, 李伟
- XING Shugang, ZHANG Lihong, JIN Minghua, LI Baihui, WU Zexin, FANG Bo, LI Wei
- 杨梅黄酮对小鼠脑胶质瘤GL261细胞增殖和凋亡的影响
- Effects of myricetin on proliferation and apoptosis of glioma GL261 cells in mice
- 吉林大学学报(医学版), 2018, 44(05): 955-961
- Journal of Jilin University (Medicine Edition), 2018, 44(05): 955-961
- 10.13481/j.1671-587x.20180512
-
文章历史
- 收稿日期: 2018-04-24
2. 吉林大学公共卫生学院卫生检验学教研室, 吉林 长春 130021
2. Department of Hygienic Inspection, School of Public Health, Jilin University, Changchun 130021, China
胶质瘤是中枢神经系统最常见的原发性恶性肿瘤,目前主要治疗方法是手术切除辅以放化疗。手术切除后肿瘤常易复发,常用的化疗药物有卡莫司汀和替硝唑胺等,上述这些化疗药物虽然取得了一定的治疗效果,但由于药物本身存在的不良反应及部分胶质瘤的耐药性,使胶质瘤的治疗和预后难以取得理想效果[1-2],因此寻找更有效且不良反应少的药物成为胶质瘤治疗的研究重点。杨梅黄酮(Myricetin)是从植物中提取的一种化学物,其来源广泛、毒性低、不良反应少,并且对基质金属蛋白酶(matrix metalloproteases, MMPs)具有高效的特异性抑制作用[3-6]。目前已有研究证实杨梅黄酮对上皮源性恶性肿瘤如食管癌、非小细胞肺癌、结直肠癌、乳腺癌和肝癌等[7-13]以及实验动物骨肉瘤[14]均有一定的抑制作用,但其作用机制目前尚不明确,迄今为止尚无将其应用于胶质瘤治疗学的研究。本实验拟通过体外实验研究杨梅黄酮对小鼠脑胶质瘤GL261细胞的抑制作用,为进一步阐明其对脑胶质瘤的治疗作用提供实验依据。
1 材料与方法 1.1 细胞和主要试剂小鼠胶质瘤GL261细胞由吉林大学病理生物学教育部重点实验室提供;杨梅黄酮购自美国Sigma公司,Matrigel购自美国BD公司,RPMI-1640培养基及胎牛血清购自美国Gibco公司,CCK-8 Kit购自日本同仁公司,Hoechst 33342购自北京碧云天生物技术有限公司,Annexin Ⅴ/PI凋亡检测试剂盒购自天津三箭生物技术有限公司。
1.2 CCK8实验检测细胞活性GL261细胞选用含10%胎牛血清的RPMI-1640培养基,置于37℃、5% CO2孵箱中培养。取对数生长期的GL261细胞,以1×105mL-1细胞密度接种于96孔板中,置37℃、5% CO2孵箱中培养24 h后,弃上清液,加入不同浓度杨梅黄酮(浓度梯度为10、20、30、40、50和60 μmol·L-1),同时设对照组,各组均设4个复孔,分别于24和48 h各取出一块培养板,每孔加入10 μL CCK-8溶液,避光孵育1~2 h,观察培养基颜色变化,用酶标仪在450 nm波长处检测每孔的吸光度(A)值,计算每孔细胞存活率。细胞存活率=处理组A值/对照组A值×100%。
1.3 流式细胞术检测细胞周期取对数生长期GL261细胞,调整细胞密度为1×106 mL-1,接种于6孔板,待细胞融合至80%时,加含40 μmol·L-1杨梅黄酮的新鲜培养基继续培养24 h后,设对照组,收取单细胞悬液,用预冷的PBS洗2次,70%乙醇固定,5 μL RNA酶A(10 g·L-1),37℃孵育30 min,加入25 μL PI染色液(1 g·L-1),4℃避光孵育30 min,流式细胞仪检测细胞周期。
1.4 Hoechst 33342染色及结果判定标准调整细胞密度为1×105 mL-1,24孔板中每孔加入500 μL单细胞悬液,待细胞融合度达80%时,取出培养板,弃去培养基,加入含有不同浓度(30、40和50 μmol·L-1)杨梅黄酮的新鲜培养基,并设置相应的溶剂平行对照。然后加入200 μL Hoechst 33342(1:2 000稀释)染液,室温孵育。荧光显微镜下任取5个视野照相,观察凋亡细胞核形态。凋亡的细胞核固缩、深染,核内可见浓染致密的颗粒块状荧光。
1.5 流式细胞术检测细胞凋亡取对数生长期的GL261细胞,调整细胞密度至1×106 mL-1,接种于6孔板,待细胞融合至80%时,加入含有不同浓度(0、30、40和50 μmol·L-1)杨梅黄酮的新鲜培养基,继续培养24 h后,Annexin Ⅴ-FITC与PI匹配标记细胞,流式细胞术检测细胞凋亡率。凋亡结果判断:正常活细胞AnnexinⅤ(-)、PI(-);早期凋亡细胞AnnexinⅤ(+)、PI(-);晚期凋亡细胞或坏死细胞AnnexinⅤ (+)、PI(+)。细胞凋亡率=(早期凋亡细胞数+晚期或坏死细胞数)/总细胞数×100%。
1.6 Transwell法检测细胞迁移能力GL261细胞用无血清培养基重悬,调整细胞密度为1×106 mL-1,将小室放入24孔板中,接种50 μL单细胞悬液,并用无血清培养基将体积补充至200 μL,分别在上室和下室加入杨梅黄酮(0、5、10和20 μmol·L-1),继续培养12 h后,下室面细胞甲醇固定20 min,PBS清洗,置于含有0.1%结晶紫的孔中染色15~20 min,倒置显微镜观察,于400倍视野下任取5个不重复视野照相并计数穿膜细胞数。
1.7 Transwell法检测细胞侵袭将Matrigel至4℃冰箱预溶解,无血清培养基1:3稀释,混匀后60 μL每孔加至小室上室聚碳酸酯膜(孔径8 μm),37℃孵育30 min,取对数生长期的GL261细胞,调整细胞密度为1×105 mL-1,将小室放入含有10%血清及新鲜培养基的24孔板中,接种单细胞悬液,分别在上室和下室加入杨梅黄酮(0、5、10和20 μmol·L-1),12 h后下室面细胞甲醇固定20 min,PBS清洗,置于含有0.1%结晶紫的孔中染色15~20 min,倒置显微镜下观察,于400倍视野下任取5个不重复视野照相并计数。
1.8 RT-PCR法检测MMP-2、MMP-9和MMP-14 mRNA表达水平Trizol法提取杨梅黄酮(0、5和10 μmol·L-1)处理的GL261细胞总RNA,核酸蛋白测定仪检测RNA浓度,逆转录反应条件为:42℃、30 min,99℃、5 min,5℃、5 min。PCR引物序列:GAPDH正义链,5′-TGTTGCCATCAATGACCCCTT-3′,反义链,5′-CTCCACGACGTACTCAGCG-3′;小鼠MMP-2正义链,5′-CAAGTTCCCCGGCGATGTC-3′,反义链,5′-TTCTGGTCAAGGTCACCTGTC-3′;MMP-9正义链,5′-GCAGAGGCATACTTGTACCG-3′,反义链,5′-TGATGTTATGATGGTCCCACTTG-3′;MMP-14正义链,5′-CAGTATGGCTACCTACCTCCAG-3′,反义链,5′-GCCTTGCCTGTCACTTGTAAA-3′。PCR反应体系:94℃预变性3 min;94℃、30 s,55℃~60℃、30 s,72℃、30 s,32个循环;72℃终延伸10 min;1.5%琼脂糖凝胶电泳,观察各条带并照相,利用凝胶成像系统分析各条带灰度值。
1.9 统计学分析采用SPSS 18.0软件进行统计学分析。各组细胞存活率、细胞周期抑制率、细胞凋亡率、细胞迁移和侵袭率及MMPs mRNA表达水平均以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD法。检验水准α=0.05。
2 结果 2.1 各组GL261细胞的存活率20、30、40、50和60 μmol·L-1杨梅黄酮组在24和48 h时细胞存活率较对照组均明显下降(P < 0.01),且呈时间-剂量依赖性。见表 1。
| (x±s, η/%) | ||
| Group | Survival rate | |
| (t/h) 24 | 48 | |
| Control | 1 | 1 |
| Myricetin(μmol·L-1) | ||
| 10 | 1.02±0.06 | 0.97±0.04 |
| 20 | 0.85±0.03* | 0.73±0.01* |
| 30 | 0.74±0.03* | 0.51±0.05* |
| 40 | 0.66±0.07* | 0.42±0.04* |
| 50 | 0.61±0.02* | 0.38±0.03* |
| 60 | 0.47±0.03* | 0.33±0.03* |
| *P < 0.01 compared with control group. | ||
与对照组比较,40 μmol·L-1杨梅黄酮组GL261细胞G1期比例升高(P < 0.05),S期比例降低(P < 0.05)。见图 1。
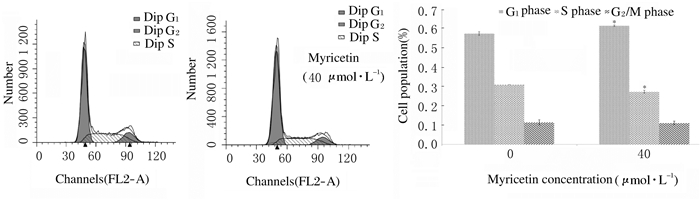
|
| 图 1 流式细胞术检测各组GL261细胞周期 Figure 1 Cell cycle of GL261 cells in various groups detected by flow cytometry |
|
|
Hoechst 33342染色结果:与对照组比较,杨梅黄酮组GL261细胞出现典型的凋亡形态改变,出现凋亡小体。并且随药物浓度的增加,凋亡小体的比例也随之增加,见图 2(插页二)。进一步通过流式细胞术AnnexinⅤ/PI荧光双染法检测杨梅黄酮对GL261细胞的凋亡诱导作用。与对照组比较,30、40和50 μmol·L-1杨梅黄酮组早期凋亡和晚期凋亡的细胞比例均增加(P < 0.05或P < 0.01),并且随药物浓度的增加,晚期凋亡的细胞比例有增加的趋势。见图 3和4。
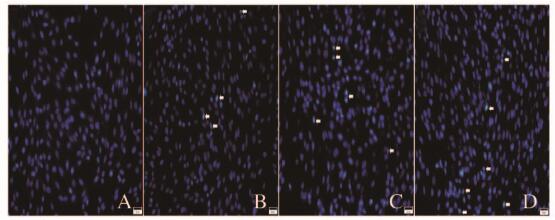
|
| A:Control group; B-D:30, 40, and 50 μmol·L-1myricetin groups.The white arrow indicated apoptotic body. 图 2 AnnexinⅤ/PI荧光双染检测各组GL261细胞凋亡(×200) Figure 2 Apoptosis of GL261 cells in various groups detected by AnnexinⅤ/PI fluoresence double staining (×200) |
|
|
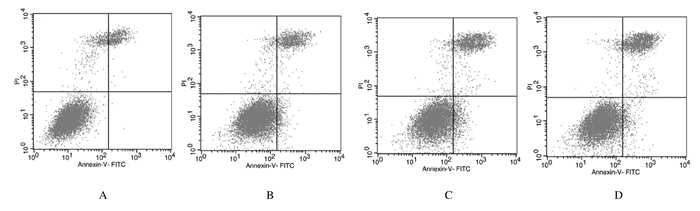
|
| A:Control group; B-D:30, 40, and 50 μmol·L-1 myricetin groups. 图 3 流式细胞术检测各组GL261细胞的凋亡情况 Figure 3 Apoptosis of GL261 cells in various groups detected by flow cytometry |
|
|
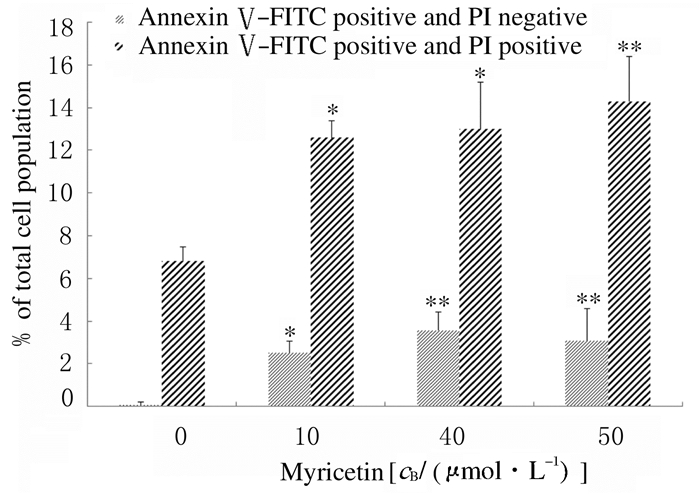
|
| *P < 0.05, **P < 0.01 compared with 0 mol·L-1 Myricetin. 图 4 流式细胞术检测各组GL261细胞凋亡率 Figure 4 Apoptotic rates fo GL261 cells in various groups detected by flow cytometry |
|
|
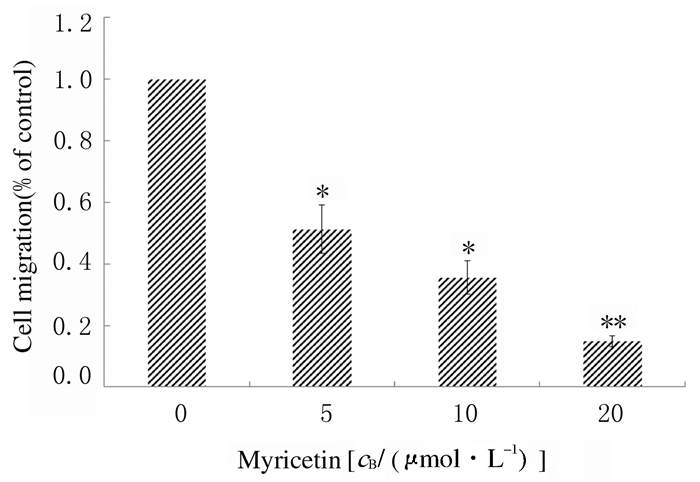
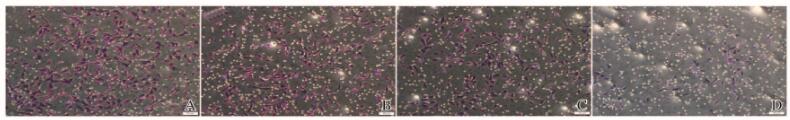
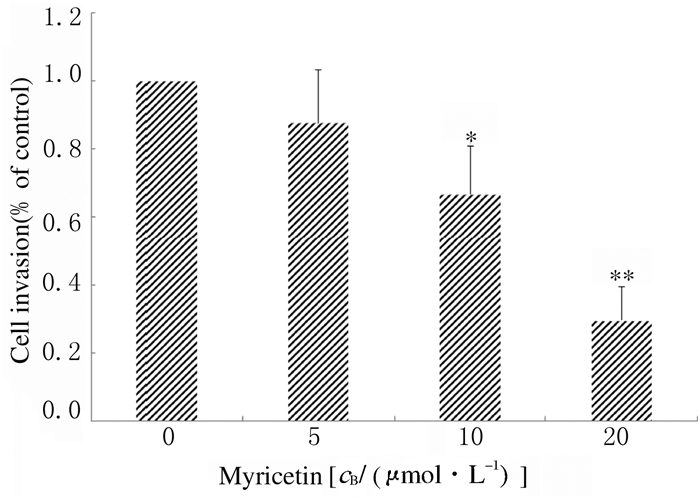
与对照组比较,5、10和20 μmol·L-1杨梅黄酮组GL261细胞迁移率明显降低(P < 0.05或P < 0.01),并随杨梅黄酮浓度的增加,GL261细胞迁移率呈递减的趋势,见图 5(插页二)和图 6。进一步通过包被Matrigel的Transwell小室检测GL261细胞的侵袭能力,与对照组比较,杨梅黄酮组GL261细胞侵袭率明显降低(P < 0.05或P < 0.01),且随着杨梅黄酮浓度的增加,GL261细胞侵袭率逐渐减少。见图 7(插页三)和图 8。

|
| (seen on page 958in paragraph) A:Control group; B-D:5, 10, and 20 μmol·L-1 myricetin groups. 图 5 各组GL261细胞迁移情况(结晶紫,×100) Figure 5 Migration of GL261 cells in various groups(Crystal violet, ×100) |
|
|
|
| *P < 0.05**P < 0.01 vs 0 μmol·L-1 myricetin(control) group. 图 6 各组GL261细胞迁移率 Figure 6 Migration rates of GL261 cells in various groups |
|
|
|
| A:Control group; B-D:5, 10, and 20 μmol·L-1 myricetin groups. 图 7 各组GL261细胞的侵袭情况(结晶紫,×100) Figure 7 Invasion of GL261 cells in various grups(Crystal violet, ×100) |
|
|
|
| *P < 0.05, **P < 0.01 vs 0 μmol·L-1 myricetin(control group). 图 8 各组GL261细胞侵袭率 Figure 8 Invasion rates of GL261 cells in various groups |
|
|
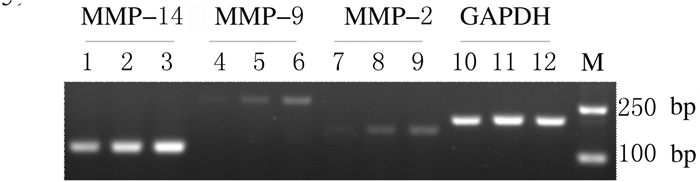
与对照组比较,杨梅黄酮5和10 μmol·L-1组MMP-2与MMP-9 mRNA的表达水平均降低(P < 0.05或P < 0.01),MMP-14 mRNA表达水平无明显变化(P>0.05)。见表 2和图 9。
| (n=3, x±s) | ||||
| Group | GAPDH | MMP-2 mRNA | MMP-9 mRNA | MMP-14 mRNA |
| Control | 1 | 0.492±0.004 | 0.570±0.014 | 0.945±0.023 |
| Myricetin (μmol·L-1) | ||||
| 5 | 1 | 0.439±0.012* | 0.491±0.013* | 0.874±0.086 |
| 10 | 1 | 0.358±0.014** | 0.425±0.015** | 0.761±0.021 |
| *P < 0.05, ** P < 0.01 compared with control group. | ||||
|
| Lane 1, 4, 7, 10: 10 μmol·L-1 myricetin group; Lane 2, 5, 8, 11: 5 μmol·L-1 myricetin group; Lane 3, 6, 9, 12: Control group; M:Marker. 图 9 各组GL261细胞中MMPs mRNA表达电泳图 Figure 9 Electrophoregram of MMPs mRNA expressions in GL261 cells in various groups |
|
|
杨梅黄酮广泛存在于自然界的各种植物中,已有研究证实其具有抗氧化、抗炎、抗肿瘤、保护神经元和抑制血栓形成等多种功能[15-20]。近年来杨酶黄酮在肿瘤治疗中的作用越来越引起研究者的关注。目前已有研究[7-10]证实:杨梅黄酮对肺癌、肝癌、食管癌和皮肤癌等均有一定的治疗作用,但其在脑胶质瘤中的作用及其相关机制尚不清楚。
促进增殖和抑制凋亡是导致肿瘤细胞恶性增殖的2个重要因素。为研究杨梅黄酮对胶质瘤增殖和凋亡的影响,本研究首先应用CCK-8实验以及流式细胞术检测杨梅黄酮对胶质瘤细胞GL261增殖的影响,结果显示:杨梅黄酮能抑制GL261细胞的活性,并呈时间-剂量依赖性;细胞周期分析证实杨梅黄酮通过将细胞周期阻滞于G1期抑制胶质瘤细胞的分裂增殖;通过Hoechst 33342染色形态学观察可见杨梅黄酮可导致细胞凋亡小体增多;流式细胞术对早期凋亡和晚期凋亡的细胞计数结果显示:杨梅黄酮可增加细胞凋亡率。由以上结果本文作者推测:杨梅黄酮对胶质瘤细胞的抑制作用通过抑制增殖和促进凋亡双重机制来完成。有研究[12]显示:杨梅黄酮可将肝癌细胞HepG2细胞周期阻滞于G2/M期,并证实其诱导肝癌细胞的凋亡机制可能是通过线粒体凋亡途径以及Akt/p70s6k1/Bad信号通路进行的;有研究[13]还显示:杨梅黄酮通过降低ERK1/2以及Cycline D1的水平将细胞周期阻滞于G1期。Maggioni等[7]的研究也证实:杨梅黄酮可通过下调鳞状细胞癌SCC-25细胞Cycline D1的表达将细胞周期阻滞于G1期。上述研究结果与本实验结果一致,并为本课题组进一步研究杨梅黄酮调控胶质瘤增殖和凋亡的相关信号通路及其机制提供一定理论依据。
恶性肿瘤的一个重要生物学特征是局部浸润和转移,细胞外基质和基底膜的降解是肿瘤侵袭和转移的关键环节。MMPs是目前已知的能降解细胞外基质的关键酶。本文作者通过酶动力学实验证实杨梅黄酮对MMP-2、MMP-9和MMP-14具有特异性抑制作用。本研究首先利用Transwell小室检测GL261细胞在杨梅黄酮作用下的迁移及侵袭能力,结果显示:杨梅黄酮可抑制GL261细胞的迁移;进而在Transwell小室内包被Matrigel用以模仿体内细胞外基质,结果表明:杨梅黄酮可降低穿透Matrigel的细胞比例,因此本文作者认为杨梅黄酮可降低胶质瘤细胞的侵袭能力。
为进一步明确杨梅黄酮是否通过抑制MMPs从而降低GL261细胞的迁移及侵袭能力,本研究应用RT-PCR法检测MMP-2、MMP-9和MMP-14 mRNA的表达水平,结果表明:在杨梅黄酮的作用下,GL261细胞MMP-2和MMP-9 mRNA的表达水平明显降低。MMP-2和MMP-9又称明胶酶、Ⅳ型胶原酶,其主要功能是降解基底膜的主要成分Ⅳ型、Ⅴ型和Ⅵ胶原,肿瘤细胞的基底膜是肿瘤的天然组织学屏障,基底膜降解是肿瘤侵袭的关键环节[21-22]。有研究[8]显示:杨梅黄酮可抑制肺癌A549细胞MMP-2的表达及活性。Jung等[5]通过应用杨梅黄酮治疗经紫外线照射的小鼠发现:杨梅黄酮可抑制紫外线诱导的MMP-9的表达及酶活性。由此本文作者认为:杨梅黄酮可通过降低MMP-2和MMP-9的表达抑制胶质瘤细胞的迁移及侵袭。MMP-14属膜型基质蛋白酶,又名MT1-MMP,其在恶性肿瘤进展及肿瘤血管生成中发挥重要作用[23]。本研究结果显示:经杨梅黄酮处理后MMP-14 mRNA的表达无明显影响,提示其在杨梅黄酮促进胶质瘤侵袭中未发挥作用。
综上所述,杨梅黄酮可在体外抑制小鼠胶质瘤GL261细胞的增殖,促进其凋亡,并通过抑制MMP-2和MMP-9的表达抑制胶质瘤细胞的迁移和侵袭。上述作用的相关信号通路、机制以及杨梅黄酮在胶质瘤生长和转移中的作用有待进一步通过体内实验研究证实。
| [1] | Minniti G, Scaringi C, Lanzetta G, et al. Standard (60 Gy) or short-course (40 Gy) irradiation plus concomitant and adjuvant temozolomide for elderly patients with glioblastoma:a propensity-matched analysis[J]. Int J Radiat Oncol Biol Phys, 2015, 91(1): 109–115. DOI:10.1016/j.ijrobp.2014.09.013 |
| [2] | Hegi ME, Diserens AC, Gorlia T, et al. MGMT gene silencing and benefit from temozolomide in glioblastoma[J]. N Engl J Med, 2005, 352(10): 997–1003. DOI:10.1056/NEJMoa043331 |
| [3] | Griffiths LA, Smith GE. Metabolism of apigenin and related compounds in the rat. Metabolite formation in vivo and by the intestinal microflora in vitro[J]. Biochem J, 1972, 128(4): 901–911. DOI:10.1042/bj1280901 |
| [4] | Voskresensky ON, Levitsky AP. QSAR aspects of flavonoids as a plentiful source of new drugs[J]. Curr Med Chem, 2002, 9(14): 1367–1383. DOI:10.2174/0929867023369790 |
| [5] | Jung SK, Lee KW, Kim HY, et al. Myricetin suppresses UVB-induced wrinkle formation and MMP-9 expression by inhibiting Raf[J]. Biochem Pharmacol, 2010, 79(10): 1455–1461. DOI:10.1016/j.bcp.2010.01.004 |
| [6] | Knickle A, Fernando W, Greenshields AL, et al. Myricetin-induced apoptosis of triple-negative breast cancer cells is mediated by the iron-dependent generation of reactive oxygen species from hydrogen peroxide[J]. Food Chem Toxicol, 2018, 118: 154–167. DOI:10.1016/j.fct.2018.05.005 |
| [7] | Maggioni D, Nicolini G, Rigolio R, et al. Myricetin and naringenin inhibit human squamous cell carcinoma proliferation and migration in vitro[J]. Nutr Cancer, 2014, 66(7): 1257–1267. DOI:10.1080/01635581.2014.951732 |
| [8] | Shih YW, Wu PF, Lee YC, et al. Myricetin suppresses invasion and migration of human lung adenocarcinoma A549 cells:possible mediation by blocking the ERK signaling pathway[J]. J Agric Food Chem, 2009, 57(9): 3490–3499. DOI:10.1021/jf900124r |
| [9] | Ko CH, Shen SC, Lee TJ, et al. Myricetin inhibits matrix metalloproteinase 2 protein expression and enzyme activity in colorectal carcinoma cells[J]. Mol Cancer Ther, 2005, 4(2): 281–290. |
| [10] | Lee JH, Choi YJ, Park SH, et al. Potential role of nucleoside diphosphate kinase in myricetin-induced selective apoptosis in colon cancer HCT-15cells[J]. Food Chem Toxicol, 2018, 116: 315–322. DOI:10.1016/j.fct.2018.04.053 |
| [11] | Vukovic NL, Obradovic AD, Vukic MD, et al. Cytotoxic, proapoptotic and antioxidative potential of flavonoids isolated from propolis against colon (HCT-116) and breast (MDA-MB-231) cancer cell lines[J]. Food Res Int, 2018, 106: 71–80. DOI:10.1016/j.foodres.2017.12.056 |
| [12] | Zhang XH, Chen SY, Tang L, et al. Myricetin induces apoptosis in HepG2 cells through Akt/p70S6K/bad signaling and mitochondrial apoptotic pathway[J]. Anticancer Agents Med Chem, 2013, 13(10): 1575–1581. DOI:10.2174/1871520613666131125123059 |
| [13] | Zhang XH, Zou ZQ, Xu CW, et al. Myricetin induces G2/M phase arrest in HepG2 cells by inhibiting the activity of the cyclin B/Cdc2 complex[J]. Mol Med Rep, 2011, 4(2): 273–277. |
| [14] | Park H, Park S, Bazer FW, et al. Myricetin treatment induces apoptosis in canine osteosarcoma cells by inducing DNA fragmentation, disrupting redox homeostasis, and mediating loss of mitochondrial membrane potential[J]. J Cell Physiol, 2018, 233(9): 7457–7466. DOI:10.1002/jcp.v233.9 |
| [15] | Shimmyo Y, Kihara T, Akaike A, et al. Multifunction of myricetin on A beta:neuroprotection via a conformational change of A beta and reduction of A beta via the interference of secretases[J]. J Neurosci Res, 2008, 86(2): 368–377. DOI:10.1002/(ISSN)1097-4547 |
| [16] | 臧宝霞, 金鸣, 吴伟, 等. 杨梅素对血小板活化因子拮抗的作用[J]. 药学学报, 2003(11): 831–833. DOI:10.3321/j.issn:0513-4870.2003.11.008 |
| [17] | 钟正贤, 陈学芬, 周桂芬, 等. 西藤茶中杨梅树皮素降血糖的实验研究[J]. 中国现代应用药学, 2003, 20(6): 466–468. DOI:10.3969/j.issn.1007-7693.2003.06.011 |
| [18] | Bennett CJ, Caldwell ST, McPhail DB, et al. Potential therapeutic antioxidants that combine the radical scavenging ability of myricetin and the lipophilic chain of vitamin E to effectively inhibit microsomal lipid peroxidation[J]. Bioorg Med Chem, 2004, 12(9): 2079–2098. DOI:10.1016/j.bmc.2004.02.031 |
| [19] | Grenier D, Chen H, Ben Lagha, et al. Dual action of Myricetin on Porphyromonas gingivalis and the inflammatory response of host cells:A promising therapeutic molecule for periodontal diseases[J]. PLoS One, 2015, 10(6): e0131758.. DOI:10.1371/journal.pone.0131758 |
| [20] | Weng CJ, Yen GC. Flavonoids, a ubiquitous dietary phenolic subclass, exert extensive in vitro anti-invasive and in vivo anti-metastatic activities[J]. Cancer Metastasis Rev, 2012, 31(1/2): 323–351. |
| [21] | Kapoor C, Vaidya S, Wadhwan V, et al. Seesaw of matrix metalloproteinases (MMPs)[J]. J Cancer Res Ther, 2016, 12(1): 28–35. DOI:10.4103/0973-1482.157337 |
| [22] | Kessenbrock K, Plaks V, Werb Z. Matrix metalloproteinases:Regulators of the tumor microenvironment[J]. Cell, 2010, 141(1): 52–67. DOI:10.1016/j.cell.2010.03.015 |
| [23] | Sounni NE, Paye A, Host L, et al. MT-MMPS as regulators of vessel stability associated with angiogenesis[J]. Front Pharmacol, 2011, 2: 111. |
 2018, Vol. 44
2018, Vol. 44


