扩展功能
文章信息
- 赵丽艳, 宋扬, 陈勇, 吕晓艳, 贾茗博, 李蕴潜
- ZHAO Liyan, SONG Yang, CHEN Yong, LYU Xiaoyan, JIA Mingbo, LI Yunqian
- 白藜芦醇对胶质瘤U87细胞上皮-间质转化的抑制作用
- Inhibitory effect of resveratrol on epithelial to mesenchymal transition of glioma U87 cells
- 吉林大学学报(医学版), 2018, 44(05): 943-948
- Journal of Jilin University (Medicine Edition), 2018, 44(05): 943-948
- 10.13481/j.1671-587x.20180510
-
文章历史
- 收稿日期: 2018-03-21
2. 吉林大学第一医院神经外科, 吉林 长春 130021
2. Department of Neurosurgery, First Hospital, Jilin University, Changchun 130021, China
恶性胶质瘤是高度恶性和高致死性的常见颅内肿瘤,最主要的生物学特性是侵袭性生长,是手术难以彻底切除、术后复发率高和预后不良的重要原因,这种侵袭性生长的机制尚未阐明。本课题组前期研究[1]表明:在一定条件下胶质瘤细胞能发生上皮-间质转化(epithelial to mesenchymal transition, EMT),EMT可能在胶质瘤侵袭性生长中起重要作用[2-3]。细胞EMT是一种由上皮细胞向间质细胞表型转化的生物学过程,通过EMT,上皮细胞间的紧密连接缺失,细胞转变为具有高迁移、高侵袭的间质细胞特征,是肿瘤侵袭、转移、复发和治疗抵抗的重要原因[4]。因此,抑制或逆转肿瘤细胞EMT,已成为抗肿瘤治疗的新靶标[5]。白藜芦醇(resveratrol, Res)是一种具有多种生物活性的多酚化合物,研究[6]显示:Res具有很强的抗肿瘤作用,但Res对胶质瘤细胞EMT影响的研究报道很少。本研究探讨Res对胶质瘤细胞EMT的抑制作用,为改进胶质瘤的治疗现状提供新的思路。
1 材料与方法 1.1 细胞、主要试剂和仪器人胶质母细胞瘤U87细胞购自美国ATCC细胞库。DMEM培养基和胰酶-EDTA消化液为美国Gibco公司产品,胎牛血清(FBS)、青霉素、链霉素和四甲基偶氮唑盐(MTT)购自美国Sigma公司,TGF-β1购自美国Peprotech公司,Res购自美国ApexBio公司,Transwell小室和Matrigel基质胶为美国Corning公司产品,抗N-钙黏蛋白(N-cadherin)、抗β-连环蛋白(β-catenin)、抗波形蛋白(Vimentin)、抗Snail、抗基质金属蛋白酶2(MMP-2)和抗基质金属蛋白酶9(MMP-9)抗体购自美国Cell Signaling Technology公司(1:1 000),抗Twist1抗体(中国万类生物公司),RIPA细胞裂解液、BCA蛋白浓度测定试剂盒和SDS蛋白上样缓冲液(中国碧云天公司),蛋白Marker(美国Thermo公司),抗GAPDH抗体(美国Origene公司)。细胞培养箱和超净工作台(美国Thermo公司),倒置显微镜(日本Olympus公司),电泳仪和转膜仪(美国Bio-Rad公司)。
1.2 细胞培养及传代人胶质瘤U87细胞用含有10%FBS的DMEM培养基置于37℃、5% CO2的饱和湿度培养箱中培养。每2~3 d更换1次培养基,每3~5 d用胰酶消化后按1:2~1:3传代,取处于对数生长期的细胞进行后续实验。
1.3 Western blotting法检测EMT标志物和转录因子表达水平本研究组MTT法的预实验结果显示:Res终浓度在40 μmol·L-1及以下时对U87细胞的存活率影响不明显,因此选择40 μmol·L-1及以下浓度的Res进行后续实验。取对数生长期U87细胞接种于10 cm细胞培养皿,细胞密度为每个培养皿5×105个细胞,37℃培养箱中培养,待细胞生长至70%~80%融合时,换无血清培养基饥饿细胞12 h,再加入终浓度为10×10-6g·L-1转化生长因子β1(TGF-β1)(EMT组),加入20和40 μmol·L-1 Res(Res处理组),作用48 h后弃掉培养基,收集细胞,离心后弃去上清,加入RIPA裂解液提取细胞蛋白,并用BCA试剂盒进行蛋白定量。每孔加入30~50 μg蛋白,进行聚丙烯酰胺凝胶电泳,电转蛋白至PVDF膜上,室温下用含5%脱脂奶粉的TBS封闭1 h,而后分别加入含有抗N-钙黏蛋白、β-连环蛋白和波形蛋白,诱导EMT的转录因子Snail、Slug、Twist1、MMP-2、MMP-9和GAPDH一抗,4℃过夜孵育后洗膜,加入相应二抗孵育1~2 h后洗膜,加ECL显色剂,在Sagecreation凝胶成像系统中显影。采用AlphaEaseFC软件分析目的条带灰度值,以GAPDH为内参,目的条带相对灰度值=目的条带灰度值/GAPDH灰度值。以目的条带相对灰度值表示蛋白表达水平。
1.4 划痕愈合试验检测细胞迁移率取对数生长期U87细胞接种于6孔板,每孔3×105个细胞,待细胞生长至70%~80%融合时,换用无血清培养基饥饿细胞12 h,再用含10×10-6g·L-1的TGF-β1无血清培养基诱导48 h后,用10 μL的枪头尖在6孔板上平行划痕,用PBS冲掉刮下的细胞,并在显微镜下测量划痕的宽度(0 h),换用含40 μmol·L-1 Res的培养基培养24 h,测量划痕宽度(24 h)。实验重复3次。细胞的迁移能力以细胞迁移率表示:细胞迁移率=[(0 h划痕宽度-24 h划痕宽度)/0h划痕宽度]×100%。
1.5 Transwell侵袭实验检测细胞侵袭率Transwell小室(聚碳酸酯膜微孔径8 μm)内加入稀释的Matrigel 100 μL。将Transwell小室插入24孔板,37℃恒温培养箱孵育24 h,使Matrigel在微孔滤膜上重组成基底膜结构。取对数生长期U87细胞接种于6孔板中,每孔3×105个细胞,用TGF-β1诱导细胞EMT(EMT组)及加入40 μmol·L-1Res(Res处理组)处理48 h后,消化细胞制备单细胞悬液)。取2.5×105 mL-1细胞悬浮在200 μL无血清培养基,加入Transwell小室的上室面,每组设3个复孔,小室的下室内加入500 μL含10%FBS培养基作为趋化剂。置于恒温细胞培养箱培养48 h后,取出Transwell小室,吸弃培养基,用棉签擦去上室面未穿过膜的细胞,PBS清洗。4%多聚甲醛固定细胞后,0.1%结晶紫染色,将Transwell小室的滤膜取下,在显微镜下每个样本随机选取5个视野,计数每个视野内染色的细胞数量,即穿膜细胞数,拍照记录实验结果。药物对细胞侵袭能力的影响以细胞侵袭率表示:细胞侵袭率=(处理组穿膜细胞数/对照组穿膜细胞数)×100%。
1.6 统计学分析采用SPSS 19.0统计软件进行统计学分析。N-钙黏蛋白、β-连环蛋白、波形蛋白、Snail、Slug和Twist1蛋白表达水平,细胞迁移率和细胞侵袭率符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。所有实验重复3次。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组U87细胞间质标志物和转录因子蛋白表达水平与对照组比较,EMT组胶质瘤U87细胞的间质标志物N-钙黏蛋白、β-连环蛋白和波形蛋白表达水平明显升高(P < 0.05),转录因子Snail、Slug和Twist1蛋白表达水平明显升高(P < 0.05)。与EMT组比较,Res处理组间质标志物N-钙黏蛋白、β-连环蛋白和波形蛋白表达水平明显降低(P < 0.05或P < 0.01),转录因子Snail、Slug和Twist1蛋白表达水平明显降低(P < 0.05)。40 μmol·L-1 Res处理组上述指标变化较20 μmol·L-1Res处理组更明显(P < 0.05)。见图 1、表 1和2。
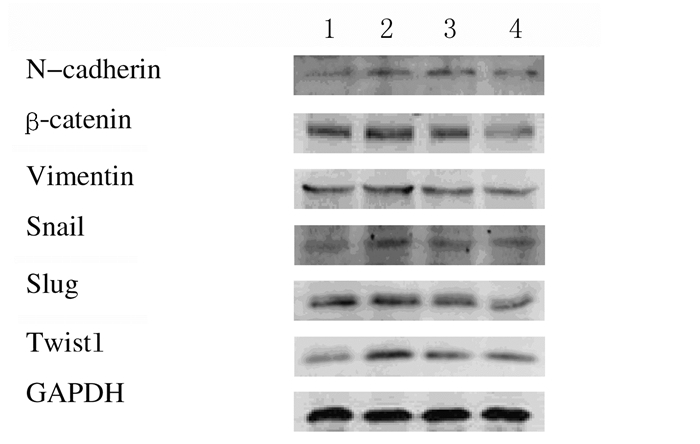
|
| Lane 1:Control group; Lane 2:EMT group; Lane 3:20 μmol·L-1 Res treatment group; Lane 4:40 μmol·L-1 Res treatment group. 图 1 各组胶质瘤U87细胞中间质标志物和转录因子表达电泳图 Figure 1 Eleectrophoregram of expressions of mesenchymal markers and transcription factors in glioma U87 cells in various groups |
|
|
| (n=3, x±s) | |||
| Group | N-cadherin | β-catenin | Vimentin |
| Control | 0.98±0.05 | 0.99±0.06 | 0.98±0.05 |
| EMT | 1.17±0.05* | 1.15±0.07* | 1.17±0.09* |
| Res treatment | |||
| 20 μmol·L-1 | 0.99±0.08△ | 0.84±0.08△△ | 0.92±0.07△ |
| 40 μmol·L-1 | 0.83±0.05△# | 0.69±0.02△△# | 0.72±0.09△# |
| *P < 0.05 vs control group; △P < 0.05, △△P < 0.01 vs EMT group; #P < 0.05 vs 20 μmol·L-1 Res treatment group. | |||
| (n=3, x±s) | |||
| Group | Snail | Slug | Twist1 |
| Control | 1.00±0.05 | 1.00±0.10 | 0.97±0.16 |
| EMT | 1.24±0.09* | 1.18±0.06* | 1.38±0.15* |
| Res treatment | |||
| 20 μmol·L-1 | 1.03±0.08△ | 0.94±0.07△ | 1.02±0.13△ |
| 40 μmol·L-1 | 0.88±0.04△# | 0.75±0.05△# | 0.78±0.06△# |
| *P < 0.05 vs control group; △P < 0.05 vs EMT group; #P < 0.05 vs 20 μmol·L-1 Res treatment group. | |||
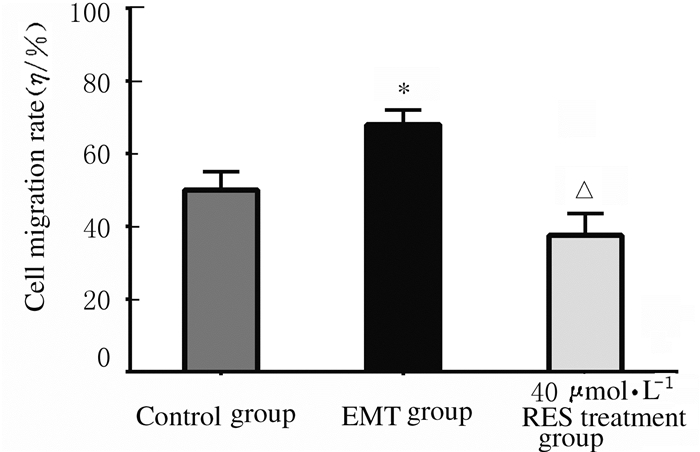
EMT组的细胞迁移率(68%±4%)明显高于对照组(50%±5%, P < 0.01),而40 μmol·L-1 Res处理组的细胞迁移率(37%±6%)较EMT组明显降低(P < 0.01)。见图 2和3。

|
| A-C: 0 h; D-F: 24 h; A, D: Control group; B, E: EMT group; C, F: Res treatment group. 图 2 划痕后24 h各组U87细胞的迁移距离 Figure 2 Migration distances of glioma U87 cells at 24 h after scratch in various groups |
|
|
|
| *P < 0.01 vs control group; △P < 0.01 vs EMT group. 图 3 各组胶质瘤U87细胞的迁移率 Figure 3 Migration rates of glioma U87 cells in various groups |
|
|
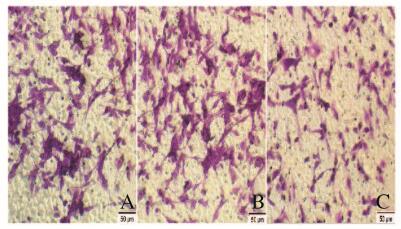
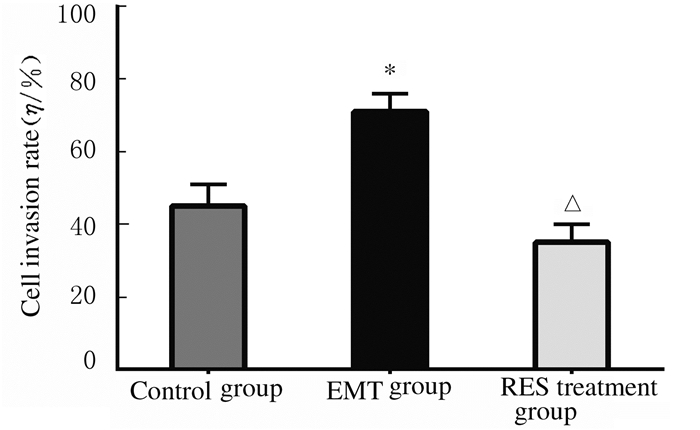
EMT组的细胞侵袭率(71%±5%)明显高于对照组(45%±6%, P < 0.01),而40 μmol·L-1 Res处理组细胞侵袭率(35%±5%)明显低于EMT组(P < 0.01)。见图 4(插页二)和5。
|
| A: Control group; B: EMT group; C: Res treatment group. 图 4 各组胶质瘤U87细胞的侵袭情况(×100) Figure 4 Invasion of glioma U87 cells in various groups (×100) |
|
|
|
| *P < 0.01 vs Control group; △P < 0.01 vs EMT group. 图 5 各组胶质瘤U87细胞的侵袭率 Figure 5 Invasion rates of glioma U87 cells in various groups |
|
|
与对照组比较,EMT组U87细胞中MMP-2和MMP-9蛋白表达水平明显升高(P < 0.05);与EMT组比较,Res处理组MMP-2和MMP-9蛋白表达水平明显降低(P < 0.05或P < 0.01);与20μmol·L-1 Res处理组比较,40μmol·L-1Res处理组U87细胞中MMP-2和MMP-9蛋白表达水平明显降低(P < 0.05)。见图 6和表 3。
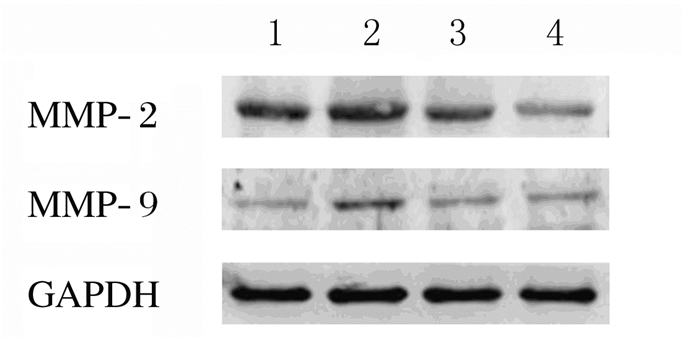
|
| Lane 1:Control group; Lane 2:EMT group; Lane 3:20 μmol·L-1 Res treatment group; Lane 4:40 μmol·L-1Res treatment group. 图 6 Western blotting法检测各组胶质瘤U87细胞中MMP-2和MMP-9蛋白表达电泳图 Figure 6 Electrophoregram of expressions of MMP-2 and MMP-9 proteins in glioma U87 cells in various groups detected with Western blotting method |
|
|
| (n=3, x±s) | ||
| Group | MMP-2 | MMP-9 |
| Control | 0.99±0.08 | 1.02±0.14 |
| EMT | 1.28±0.07* | 1.49±0.16* |
| Res treatment | ||
| 20 μmol·L-1 | 0.89±0.07△ | 1.10±0.11△ |
| 40 μmol·L-1 | 0.65±0.07△△# | 1.06±0.13△# |
| *P < 0.05 vs control group; △P < 0.05, △△P < 0.01 vs EMT group;#P < 0.05 vs 20 μmol·L-1 Res treatment group. | ||
恶性胶质瘤的一个显著特点是高度侵袭性生长,研发抑制侵袭性生长的药物对提高胶质瘤的疗效具有重要理论意义和应用价值。近年来越来越多的证据[7-8]表明:EMT在胶质瘤的侵袭性生长发生机制中起重要作用。上皮性肿瘤发生EMT时,上皮标志物E-钙黏蛋白表达下调,而间质标志物表达上调,其中E-钙黏蛋白表达下调是EMT最重要的改变[9],即EMT过程中出现E-钙黏蛋白向N-钙黏蛋白的“钙黏蛋白转换(cadherin switch)”,已成为EMT最关键的标志[10]。然而,由于胶质瘤细胞缺少典型上皮细胞的特征,在大多数胶质瘤E-钙黏蛋白不表达或表达水平很低[11],不出现经典的“钙黏蛋白转换”[12],因此有时把胶质瘤细胞EMT称为上皮-间质转化样改变或过程。本研究未检测E-钙黏蛋白的表达。
本研究表明:在TGF-β1诱导下胶质瘤U87细胞的间质标志物N-钙黏蛋白、β-连环蛋白和波形蛋白表达水平均明显升高,显示胶质瘤细胞发生EMT改变,进一步证明了本课题前期的研究结果[1]。近年来EMT抑制剂已成为抗癌药物研究的重要方向[13]。Res是一种强效抗癌多酚类化合物。最近研究[14]显示:Res一个新的抗癌作用是抑制肿瘤细胞EMT。在前列腺癌、肺癌和胰腺癌的研究[14-16]中已证明:Res能抑制或逆转肿瘤细胞EMT,有效抑制肿瘤细胞的侵袭和转移。本研究结果显示:Res能明显抑制胶质瘤U87细胞间质标志物N-钙黏蛋白、β-连环蛋白和波形蛋白的表达,表明Res能抑制胶质瘤细胞EMT改变。
诱导EMT的转录因子(EMT-inducing transcription factors)主要包括Snail、Slug、Twist1和Zeb等,其通过不同信号通路下调上皮标志物的表达和抑制间质标志物(N-钙黏蛋白和波形蛋白)的表达,从而诱导和激活EMT,参与肿瘤转移[17]。本实验结果显示:在TGF-β1作用下,胶质瘤U87细胞中诱导EMT的转录因子Snail、Slug和Twist1蛋白的表达水平均升高,而Res处理能明显抑制上述转录因子的表达,表明Res能抑制转录因子Snail、Slug和Twist1对胶质瘤细胞EMT的诱导作用,进一步证明Res能抑制胶质瘤细胞EMT。
经历EMT的细胞最重要的行为改变是迁移和侵袭能力的增强。本研究结果显示:发生EMT的U87细胞迁移率明显增强,而Res处理可使细胞的迁移率明显降低,表明Res可以抑制胶质瘤细胞EMT引起的细胞迁移能力。本研究Transwell侵袭实验结果显示:EMT组的U87细胞穿过人工基膜的细胞数较对照组明显增多,细胞侵袭率增加,说明诱导EMT使胶质瘤细胞的侵袭能力增强,而Res处理组穿膜的细胞数量明显减少,细胞侵袭率明显降低,表明Res可以抑制胶质瘤细胞EMT诱导的细胞侵袭能力。
基膜是肿瘤的天然组织学屏障,基膜降解是肿瘤侵袭的关键环节。MMP-2和MMP-9又称明胶酶或Ⅳ型胶原酶,通过降解基膜主要成分Ⅳ型胶原影响肿瘤的侵袭和转移[18]。最近报道[19-23]显示:Res能明显抑制人膀胱癌细胞和人乳腺癌细胞MMP-2和MMP-9表达。本研究结果显示:EMT组胶质瘤细胞中MMP-2和MMP-9蛋白表达水平明显上调,而Res处理组胶质瘤细胞中MMP-2和MMP-9蛋白表达水平明显降低。上述研究结果表明:Res能抑制胶质瘤细胞EMT引起的MMP-2和MMP-9蛋白表达上调,进一步证明Res能抑制胶质瘤细胞的侵袭能力。
综上所述,Res能抑制胶质瘤U87细胞EMT,降低细胞迁移和侵袭能力,抑制MMP-2和MMP-9表达水平,提示Res是抑制胶质瘤侵袭性生长的重要候选药物。Res抑制胶质瘤细胞EMT具有重要临床意义,因为EMT不仅在肿瘤细胞的侵袭和转移过程中起重要作用,而且还能促使肿瘤细胞获得干细胞特性[21-23]。Res可以作为双抑制剂,既抑制肿瘤细胞侵袭和转移,又抑制经EMT产生的干细胞样细胞,对包括胶质瘤在内的肿瘤的治疗具有重要价值。
| [1] | 宋扬, 赵丽艳, 陈勇, 等. TGFβ1对胶质瘤U87细胞上皮-间质转化的诱导作用[J]. 吉林大学学报:医学版, 2016, 42(6): 1087–1091. |
| [2] | Kahlert UD, Nikkhah G, Maciaczyk J. Epithelial-to-mesenchymal(-like) transition as a relevant molecular event in malignant gliomas[J]. Cancer Lett, 2013, 331(2): 131–138. DOI:10.1016/j.canlet.2012.12.010 |
| [3] | Lee JK, Joo KM, Lee J, et al. Targeting the epithelial to mesenchymal transition in glioblastoma:the emerging role of MET signaling[J]. Onco Targets Ther, 2014, 7: 1933–1944. |
| [4] | Iwatsuki M, Mimori K, Yokobori T, et al. Epithelial-mesenchymal transition in cancer development and its clinical significance[J]. Cancer Sci, 2010, 101(2): 293–299. DOI:10.1111/cas.2010.101.issue-2 |
| [5] | Marcucci F, Stassi G, De Maria R. Epithelial-mesenchymal transition:a new target in anticancer drug discovery[J]. Nat Rev Drug Discov, 2016, 15(5): 311–325. DOI:10.1038/nrd.2015.13 |
| [6] | Han G, Xia J, Gao J, et al. Anti-tumor effects and cellular mechanisms of resveratrol[J]. Drug Discov Ther, 2015, 9(1): 1–12. |
| [7] | Iser IC, Pereira MB, Lenz G, et al. The epithelial-to-mesenchymal transition-like process in glioblastoma:An updated systematic review and in silico investigation[J]. Med Res Rev, 2017, 37(2): 271–313. DOI:10.1002/med.2017.37.issue-2 |
| [8] | 宋扬, 赵丽艳, 李蕴潜, 等. 胶质瘤细胞上皮-间质转化及靶向抑制策略的研究进展[J]. 吉林大学学报:医学版, 2017, 43(5): 1064–1066. |
| [9] | Cervantes-Arias A, Pang LY, Argyle DJ. Epithelial-mesenchymal transition as a fundamental mechanism underlying the cancer phenotype[J]. Vet Comp Oncol, 2013, 11(3): 169–184. DOI:10.1111/vco.2013.11.issue-3 |
| [10] | Gheldof A, Berx G. Cadherins and epithelial-to-mesenchymal transition[J]. Prog Mol Biol Transl Sci, 2013, 116: 317–336. DOI:10.1016/B978-0-12-394311-8.00014-5 |
| [11] | Kahlert UD, Maciaczyk D, Doostkam S, et al. Activation of canonical WNT/beta-catenin signaling enhances in vitro motility of glioblastoma cells by activation of ZEB1 and other activators of epithelial-to-mesenchymal transition[J]. Cancer Lett, 2012, 325(1): 42–53. DOI:10.1016/j.canlet.2012.05.024 |
| [12] | Brabletz T. To differentiate or not-routes towards metastasis[J]. Nat Rev Cancer, 2012, 12(6): 425–436. DOI:10.1038/nrc3265 |
| [13] | Davis FM, Stewart TA, Thompson EW, et al. Targeting EMT in cancer:opportunities for pharmacological intervention[J]. Trends Pharmacol Sci, 2014, 35(9): 479–488. DOI:10.1016/j.tips.2014.06.006 |
| [14] | Li J, Chong T, Wang Z, et al. A novel anticancer effect of resveratrol:Reversal of epithelial mesenchymal transition in prostate cancer cells[J]. Mol Med Rep, 2014, 10(4): 1717–1724. DOI:10.3892/mmr.2014.2417 |
| [15] | Wang H, Zhang H, Tang L, et al. Resveratrol inhibits TGF-β1-induced epithelial-to-mesenchymal transition and suppresses lung cancer invasion and metastasis[J]. Toxicology, 2013, 303: 139–146. DOI:10.1016/j.tox.2012.09.017 |
| [16] | Li W, Ma J, Ma Q, et al. Resveratrol inhibits the epithelial-mesenchymal transition of pancreatic cancer cells via suppression of the PI-3K/Akt/NF-κB pathway[J]. Curr Med Chem, 2013, 20(33): 4185–4194. DOI:10.2174/09298673113209990251 |
| [17] | Tania M, Khan MA, Fu J. Epithelial to mesenchymal transition inducing transcription factors and metastatic cancer[J]. Tumor Biol, 2014, 35(8): 7335–7342. DOI:10.1007/s13277-014-2163-y |
| [18] | Bjorklund M, Koivunen E. Gelatinase-mediated migration and invasion of cancer cells[J]. Biochim Biophys Acta, 2005, 1755(1): 37–69. |
| [19] | Bai Y, Yang H, Zhang G, et al. Inhibitory effects of resveratrol on the adhesion, migration and invasion of human bladder cancer cells[J]. Mol Med Rep, 2017, 15(2): 885–889. DOI:10.3892/mmr.2016.6051 |
| [20] | Suh J, Kim DH, Surh YJ. Resveratrol suppresses migration, invasion and stemness of human breast cancer cells by interfering with tumor-stromal cross-talk[J]. Arch Biochem Biophys, 2018, 643: 62–71. DOI:10.1016/j.abb.2018.02.011 |
| [21] | 鲁艳杰, 刘绍晨, 胡亚涛, 等. TGF-β_1对人绒毛膜癌细胞上皮间质转化及其迁移能力的促进作用研究[J]. 解放军医学杂志, 2016, 41(2): 114–118. |
| [22] | Liu X, Fan D. The epithelial-mesenchymal transition and cancer stem cells:functional and mechanistic links[J]. Curr Pharm Des, 2015, 21(10): 1279–1291. DOI:10.2174/1381612821666141211115611 |
| [23] | Sato R, Semba T, Saya H, et al. Concise Review:Stem cells and epithelial-mesenchymal transition in cancer:Biological implications and therapeutic targets[J]. Stem Cells, 2016, 34(8): 1997–2007. DOI:10.1002/stem.2406 |
 2018, Vol. 44
2018, Vol. 44


