扩展功能
文章信息
- 石旭, 余欣, 曲兴龙, 曹扬, 张广娟, 李长远
- SHI Xu, YU Xin, QU Xinglong, CAO Yang, ZHANG Guangjuan, LI Changyuan
- 低氧及其下游因子miRNA-145在脐带间充质干细胞向Ⅱ型肺泡上皮细胞分化中的作用
- Effects of hypoxia and its downstream factor mirRNA-145 on differentiation of umbilical cord mesenchymal stem cells into type Ⅱ alveolar epithelial cells
- 吉林大学学报(医学版), 2018, 44(05): 935-942
- Journal of Jilin University (Medicine Edition), 2018, 44(05): 935-942
- 10.13481/j.1671-587x.20180509
-
文章历史
- 收稿日期: 2018-03-13
2. 吉林大学第一医院手足外科, 吉林 长春 130021;
3. 吉林大学第一医院呼吸内科, 吉林长春 130021;
4. 吉林大学第一医院胸外科, 吉林 长春 130021
2. Department of Hand and Foot Surgery, First Hospital, Jilin University, Changchun 130021, China;
3. Department of Respiratory Medicine, First Hospital, Jilin University, Changchun 130021, China;
4. Department of Thoracic Surgery, First Hospital, Jilin University, Changchun 130021, China
急性肺损伤(acute lung injury,ALI)是严重威胁人类健康的危重症,可由严重肺部感染、外伤等多种因素诱发肺泡上皮细胞及毛细血管内皮细胞损伤,造成动脉血氧不足、水肿和气体交换功能受损,引起严重的肺纤维化,最终导致急性呼吸功能不全或急性呼吸衰竭[1-2]。目前,针对肺泡上皮细胞损伤的修复尚缺乏有效的方法。干细胞是组织修复及功能重建领域中重要的“工具细胞”,目前已发现多种类型的间充质干细胞(mesenchymal stem cells,MSC)均可通过直接分化为Ⅱ型肺泡上皮细胞(type Ⅱ alveolar epithelial,ATⅡ)对肺损伤进行修复,降低肺损伤程度[3-4],然而MSC分化的机制,尤其是损伤部位微环境对MSC分化的影响尚未明确。低氧是肺损伤组织中重要的微环境特征之一。McClendon等[5]发现:低氧诱导因子1(hypoxia-inducible factor 1,HIF-1)可通过促进MSC分化为ATⅡ从而促进肺损伤后修复;Ito等[6]证明:在低氧条件下下游靶基因STC1在ATⅡ中的高表达能够增强肺泡上皮细胞伤口的修复。同时,转化生长因子β(transforming growth factor β,TGF-β)则是肺损伤部位的另一个重要的微环境特征,其主要通过受体TGF-βRⅠ和TGF-βRⅡ传递信号,诱导及促进细胞纤维化[7-9]。有研究[10-11]报道:TGF-β信号通路在ALI发生后9 h便可被激活,而TGF-β刺激可使MSC向成肌纤维细胞分化。目前,MSC在低氧和TGF-β的双重影响下是向ATⅡ分化还是向纤维细胞分化尚未见报道,其分化的调控机制有待进一步阐明。微小RNA(microRNA,miRNA)是17~24个核苷酸的非编码RNA,可在转录后水平调节靶基因的mRNA翻译。目前已有多项报道[12-13]表明:HIF-1能够结合于miR-145启动子区,上调其表达;同时,miR-145与TGF-β也密切相关,并在细胞纤维化及肌成纤维细胞分化过程中具有重要作用[14-15]。然而,miR-145在低氧诱导的MSC分化与纤维化间发挥何种调控作用尚未见报道。本研究在低氧条件下诱导人脐带间充质干细胞(umbilical cord MSC,UCMSC)向ATⅡ分化,揭示低氧对UCMSC分化的影响,同时在低氧诱导分化过程中加入促细胞纤维化的TGF-β,探讨在UCMSC分化过程中低氧对细胞纤维化的影响及其机制,为阐明UCMSC在损伤肺部微环境低氧和TGF-β的双重刺激下向ATⅡ分化的机制提供理论依据。
1 材料与方法 1.1 试剂和主要仪器DMED培养液、DMEM/F12培养液、胎牛血清、L-谷氨酰胺和双抗均购自美国Gibco公司,重组人碱性成纤维细胞生长因子购自美国R & D公司,氯化钴(cobaltous chloride,CoCl2)购自美国Sigma公司,anti-AQP5-PE和anti-SpC-FITC均购自美国BD公司,逆转录试剂盒(superscript Ⅱ reverse transcriptase)购自美国Invitrogen公司,Power SYBR Green Master Mix购自美国Applied Biosystems公司,miRNA定量检测试剂盒(All-in-One miRNA qRT-PCR Detection Kit)购自广州复能基因公司,Ⅰ型胶原蛋白(Col-Ⅰ)、转化生长因子βⅠ型受体(TGF-βRⅠ)和转化生长因子βⅡ型受体(TGF-βRⅡ)一抗购自美国Abcam公司,Smad2、Smad3、p-Smad2、p-Smad3、HIF-1α一抗和辣根过氧化物酶标记的二抗均购自美国Santa Cruz公司,ECL化学发光试剂盒购自中国碧云天生物公司,双荧光素酶报告基因检测试剂盒购自美国Promega公司。T25培养瓶和Transwell小室均购自美国康宁公司。AriaⅡ流式细胞仪购自美国BD公司,Ⅸ71荧光显微镜购自日本奥林巴斯公司,CFX96Touch实时荧光定量PCR仪购自美国Bio-RAD公司。
1.2 细胞培养人UCMSC由本实验室自足月剖宫产健康孕妇脐带分离鉴定并保存,具体步骤:无菌条件下取新鲜脐带约10 cm,生理盐水漂洗后剪至长2~3 cm小段,再次漂洗,纵行剖开脐带,剔除脐静脉和脐动脉,取华尔通胶并剪碎成1 mm×1mm×1 mm左右的组织块,将小组织块铺在培养皿中,加入含10%胎牛血清、2 mmol·L-1 L-谷氨酰胺、1%双抗的DMED培养液,置于5% CO2、37℃培养箱中静置培养,待组织块中爬出的成纤维样细胞达到80%融合时收集细胞,随后重悬并铺入新的T25培养瓶,加入含10%胎牛血清、2 mmol·L-1 L-谷氨酰胺、1%双抗、10 μg·L-1重组人碱性成纤维细胞生长因子的DMEM/F12培养液继续培养,待UCMSC生长至80%融合时传代。人肺腺癌细胞株A549由本实验室保存,复苏后用含10%胎牛血清的DMED培养液培养,培养至对数生长期后与UCMSC共培养,诱导UCMSC向ATⅡ分化。
1.3 细胞分化收集体外培养的UCMSC,调整细胞密度为1×104mL-1,在6孔板中加入1.5 mL单细胞悬液,待细胞贴壁后在每孔上放置Transwell小室,随后在小室中放入1 mL DMEM培养液重悬的A549细胞(细胞密度为1×104mL-1)开始诱导分化,低氧诱导组则通过在诱导初始阶段加入CoCl2模拟低氧环境来实现。每2 d进行1次细胞换液,在光镜下观察细胞形态,共培养8 d。
1.4 流式细胞术鉴定ATⅡ表型收集体外诱导后获得的肺泡上皮样细胞,1 000 r·min-1离心10 min,洗涤后用100 μL PBS重悬细胞,分装至流式管中,设置同型对照组和实验组,在实验组每个流式管中加入1 μL荧光标记抗体:anti-AQP5-PE和anti-SpC-FITC,混匀,室温下避光孵育30 min,PBS洗涤2次后弃掉上清,1%多聚甲醛固定,24 h内用FACS Calibur流式细胞术检测,通过Flowjo软件分析目的细胞占收集细胞的百分比。
1.5 实时荧光定量PCR法检测ATⅡ标志性基因使用Trizol从诱导后细胞中提取总RNA,260 nm处测定样品吸光度(A)值,对RNA进行定量,使用逆转录试剂盒Superscript Ⅱ reverse transcriptase获得cDNA,随后使用Power SYBR Green Master Mix对目的基因进行扩增,以GAPDH作为内参,使用2-ΔΔCt法计算目的基因mRNA相对于内参mRNA表达水平的变化倍数。所使用的基因的引物如表 1所示。
| Gene | Primer sequence (5′-3′) | Size(bp) |
| HIF-1α | F: ACCATGCCCCAGATTCAGG R: AGTGCTTCCATCGGAAGGACT |
261 |
| KGF | F: TTGTGGCAATCAAAGGGGTG R: CCTCCGTTGTGTGTCCATTTA |
168 |
| CK18 | F: ATCTTGGTGATGCCTTGGAC R: CCTGCTTCTGCTGGCTTAAT |
203 |
| SpA | F: GTGATGGGATGACTGGAGCC R: TCTGAAGTCGTGGAGTGTGC |
199 |
| SpB | F: ACAAGACTCTGACTGCCAGC R: CACACTTTTGCCTGTCCAGC |
215 |
| SpC | F: AACGCCTTCTTATCGTGGTG R: AAGACTGGGGATGCTCTCTG |
178 |
| AQP5 | F: ATCTTCGCCTCCACTGACTC R: TTTCTTCTTTTCCCCCTTGG |
192 |
| Col-Ⅰ | F: GGAAAGAATGGAGATGATGG R: CCAAACCACTGAAACCTCTG |
211 |
| TGFβRⅠ | F: TGATAAAACTTGCTCTGTCCAC R: AATGGCTGGCTTTCCTTGG |
227 |
| TGFβRⅡ | F: TGGAGTTCAGCGAGCACTGTG R: TGTTGTGGTTGATGTTGTTG |
194 |
| Smad2 | F: ATGTCGTCCATCTTGCCATTC R: AACCGTCCTGTTTTCTTTAGCT |
210 |
| Smad3 | F: CCCCAGAGCAATATTCCAGA R: GACATCGGATTCGGGGATAG |
221 |
| GAPDH | F: GGTGGTCTCCTCTGACTTCAACA R: GTGGTCGTTGAGGGCAAT |
237 |
在提取总RNA后使用miRNA定量检测试剂盒(All-in-One miRNA qRT-PCR Detection Kit)检测miR-145表达水平,以RNU6B作为内参基因,所有的样本均分别对miRNA和U6进行扩增,每个样本重复3次。miR-145-5p和RNU6B的引物均由美国GeneCopoeia公司设计并合成。
1.7 Western blotting法检测纤维化相关蛋白表达水平采用RIPA细胞裂解液冰上裂解收集的细胞,12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离总蛋白,并将其转移到PVDF膜上,经5%脱脂牛奶室温封闭10 min后,分别加入Col-Ⅰ、TGF-βRⅠ、TGF-βRⅡ、Smad2、Smad3、p-Smad2、p-Smad3和HIF-1α抗体,4℃缓慢摇动孵育过夜。次日,使用TBST冲洗膜后,再用对应的辣根过氧化物酶标记的二抗室温孵育2 h,经TBST充分漂洗后使用ECL化学发光试剂盒进行目的条带显色,扫描仪进行扫描,采用Image J软件进行灰度值分析。按照公式计算蛋白表达水平:蛋白表达水平=每个样本条带灰度值/内参灰度值。
1.8 载体构建应用PCR法扩增TGF-βRⅡ基因3′端非编码区(3′-UTR)中miR-145可能的结合位点,选择合适的酶切位点后克隆至pGL3荧光素酶报告基因载体上,构建pGL3-TGFβRⅡ野生型载体(pGL3-TGF-βRII WT),同时通过PCR法对miR-145可能的结合位点进行点突变,构建pGL3-TGF-βRⅡ突变型载体(pGL3-TGFβRⅡMut)。miR-145-5p前体表达质粒(pre-145,5′-GUCCAGUUUUCCCAGGAAUCCCU-3′)及其无义序列对照质粒(scrambled control)均由美国GeneCopoeia公司设计并构建。miR-145抑制剂均由上海吉玛制药技术有限公司设计并合成。
1.9 双荧光素酶报告基因检测利用Lipofectamine 2000将pre-145及其对照质粒分别与TGFβRⅡ报告基因质粒共转染至293T细胞中,以海肾荧光素酶报告质粒作为内参,在转染48 h后裂解细胞,用双荧光素酶报告基因检测试剂盒检测目的基因的相对荧光素酶活性(relative luciferase unit, RLU)。RLU=RLU1/RLU2,RLU1为萤火虫荧光素酶反应强度,RLU2为内参海肾荧光素酶反应强度。
1.10 统计学分析采用SPSS 16.0统计软件进行统计学分析。诱导前后HIF-1α、ATII特异性基因、纤维化相关基因和miR-145表达水平,ATⅡ细胞所占百分率和目的基因相对荧光素酶活性均以x±s表示,两组间样本均数比较采用两独立样本t检验,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 CoCl2处理后UCMSC中HIF-1α表达水平用不同浓度CoCl2处理UCMSC 12 h,与常氧培养组比较,100 nmol·L-1 CoCl2组中HIF-1α mRNA和蛋白表达水平明显升高(P < 0.05)。用100 nmol·L-1CoCl2处理UCMSC不同时间:与常氧培养组比较,CoCl2处理6 h组中HIF-1α蛋白表达水平明显上升(P < 0.05),而HIF-1α mRNA表达水平则无明显改变(P>0.05)。UCMSC中HIF-1α表达水平与CoCl2处理呈时间-剂量依赖性。故本实验选用100 nmol·L-1 CoCl2模拟低氧环境。见表 2。
| Group | HIF-1α mRNA | HIF-1α protein |
| Treatment with different concentrations of CoCl2 for 12 h | ||
| 50 nmol·L-1 | 1.88±0.20 | 1.47±0.19 |
| 100 nmol·L-1 | 3.15±0.25* | 2.40±0.21* |
| 200 nmol·L-1 | 3.75±0.80* | 3.42±0.42* |
| 300 nmol·L-1 | 3.53±0.26* | 3.27±0.26* |
| Treatment with 100 nmol·L-1 CoCl2 for different time | ||
| 4 h | 1.43±0.12 | 1.31±0.16 |
| 6 h | 1.89±0.20 | 2.48±0.26△ |
| 8 h | 2.82±0.16△ | 2.77±0.17△ |
| 12 h | 2.80±0.27△ | 2.92±0.24△ |
| *P < 0.05 compared with 50 nmol·L-1group; △P < 0.05 compared with 4 h group. | ||
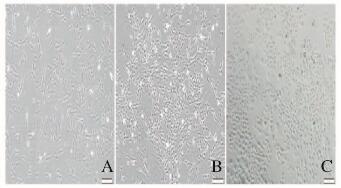
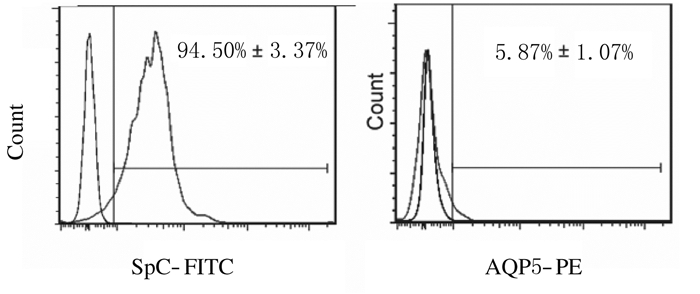
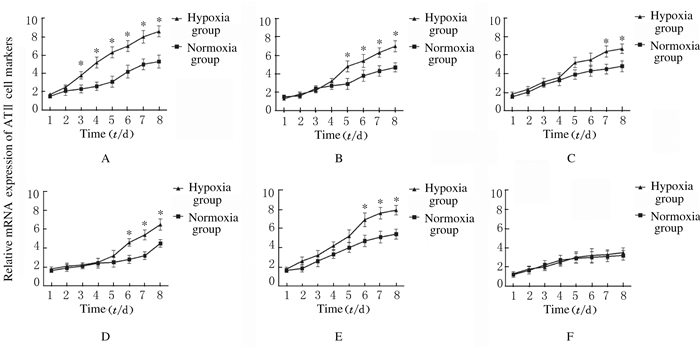
在低氧条件下利用Transwell小室对UCMSC和A549细胞进行共培养,诱导4 d后UCMSC开始出现多角形形态改变;诱导8 d后细胞形态出现明显改变,由成纤维样变为铺路石样的上皮细胞。见图 1(插页二)。经流式细胞术鉴定,低氧诱导后细胞ATⅠ标志性分子AQP5阳性表达率仅为(5.87±1.07)%,而ATⅡ标志性分子SpC阳性表达率为(94.5±3.37)%。见图 2。同时,与常氧条件下诱导分化的对照组比较,低氧条件下诱导分化细胞中KGF、CK18、SpA、SpB和SpC等ATⅡ特异性基因的表达水平明显升高(P < 0.05),而2组间ATⅠ特异性基因AQP5的表达水平比较差异无统计学意义(P>0.05)。见图 3。
|
| A:0 d; B:4 d; C:8 d. 图 1 低氧条件下UCMSC向ATⅡ分化过程中的细胞形态(Bar=20 μm) Figure 1 Morphology of UCMSC during its differentiation towards ATⅡ under hypoxia condition(Bar=20 μm) |
|
|
|
| 图 2 ATⅠ和ATⅡ表面标志性分子流式细胞术鉴定 Figure 2 Surface markers of ATⅠ and ATⅡ identificated with flow cytometry |
|
|
|
| *P < 0.05 vs normoxic group; A: KGF; B: CK18; C: SpA; D: SpB; E: SpC; F: AQP5. 图 3 ATⅡ特异性基因的表达水平 Figure 3 Expressionlevels of ATⅡ specific genes |
|
|
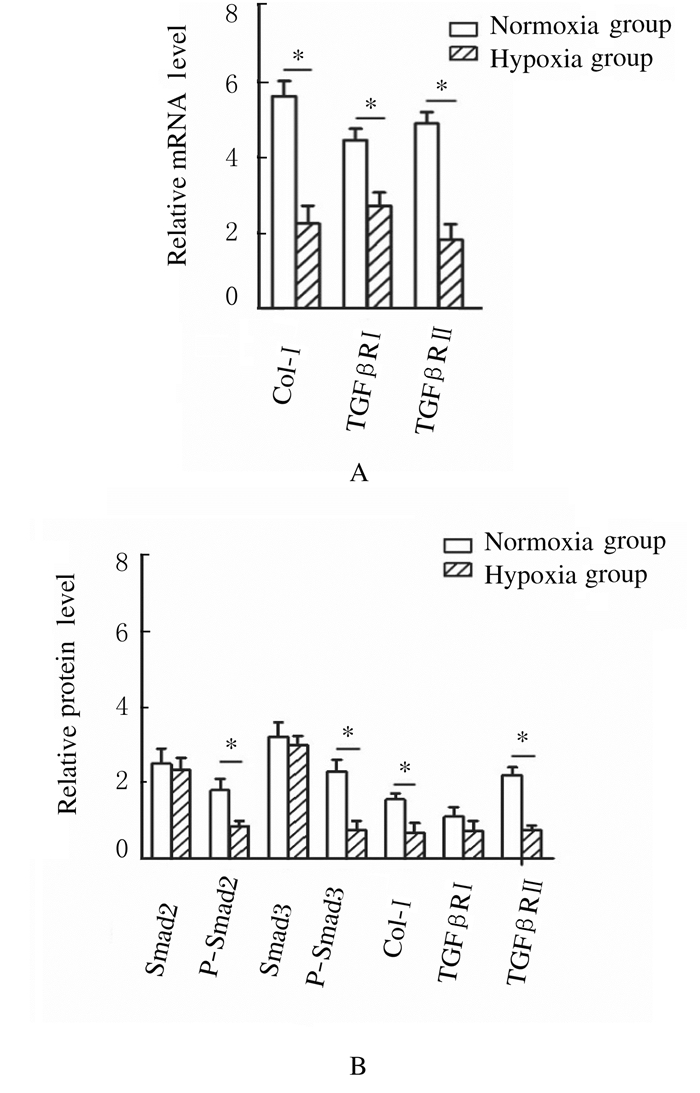
在UCMSC向ATⅡ分化过程中加入5 μg·L-1 TGF-β1处理,8 d后收集细胞,与常氧对照组比较,低氧组中细胞纤维化相关基因Col-Ⅰ及TGF-β1受体(TGF-βRⅠ和TGF-βRⅡ)mRNA表达水平均明显下降(P < 0.05),Col-Ⅰ和TGF-βRⅡ蛋白表达水平也明显下降(P < 0.05),TGF-βRⅠ蛋白表达水平比较差异无统计学意义(P>0.05);2组间TGF-β1下游因子Smad2和Smad3蛋白表达水平比较差异无统计学意义(P>0.05),但在低氧组中Smad2和Smad3蛋白磷酸化水平(p-Smad2和p-Smad3)与常氧对照组比较明显下降(P < 0.05)。见图 4。
|
| *P < 0.05 vs normoxia group. 图 4 各组UCMSC中TGF-β下游纤维化相关基因mRNA(A)和蛋白(B)表达水平 Figure 4 Expression levels of mRNA (A) and protein (B) of TGF-β downstream fibrosisrelated-genes in UCMSC in various groups |
|
|
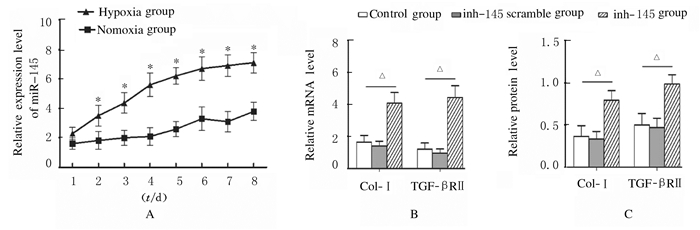
在低氧诱导UCMSC向ATⅡ分化过程中miR-145表达水平呈逐渐上升趋势,且在同一诱导时间点低氧组miR-145表达水平明显高于常氧诱导组(P < 0.05)。见图 5A。在低氧诱导UCMSC向ATⅡ分化过程中同时加入5 μg·L-1TGF-β1和miR-145抑制剂,8 d后收集细胞,与未加miR-145抑制剂的对照组比较,miR-145抑制剂组中Col-Ⅰ和TGF-βRⅡmRNA及蛋白表达水平均明显升高(P < 0.05)。见图 5B和C。
|
| *P < 0.05 vs normoxic group; △P < 0.05 vs control group; A: Expression level of miRNA-145; B: Expression levels of Col-Ⅰ and TGF-βRⅡ mRNA; C:Expression levels of Col-Ⅰ and TGF-βRⅡ proteins. 图 5 各组UCMSC中miR-145、Col-Ⅰ和TGF-βRⅡ表达水平 Figure 5 Expression levels of miR-145, Col-Ⅰ and TGF-βRⅡ in UCMSC in various groups |
|
|
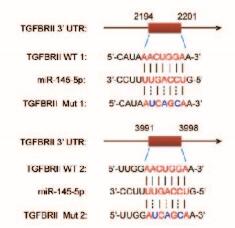
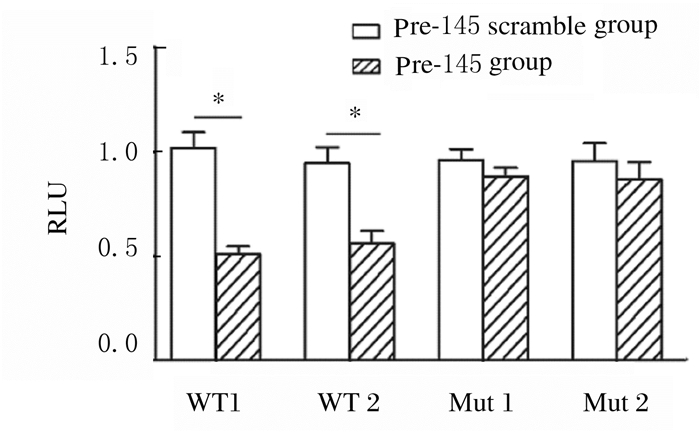
TGF-βRⅡ 3′-UTR区域含有2个miR-145-5p的结合位点,见图 6(插页二)。与miR-145-5p的无义序列的对照质粒比较,miR-145-5p前体使TGF-βRⅡ 3′-UTR目的序列报告质粒的RLU明显降低(P < 0.05),而miR-145-5p前体的突变体则对TGF-βRⅡ 3′-UTR目的序列报告质粒的RLU无明显影响(P>0.05)。见图 7。
|
| Red: Binding site of miR-145 on TGF-βRⅡ 3′-UTR; Blue: Mutation site. 图 6 TGF-βRⅡ3′-UTR与miR-145-5p结合位点序列比对 Figure 6 Comparison of binding sites between TGF-βRⅡ 3′-UTR and miR-145-5p |
|
|
|
| *P < 0.05 vs pre-145 scramble group. 图 7 转染miR-145前体后TGF-βRⅡ3′-UTR区RLU Figure 7 RLU of TGF-βRⅡ-3′-UTR after transfection with pre-145-5p |
|
|
目前,人们认为ALI发病的初始阶段是由内皮和上皮损伤引起的肺间质和肺泡水肿,水肿液中含有大量纤维蛋白、白蛋白、炎性细胞及其分泌的炎性因子,可促进成纤维细胞的增殖和细胞间黏附,导致异常的细胞外纤维蛋白沉积,最后渐进性发展成为不可逆的肺部纤维化,造成肺功能损伤[1-2]。因此,肺泡上皮细胞ATⅠ和ATⅡ的修复便成为ALI治疗的一个重要方向。ATⅠ细胞覆盖了肺泡95%的表面积,是进行气体交换、吞饮微小粉尘和表面活性物质的重要部位;但ATⅠ细胞分化程度高、无增殖能力、不能更新修复,损伤后由ATⅡ增殖分化补充,研究者认为ATⅡ细胞是ATⅠ的前体细胞,因此在ALI发生时,ATⅡ的修复显得尤为重要。
大量研究[16-17]结果表明:MSC能够在体外诱导分化为神经、心脏、肝脏和上皮等多种组织细胞,并且MSC的分化与其所在微环境有密切关联。作为损伤肺部微环境的重要特征,低氧与高水平的TGF-β均对MSC的分化起重要的调控作用,但二者在UCMSC向ATⅡ分化过程中究竟发挥何种作用尚不明确。
MSC可通过与ATⅡ细胞共培养的方法在体外被诱导分化为ATⅡ样细胞[4, 18]。由于人肺腺癌细胞系A549与人Ⅱ型肺泡上皮细胞有相似特性,故A549被广泛用于模拟ATⅡ细胞[19-20]。本实验利用CoCl2竞争性结合HIF-1α的ODD区,从而抑制HIF-1α降解的特性[21],在体外模拟低氧环境,在低氧条件下通过与A549共培养诱导UCMSC向ATⅡ分化。本研究结果表明:HIF-1α的表达与CoCl2处理剂量和时间成正相关关系,并且低氧条件诱导的细胞具有上皮细胞样形态,同时高表达ATⅡ表面标志性分子SpC而低表达ATⅠ表面标志性分子AQP5,证明通过共培养的方式能够在低氧条件下成功诱导UCMSC分化为ATⅡ。同时,本实验还比较了常氧和低氧诱导组中ATⅡ特异性基因的表达,结果显示:与常氧组比较,低氧组中ATⅡ特异性基因KGF、CK18、SpA、SpB和SpC表达水平明显上升,而ATⅠ特异性基因AQP5则无明显差异,表明低氧能够促进UCMSC向ATⅡ分化。
高水平TGF-β1是损伤肺部微环境的重要因素,能够诱导MSC向成纤维细胞分化[11]。为了研究TGF-β1和低氧二者同时存在对UCMSC分化的影响,本实验在低氧诱导UCMSC向ATⅡ分化过程中加入TGF-β1刺激,结果显示:与常氧对照组比较,低氧组中细胞纤维化相关基因Col-Ⅰ和TGF-βRⅡ在mRNA和蛋白水平上均明显下调,而TGF-β1/TGF-βRⅡ通路下游p-Smad2和p-Smad3蛋白表达水平也明显下调,表明低氧可通过下调TGF-βRⅡ表达来抑制TGF-β1/TGF-βRⅡ信号通路的活化以及纤维化关键因子Col-Ⅰ的表达,介导UCMSC对TGF-β1刺激耐受,从而抑制TGF-β1引起的组织纤维化。
为了研究低氧对TGF-βRⅡ表达的抑制作用,本实验对与低氧密切相关的miRNA进行了分析。多项研究[12-13]显示:低氧可通过结合于miR-145启动子区上调其表达,而miR-145在细胞纤维化中也具有重要作用。Zhao等[14]发现:miR-145能够下调平滑肌细胞中TGF-β下游细胞基质相关因子的表达水平;Yang等[15]发现:肺成纤维细胞中miR-145过表达可上调α-SMA,进而导致其向平滑肌细胞分化。本研究结果表明:在低氧诱导UCMSC分化为ATⅡ过程中,miR-145表达水平呈上升趋势,并且在低氧组中的表达明显高于同时间点的常氧组。随后,为了验证miR-145对TGF-βRⅡ的影响,本实验在低氧诱导UCMSC向ATⅡ分化过程中同时加入TGF-β1和miR-145抑制剂,结果显示:miR-145抑制剂能够明显上调Col-Ⅰ和TGF-βRⅡ表达水平。以上结果表明:低氧可通过miR-145负向调控TGF-βRⅡ表达,抑制TGF-β1/TGF-βRⅡ信号通路活化和纤维化关键因子Col-Ⅰ的表达,从而抑制UCMSC向成纤维细胞分化。
通过TargetScan数据库进行生物信息学分析,TGF-βRⅡ基因3′-UTR区可能存在2个miR-145的结合位点,而Col-Ⅰ mRNA的3′末端区域则没有miR-145的结合序列,因此miR-145并不直接抑制Col-Ⅰ表达。针对上述miR-145结合位点分别构建相应的荧光素酶报告质粒,利用双荧光素酶报告基因系统检测结果显示:野生型miR-145-5p前体可明显降低目的序列报告质粒的荧光素酶活性,表明miR-145-5p可与TGF-βRⅡ 3′-UTR区的两段序列直接结合,从而介导TGF-βRⅡ的降解。
综上所述,在UCMSC向ATⅡ分化过程中,低氧能够通过直接上调miR-145降解TGF-βRⅡ,抑制TGF-β1/TGF-βRⅡ信号通路,介导UCMSC抵抗TGF-β1刺激,促进UCMSC向ATⅡ分化而抑制其向成纤维细胞分化。本研究阐明这一机制将为后续利用低氧相关miRNA治疗肺损伤及促进损伤后修复提供理论依据。
| [1] | Raghavendran K, Pryhuber GS, Chess PR, et al. Pharmacotherapy of acute lung injury and acute respiratory distress syndrome[J]. Curr Med Chem, 2008, 15(19): 1911–1924. DOI:10.2174/092986708785132942 |
| [2] | Ware LB, Matthay MA. The acute respiratory distress syndrome[J]. N Engl J Med, 2000, 342(18): 1334–1349. DOI:10.1056/NEJM200005043421806 |
| [3] | Rawlins EL, Hogan BL. Epithelial stem cells of the lung:privileged few or opportunities for many[J]. Development, 2006, 133(13): 2455–2465. DOI:10.1242/dev.02407 |
| [4] | Gong X, Sun Z, Cui D. Isolation and characterization of lung resident mesenchymal stem cells capable of differentiating into alveolar epithelial type Ⅱ cells[J]. Cell Biol Int, 2014, 38(4): 405–411. DOI:10.1002/cbin.v38.4 |
| [5] | McClendon J, Jansing NL, Redente EF, et al. Hypoxia-inducible factor 1α signaling promotes repair of the alveolar epithelium after acute lung injury[J]. Am J Pathol, 2017, 187(8): 1772–1786. DOI:10.1016/j.ajpath.2017.04.012 |
| [6] | Ito Y, Zemans R, Correll K, et al. Stanniocalcin-1 is induced by hypoxia inducible factor in rat alveolar epithelial cells[J]. Biochem Biophys Res Commun, 2014, 452(4): 1091–1097. DOI:10.1016/j.bbrc.2014.09.060 |
| [7] | Narikawa M, Umemura M, Tanaka R, et al. Acute hyperthermia inhibits TGF-β1-induced cardiac fibroblast activation via suppression of akt signaling[J]. Sci Rep, 2018, 8(1): 6277. DOI:10.1038/s41598-018-24749-6 |
| [8] | Caja L, Dituri F, Mancarella S, et al. TGF-β and the tissue microenvironment:relevance in fibrosis and cancer[J]. Int J Mol Sci, 2018, 19(5): pii:E1294. DOI:10.3390/ijms19051294 |
| [9] | Atallah MAA, Elaidy SM, Tawfik MK. Assessment of the possible roles of SB-269970 versus ketanserin on carbon tetrachloride-induced liver fibrosis in rats:Oxidative stress/TGF-β1-induced HSCs activation pathway[J]. Pharmacol Rep, 2018, 70(3): 509–518. DOI:10.1016/j.pharep.2017.11.017 |
| [10] | Pittet JF, Griffiths MJ, Geiser T, et al. TGF-beta is a critical mediator of acute lung injury[J]. J Clin Invest, 2001, 107(12): 1537–1544. DOI:10.1172/JCI11963 |
| [11] | Desai VD, Hsia HC, Schwarzbauer JE. Reversible modulation of myofibroblast differentiation in adipose-derived mesenchymal stem cells[J]. PLoS One, 2004, 9(1): e86865. |
| [12] | Blick C, Ramachandran A, McCormick R, et al. Identification of a hypoxia-regulated miRNA signature in bladder cancer and a role for miR-145 in hypoxia-dependent apoptosis[J]. Br J Cancer, 2015, 113(4): 634–644. DOI:10.1038/bjc.2015.203 |
| [13] | Sun N, Meng F, Xue N, et al. Inducible miR-145 expression by HIF-1α protects cardiomyocytes against apoptosis via regulating SGK1 in simulated myocardial infarction hypoxic microenvironment[J]. Cardiol J, 201.doi: 10.5603/cj.a2017.0105. |
| [14] | Zhao N, Koenig SN, Trask AJ, et al. MicroRNA miR145 regulates TGFBR2 expression and matrix synthesis in vascular smooth muscle cells[J]. Circ Res, 2015, 116: 23–34. DOI:10.1161/CIRCRESAHA.115.303970 |
| [15] | Yang S, Cui H, Xie N, et al. MiR-145 regulates myofibroblast differentiation and lung fibrosis[J]. FASEB J, 2013, 27(6): 2382–2391. DOI:10.1096/fj.12-219493 |
| [16] | Casiraghi F, Perico N, Remuzzi G. Mesenchymal stromal cells for tolerance induction in organ transplantation[J]. Hum Immunol, 2018, 79(5): 304–313. DOI:10.1016/j.humimm.2017.12.008 |
| [17] | Volarevic V, Gazdic M, Simovic Markovic B, et al. Mesenchymal stem cell-derived factors:Immuno-modulatory effects and therapeutic potential[J]. Biofactors, 2017, 43(5): 633–644. DOI:10.1002/biof.v43.5 |
| [18] | Ito H, Uchida T, Makita K. Interactions between rat alveolar epithelial cells and bone marrow-derived mesenchymal stem cells:an in vitro co-culture model[J]. Intensive Care Med Exp, 2015, 3(1): 53. |
| [19] | Foster KA, Oster CG, Mayer MM, et al. Characterization of the A549 cell line as a type Ⅱ pulmonary epithelial cell model for drug metabolism[J]. Exp Cell Res, 1998, 243: 359–366. DOI:10.1006/excr.1998.4172 |
| [20] | Lieber M, Smith B, Szakal A, et al. A continuous tumor-cell line from a human lung carcinoma with properties of type Ⅱ alveolar epithelial cells[J]. Int J Cancer, 1976, 17: 62–70. DOI:10.1002/(ISSN)1097-0215 |
| [21] | Piret JP, Mottet D, Raes M, et al. CoCl2, a chemical inducer of hypoxia-inducible factor-1, and hypoxia reduce apoptotic cell death in hepatoma-cell line HepG2[J]. Ann N Y Acad Sci, 2002, 973: 443–447. DOI:10.1111/nyas.2002.973.issue-1 |
 2018, Vol. 44
2018, Vol. 44


