扩展功能
文章信息
- 阎慧, 马淑飞, 段明华, 闫玉礼, 潘新, 李海清, 周长龙, 赵天倚
- YAN Hui, MA Shufei, DUAN Minghua, YAN Yuli, PAN Xin, LI Haiqing, ZHOU Changlong, ZHAO Tianyi
- 京尼平对胃癌SGC 7901细胞体外增殖、侵袭能力和凋亡的影响及其机制
- Influence of genipin in abilities of proliferation and invasion and apoptosis of gastric cancer SGC 7901 cells and their mechanisms in vitro
- 吉林大学学报(医学版), 2018, 44(05): 924-928
- Journal of Jilin University (Medicine Edition), 2018, 44(05): 924-928
- 10.13481/j.1671-587x.20180507
-
文章历史
- 收稿日期: 2018-01-07
2. 国药一心制药有限公司研发中心项目管理室, 吉林 长春 130022;
3. 长春中医药大学药学院生物制药与保健食品教研室, 吉林 长春 130117;
4. 空军航空大学飞行训练基地飞行二大队, 吉林 长春 130022
2. Sinopharm A-THINK Pharmaccutiacl Co., Ltd, Changchun 130022, China;
3. Department of Bio-pharmaceutics and Health food, College of Pharmacy, Changchun University of Chinese Medicine, Changchun 130117, China;
4. Flight Two, Aviation University of Air Force, Changchun 130022, China
胃癌是起源于胃黏膜上皮的恶性肿瘤,有明显的地域性差别。靶向治疗可针对性地杀伤癌细胞,减轻正常细胞损害。目前胃癌靶向治疗药物种类及作用均有限。靶向治疗药物主要有表皮生长因子受体抑制剂、血管生成抑制剂、细胞周期抑制剂、细胞凋亡促进剂和基质金属蛋白酶抑制剂等。京尼平(genipin,GP)的制备方法一般采用从栀子中提取京尼平苷(geniposide)[1],再用β-葡萄糖苷酶水解,然后用乙醚萃取、真空浓缩、重结晶而制得,也可以采用微生物转化法制备[2]。京尼平苷在杜仲和栀子中含量均较高,达到3%~8%,但由于栀子栽培容易、产量大,因此GP的生产主要以栀子为原料。GP来源于京尼平苷,在抗肿瘤、抗血栓、抗炎和治疗糖尿病等方面疗效显著,作为一种新兴的药物中间体具有很多新型的、重要的药理价值[3]。研究[4-6]表明:GP可有效抑制前列腺癌(AIPC)、肾癌细胞株(GRC-1)和前列腺癌细胞(PC-3)的增殖。但目前GP对胃癌SGC7901的影响尚不清楚,未见相关研究报道。因此,本实验通过检测GP对SGC7901细胞增殖、迁移和凋亡的影响,进一步探讨其对SGC7901细胞的促凋亡作用,阐明其对胃癌细胞抑制和促凋亡机制,为胃癌的临床治疗提供更多实验数据。
1 材料与方法 1.1 细胞、试剂和主要仪器胃癌SGC7901细胞(湖南丰晖生物),RPMI培养基、胎牛血清、乙二胺四甲酸(EDTA)、胰蛋白酶、GP和噻唑蓝(MTT)(吉林省金泰生物试剂有限公司),全蛋白提取试剂盒、RIPA裂解液和SDS-PAGE凝胶配制试剂盒(美国Sigma公司),PVDF膜(美国密理博公司)、β-actin、小鼠抗人Bcl-2抗体、小鼠抗人Bax抗体和小鼠抗人caspase-3抗体(美国BD公司)。Olympus倒置显微镜(日本Olympus公司)。
1.2 细胞株培养将细胞株复苏后,用含10%胎牛血清的高糖RPMI 1640培养基放置于37℃、5% CO2恒温培养箱培养。2~3 d传代1次,传代3次后,进行细胞实验。
1.3 细胞分组经查阅文献[7]和预实验,初步确定GP浓度为10 mg·L-1。将胃癌SGC 7901细胞分为4组:对照(DMSO)组,低、中和高剂量(5、10和20 mg·L-1)GP组。
1.4 MTT法检测胃癌SGC 7901细胞增殖抑制率取对数生长期细胞,用含0.02% EDTA的0.25%胰蛋白酶消化,调整细胞密度为2×105 mL-1,接种于96孔板,接种量为每孔100 μL,培养24 h弃去培养基,加入3个药物实验组和DMSO对照组,每组药物3个复孔,每孔100 μL。放置于37℃、5% CO2恒温培养箱培养,分别培养24、48和72 h,于培养结束前4 h加入MTT(5 μg·L-1)20 μL,恒温培养箱内孵育4 h,于离心机2 500 r·min-1离心15 min,吸尽上清,加入DMSO 150 μL,100 r·min-1振荡10 min,用酶标仪测定吸光度(A)值,计算细胞增殖抑制率。细胞增殖抑制率= [1-实验组A(490)值/对照组A(490)值] × 100%。
1.5 Transwell小室实验检测细胞侵袭能力用不含EDTA的0.25%胰蛋白酶消化对数生长期细胞,细胞密度稀释至2 × 105mL-1,根据MTT实验结果,选择MTT作用效果比较明显的GP浓度,加入细胞悬浮液中,使药物终浓度为10和20 mg·L-1。将GP加入RPMI 1640培养基中,使药物终浓度为10和20 mg·L-1,然后加入胎牛血清,使其浓度为10%。吸取200 μL含有不同浓度(10和20 mg·L-1)GP的细胞悬液接种于Transwell小室上室,下室加入含10%胎牛血清的不同浓度(10和20 mg·L-1)GP的RPMI 1640培养基800 μL,同时设DMSO对照组,分别培养24、48和72 h后,去掉Transwell小室半透膜,PBS清洗2次,多聚甲醛固定30 min,0.1%结晶紫染色20 min,用棉签轻轻擦拭去除半透膜上未穿透膜细胞,PBS清洗3次,普通显微镜下随机选取5个视野观察细胞并计数,以穿膜的细胞个数表示细胞的侵袭能力。
1.6 Western blotting法检测各组细胞中Bax、Bcl-2和caspase-3蛋白表达水平在6孔细胞培养板,GP作用于细胞48 h后,弃去培养基,用PBS洗涤细胞2次。每孔加入RIPA裂解液100 μL,刮下底部细胞,吹打成单细胞悬液。根据BCA蛋白测定试剂盒(全蛋白提取试剂盒)要求,绘制标准曲线,并进行样品蛋白浓度测定。灌制4%浓缩胶和12%分离胶进行SDS-PAGE凝胶电泳,PVDF膜转膜,封闭。分别加入Bax、Bcl-2和caspase-3-抗,4℃孵育过夜,室温摇床孵育2 h,漂洗3次,分别加入HRP标记的二抗,室温孵育2 h,漂洗3次。取膜,压片,检测,用分析软件Quanlity One分析目的条带的相对灰度值(以β-actin作为内参),以Bax/β-actin表示Bax蛋白表达水平,以Bcl-2/β-actin表示Bcl-2蛋白表达水平,以caspase-3/β-actin表示caspase-3蛋白表达水平[8]。
1.7 统计学分析采用Graphpad Prism 5.0软件进行统计学分析。各组细胞增殖抑制率,穿膜细胞数和Bcl-2、Bax及caspase-3蛋白表达水平均以x±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 MTT法检测各组SGC7901细胞增殖抑制率不同浓度GP(5、10和20 mg·L-1)作用于胃癌SGC7901细胞24、48和72 h后,其增殖抑制率均升高,与对照组比较差异均有统计学意义(P < 0.05),且呈时间-浓度依赖性。见表 1。
| (n=4, x±s, η/%) | ||||
| Group | Dose | Inhibitory rate of proliferation of cells | ||
| (t/h) 24 | 48 | 72 | ||
| Control | 0 | 2.35±2.30 | 3.59±2.69 | 6.58±2.54 |
| GP(mg·L-1) | 5 | 11.18±3.11* | 18.23±5.69* | 23.19±3.12* |
| 10 | 21.49±3.41* | 28.21±3.15* | 32.23±3.48* | |
| 20 | 41.08±1.15* | 47.84±2.65* | 50.56±2.72* | |
| *P < 0.05 vs control group. | ||||
10和20 mg·L-1 GP作用于胃癌SGC7901细胞后,检测穿膜细胞数。Transwell小室检测结果:与对照组比较,10和20 mg·L-1 GP组穿膜细胞数明显降低(P < 0.05),且呈时间-浓度依赖性。见图 1(插页二)和图 2。
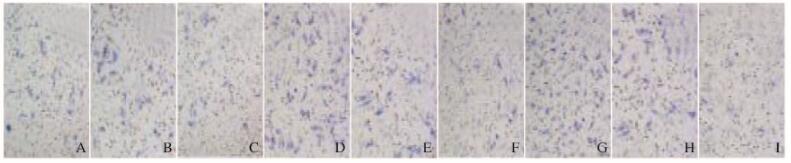
|
| A-C:24 h; D-F:48 h; G-I:72 h; A, D, G:Control group; B, E, H:10.0 mg·L-1GP group; C, F, I:20.0 mg·L-1GP group. 图 1 Transwell小室实验检测各组SGC7901细胞的侵袭能力 Figure 1 Invasion abilities of SGC7901 cells in various groups detected by Transwell chamber assay |
|
|
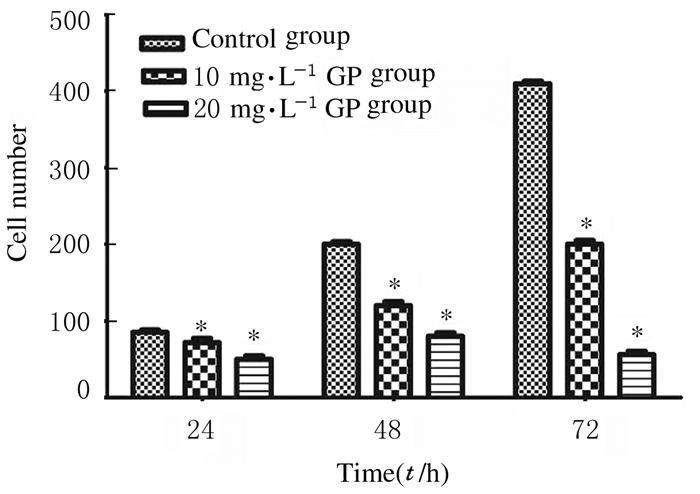
|
| *P < 0.05 vs control group. 图 2 Transwell小室实验检测各组SGC 7901细胞穿膜细胞数 Figure 2 Number of transmembrane SGC7901 cells in various groups detected by Transwell chamber assay |
|
|
作用48 h后,与对照组比较,5、10和20 mg·L-1GP组SGC7901细胞中Bcl-2蛋白表达水平降低(P < 0.05),Bax和caspase-3蛋白表达水平升高(P < 0.05)。见图 3和4。
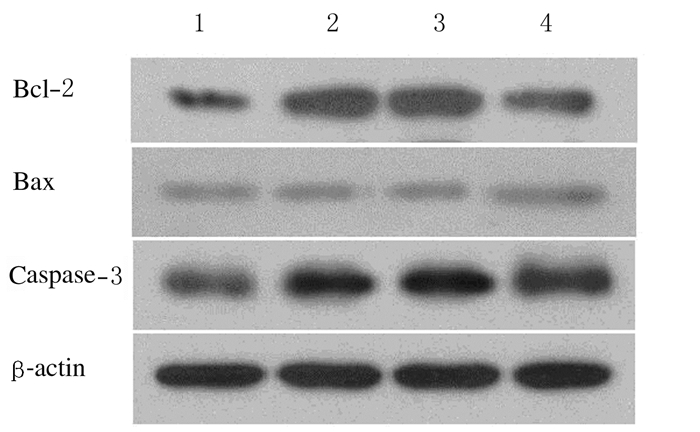
|
| Lane 1:Control group; Lane 2-4:5, 10, and 20 mg·L-1 GP groups. 图 3 Western blotting法检测各组SGC7901细胞中Bcl-2、Bax和caspase-3蛋白表达电泳图 Figure 3 Electrophoregram of expressions of Bcl-2, Bax and caspase-3 proteins in SGC7901 cells in various groups detected by Western blotting method |
|
|
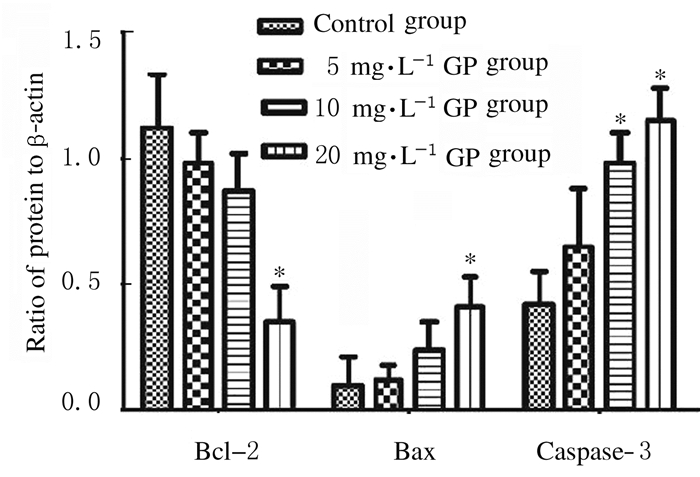
|
| *P < 0.05, **P < 0.01 vs control group. 图 4 Western blotting法检测各组SGC 7901细胞中Bcl-2、Bax和caspase-3蛋白表达水平 Figure 4 Expression levels of Bcl-2, Bax, and caspase-3 proteins in SGC 7901 cells in various groups detected by Western blotting method |
|
|
癌症是一种复杂的疾病,单纯的靶向治疗并不能有效抑制肿瘤的生长和转移,通过药物来抑制细胞存活,也会导致药效变差,因此寻找能够调节肿瘤生存或凋亡的信号分子,是治疗肿瘤的关键[9]。本研究采用MTT法检测GP对胃癌SGC7901细胞的增殖调节作用与其浓度和时间的关系。本研究结果表明:培养24 h,当GP浓度为5 mg·L-1时,对细胞增殖抑制率仅为11.18%,随着给药浓度增加和给药时间延长,对胃癌细胞抑制作用逐渐增强;培养72 h,当浓度为20 mg·L-1时,对细胞增殖抑制率高达50.56%。本研究中Transwell小室细胞侵袭实验结果表明:与对照组比较,10和20 mg·L-1GP能明显降低胃癌SGC7901细胞的迁移和侵袭能力。Bcl-2基因家族及其相关蛋白Bcl-2是最早被发现与凋亡有关的基因[10-11],也是目前最受重视的调控细胞凋亡的基因家族。Bax和Bcl-2通过形成同源或异源二聚体来调节细胞凋亡。caspase-3是半胱氨酸蛋白酶[12],使用半胱氨酸裂解的多肽链中的硫原子切割caspase-3的活性形式,触发细胞凋亡[13]。裂解的caspase-3将最终诱导肿瘤细胞中DNA片段化,因此剪切后的caspase-3是很多化合物抑制肿瘤生长增加肿瘤凋亡的关键靶点[14]。而caspase-3在caspase家族中被认为是最重要的执行蛋白,在细胞死亡过程中常会出现caspase-3激活。因此,测定caspase-3蛋白水平变化[15],可以研究细胞凋亡机制。本实验中使用不同浓度GP(10和20 mg·L-1)作用于胃癌细胞48 h,检测胞内Bax、caspase-3和Bcl-2蛋白表达水平[16],与对照组比较,GP在低浓度时就能够使Bax和caspase-3表达水平增加,且呈现一定浓度依赖性,而Bcl-2蛋白变化与此相反[17]。
综上所述,GP能够上调Bax和caspase-3蛋白表达,下调Bcl-2蛋白表达,进而激活线粒体凋亡通路,诱导细胞凋亡[18]。本研究结果表明:GP对胃癌SCG7901细胞具有明显的增殖抑制作用,能够诱导细胞凋亡,但其具体作用机制有待进一步研究。
| [1] | 万丽花, 姚忠, 倪芳, 等. 两相体系中β-葡萄糖苷酶催化栀子苷水解制备京尼平[J]. 化工学报, 2014, 65(9): 135–138. |
| [2] | 董悦生, 刘乐平, 包永明, 等. 哈茨木霉CGMCC2979生物转化栀子中的京尼平苷制备京尼平[J]. 催化学报, 2014, 35(9): 68–71. |
| [3] | 杨轶舜, 张彤, 于筛成. 京尼平的研究进展及其药理价值[J]. 中成药, 2011, 33(1): 49–52. DOI:10.3969/j.issn.1001-1528.2011.01.013 |
| [4] | 杨清滔, 谷江, 张永春, 等. 京尼平阻断线粒体解偶联蛋白2对激素非依赖性前列腺癌细胞产能及生长的抑制作用[J]. 中华实验外科杂志, 2014, 31(2): 56–59. |
| [5] | 王楠, 谷江, 张永春, 等. 京尼平对肾癌细胞解耦连蛋白2线粒体能量代谢的作用[J]. 贵阳医学院学报, 2013, 38(1): 26–29. |
| [6] | 姚茂良, 谷江, 张永春, 等. 京尼平抑制解耦连蛋白2对激素非依赖性前列腺癌细胞能量代谢的影响[J]. 中华男科学杂志, 2015, 21(11): 14–18. |
| [7] | 任艳青, 田宇柔, 李琛, 等. 京尼平苷及其代谢产物京尼平对HepG2细胞毒性的比较及机制研究[J]. 中国药理学通报, 2016, 32(12): 186–189. |
| [8] | 王雪, 秦瑞, 王皓莹, 等. 乳胞素联合卡铂对卵巢癌SKOV3细胞的增殖抑制作用和促凋亡作用[J]. 吉林大学学报:医学版, 2017, 43(6): 1098–1112. |
| [9] | 郭雅馨, 孔庆宏, 王冠林. PAR-4选择性诱导肿瘤细胞凋亡机制的研究进展[J]. 中国细胞生物学学报, 2017, 39(2): 1–7. |
| [10] | Tsao YT, Kuo CY, Cheng SP, et al. Downregulations of AKT/mTOR Signaling Pathway for Salmonella-Mediated Suppression of Matrix Metalloproteinases-9 Expression in Mouse Tumor Models[J]. Int J Mol Sci, 2018, 19(6): 253–256. |
| [11] | Polimeni M, Voena C, Kopecka J, et al. Modulation of doxorubicin resistance by the glucose-6-phosphate dehydrogenase activity[J]. Biochem J, 2011, 439(1): 141–149. DOI:10.1042/BJ20102016 |
| [12] | Love NR, Ziegler M, Chen Y, et al. Carbohydrate metabolism during vertebrate appendage regeneration:what is its role? How is it regulated? A postulation that regenerating vertebrate appendages facilitate glycolytic and pentose phosphate pathways to fuel macromolecule biosynthesis[J]. Bioessays, 2014, 36(1): 27–33. DOI:10.1002/bies.v36.1 |
| [13] | Cernaj IE. Simultaneous dual targeting of Par-4 and G6PD:a promising new approach in cancer therapy? Quintessence of a literature review on survival requirements of tumor cells[J]. Cancer Cell Int, 2016, 16: 87. DOI:10.1186/s12935-016-0363-9 |
| [14] | Nguyen JQ, Irby RB. TRIM21 is a novel regulator of Par-4 in colon and pancreatic cancer cells[J]. Cancer Biol Ther, 2017, 18(1): 16–25. DOI:10.1080/15384047.2016.1252880 |
| [15] | Al-Rasheed NM, Al-Rasheed NM, Bassiouni YA, et al. Simvastatin ameliorates diabetic nephropathy by attenuating oxidative stress and apoptosis in a rat model of streptozotoc in-induced type 1 diabetes[J]. Biomed Pharmacother, 2018, 105: 290–298. DOI:10.1016/j.biopha.2018.05.130 |
| [16] | Rodríguez V, Plavnik L, Tolosa de Talamoni N, et al. Naringin attenuates liver damage in streptozotoc in-induced diabetic rats[J]. Biomed Pharmacother, 2018, 28(105): 95–102. |
| [17] | Burikhanov R, Hebbar N, Noothi SK, et al. Chloroquine-inducible Par-4 secretion is essential for tumor cell apoptosis and inhibition of metastasis[J]. Cell Rep, 2017, 18(2): 508–519. DOI:10.1016/j.celrep.2016.12.051 |
| [18] | Moselhy J, Suman S, Alghamdi M, et al. Withaferin a inhibits prostate carcinogenesis in a PTEN-deficient mouse model of prostate cancer[J]. Neoplasia, 2017, 19(6): 451–459. DOI:10.1016/j.neo.2017.04.005 |
 2018, Vol. 44
2018, Vol. 44


