扩展功能
文章信息
- 范东艳, 王苹, 任海龙, 周余来, 石艳
- FAN Dongyan, WANG Ping, REN Hailong, ZHOU Yulai, SHI Yan
- 西藏高原环境对移居大鼠子代主要脏器发育和形态的影响
- Influence of Tibetan plateau environment in development and morphology of main organs of offsprings of migrated rats
- 吉林大学学报(医学版), 2018, 44(05): 914-918
- Journal of Jilin University (Medicine Edition), 2018, 44(05): 914-918
- 10.13481/j.1671-587x.20180505
-
文章历史
- 收稿日期: 2017-10-08
2. 吉林大学第一医院耳鼻咽喉-头颈外科, 吉林 长春 130021;
3. 吉林大学药学院再生医学系, 吉林 长春 130021;
4. 吉林大学药学院药学系, 吉林 长春 130021
2. Department of Otorhinolaryngology and Head-Neck Surgery, First Hospital, Jilin University, Changchun 130021, China;
3. Department of Regenerative Medicine, School of Pharmacy, Jilin University, Changchun 130021, China;
4. Department of Pharmacy, School of Pharmacy, Jilin University, Changchun 130021, China
海拔3 000 m以上的地区称为医学意义上的高原。我国高原(海拔3 000 m以上)面积占国土陆地总面积的33%以上,而且有漫长的边境线位于高原之上,高原地区空气稀薄,氧分压低,导致低压性缺氧,因此人体快速进入海拔3 000 m以上的高原缺氧环境地区可导致机体各器官功能的严重损伤,甚至发生急性重症高原病,这对初入高原人群的生命安全构成极大的威胁[1-2]。随着我国西部大开发战略实施,高原列车的开通和高原航空业的发展,越来越多世居平原地区的人群进入西藏旅游、工作和定居。研究高原环境对人体及其子代的影响对于保障高原建设者和世居高原人群的健康、边疆地区的经济发展以及拓宽人类生存空间, 顺利实施西部大开发战略具有重要的现实意义和深远的历史意义。
目前多数研究者认为疾病是环境因素与遗传因素相互作用的结果。研究[3]已经证实:缺氧是影响内环境稳态的常见应激之一,也是胎儿遭受最重要的、与临床最相关的应激。孕妇居住于高海拔环境中会导致胎儿长期慢性缺氧, 而胎儿宫内缺氧又是先天性心脏病的一个十分重要的诱因[4-6]。高原缺氧对动物子代心、脑和肺等脏器影响的研究尚未见报道。本研究以移居高原大鼠子代作为研究对象,探讨高原低压低氧对动物脏器发育及形态的影响,以期为缺氧性疾病防治提供理论依据。
1 材料与方法 1.1 实验动物、试剂和主要仪器Wistar大鼠,56只,雌雄比例为3:1,购于北京市维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2012-0001;多聚甲醛(001219,上海凌峰化学试剂有限公司);正置显微镜(Nikon ECLIPSE 80i,日本尼康公司),石蜡切片机(LEICA-2455,德国LEICA公司)。
1.2 高原移居孕鼠模型制备将生活在平原地区(北京,平均海拔33m、1个大气压、平均气温12.3℃)8周龄大鼠(雄性14只,雌性42只)移居到高原地区(拉萨市,平均海拔3 600 m、0.7个大气压、平均气温7.4℃),动物适应1周后,大鼠按雌雄3:1比例合笼受孕,所有孕鼠均自然分娩。仔鼠每窝随机留8只饲养,以避免奶水摄入不足对新生仔鼠生长的影响。子代大鼠满3周后断乳,根据肛门与生殖突间的距离并结合乳状突的有无来判断性别,雌雄分笼,标准饲料喂养。
1.3 标本采集子代大鼠于出生后1、3和6月龄,每组随机取仔鼠雌雄各5只,同一时间点用电子天平(精确到0.01 g)测定体质量及脑、心、肺、肝和肾等主要脏器的质量(各脏器离体后去残血及残留脂肪、结缔组织,用生理盐水漂洗擦干后称净质量), 用4℃预冷的0.1 mol·L-1、pH7.4的PBS溶液冲洗3次,滤纸吸干水分后称质量。取部分心肌、脑、肺组织置于10%的甲醛固定液中4℃固定12 h,常规石蜡包埋,HE染色(心肌顺心脏长轴方向在左心室和右心室各取材一块,脑取大脑皮质和海马区、中脑区和小脑区3个冠状切,左右肺与主支气管垂直方向各取材一块)。
1.4 行为学检测每组随机抽取45只仔鼠进行Morris水迷宫实验、旷场实验和拒俘反应实验。仔鼠出生2周后进行游泳训练,每隔3 d训练1次,在出生第4周进行正式行为学检测。检测时间分别在1、3和6月龄。
1.5 统计学分析采用SPSS 17.0统计软件进行统计学分析。子代大鼠体质量、脏器/体质量比以x±s表示,多组间样本均数比较采用单因素方差分析。以P<0.05表示差异有统计学意义。
2 结果 2.1 高原移居孕鼠及子代大鼠发育的一般情况平原移居高原的孕鼠饮食正常,无早产和死亡。孕鼠平均每窝产仔8~10只,共计产仔345只。仔鼠体质量增长为1.0~1.5 g·d-1。有部分仔鼠出现采食量低和觅食困难的现象,15只仔鼠在出生后3~5 d后陆续死亡,死亡率为4.3%。与1月龄子鼠比较,6月龄子鼠体质量明显增加(P<0.05)。不同月龄子鼠的体质量和脏器/体质量比见表 1。
| (n=10, x±s) | ||||||
| Age(month) | Weight(m/g) | Heart/body weight ratio | Lung/body weight ratio | Liver/body weight ratio | Kidney/body weight ratio | Brain/body weight ratio |
| 1 | 60.0±1.2 | 2.14±0.14 | 2.23±0.14 | 3.81±0.26 | 0.80±0.02 | 0.62±0.02 |
| 3 | 150.0±1.3 | 2.32±0.15 | 2.25±0.15 | 4.35±0.28 | 0.83±0.03 | 0.64±0.02 |
| 6 | 290.0±1.5* | 2.51±0.17 | 2.81±0.18 | 4.86±0.35* | 0.85±0.03 | 0.66±0.02 |
| *P<0.05 vs 1 month. | ||||||
45只仔鼠在水迷宫实验检测过程中未出现溺水和死亡情况。每一时间点每只仔鼠找到水中平台的时间,其中3月龄有7只仔鼠(3雌4雄)找到水中平台的时间低于其他仔鼠,但差异无统计学意义(P>0.05),其他时间点各组比较差异无统计学意义(P>0.05)。旷场实验中,其中1月龄有6只仔鼠(2雌4雄)表现为中央区停留时间高于其他仔鼠,其他时间点各组比较无明显差异。拒俘反应实验中各时间点所有动物表现基本一致。
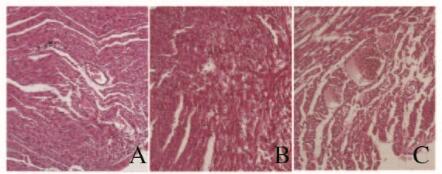
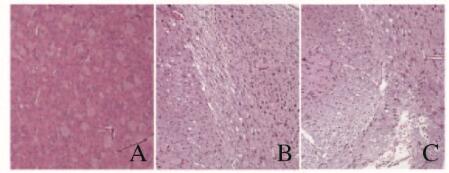
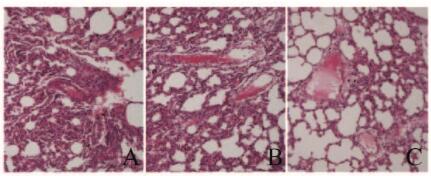
2.3 高原移居大鼠子代心、脑和肺组织病理学表现平原移居高原孕鼠子代中有部分仔鼠出现不同程度的心、脑和肺组织病理损伤。1、3和6月龄仔鼠心、脑和肺组织进行HE染色后镜下表现:1月龄仔鼠中有7只心肌间质存在大量淋巴细胞和浆细胞等炎症细胞浸润,心肌间质及小静脉明显淤血,心肌细胞发生凝固性坏死,胞核消失,但细胞轮廓仍保存;3月龄仔鼠中有10只心肌间质内有炎细胞浸润,心肌细胞肥大,胞核消失,但细胞轮廓仍保存;6月龄仔鼠中10只心肌间质内有炎细胞浸润,心肌细胞结构破坏,胞核消失,胞质溶解,心肌间质及血管明显淤血,部分心肌纤维呈不规则断裂,心肌间隙扩大(图 1,见插页二)。1月龄仔鼠中9只脑组织中有玻璃样小体形成,散在分布,其内为淡伊红色均质毛玻璃样变化,小体内神经细胞染色淡,胞核不易辨认或消失;3月龄仔鼠中9只脑组织结构疏松呈筛网状,空泡样变化,坏死灶内染色减退,可见较多淋巴细胞和泡沫细胞及大量毛细血管高度扩张,明显充血,坏死灶中有些神经元轮廓仍保存,胞质嗜碱性增强,神经元胞体变形,胞核固缩、溶解或消失;6月龄仔鼠中有7只脑组织中有玻璃样小体形成,结构疏松呈筛网状,空泡样变化,坏死灶内染色减退,可见较多泡沫细胞,毛细血管高度扩张,明显充血(图 2,见插页二)。1月龄仔鼠中有5只肺组织内部分肺泡壁增生变厚,内有大量淋巴细胞及浆细胞浸润,肺泡壁毛细血管扩张充血;3月龄仔鼠中有7只肺组织内大部分肺泡壁增生变厚,内有大量淋巴细胞及浆细胞浸润,肺泡壁毛细血管扩张充血;6月龄仔鼠中有7只肺组织部分肺泡壁增生变厚,内有大量淋巴细胞及浆细胞浸润,肺间质有淡伊红色水肿液。肺泡壁毛细血管扩张淤血,血管内部分红细胞液化,坏死(图 3,见插页二)。
|
| A:1 month; B:3 months; C:6 months. 图 1 各组大鼠心肌组织HE染色结果(×100) Figure 1 HE staining results of myocardium tissue of rats in various groups(×100) |
|
|
|
| A:1 month; B:3 months; C:6 months. 图 2 各组大鼠脑组织HE染色结果(×100) Figure 2 HE staining results of brain tissue of rats in various groups(×100) |
|
|
|
| A:1 month; B:3 months; C:6 months. 图 3 各组大鼠脑组织HE染色结果(×100) Figure 3 HE staining results of lung tissue of rats in various groups(×100) |
|
|
研究[7]表明:影响高原地区胎儿生长的因素包括产妇的生理状态(即母体氧气的供应量和运送到子宫胎盘循环的营养等)和胎盘因素等。随着高原地区经济建设的发展,大量人员从平原地区到达高原地区,因此深入研究高原缺氧环境对胎儿生长的影响,对临床和公共健康有重要的意义,可以有效地提高高原新生儿的出生质量,降低出生缺陷率。慢性缺氧可以影响高原移居孕产妇妊娠和胎儿生长,而高原世居孕妇子宫动脉血流较高,可保护胎儿生长[8-11]。
本研究利用西藏特有的高原地理条件,复制孕鼠高原移居模型,对高原移居孕鼠子代发育进行了一般情况观察,通过Morris水迷宫实验、旷场实验和拒俘反应实验进行了仔鼠行为学检测;利用HE染色检测仔鼠不同月龄心、脑和肺组织的病理学改变等,初步阐明高原缺氧环境对高原移居孕鼠子代发育的影响,为进一步研究缺氧对组织脏器发育的影响提供理论依据。
我国是世界上高原面积最大的国家之一,主要分布在西部。随着我国西部大开发和“一带一路”国家发展战略的稳步推进,越来越多的人进驻高原工作或者旅游[12]。先天性心脏损伤可导致心脏结构改变和心肌微结构受损,由此引发先天性心脏病和心肌病的发生,在高原地区常见多发。国内外已有多项流行病学统计分析及相关研究间接显示先天性心脏损伤的发生与母体妊娠期缺氧存在一定联系[13-14],但母体妊娠期处于缺氧环境对胎儿心脏发育的确切病理生理影响尚不明确。揭示心脏病的病因一直是国内外研究的热点,但致病因素及发病机制至今仍不明确。目前大部分研究者认为:先天性心脏损伤的发病是遗传因素和环境因素相互作用所引起的一个复杂过程,但其具体过程尚不明确。高原环境高海拔、低温、低压且缺氧。早期胚胎的心脏发育对环境因素高度敏感,其细胞增殖、分化和凋亡等发育过程均易受到外界因素影响。研究[15-16]显示:当母体处于低氧环境,动脉氧分压降为40 mmHg时,其体内胎儿的动脉氧分压可降至10~12mmHg,胎儿处于缺氧状态。
低压低氧诱导的氧化应激会对多个器官造成损伤,特别是脑组织。大脑组织耗氧量大,含有高浓度的不饱和脂肪酸以及丰富的金属离子,同时抗氧化酶的水平较低,这些因素使其对高原缺氧造成的氧化应激非常敏感[17]。研究[18-20]表明:低压低氧严重影响脑组织结构和功能,特别是神经认知功能和空间记忆能力。虽然低压低氧导致脑损伤的机制尚不完全明确,但是目前公认活性氧簇(ROS)的过度蓄积是造成损伤的重要原因之一[21]。
动物实验[22]表明:母鼠在妊娠期最后1 d氧浓度控制为10%,则幼鼠在出生后1~2 h出现肺容积增加延迟、远端球囊扩张,影响气体交换,气体交换面积减少,并在出生后7~30 d加速肺泡壁变薄。
本研究利用水迷宫实验主要是检测实验动物工作学习记忆方面的功能,45只受试仔鼠中有7只仔鼠不能在相应的时间内找到水中的平台,说明这7只受试动物学习或记忆方面欠缺;旷场实验中有6只受试动物表现出中央区停留时间长,提示动物行为有异常;拒俘反应实验中受试动物本能攻击性表现正常。根据以上行为学检测发现高原移居孕鼠子代有部分出现神经系统发育异常现象,推测可能与缺氧环境有关。
| [1] | 邓炳楠, 李培兵, 毛忠, 等. 单兵供氧器对高原移居青年心率和SaO2影响的评价[J]. 中国应用生理学杂志, 2015, 31(1): 17–18, 22. |
| [2] | 安方玉, 刘永琦, 骆亚莉, 等. 当归不同有效部位对高原低氧模型小鼠免疫功能的影响[J]. 中国医药信息杂志, 2015, 22(2): 51–54. |
| [3] | Hoffman JIe. The global burden of congenital heart disease[J]. Cardiovasc J Afr, 2013, 24(4): 141–145. DOI:10.5830/CVJA-2013-028 |
| [4] | Licht DJ, Wang J, Silvestre DW, et al. Preoperative cerebral blood flow is diminished in neonates with severe congenital heart defects[J]. J Thorac Cardiovasc Surg, 2004, 128(6): 841–849. DOI:10.1016/j.jtcvs.2004.07.022 |
| [5] | Miller SP, Mc Quillen PS, Hamrick S, et al. Abnormal brain development in newborns with congenital heart disease[J]. N Engl J Med, 2007, 357(19): 1928–1938. DOI:10.1056/NEJMoa067393 |
| [6] | McQuillen PS, Barkovich AJ, Hamrick SE, et al. Temporal and anatomic risk profile of brain injury with neonatal repair of congenital heart defects[J]. Stroke, 2007, 38(2 Suppl): 736–741. |
| [7] | 李传红, 朱俊宇, 罗勇军, 等. 高原缺氧环境对胎儿生长的影响[J]. 西南国防医药, 2014(4): 435–437. DOI:10.3969/j.issn.1004-0188.2014.04.035 |
| [8] | Luo YJ, Gao WX, Zhao XX, et al. Altered expression of mitochondria-related genes in the native Tibetan placents, as revealed by cDNA array analysis[J]. J Med Coll PLA, 2009, 24(1): 88–93. |
| [9] | 刘福玉, 罗勇军, 高文祥, 等. 移居汉族与平原汉族胎盘组织基因表达谱的差异[J]. 西南国防医药, 2011, 21(12): 1347–1349. DOI:10.3969/j.issn.1004-0188.2011.12.032 |
| [10] | 赵秀欣, 高文祥, 李素芝, 等. 高原缺氧环境对世居藏族和移居汉族胎儿生长发育的影响[J]. 西南国防医药, 2007, 17(2): 146–148. DOI:10.3969/j.issn.1004-0188.2007.02.006 |
| [11] | Moore LG, Charles SM, Julian CG. Humans at high altitude:hypoxia and fetal growth[J]. Respir Physiol Neurobiol, 2011, 178(1): 181–190. DOI:10.1016/j.resp.2011.04.017 |
| [12] | 马慧萍, 景临林, 何蕾, 等. 4-羟基-2, 2, 6, 6-四甲基哌啶基-N-氧化物对高原缺氧小鼠心肌组织损伤的保护作用及机制研究[J]. 中国药学杂志, 2017, 52(18): 597–1603. |
| [13] | Monroy-Muñoz IE, Pérez-Hernández N, Vargas-Alarcón G, et al. Changing the paradigm of congenital heart disease:from theanatomy to the molecular etiology[J]. Gac Med Mex, 2013, 149(2): 212–219. |
| [14] | Zaffran S, Robert GK. New developments in the second heart field[J]. Differentiation, 2012, 84(1): 17–24. DOI:10.1016/j.diff.2012.03.003 |
| [15] | Camm EJ, Hansell JA, Kane AD, et al. Partial contributionsof developmental hypoxia and undernutrition to prenatal alterations in somatic growth and cardiovasular structure and function[J]. Am J Obstet Gynecol, 2010, 203(5): 424–495. |
| [16] | 胡劼, 李华, 牛铭, 等. 高原环境中妊娠期母体缺氧与胎羊先天性心脏病理损伤相关性分析的实验研究[J]. 中国超声医学杂志, 2016, 32(11): 1042–1044. |
| [17] | Soule BP, Hyodo F, Matsumoto K, et al. The chemistry and biology of nitroxide compounds[J]. Free Radic Biol Med, 2007, 42(11): 1632–1650. DOI:10.1016/j.freeradbiomed.2007.02.030 |
| [18] | Singh M, Thomas P, Shukla D, et al. Effect of subchronic hypobaric hypoxia on oxidative stress in rat heart[J]. Appl Biochem Biotechnol, 2013, 169(8): 2405–2419. DOI:10.1007/s12010-013-0141-2 |
| [19] | 李燕, 李思雪, 王立轩, 等. 慢性间歇性低压低氧对大鼠离体肺动脉环舒张功能的影响[J]. 郑州大学学报:医学版, 2016, 51(5): 587–591. |
| [20] | 徐娇阳, 司马玲, 是文辉, 等. 低压低氧暴露条件下肺动脉高压大鼠循环microRNA表达及其意义[J]. 西安交通大学学报:医学版, 2016, 37(4): 556–559. |
| [21] | 景临林, 马慧萍, 樊鹏程, 等. Tempol对高原缺氧致小鼠脑组织损伤的保护作用[J]. 中国医院药学杂志, 2017, 37(20): 2009–2013. |
| [22] | Moore LG, Rounds SS, Jahnigen D, et al. Infant birth weight is related to maternal arterial oxygenation at high altitude[J]. J Appl Physiol Respir Environ Exerc Physiol, 1982, 52(3): 695–699. |
 2018, Vol. 44
2018, Vol. 44


