扩展功能
文章信息
- 冉琴, 张雷, 张沄, 邱玉环, 袁谢芳, 王孝芸, 唐红梅, 王星, 李国平
- RAN Qin, ZHANG Lei, ZHANG Yun, QIU Yuhuan, YUAN Xiefang, WANG Xiaoyun, TANG Hongmei, WANG Xing, LI Guoping
- 白藜芦醇对中性粒细胞性哮喘小鼠肺组织炎症的抑制作用及其机制
- Inhibitory effect of resveratrol on pulmonary inflammation in mice with neutrophilic asthma and its mechanism
- 吉林大学学报(医学版), 2018, 44(05): 897-902
- Journal of Jilin University (Medicine Edition), 2018, 44(05): 897-902
- 10.13481/j.1671-587x.20180502
-
文章历史
- 收稿日期: 2018-01-07
2. 西南医科大学附属医院炎症与变态反应实验室, 四川 泸州 646000
2. Inflammation and Allergy Laboratory, Affiliated Hospital, Southwest Medical University, Luzhou 646000, China
根据发病机制哮喘可分为辅助性T淋巴细胞2(T-helper lymphocyte type-2, Th2)型和非Th2型,相应的气道炎症也存在着不同的亚型[1],在非Th2型重症哮喘患者中发现炎症细胞以中性粒细胞为主。然而,中性粒细胞性哮喘与哮喘的急性发作、控制不佳和重症哮喘等有关,并且对激素的治疗效果欠佳,甚至出现“激素抵抗”反应[2-3]。目前,如何有效治疗中性粒细胞性哮喘是临床急需解决的重要难题,因此寻找新的药物用于治疗中性粒细胞性哮喘具有重要意义。白藜芦醇是多酚类化合物,存在于多种植物中[4],具有多种生物活性,其是公认的具有抗炎、抗氧化、抗衰老作用和癌症化学预防剂[5-6]。研究[7]表明:在人群中观察到白藜芦醇摄入与肺功能成正相关关系,即摄入白藜芦醇可以增加用力肺活量(forced vital capacity, FVC)的水平。越来越多的证据[8-9]表明:白藜芦醇对呼吸系统疾病有保护作用,如急性肺损伤、慢性阻塞性肺疾病、支气管哮喘和肺纤维化等肺部疾病。然而,国内外至今尚无白藜芦醇改善中性粒细胞性哮喘气道炎症的研究报道。本研究拟通过建立中性粒细胞性哮喘模型,探讨白藜芦醇对中性粒细胞性哮喘的作用及其可能的作用机制,为临床上治疗中性粒细胞性哮喘寻找新的途径。
1 材料与方法 1.1 实验动物、主要试剂和仪器24只无特殊病原体(specific pathogen free, SPF)级C57BL/6J雌性小鼠购自重庆腾鑫科技公司,周龄6~8周,体质量18~22 g,动物合格证号:SCXK(京)2016-0002。脂多糖(lipopolysaccharide, LPS)、卵白蛋白(ovalbumin, OVA)、白藜芦醇(resveratrol, Res)和N-乙酰半胱氨酸(N-acetylcysteine, NAC)均购自美国Sigma公司,白细胞介素17(interleukin-17, IL-17)检测试剂盒购自北京诚林生物科技有限公司,丙二醛(malondialdehyde, MDA)试剂盒购自南京建成生物科技研究所,BCA蛋白分析试剂盒和活性氧(reactive oxygen species, ROS)检测试剂盒购自上海碧云天生物科技公司。小鼠肺功能仪购自美国Buxco公司,全光谱分光光度计购自德国Thermo公司,离心机购自北京白洋医疗器械有限公司,低温超速离心机购自德国Eppendorf公司,正置荧光显微镜购自日本Olympus公司,光学显微镜病理图像分析仪购自德国Leica公司,低温恒温水浴槽购自上海恒平科学仪器有限公司。
1.2 实验动物分组选取18只C57BL/6J雌鼠作为实验组构建制备中性粒细胞性哮喘模型,再随机分为3组:LPS+OVA组、Res组和NAC组,每组6只。同时选取6只同周龄C57雌鼠作为对照组(PBS组)。Res组小鼠于激发前2 h灌胃给予30 mg·kg-1白藜芦醇,NAC组小鼠于激发前2 h灌胃给予3 mg·kg-1 NAC,LPS+OVA组和PBS组仅给予等体积生理盐水,各组小鼠给药体积均为0.2 mL。所有小鼠造模前均在相通环境(12 h/12 h明暗周期,60%~70%湿度及饮水饮食可自由获取)下饲养1周。
1.3 中性粒细胞性哮喘小鼠模型的建立中性粒细胞性哮喘造模方法参照文献[10]。采用腹腔注射戊巴比妥钠(100 mg·kg-1)麻醉小鼠,于实验开始的第0、1、2、7和14天用LPS (10 μg)滴鼻联合OVA (75 μg)腹腔注射致敏实验组小鼠,PBS组小鼠致敏药物用生理盐水代替,方法及剂量同实验组。于实验的第15天起,实验组小鼠于麻醉状态下鼻腔滴入0.1% OVA溶液50 μL,每天1次,连续激发7 d,PBS组给予等体积生理盐水滴鼻。末次激发后24 h检测小鼠气道阻力,48 h处死小鼠。
1.4 小鼠气道阻力检测最后一次滴鼻激发小鼠后24 h,即第22天用乙酰甲胆碱依次按0、6.25、12.50、25.00和50.00 g·L-1递增的浓度雾化小鼠,并采用肺功能仪对小鼠进行气道阻力的测定,每个浓度下的反应时间为3 min,取每个浓度反应期间的增强呼气间歇(enhanced pause, Penh)均值作为评价气道高反应(airway hyperresponsiveness, AHR)的指标。
1.5 小鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)的收集及检测于实验第23天行腹腔注射致死剂量戊巴比妥钠处死小鼠并分离气道,22G留置针气管插管并固定,结扎主支气管,0.8 mL PBS灌洗肺3次(回收率≥80%时为合格),收集BALF,1 500 r·min-1、4℃离心10 min。取上清-80℃保存,溶液激用于ELISA检测。用1 mL PBS重悬细胞,于光学显微镜下进行细胞总数和炎症细胞分类计数。
1.6 小鼠肺组织病理切片HE染色取左肺组织,4%多聚甲醛固定,梯度酒精脱水、石蜡包埋后行HE染色,于光学显微镜下观察肺组织中的炎症情况,并采用HE染色切片半定量方法评定支气管周围炎症细胞浸润程度[11]。评分标准:无炎症细胞(0分);少许炎症细胞(1分);较多分布不均的炎症细胞(2分);大量炎症细胞,分布较均匀,少见聚集成团(3分);大量炎症细胞聚集成团(4分)。
1.7 小鼠肺组织中ROS和MDA水平检测取出右肺组织,将一叶肺包埋行冰冻切片(切片厚度为4 μm),按试剂盒说明书中步骤进行ROS检测,于荧光显微镜下观察肺组织内的荧光强度。将剩余肺组织于冰上进行手工匀浆:先取组织块在冰生理盐水中漂洗,除去血液,滤纸吸干,准确称质量,放入5 mL匀浆管中,按质量(g):体积(mL)= 1:9的比例加入9倍体积的匀浆介质,后按试剂盒说明书进行操作,用全光谱分光光度计进行MDA的测定。
1.8 统计学分析采用SPSS 17.0统计软件进行统计学处理。各组小鼠Penh值和BALF中细胞总数、炎症细胞分类计数、炎症评分、BALF上清中IL-17水平以及肺匀浆中MDA水平均以x±s表示,组间比较采用单因素方差分析。以P < 0.05表示差异有统计学意义。
2 结果 2.1 各组小鼠吸入不同浓度乙酰甲胆后的气道阻力与PBS组比较,LPS+OVA组小鼠在雾化期间出现呼吸急促和打喷嚏等表现,且各浓度下的Penh值均明显升高(P < 0.01);与LPS+OVA组比较,Res组和NAC组小鼠的哮喘症状明显改善,各浓度下的Penh值均明显降低(P < 0.05或P < 0.01)。见表 1。
| (n=6, x±s) | |||||
| Group | Penh value | ||||
| Methacholine(g·L-1) 0.00 | 6.25 | 12.50 | 25.00 | 50.00 | |
| PBS | 0.45±0.02 | 0.56±0.03 | 0.73±0.04 | 1.87±0.26 | 3.52±0.25 |
| LPS+OVA | 0.61±0.05* | 0.96±0.04** | 2.38±0.24** | 4.43±0.23** | 6.39±0.33** |
| Res | 0.55±0.03 | 0.78±0.02**△△ | 1.51±0.13*△ | 3.18±0.18*△ | 5.07±0.29*△ |
| NAC | 0.53±0.03 | 0.73±0.03**△△ | 1.21±0.09△△ | 2.74±0.15** | 4.69±0.23* |
| *P < 0.05, ** P < 0.01 compared with PBS group; △P < 0.05, △△P < 0.01 compared with LPS+OVA group. | |||||
与PBS组比较,LPS+OVA组BALF中细胞总数(total cells, TC)、中性粒细胞(neutrophil, NEU)数和嗜酸性粒细胞(eosnophils, EOS)均明显增加(P < 0.01)。与LPS+OVA组比较,Res组和NAC组BALF中TC、NEU和EOS明显减少(P < 0.05或P < 0.01)。各组小鼠BALF中炎症细胞均以中性粒细胞为主。见表 2。
| (n=6, x±s) | |||
| Group | Total number of cells (×104 mL-1) | Neutrophil (×103 mL-1) | Eosnophils (×103 mL-1) |
| PBS | 6.20±0.17 | 4.40±0.55 | 1.10±0.23 |
| LPS+OVA | 181.87±34.69** | 236.67±17.63** | 43.33±8.99** |
| Res | 63.67±11.98△ | 75.00±10.79*△△ | 13.33±2.60△ |
| NAC | 54.33±13.30△△ | 64.33±11.41*△△ | 10.67±2.61△△ |
| *P < 0.05, ** P < 0.01 compared with PBS group; △P < 0.05, △△P < 0.01 compared with LPS+OVA group. | |||
PBS组小鼠气道上皮细胞排列整齐,周围无或少量炎症细胞,肺泡壁结构完整,肺泡内无或存在少许炎症细胞;LPS+OVA组小鼠气道上皮明显增厚,气道周围存在大量聚集成团的炎症细胞,肺泡壁结构大量破坏,肺泡内存在大量炎症细胞浸润;Res组和NAC组小鼠气道上皮增厚较LPS+OVA组明显减弱,肺泡壁结构破坏明显减少,气道周围和肺泡内炎症细胞浸润明显减少。见图 1(插页一)。与PBS组比较,LPS+OVA组小鼠肺组织炎症评分明显升高(P < 0.01);与LPS+OVA组比较,Res组和NAC组小鼠肺组织炎症评分明显降低,但明显高于PBS组(P < 0.01)。各组小鼠肺组织炎症评分见表 3。
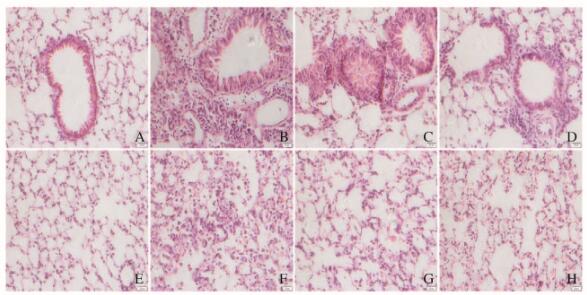
|
| A-D:Airway; E-H:Alveolus; A, E:PBS group; B, F:LPS+OVA group; C, G:Res group; D, H:NAC group. 图 1 各组小鼠肺组织形态及炎症表现(HE, ×200) Figure 1 Morphology of lung tissue and inflammation of mice in various groups(HE, ×200) |
|
|
| (n=6, x±s) | ||
| Group | Inflammation score (0-4) | IL-17 [ρB/(ng·L-1)] |
| PBS | 0.33±0.24 | 28.05±6.79 |
| LPS+OVA | 3.80±0.12** | 126.92±10.68** |
| Res | 2.53±0.18**△△ | 86.66±4.59**△ |
| NAC | 2.40±0.23**△△ | 71.29±4.77*△△ |
| *P < 0.05, ** P < 0.01 compared with PBS group; △P < 0.05, △△P < 0.01 compared with LPS+OVA group. | ||
与PBS组比较,LPS+OVA组小鼠BALF上清中IL-17水平明显升高(P < 0.01);与LPS+OVA组比较,Res组和NAC组BALF上清中IL-17水平明显降低,但高于PBS组(P < 0.05或P < 0.01)。见表 3。
2.5 各组小鼠肺组织中ROS水平与PBS组比较,LPS+OVA组小鼠气道及肺泡中ROS荧光强度明显增强;与LPS+OVA组比较,Res组和NAC组小鼠气道及肺泡中ROS荧光强度明显减弱。见图 2(插页一)。
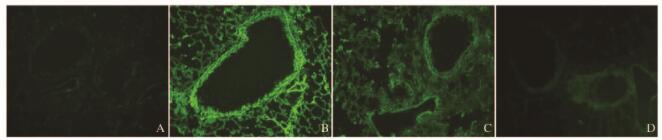
|
| 图 2 各组小鼠气道和肺泡中ROS水平(免疫荧光,×200) Figure 2 ROS levels of airway and alveolus of mice in various groups (Immunofluorescence, ×200) |
|
|
PBS组小鼠肺匀浆中MDA水平为(1.66±0.10)μmol·mg-1,LPS+OVA组小鼠肺匀浆中MDA水平为(3.90±0.23)μmol·g-1,与PBS组比较,LPS+OVA组肺匀浆中MDA水平明显升高(P < 0.01);与LPS+OVA组比较,Res组小鼠肺匀浆中MDA水平[2.77±0.07)μmol·g-1]和NAC组小鼠肺匀浆中MDA水平[(2.39±0.09)μmol·g-1]明显降低(P < 0.01),但较PBS组明显升高(P < 0.05或P < 0.01)。
3 讨论白藜芦醇主要来源于花生、红葡萄酒、虎杖和桑葚等植物。许多研究[12-13]已证实:白藜芦醇具有不同的生物学效应,其最主要的生物作用是抗氧化、抗炎、雌激素作用、抗癌以及癌症化学预防活性。在肿瘤、动脉粥样硬化和心脑血管疾病等方面白藜芦醇已得到广泛应用,目前也将其应用于呼吸系统疾病的研究。研究[14-15]表明:白藜芦醇对支气管哮喘具有治疗作用,其机制可能与抑制哮喘的炎症反应有关。本研究采用白藜芦醇干预中性粒细胞性哮喘具有一定的可行性。
本研究结果表明:白藜芦醇对中性粒细胞性哮喘小鼠肺组织损伤具有保护作用,主要表现:①降低小鼠AHR和BALF中的炎症细胞及上清中细胞因子;②减轻肺组织的炎症反应;③降低肺组织内氧化应激水平。本研究中小鼠肺组织HE染色显示:白藜芦醇可明显降低肺组织气道及肺泡炎症,改善气道壁增厚。同时,为了进一步探讨白藜芦醇对中性粒细胞性哮喘小鼠肺组织炎症的影响,本研究分析了小鼠气道炎症指标(AHR、炎症细胞计数和IL-17),其中IL-17为Th17细胞分泌的一种细胞因子,认为其为中性粒细胞浸润的一个触发者[16],因此测定IL-17的水平可以反映组织的炎症浸润程度。本研究结果显示:与LPS+OVA组比较,Res组小鼠AHR、炎症细胞和IL-17均明显降低,表明白藜芦醇可减轻中性粒细胞性哮喘小鼠肺组织的炎症反应。
ROS是外源性氧化剂或细胞内有氧代谢过程中产生的具有很高生物活性的含氧合物的总称,在调控细胞生物学行为中起到重要作用[17]。氧化应激是哮喘炎症发生发展的重要机制之一,ROS与多种细胞信号传导级联有关,是导致呼吸道炎症的重要介质[18]。多项研究[18-21]表明:吸入不同的变应原均可促进细胞内ROS的产生,在动物模型中过量的ROS产生还可引起AHR、组织损伤和重塑,因此抑制体内ROS反应具有重要意义。MDA是脂质过氧化产物,由多不饱和脂肪酸(PUFA)通过化学反应和酶催化反应产生,为硫代巴比妥酸反应物质(TBARS)的原型,常作为氧化应激的生物标记,即脂质过氧化[22]。白藜芦醇具有抗氧化作用,本文作者推测:白藜芦醇可以通过抗氧化作用抑制中性粒细胞性哮喘的炎症反应。ROS和MDA均可反应组织内氧化应激水平,本研究结果显示:与PBS组比较,LPS+OVA组小鼠肺内ROS和MDA表达水平升高,提示该组小鼠体内氧化应激反应强烈;与LPS+OVA组比较,Res组和NAC组小鼠肺内ROS和MDA水平明显降低,提示白藜芦醇可以通过抗氧化作用抑制小鼠体内氧化应激反应来发挥保护作用。
综上所述,白藜芦醇对中性粒细胞性哮喘小鼠肺组织的炎症反应具有抑制作用,其机制可能与抑制体内的氧化应激有关,但具体的作用通路还有待进一步研究。
| [1] | Douwes J, Gibson P, Pekkanen J, et al. Non-eosinophilic asthma importance and possible[J]. Thorax, 2002, 57(7): 643–648. DOI:10.1136/thorax.57.7.643 |
| [2] | Ordonez CL, Shaughnessy TE, Matthay MA, et al. Increased neutrophil numbers and IL-8 levels in airway secretions in acute severe asthma:Clinical and biologic significance[J]. Am J Respir Crit Care Med, 2000, 161(4 Pt 1): 1185–1190. |
| [3] | Ito K, Herbert C, Siegle JS, et al. Steroid-resistant neutrophilic inflammation in a mouse model of an acute exacerbation of asthma[J]. Am J Respir Cell Mol Biol, 2008, 39(5): 543–550. DOI:10.1165/rcmb.2008-0028OC |
| [4] | Soleas GJ, Diamandis EP, Goldberg DM. Resveratrol:a molecule whose time has come? And gone?[J]. Clin Biochem, 1997, 30(2): 91–113. DOI:10.1016/S0009-9120(96)00155-5 |
| [5] | Nakata R, Takahashi S, Inoue H. Recent advances in the study on resveratrol[J]. Biol Pharm Bull, 2012, 35(3): 273–279. DOI:10.1248/bpb.35.273 |
| [6] | Borriello A, Bencivenga D, Caldarelli I, et al. Resveratrol:from basic studies to bedside[J]. Cancer Treat Res, 2014, 159: 167–184. DOI:10.1007/978-3-642-38007-5 |
| [7] | Siedlinski M, Boer JM, Smit HA, et al. Dietary factors and lung function in the general population:wine and resveratrol intake[J]. Eur Respir J, 2012, 39(2): 385–391. DOI:10.1183/09031936.00184110 |
| [8] | Conte E, Fagone E, Fruciano M, et al. Anti-inflammatory and antifibrotic effects of resveratrol in the lung[J]. Histol Histopathol, 2015, 30(5): 523–529. |
| [9] | Wood LG, Wark PA, Garg ML. Antioxidant and anti-inflammatory effects of resveratrol in airway disease[J]. Antioxid Redox Signal, 2010, 13(10): 1535–1548. DOI:10.1089/ars.2009.3064 |
| [10] | Kim YS, Hong SW, Choi JP, et al. Vascular endothelial growth factor is a key mediator in the development of T cell priming and its polarization to type 1 and type 17 T helper cells in the airways[J]. J Immunol, 2009, 183(8): 5113–5120. DOI:10.4049/jimmunol.0901566 |
| [11] | Henderson WR, Tang LO, Chu SJ, et al. A role for cysteinyl leukotrienes in airway remodeling in a mouse asthma model[J]. Am J Respir Crit Care Med, 2002, 165(1): 108–116. DOI:10.1164/ajrccm.165.1.2105051 |
| [12] | Cui XF, Imaizumi T, Yoshida H, et al. Lipopolysaccharide induces the expression of cellular inhibitor of apoptosis protein-2 in human macrophages[J]. Biochim Biophys Acta, 2000, 1524(2/3): 178–182. |
| [13] | Ni ZH, Tang JH, Chen G, et al. Resveratrol inhibits mucus overproduction and MUC5AC expression in a murine model of asthma[J]. Mol Med Rep, 2016, 13(1): 287–294. DOI:10.3892/mmr.2015.4520 |
| [14] | Chen J, Zhou H, Wang J, et al. Therapeutic effects of resveratrol in a mouse model of HDM-induced allergic asthma[J]. Int Immunopharmacol, 2015, 25(1): 43–48. DOI:10.1016/j.intimp.2015.01.013 |
| [15] | Lee M, Kim S, Kwon OK, et al. Anti-inflammatory and anti-asthmatic effects of resveratrol, a polyphenolic stilbene, in a mouse model of allergic asthma[J]. Int Immunopharmacol, 2009, 9(4): 418–424. DOI:10.1016/j.intimp.2009.01.005 |
| [16] | Gupta RK, Gupta K, Dwivedi PD. Pathophysiology of IL-33 and IL-17 in allergic disorders[J]. Cytokine Growth Factor Rev, 2017, 38: 22–36. DOI:10.1016/j.cytogfr.2017.09.005 |
| [17] | 张静, 马翠丽, 王志国. 黄芪甲苷对大鼠心肌局部缺血再灌注损伤的改善作用及其对PI3K/Akt/mTOR信号通路的影响[J]. 吉林大学学报:医学版, 2014, 40(5): 991–996. |
| [18] | Qu J, Li Y, Zhong W, et al. Recent developments in the role of reactive oxygen species in allergic asthma[J]. J Thorac Dis, 2017, 9(1): E32–E43. DOI:10.21037/jtd |
| [19] | Yuan X, Wang E, Xiao X, et al. The role of IL-25 in the reduction of oxidative stress and the apoptosis of airway epithelial cells with specific immunotherapy in an asthma mouse model[J]. Am J Transl Res, 2017, 9(9): 4137–4148. |
| [20] | 殷俊, 谭雪梅, 张秀丽, 等. TCDD对大鼠睾丸间质细胞凋亡相关蛋白表达及ROS含量的影响[J]. 郑州大学学报:医学版, 2017, 52(5): 558–562. |
| [21] | 李莉, 古正涛, 何旋, 等. 异丙酚对热打击后内皮细胞线粒体氧化应激损伤的保护作用[J]. 解放军医学杂志, 2017, 42(6): 500–505. |
| [22] | Tsikas D. Assessment of lipid peroxidation by measuring malondialdehyde (MDA) and relatives in biological samples:Analytical and biological challenges[J]. Anal Biochem, 2017, 524: 13–30. DOI:10.1016/j.ab.2016.10.021 |
 2018, Vol. 44
2018, Vol. 44


