扩展功能
文章信息
- 孟琳, 王璐, 布文奂, 丁鑫鑫, 高华丽, 王梓霖, 刘玉兰, 李琛, 孙宏晨
- MENG Lin, WANG Lu, BU Wenhuan, DING Xinxin, GAO Huali, WANG Zilin, LIU Yulan, LI Chen, SUN Hongchen
- 小鼠骨髓间充质干细胞对人舌鳞状细胞癌Cal27细胞的归巢作用及其对Cal27细胞增殖和迁移的促进作用
- Homing effect of mouse bone marrow-derived mesenchymal stem cells on human tongue squamous cell carcinoma Cal27 cells and its promotion on proliferation and migration of Cal27 cells
- 吉林大学学报(医学版), 2018, 44(05): 891-896
- Journal of Jilin University (Medicine Edition), 2018, 44(05): 891-896
- 10.13481/j.1671-587x.20180501
-
文章历史
- 收稿日期: 2017-12-28
2. 吉林大学口腔医院病理科, 吉林 长春 130021;
3. 吉林大学口腔医院种植科, 吉林 长春 130021;
4. 吉林大学口腔医院儿童口腔科, 吉林 长春 130021;
5. 吉林大学口腔医院口腔黏膜病科, 吉林 长春 130021
2. Department of Oral Pathology, Stomatology Hospital, Jilin University, Changchun 130021, China;
3. Department of Dental Implantology, Stomatology Hospital, Jilin University, Changchun 130021, China;
4. Department of Pediatric Dentistry, Stomatology Hospital, Jilin University, Changchun 130021, China;
5. Department of Oral Mucosal Disease, Stomatology Hospital, Jilin University, Changchun 130021, China
口腔癌是最常见的头颈部恶性肿瘤, 以鳞状细胞癌为主, 每年约有50万新增病例, 尤其是舌鳞癌患者可并发有不同程度的局部复发及远处转移, 一般预后较差[1]。肿瘤的发生与遗传和表观遗传学有关,而近年来有研究[2]显示:肿瘤的发生发展也与肿瘤微环境(tumor microenvironment,TME)密切相关, 免疫细胞、微血管、基底膜、肿瘤相关成纤维细胞(carcinoma-associated fibroblasts, CAF)和细胞外基质围绕肿瘤细胞构成TME。骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,BMSCs)作为成人多能干细胞引起了研究者的兴趣,有文献[3]报道:BMSCs可以归巢到TME从而调节其稳态和免疫。然而近年来研究报道BMSCs对肿瘤的影响尚无定论,有文献[4-7]报道:BMSCs促进肿瘤发展,如促进乳腺癌增殖,通过Hedgehog信号通路促进骨肉瘤和胃癌增殖;BMSCs抑制肺癌和恶性胶质瘤发展。除此之外,对同一肿瘤BMSCs也会通过不同的通路产生截然相反的作用,例如BMSCs可以通过分泌IL-6促进肝细胞癌增殖[8],也通过MAPK通路抑制肝细胞癌增殖[9]。目前舌鳞状细胞癌与BMSCs的相互作用鲜有报道。本研究从小鼠骨髓中提取小鼠骨髓间充质干细胞(mBMSCs),并探讨舌鳞状细胞癌Cal27细胞和mBMSCs的关系,为阐明其作用机制奠定基础,为肿瘤治疗的发展提供新思路。
1 材料与方法 1.1 实验动物、细胞、主要试剂和仪器4~6周龄C57BL/6雄性小鼠,购自吉林大学动物实验中心,动物合格证号:SCXK(吉)2015-0003。人舌鳞癌细胞系Cal27和人正常口腔上皮细胞系Hacat(中国科学院细胞库)。H-DMEM培养基、α-MEM培养基、胎牛血清、青/链双抗和胰蛋白酶(美国Gibco公司),FITC标记抗小鼠/人CD11b、FITC标记抗小鼠/大鼠CD29、PE标记抗小鼠/人CD44、APC标记抗小鼠Ly-6A/E (Sca-1)和FITC标记抗小鼠CD45(美国Biolegend公司)。8.0 μm孔径Transwell共培养系统、24孔板,0.4 μm孔径Transwell共培养系统、6孔板(美国Costar公司),荧光倒置显微镜(日本Olympus公司),细胞培养箱(日本SANYO公司),流式细胞仪(美国BD Biosciences公司)。
1.2 细胞培养培养条件:37℃、5%CO2,饱和湿度。Cal27和Hacat细胞于H-DMEM(含10%胎牛血清、1%青霉素和链霉素双抗)常规培养。每隔3 d换液,并根据细胞的生长情况用0.25%胰蛋白酶消化传代。
1.3 mBMSCs分离和培养选取4~6周龄C57BL/6型雄性小鼠10只,体质量为15~20 g,采用脊髓脱臼法处死,70%酒精喷洒小鼠背部消毒,持止血钳从背部中央开始分离皮肤,直至露出后肢;取出双侧后肢,切下耻股关节和掌趾关节后,将股骨和胫骨放于70%酒精数秒后转至无菌PBS;在超净台内分离股骨和胫骨,尽可能将肌肉等软组织去净,尽快取出股骨和胫骨用25号针头将完全培养基冲出骨髓至100 mm培养皿,加入10 mL α-MEM(含10%胎牛血清、1%青霉素和链霉素双抗), 放于恒温孵箱培养5~7 d,每2 d换1次液,细胞长至80%融合时传代,传至P2代进行实验,获得mBMSCs,应用倒置相差显微镜和光学显微镜观察。
1.4 流式细胞术鉴定mBMSCs表面抗原将第2代mBMSCs消化后收获细胞, 用抗CD11b、CD29、CD44、Sca-1和CD45抗体室温反应30 min, PBS洗涤2次后悬于PBS中, 采用流式细胞术检测各抗体阳性率。
1.5 Transwell趋化实验条件培养基的获取:将Cal27和Hacat细胞以每孔2×105个细胞接种于6孔板,将培养24 h后的细胞培养液采用0.22 μm滤膜抽滤去除死细胞及细胞碎片后获得相应细胞的条件培养基。将mBMSCs消化,使用无血清培养基制成细胞悬液,每个小室中加入200 μL,使细胞数为5 000个。下室中加入600 μL的α-MEM完全培养基作为空白对照组,Cal27细胞实验组加入等量Cal27细胞的条件培养基,Hacat细胞对照组加入等量Hacat细胞条件培养基, 培养条件一致;24 h后去除上室培养基,PBS洗涤2次,4%多聚甲醛固定5 min,PBS洗涤2次,1%结晶紫染色15 min,PBS洗涤2次,用棉棒擦掉上室中的细胞,于荧光倒置显微镜下观察,随机选取5个清晰视野,拍照,计数每个视野下穿膜细胞数(个)。
1.6 舌鳞癌Cal27细胞与mBMSCs共培养Cal27细胞消化后以每孔3×105个细胞接种于6孔板内,24 h后待Cal27细胞贴壁后,放入0.4 μm规格的Transwell小室至上述6孔板中;上室加入消化后的mBMSCs细胞悬液200 μL,细胞密度为1×104个细胞/孔,放入孵箱培养24 h后进行实验,对照组为未共培养的Cal27细胞。
1.7 细胞增殖实验以未共培养的Cal27细胞为单纯Cal27细胞对照组,以上述共培养的Cal27细胞为实验组(共培养组)。将2组细胞消化后接种于24孔板,每孔2×104个细胞,每组设3个复孔,设时间点分别为1、2、3、4、5、6和7 d。每24 h消化一组时间点细胞进行细胞计数,每孔重复3次取平均值。绘制增殖曲线。
1.8 克隆形成实验以未共培养的Cal27细胞为单纯Cal27细胞对照组,以上述共培养的Cal27细胞为实验组(共培养组)。2组细胞消化后以每皿1 000个细胞的密度接种于60 mm的细胞培养皿中,摇匀。于孵箱中培养1~2周,共培养组每隔2~3 d补加200 μL mBMSCs条件培养基,单纯Cal27细胞对照组加等量PBS;当培养皿中出现肉眼可见的克隆时,终止培养,倒置显微镜照相,观察克隆形成是否达到标准(克隆细胞数>300个);弃上清液,PBS洗涤2次,4%多聚甲醛固定15 min,PBS洗涤2次,1%结晶紫染色15 min,洗去染色液,空气干燥,扫描。
1.9 Transwell迁移实验将单纯Cal27细胞对照组和共培养组细胞分别消化,使用无血清培养基制成细胞悬液,采用8 μm Transwell培养系统,每个小室中加入200 μL,使细胞数目为1×104个。下室中加入600 μL的10%FBS, 培养条件一致;24 h后去除上室培养基,PBS洗涤2次,4%多聚甲醛固定5 min,PBS洗涤2次,1%结晶紫染色15 min,PBS洗涤2次,用棉棒擦掉上室中的细胞,于荧光倒置显微镜下观察,随机选取5个清晰视野,拍照,计数每个视野下穿膜细胞数(个)。
1.10 统计学分析采用SPSS 19.0软件进行统计学分析。各组细胞中穿膜细胞数、细胞增殖数和细胞迁移数以x±s表示,各组样本均数间比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 mBMSCs的分离、培养及鉴定经反复贴壁法纯化后的mBMSCs传代培养至第2代,形态稳定,倒置显微镜观察:mBMSCs多数细胞呈短梭形,细胞质丰富,细胞核呈椭圆形或肾形,细胞突长短不一,细胞排列整齐(图 1)。采用流式细胞术检测培养第2代的mBMSCs细胞表型结果:mBMSCs特异性抗原高表达APC标记的Ly-6A/E (Sca-1)(87.62%),PE标记的CD44(77.84%),FITC标记的CD29(90.73%),造血系抗原低表达FITC标记的CD45(0.02%)和FITC标记的CD11b(0.04%)(图 2)。

|
| A:P0 mBMSCs; B:P1 mBMSCs; C:P2 mBMSCs. 图 1 光镜下mBMSCs的形态表现(×100) Figure 1 Morphology of mBMSCs under light microscope(×100) |
|
|

|
| A:Sca-1;B:CD44;C:CD29;D:CD45;E:CD11b. 图 2 流式细胞术检测mBMSCs的细胞表型 Figure 2 Phenotypes of mBMSCs detected by flow cytometry |
|
|
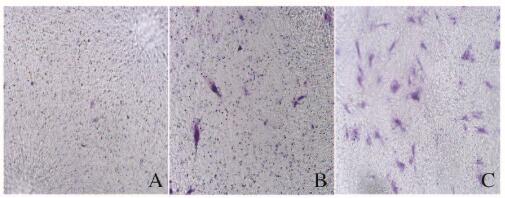
Transwell趋化实验:空白对照组趋化的mBMSCs细胞数稀少;Hacat细胞对照组Hacat细胞募集的mBMSCs细胞数较少;与空白对照组(1.60±0.51)及Hacat细胞对照组(11.80±1.56)比较,Ca127细胞实验组Cal27细胞募集的mBMSCs细胞数(59.00±2.78)明显增加(P < 0.01)(图 3,见插页一)。
|
| A: Blank control group; B: Hacat cell control group; C: Cal27 cell experiment group. 图 3 各组mBMSCs的募集(×100) Figure 3 Migration of mBMSCs in various groups(×100) |
|
|
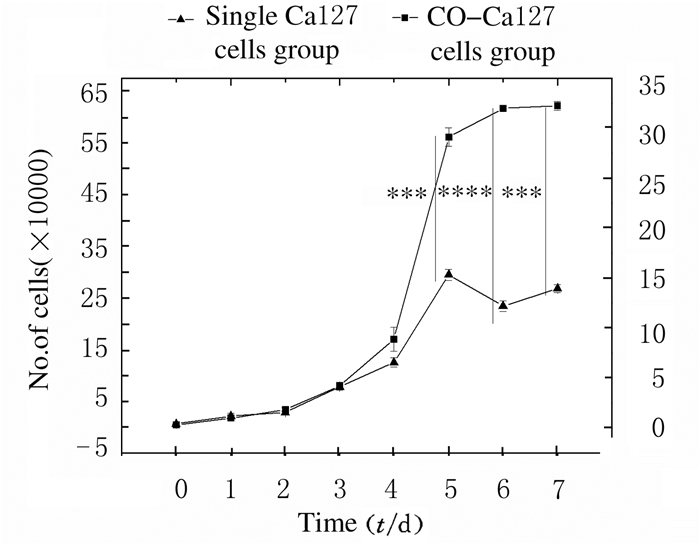
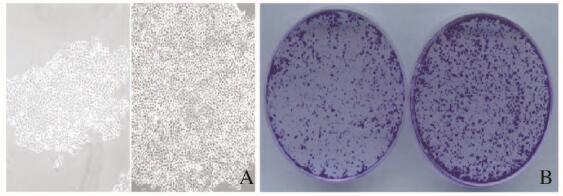
mBMSCs和Cal27细胞共培养后,与单纯Cal27细胞对照组比较,5、6和7d时共培养组细胞数明显升高(P<0.01)(图 4)。克隆形成实验:镜下克隆细胞数均大于300,为有效克隆群(图 5A,见插页一);共培养组co-Cal27细胞克隆数明显增多,且克隆细胞团较丰富(图 5B,见插页一),与单纯Cal27细胞对照组比较差异有统计学意义(P < 0.01)。见表 1。
|
| 图 4 Cal27细胞增殖情况 Figure 4 Proliferation of Cal27 cells |
|
|
|
| A: Colony formation (×100); B: Number of colony formation. 图 5 Cal27细胞克隆形成情况 Figure 5 Colony formation of Cal27 cells |
|
|
| (n=3, x±s) | |||||||||
| Group | Number of Cal27cells | ||||||||
| (t/d) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| Single Ca127 cell control | 3.17±0.14 | 10.83±2.75 | 14.33±1.23 | 39.00±1.89 | 62.67±4.37 | 114.00±30.25 | 133.75±33.61 | 134.17±3.82 | |
| Co-culture | 2.33±0.58 | 8.83±1.61 | 17.00±1.95 | 39.67±3.79 | 85.08±11.64 | 280.67±9.02* | 308.33±1.91* | 309.17±3.61* | |
| *P<0.01 compared with single Cal27 cell control group. | |||||||||
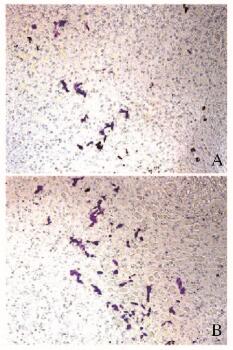
单纯Cal27对照组Cal27细胞迁移至小室下表面的数量为(29.00±2.24)个,共培养组Cal27细胞迁移到小室下表面的数量为(62.00±8.25)个,2组间比较差异有统计学意义(P < 0.01),表明co-Cal27细胞迁移能力明显增强。见图 6(插页一)。
|
| A: Single Cal27 cell group; B:Co-culture group. 图 6 各组Cal27细胞迁移能力(×100) Figure 6 Migration abilities of Cal27 cells in various groups (×100) |
|
|
口腔鳞癌尤其是舌鳞癌在临床上广泛可见,因其常发生复发和淋巴结转移而导致患者远期生存率降低,目前常规的治疗方法为手术切除,或合用放化疗法[10]。因此,探讨舌鳞癌的发展迁移过程变得非常重要,可为未来根治舌鳞癌提供思路。肿瘤的发展不仅与肿瘤实质细胞有关,还与肿瘤生存的环境,即TME有密切关联,而在TME中存在多种基质细胞成分,其中间质成分占有很大的比例,发挥了重要的作用,可以增强或抑制肿瘤的发生发展。本课题组前期研究[11]显示:舌鳞癌中存在丰富的CAFs,而且CAFs具有异质性,并已证实CAF部分来源于正常成纤维细胞(normal fibroblasts,NFs)。Wang等[12]研究发现:胃癌细胞通过miR-155-5p-NF-κB信号通路将BMSC转化为CAF。本文作者推测:舌鳞癌CAFs的另一来源可能是BMSCs。探讨BMSCs与舌鳞癌的相互作用及其机制可以寻找在这一过程中可能存在的抗肿瘤靶点,为未来抗肿瘤药物的靶向治疗奠定基础。
本研究采用全骨髓法获得mBMSCs,并采用反复贴壁法纯化将其至P2代(图 1),流式细胞术测定多个表面标记鉴定mBMSCs,即Sca-1、CD44、CD29、CD45和CD11b,证实为mBMSCs。归巢是指内源性的或外源性的细胞在多种因素的作用下穿过内皮细胞定向迁移至靶向组织血管并定植的过程[13], Xie等[14]分别在健康小鼠、肝细胞癌皮下荷瘤小鼠模型、肝细胞癌原位移植小鼠模型和肺转移癌小鼠模型中对比了尾静脉注射mBMSCs后其归巢情况,结果显示:mBMSCs明显快速归巢至TME,首先出现在微小癌细胞灶处。这一归巢过程需要包括趋化因子、生长因子和黏附因子等细胞因子的调控,如肝细胞癌通过CCL15与BMSCs上的受体CCR1结合后可促进BMSCs归巢至肿瘤微环境[15]。有研究[16-17]报道:癌细胞能够促进BMSC增殖并恶变。本研究中体外细胞趋化实验显示:mBMSCs同样对人舌鳞癌Cal27细胞存在较正常上皮Hacat细胞更明显的归巢行为,表明Cal27细胞促进mBMSCs的归巢。
BMSCs归巢至TME后对癌细胞产生的作用是两方面的[18-20]:一方面可以快速归巢至TME并具有多向分化潜能,可以作为一种新兴的细胞载体,如Lang等[21]等用BMSCs装载分泌miR-124a的外泌体治疗恶性神经胶质瘤取得良好的治疗效果;另一方面BMSCs若促进癌细胞发展,那么探讨其促癌机制以寻求一种有效的抗癌靶点,达到同时杀伤癌细胞和肿瘤基质细胞的共同治疗,如Camorani等[22]通过拮抗血小板源性生长因子受体β(PDGFR-β)而抑制BMSCs归巢至TME达到治疗乳腺癌的目的。本研究中将mBMSCs和舌鳞癌Cal27细胞共培养结果显示:共培养后Cal27细胞的增殖、迁移能力明显提高,说明mBMSCs促进舌鳞癌发展,因此可以将针对mBMSCs归巢中的主要细胞因子或促癌的主要机制作为抗癌药物的治疗靶点,抑制mBMSCs的归巢作用。
本研究的不足之处在于采用mBMSCs而未使用hBMSCs,这是由于本研究拟采用裸鼠移植瘤模型进行体内归巢实验,使用mBMSCs这种同种异源细胞能更好地模拟BMSCs在体内的循环,减少不同种属细胞间的排斥反应。有文献[23]报道:在前列腺癌中,小鼠和人的前列腺癌均分泌CXCL16作用于小鼠和人BMSCs的CXCR6,其实验结果是一致的;Chen等[24]曾采用小鼠巨噬细胞系RAW264.7与人肝癌细胞系共培养来探讨巨噬细胞与肝癌的关系。本课题组将在机制方面的研究中对于小鼠和人的BMSCs是否具有一致性进行更深入探讨。
综上所述,本研究成功分离并培养了mBMSCs,发现舌鳞癌促进mBMSCs归巢至TME并促进舌鳞癌增殖和浸润,与归巢作用可能相关的细胞因子和BMSCs促进舌鳞癌发展的具体机制是接下来研究的重点。
| [1] | 王丽萍, 郭雪琪, 闫勇勇, 等. miR-146a在口腔鳞癌组织及细胞中的表达及功能研究[J]. 口腔医学研究, 2017, 33(11): 1204–1208. |
| [2] | Kalluri R. The biology and function of fibroblasts in cancer[J]. Nat Rev Cancer, 2016, 16(9): 582–598. DOI:10.1038/nrc.2016.73 |
| [3] | Melzer C, Yang Y, Hass R. Interaction of MSC with tumor cells[J]. Cell Commun Signal, 2016, 14(1): 20. DOI:10.1186/s12964-016-0143-0 |
| [4] | Wang Y, Shao S, Luo M, et al. Effects of rat bone marrow-derived mesenchymal stem cells on breast cancer cells with differing hormone receptor status[J]. Oncol Lett, 2017, 14(6): 7269–7275. |
| [5] | Qi J, Zhou Y, Jiao Z, et al. Exosomes derived from human bone marrow mesenchymal stem cells promote tumor growth through hedgehog signaling pathway[J]. Cell Physiol Biochem, 2017, 42(6): 2242–2245. DOI:10.1159/000479998 |
| [6] | Liu T, Zhu K, Ke C, et al. Mesenchymal stem cells inhibited development of lung cancer induced by chemical carcinogens in a rat model[J]. Am J Transl Res, 2017, 9(6): 2891–2900. |
| [7] | Pacioni S, D'Alessandris QG, Giannetti S, et al. Human mesenchymal stromal cells inhibit tumor growth in orthotopic glioblastoma xenografts[J]. Stem Cell Res Ther, 2017, 8(1): 53. DOI:10.1186/s13287-017-0516-3 |
| [8] | Mi F, Gong L. Secretion of interleukin-6 by bone marrow mesenchymal stem cellspromotes metastasis in hepatocellular carcinoma[J]. Biosci Rep, 2017, 37(4): BSR20170181. DOI:10.1042/bsr20170181 |
| [9] | Wang H, Wang J, Shi X, et al. Genetically engineered bone marrow-derived mesenchymal stem cells co-expressing IFN-γ and IL-10 inhibit hepatocellular carcinoma by modulating MAPK pathway[J]. J Buon, 2017, 22(6): 1517–1524. |
| [10] | Liu C, Feng X, Wang B, et al. Bone marrow mesenchymal stem cells promote head and neck cancer progression through Periostin-mediated phosphoinositide 3-kinase/Akt/mammalian target of rapamycin[J]. Cancer Sci, 2018, 109(3): 688–698. DOI:10.1111/cas.2018.109.issue-3 |
| [11] | 孟琳, 王丹丹, 布文奂, 等. 口腔鳞癌对牙龈成纤维细胞转化为肿瘤相关成纤维细胞的影响[J]. 口腔生物医学, 2017, 8(3): 136–140. |
| [12] | Wang M, Yang F, Qiu R, et al. The role of mmu-miR-155-5p-NF-κB signaling in the education of bone marrow-derived mesenchymal stem cells by gastric cancer cells[J]. Cancer Med, 2018, 7(3): 856–868. DOI:10.1002/cam4.2018.7.issue-3 |
| [13] | 肖飞, 焦竞, 黄玉成, 等. CD44分子的体外岩藻糖基化修饰对兔骨髓间充质干细胞归巢能力的影响[J]. 实用骨科杂志, 2018, 24(2): 143–147. |
| [14] | Xie C, Yang Z, Suo Y, et al. Systemically infused mesenchymal stem cells show different homing profiles in healthy and tumor mouse models[J]. Stem Cells Transl Med, 2017, 6(4): 1120–1131. DOI:10.1002/sct3.2017.6.issue-4 |
| [15] | Gao Y, Zhou Z, Lu S, et al. Chemokine CCL15 Mediates migration of human bone marrow-derived mesenchymal stem cells toward hepatocellular carcinoma[J]. Stem Cells, 2016, 34(4): 1112–1122. DOI:10.1002/stem.v34.4 |
| [16] | Zhang YM, Zhang ZM, Guan QL, et al. Co-culture with lung cancer A549 cells promotes the proliferation and migration of mesenchymal stem cells derived from bone marrow[J]. Exp Ther Med, 2017, 14(4): 2983–2991. DOI:10.3892/etm.2017.4909 |
| [17] | Zhao Y, Chen J, Dai X, et al. Human glioma stem-like cells induce malignant transformation of bone marrow mesenchymal stem cells by activating TERT expression[J]. Oncotarget, 2017, 8(61): 104418–104429. |
| [18] | Lee HY, Hong IS. Double-edged sword of mesenchymal stem cells:Cancer-promoting versus therapeutic potential[J]. Cancer Sci, 2018, 108(10): 1939–1946. |
| [19] | 闫淑芳, 吴敬, 刘宏霞, 等. PDX-1联合利拉鲁肽诱导大鼠骨髓间充质干细胞分化为胰岛样细胞的效果[J]. 郑州大学学报:医学版, 2016, 51(2): 161–166. |
| [20] | 姚素艳, 赵刚, 刘建生, 等. 沉默HLA A2表达的骨髓间充质干细胞安全性的研究[J]. 西安交通大学学报:医学版, 2016, 37(4): 489–492, 530. |
| [21] | Lang FM, Hossain A, Gumin J, et al. Mesenchymal stem cells as natural bio-factories for exosomes carrying miR-124a in the treatment of gliomas[J]. Neuro Oncol, 2017, 20(3): 380–390. |
| [22] | Camorani S, Hill BS, Fontanella R, et al. Inhibition of bone marrow-derived mesenchymal stem cells homing towards triple-negative breast cancer microenvironment using an Anti-PDGFRβ aptamer[J]. Theranostics, 2017, 7(14): 3595–3607. DOI:10.7150/thno.18974 |
| [23] | Jung Y, Kim JK, Shiozawa Y, et al. Recruitment of mesenchymal stem cells into prostate tumours promotes metastasis[J]. Nat Commun, 2013, 4: 1795. DOI:10.1038/ncomms2766 |
| [24] | Chen M, Zhang J, Hu F, et al. Metformin affects the features of a human hepatocellular cell line (HepG2) by regulating macrophage polarization in a co-culture microenviroment[J]. Diabet Metab Res Rev, 2016, 31(8): 781–789. |
 2018, Vol. 44
2018, Vol. 44


