扩展功能
文章信息
- 赵振理, 畅继武, 孙光, 胡少华
- ZHAO Zhenli, CHANG Jiwu, SUN Guang, HU Shaohua
- AAX14401蛋白在人膀胱癌组织中的表达及其意义
- Expression of AAX14401 in human bladder cancer tissue and its significance
- 吉林大学学报(医学版), 2018, 44(05): 1052-1055
- Journal of Jilin University (Medicine Edition), 2018, 44(05): 1052-1055
- 10.13481/j.1671-587x.20180530
-
文章历史
- 收稿日期: 2017-12-06
2. 天津市泌尿外科研究所肿瘤免疫研究所, 天津 300202
2. Department of Tumor Immunity, Tianjin Institute of Urinary Surgery, Tianjin 300202, China
膀胱癌是泌尿系统最常见的恶性肿瘤之一,具体发病机制尚不明确,基因水平的研究提示膀胱癌的发生发展可能与基因的异常表达有关。研究者从基因水平对膀胱癌进行研究,在膀胱癌组织中发现谷胱甘肽S转移酶P1(glutathione S-transferase pi-1, GSTP1)的一个特异性突变体。GSTP1属于谷胱甘肽S-转移酶(GSTs)基因家族中的一种,在膀胱癌中有较高水平的表达,而在美国国立生物技术信息中心(NCBI)的基因库中尚未发现有该突变体,因此本文作者将其提交至NCBI获取基因号:AY887902,蛋白号:AAX14401,并进一步制备AAX14401抗体Anti-AY[1-2]。为了进一步对AAX14401蛋白在膀胱癌中的作用进行研究,本研究对AAX14401蛋白在膀胱癌组织中的表达情况进行分析,阐明该突变体在膀胱癌发生发展过程中的作用,为膀胱癌患者早期积极干预提供依据。
1 资料与方法 1.1 标本来源收集2004—2005年天津医科大学第二医院泌尿外科术后存档蜡块中膀胱移行细胞癌标本75例。其中男性55例,女性20例;年龄43~79岁,中位年龄63.3岁。所有患者均有详细的临床资料,且术前均未进行化疗或放疗,术后有明确的病理学诊断结果。采用世界卫生组织(WHO)病理分级标准进行分级:Ⅰ级11例,Ⅱ级48例,Ⅲ级16例。选取标本时,从12例因良性前列腺增生(BPH)行开放手术的患者中取正常膀胱黏膜作为对照组。本研究经本院伦理委员会批准,且所有实验研究均有患者知情同意授权。
1.2 主要试剂GSTP1(一抗)、免疫组织化学试剂盒(SP)和DAB显色试剂盒购自上海长岛生物公司,Anti-AY(一抗)由上海午立公司协助制备。
1.3 实验过程和染色结果判定标准切取厚度约4 μm的石蜡包埋组织切片,常规脱蜡、水化、灭活内源性酶活性,热抗原修复后,按照免疫组织化学试剂盒说明进行操作,DAB显色,苏木素复染,脱水,透明剂封片。GSTP1阳性染色为胞质着色,呈浅黄至棕黄色颗粒,根据胞质的染色程度分为:细胞质未染色(-),细胞质呈浅黄色(+),细胞质呈棕黄色(╫)。AAX14401蛋白阳性染色为胞质和胞核着色,呈浅黄至棕黄色颗粒。根据胞质的染色程度分为:胞质和胞核不着色(-),胞质和胞核呈浅黄色(+),胞质和胞核呈棕黄色(╫)。所有阅片均由病理科2位主任医师独立完成。
1.4 统计学分析应用SPSS 13.0统计软件对数据进行统计学分析。GSTP1和AAX14401蛋白在正常膀胱组织和膀胱癌组织中阳性表达率以及在膀胱癌不同分级间阳性表达率的比较均采用秩和检验;GSTP1和AAX14401蛋白在膀胱癌组织中表达情况的相关性采用Spearman等级相关分析。以P<0.05为差异有统计学意义。
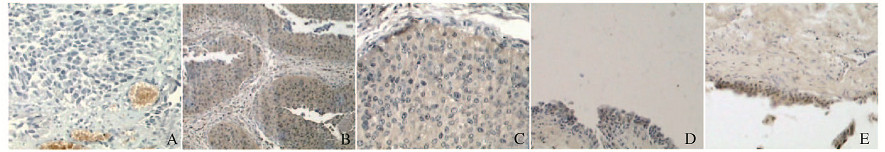
2 结果 2.1 不同组织中GSTP1免疫组织化学染色膀胱癌组织GSTP1染色结果呈阴性、染色程度“+”和“╫”者可见胞质染成棕黄色(图 1A~C,见插页五);正常膀胱组织GSTP1染色呈阴性、染色程度“+”者可见胞质染成浅黄色(图 1D和E,见插页五)。
|
| A-C:Bladder carcinoma tissue[negative, positive(+), positive(╫)]; D, E:Normal bladder tissue[negative, positive(+)]. 图 1 GSTP1在正常膀胱组织和膀胱癌组织中的表达(免疫组织化学,×400) Figure 1 Expressions of GSTP1 in normal bladder tissueand bladder cancer tissue(Immunohistochemistry, ×400) |
|
|
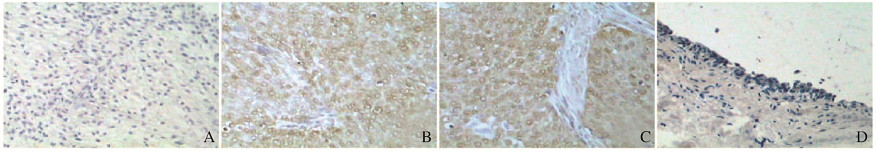
膀胱癌组织AAX14401蛋白染色结果呈阴性、染色程度“+”和“╫”者可见胞质和胞核均有棕黄色着色(图 2A~C,见插页五);正常膀胱组织AAX14401蛋白染色结果均呈阴性(图 2D,见插页五)。
|
| A-C:Bladder carcinoma [negative, positive(+), positive(╫)]; D:Normal bladder tissue. 图 2 AAX14401蛋白在正常膀胱组织和膀胱癌组织中的表达(免疫组织化学,×400) Figure 2 Expressions of AAX14401 in normal bladder tissueand bladder carcinoma tissue(Immunohistochemistry, ×400) |
|
|
在膀胱癌组织中,GSTP1和AAX14401蛋白并无同为阳性表达者。膀胱癌组织中,GSTP1蛋白阳性表达率为90.7%,而AAX14401蛋白阳性表达率为2.7%。见表 1。
| Expression of GSTP1 | Expression of AAX14401 | Total | ||
| - | + | ╫ | ||
| - | 5 | 1 | 1 | 7 |
| + | 16 | 0 | 0 | 16 |
| ╫ | 52 | 0 | 0 | 52 |
| Total | 73 | 1 | 1 | 75 |
GSTP1在正常膀胱组织中阳性表达率为58.3%(7/12),而AAX14401蛋白在正常膀胱组织中均未表达。
2.5 膀胱癌组织和正常膀胱组织中GSTP1和AAX14401蛋白表达情况秩和检验结果显示:GSTP1在膀胱癌组织和正常膀胱组织中阳性表达率比较差异有统计学意义(P<0.01),其在低级别(病理分级为Ⅰ和Ⅱ级)膀胱癌组织中表达水平和病理分级呈正相关关系(r=0.735, P<0.01),但其在Ⅲ级膀胱癌组织中表达水平下降,推测可能是GSTP1出现了失活或突变。AAX14401蛋白在膀胱癌组织和正常膀胱组织中阳性表达率比较差异无统计学意义(P=0.596)。
2.6 膀胱癌组织中GSTP1和AAX14401蛋白表达的相关性Spearman相关性分析结果显示:GSTP1和AAX14401蛋白在膀胱癌组织中的表达呈负相关关系(r=-0.274,P=0.018)。
3 讨论膀胱癌作为泌尿系统最常见的恶性肿瘤之一,其发病率和死亡率在世界范围内逐年升高[3],但具体发病机制目前仍不清楚。随着基因测序技术的发展,学者开始从基因水平对膀胱癌进行研究。为了从基因水平对膀胱癌进行研究,本课题组前期通过对正常膀胱组织与膀胱移行细胞癌组织进行抑制消减杂交文库的构建,获取了一条特异性的表达序列标签(EST)片段。对该EST片段进行全长扩增及生物信息学分析,提交至NCBI获取基因号(AY887902)和蛋白号(AAX14401),进一步分析发现AY887902是GSTP1的突变体[2]。
GSTP1属于GSTs基因家族中的一种,主要在人类组织中表达。GSTs的表达水平与肿瘤的耐药性有密切关系,作为在肿瘤细胞中最常见表达的GSTP1,可见于大多数的耐药细胞中。相关研究[4-5]证实:GSTP1的表达异常升高会使肿瘤对顺铂等治疗药物有较强的解毒能力,从而表现出对药物的耐受性。
GSTP1在膀胱癌、肺癌、卵巢癌、结直肠癌和乳腺癌等组织中阳性表达率明显高于相应的正常组织,并且肿瘤恶性程度越高,GSTP1表达水平越强[6-10]。有学者通过研究GSTP1在膀胱癌中的表达情况,发现GSTP1在膀胱癌中有较高水平的表达,并且其表达水平随着膀胱癌病理分级的升高而增强,提示GSTP1可能与癌细胞的凋亡机制相关[11-14]。本研究对不同病理分级的膀胱癌组织GSTP1表达情况进行对比分析,结果显示:GSTP1在低级别(病理分级为Ⅰ和Ⅱ级)膀胱癌组织中表达水平与病理分级呈正相关关系,在Ⅲ级膀胱癌组织中表达水平下降,这与Pljesa-Ercegovac等[14]的研究结果有所差异。但本实验结果与临床实践相吻合,即肿瘤恶性度越高,对化疗药物的敏感性越强[15-16]。
Gao等[17]研究发现:GSTP1可以抑制膀胱癌细胞的增殖,提示GSTP1可能是一种抑癌基因。本研究对正常膀胱组织和膀胱癌组织GSTP1和AAX14401蛋白的免疫组织化学染色结果显示:GSTP1基因出现突变,并形成AY887902;而AY887902是失功能的突变体,并且仅存在于膀胱癌组织中。因此本文作者推测GSTP1突变失活后导致了膀胱癌的恶化。Berendsen等[18]对膀胱癌组织、癌旁正常组织和正常膀胱组织中GSTP1蛋白表达情况进行分析结果显示:膀胱癌的发生可能与GST/GSH系统的活性较低有关。因此本文作者认为:本实验中病理分级Ⅲ级的膀胱癌组织中GSTP1蛋白表达水平较低,可能与GSTP1的失活或突变有关。
综上所述,AAX14401蛋白的出现可能是膀胱癌恶化的一个标志,因此提示如果能够早期在膀胱癌组织中发现AAX14401蛋白,则可以对膀胱癌患者采取更加积极的治疗措施。
| [1] | 赵振理, 畅继武, 孙光. AY887902全长扩增及其生物信息学研究[J]. 中国药物与临床, 2014, 14(1): 5–8. |
| [2] | 胡少华, 赵振理, 孙光, 等. 蛋白AAX14401相应抗体的制备及鉴定[J]. 临床医药实践, 2015, 24(9): 683–685. |
| [3] | Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide:sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359–386. DOI:10.1002/ijc.29210 |
| [4] | Yang SJ, Wang DD, Li J, et al. Predictive role of GSTP1-containing exosomes in chemotherapy-resistant breast cancer[J]. Gene, 2017, 623: 5–14. |
| [5] | Sawers L, Ferguson MJ, Ihrig BR, et al. Glutathione S-transferase P1(GSTP1) directly influences platinum drug chemosensitivity in ovarian tumour cell lines[J]. Br J Cancer, 2014, 111(6): 1150–1158. DOI:10.1038/bjc.2014.386 |
| [6] | Fang C, Wei XM, Zeng XT, et al. Aberrant GSTP1 promoter methylation is associated with increased risk and advanced stage of breast cancer:a meta-analysis of 19 case-control studies[J]. BMC Cancer, 2015, 15: 920. DOI:10.1186/s12885-015-1926-1 |
| [7] | Gu JD, Hua F, Mei CR, et al. HapMap-based study on the association between MPO and GSTP1 gene polymorphisms and lung cancer susceptibility in Chinese Han population[J]. Acta Pharmacol Sin, 2014, 35(5): 636–644. DOI:10.1038/aps.2014.11 |
| [8] | Kumamoto K, Ishibashi K, Okada N, et al. Polymorphisms of GSTP1, ERCC2 and TS-3'UTR are associated with the clinical outcome of mFOLFOX6 in colorectal cancer patients[J]. Oncol Lett, 2013, 6(3): 648–654. DOI:10.3892/ol.2013.1467 |
| [9] | Zhang J, Grek C, Ye ZW, et al. Pleiotropic functions of glutathione S-transferase P[J]. Adv Cancer Res, 2014, 122: 143–175. DOI:10.1016/B978-0-12-420117-0.00004-9 |
| [10] | Djukic T, Simic T, Pljesa-Ercegovac M, et al. Upregulated glutathione transferase omega-1 correlates with progression of urinary bladder carcinoma[J]. Redox Rep, 2017, 22(6): 486–492. DOI:10.1080/13510002.2017.1299909 |
| [11] | 唐荣金, 何小龙, 朱海琴, 等. GSTP1表达下调促进膀胱癌细胞T24凋亡[J]. 安徽医科大学学报, 2017, 52(10): 1463–1467. |
| [12] | Uchida Y, Chiyomaru T, Enokida H, et al. MiR-133a induces apoptosis through direct regulation of GSTP1 in bladder cancer cell lines[J]. Urol Oncol, 2013, 31(1): 115–123. DOI:10.1016/j.urolonc.2010.09.017 |
| [13] | Wang Z, Xue L, Chong T, et al. Quantitative assessment of the association between glutathione S-transferase P1 Ile105Val polymorphism and bladder cancer risk[J]. Tumour Biol, 2013, 34(3): 1651–1657. DOI:10.1007/s13277-013-0698-y |
| [14] | Pljesa-Ercegovac M, Savic-Radojevic A, Dragicevic D, et al. Enhanced GSTP1 expression in transitional cell carcinoma of urinary bladder is associated with altered apoptotic pathways[J]. Urol Oncol, 2011, 29(1): 70–77. DOI:10.1016/j.urolonc.2008.10.019 |
| [15] | Wang CS, Wei SJ, Zhao GG. Correlation of sensitivity of chemotherapy drugs with the originated tissue, clinical stage and pathological type of carcinoma[J]. Sect Clin Biochem Lab Med Foreign Med Sci, 2005, 26(4): 209–212. |
| [16] | 夏冰, 陈晓东, 刘大志, 等. 乳腺癌化疗药物的体外敏感性与临床病理的关系[J]. 肿瘤研究与临床, 2008, 20(11): 745–748. DOI:10.3760/cma.j.issn.1006-9801.2008.11.009 |
| [17] | Gao L, Fang YQ, Zhang TY, et al. GSTP1 arrests bladder cancer T24 cells in G0/G1 phase and up-regulates p21 expression[J]. Int J Clin Exp Med, 2014, 7(9): 2984–2991. |
| [18] | Berendsen CL, Peters WH, Scheffer PG, et al. Glutathione S-transferase activity and subunit composition in transitional cell cancer and mucosa of the human bladder[J]. Urology, 1997, 49(4): 644–651. DOI:10.1016/S0090-4295(96)00575-4 |
 2018, Vol. 44
2018, Vol. 44


