扩展功能
文章信息
- 李红霞, 宫海叶, 曾萧, 张素素, 刘伯锋
- LI Hongxia, GONG Haiye, ZENG Xiao, ZHANG Susu, LIU Bofeng
- TGF-β1和PLGF在不同类型妊娠滋养细胞疾病患者病变组织中的表达及其意义
- Expressions of TGF-β1 and PLGF in tissue of patients with different types of gestational trophoblastic diseases and their significances
- 吉林大学学报(医学版), 2018, 44(05): 1041-1046
- Journal of Jilin University (Medicine Edition), 2018, 44(05): 1041-1046
- 10.13481/j.1671-587x.20180528
-
文章历史
- 收稿日期: 2017-11-09
2. 江西省新余市妇幼保健院妇科, 江西 新余 338025;
3. 延安大学医学院解剖教研室, 陕西 延安 716000
2. Department of Gynecology, Xinyu Maternal and Child Health Hospital, Jangxi Province, Xinyu 338025, China;
3. Department of Anatomy, College of Medical Sciences, Yan'an University, Yan'an 716000, China
妊娠滋养细胞疾病(gestational trophoblastic disease, GTD)包括葡萄胎(hydatidiform mole, HM)、侵蚀性葡萄胎(invasive mole, IM)、绒毛膜癌(简称绒癌, choriocarcinoma, CC)和胎盘部位滋养细胞肿瘤(placental site trophoblastic tumor, PSTT),其中后三者又统称为妊娠滋养细胞肿瘤(gestational trophoblastic neoplasia, GTN),主要是由滋养细胞过度侵袭所致。细胞的过度侵袭涉及多种因子,许多癌基因、原癌基因、细胞因子、生长因子和黏附分子等均在此过程中发挥作用。妊娠滋养细胞疾病严重影响育龄期妇女的健康,甚至威胁生命。转化生长因子β1(transformation growth factor β1, TGF-β1)和胎盘生长因子(placental growth factor, PLGF)参与妊娠期高血压疾病、宫颈癌和子宫内膜异位症等多种妇产科疾病的发生发展,但关于上述2种因子在妊娠滋养细胞疾病中的研究报道较少见。本研究采用免疫组织化学法检测TGF-β1和PLGF在正常早孕妊娠绒毛组织、葡萄胎组织和妊娠滋养细胞肿瘤组织中的表达情况,研究TGF-β1和PLGF在不同类型妊娠滋养细胞疾病中的意义,为妊娠滋养细胞疾病早期发现、诊断和预后判断提供参考指标。
1 资料与方法 1.1 标本来源收集2009—2016年延安大学附属医院收治的妊娠滋养细胞疾病患者共185例。纳入标准:①无反馈炎性疾病、异常妊娠史和肿瘤病史等;②组织标本均为手术病理标本(清宫和子宫切除术);③术前均未行免疫治疗或放化疗;④均经临床和组织病理学证实;⑤均经2位副主任医师以上病理科医师复核。妊娠滋养细胞肿瘤26例,设为GTN组(22例侵蚀性葡萄胎和4例绒癌),年龄19~50岁,平均年龄(28.88±6.24)岁;采用单纯随机数字法选取40例葡萄胎设为葡萄胎组,年龄20~49岁,平均年龄(28.23±6.52)岁;所有入选者均有完整的临床资料及术后病理石蜡标本。收集同期因计划外怀孕要求终止妊娠的正常早孕患者的绒毛组织标本40例作为正常对照组。
1.2 主要试剂和仪器兔抗人TGF-β1多克隆抗体原液(BA0290)、SV0002检测试剂盒和显色剂DAB(AR1022)均购于武汉博士德生物技术有限公司,兔抗人PLGF多克隆抗体原液(bs-0280R)购于北京博奥森生物技术有限公司。所有实验仪器及设备均来自延安大学附属医院病理科。
1.3 免疫组织化学染色和结果判定将入选的妊娠滋养细胞疾病患者的石蜡标本重新制备5μm切片,行免疫组织化学SV0002法染色,严格按照试剂盒说明书操作。以PBS替代一抗作为阴性对照,采用已知阳性切片作为阳性对照。采用双盲法观测,以细胞膜或细胞浆内出现均匀淡黄色、棕黄色或褐色颗粒为阳性染色,根据细胞膜或细胞浆有无显色或显色强弱,结合半定量分级评分方法判定结果。按染色强度计分,计分1、2和3分别代表呈淡黄色、棕黄色和黄褐色。镜下选择10个高倍视野下100个细胞,计算阳性百分率并取平均值,计分0、1、2、3和4分分别代表阳性细胞数≤10%、11%~25%、26%~50%、51%~75%和≥76%。2种计分的乘积即为阳性强度,0~2分为阴性(-),3~5分为弱阳性(+),6~8分为中度阳性(
采用SPSS 20.0统计软件进行统计学分析。各组研究对象年龄和孕周等一般资料以x±s表示,多组间样本均数比较采用单因素方差分析。各组中TGF-β1和PLGF的阳性表达率比较及不同临床参数妊娠滋养细胞疾病患者中阳性表达率分析采用χ2检验;葡萄胎组和GTN组中TGF-β1与PLGF阳性表达水平相关性分析采用Spearman相关分析。以P<0.05为差异有统计学意义。
2 结果 2.1 各组研究对象一般资料各组患者年龄和孕周等一般资料比较差异均无统计学意义(P>0.05),具有可比性。见表 1。
| (x±s) | |||
| Group | n | Age(year) | Gestational age(week) |
| Normal control | 40 | 29.80±7.01 | 8.76±1.05 |
| Hydatidiform mole | 40 | 28.23±6.52 | 8.74±1.13 |
| GTN | 26 | 28.88±6.24 | 8.78±1.19 |
| F | 0.500 | 0.521 | |
| P | 0.969 | 0.982 | |
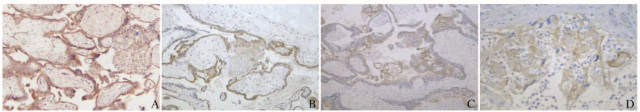
TGF-β1在正常绒毛组织、葡萄胎和GTN组织中阳性表达于细胞滋养细胞和合体滋养细胞的细胞膜和细胞浆中(图 1,见插页五)。正常对照组TGF-β1阳性表达率为87.5%,高于葡萄胎组(62.5%)和GTN组(30.8%),差异有统计学意义(χ2=6.667,P=0.01;χ2=22.337,P<0.01);葡萄胎组TGF-β1阳性表达率高于GTN组(χ2=6.346,P=0.012)。见表 2。
|
| A:Normal villus tissue; B:Hydatidiform mole tissue; C:Invasive tissue; D:Choriocarcinoma tissue. 图 1 TGF-β1在正常绒毛组织、葡萄胎组织和GTN组织中的表达(免疫组织化学,×200) Figure 1 Expressions of TGF-β1 in normal villus tissue, hydatidiform mole tissue, and GTN tissue(Immunohistochemistry, ×200) |
|
|
| Risk factor | n | TGF-β1 | χ2 | P | PLGF | χ2 | P | ||
| Positive number | Positive rate(η/%) | Positive number | Positive rate(η/%) | ||||||
| Age(year) | |||||||||
| ≤40 >40 |
28 12 |
21 4 |
75.0 33.3 |
6.067* | 0.014* | 11 9 |
39.3 75.0 |
4.286 | 0.038 |
| HCG(U·L-1) | |||||||||
| ≤105 >105 |
16 24 |
12 13 |
75.0 54.2 |
1.778 | 0.182 | 5 15 |
31.3 62.5 |
3.750 | 0.053 |
| Uterine volume | |||||||||
| ≤ Gestational week >Gestational week |
15 25 |
13 12 |
86.7 48.0 |
5.980 | 0.014 | 4 16 |
26.7 64.0 |
5.227 | 0.022 |
| Ovary cyst(cm) | |||||||||
| ≤6 >6 |
26 14 |
20 5 |
76.9 35.7 |
6.593 | 0.010 | 10 10 |
38.5 71.4 |
3.956 | 0.047 |
| Repetitive hydatidiform mole | 2 | 0 | 0 | 1 | 50.0 | ||||
| No Yes |
38 2 |
25 0 |
65.8 0.0 |
3.421* | 0.064* | 19 1 |
47.4 50.0 |
0.000* | 1.000* |
| * Fisher’s exact probability method. | |||||||||
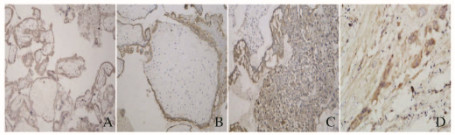
PLGF在正常绒毛组织、葡萄胎和GTN组织中阳性表达于细胞滋养细胞和合体滋养细胞的细胞膜与细胞质内(图 2,见插页五)。正常对照组PLGF阳性表达率为22.5%,低于葡萄胎组(50.0%)和GTN组(80.8%),组间比较差异均有统计学意义(χ2=6.545,P=0.011;χ2=21.579,P=0.01);葡萄胎组PLGF阳性表达率低于GTN组(χ2=6.340,P=0.012)。见表 2。
|
| A:Normal villus tissue; B:Hydatidiform mole tissue; C:Invasive tissue; D:Choriocarcinoma tissue. 图 2 PLGF在正常绒毛组织、葡萄胎组织和GTN组织中的表达(免疫组织化学,×200) Figure 2 Expressions of PLGF in normal vills, hydatidiform mole tissue, and GTN tissue(Immunohistochemistry, ×200) |
|
|
并发高危因素(年龄>40岁、子宫体积>孕周和卵巢黄素化囊肿直径>6 cm)的葡萄胎患者TGF-β1阳性表达率低于无上述高危因素患者(P<0.05),而PLGF阳性表达率高于无上述高危因素患者(P<0.05);人绒毛膜促性腺激素(hCG)>1×105 U·L-1和hCG<1×105 U·L-1患者TGF-β1和PLGF阳性表达率比较差异均无统计学意义(P>0.05)。重复性葡萄胎和无重复性葡萄胎患者TGF-β1和PLGF阳性表达率比较差异均无统计学意义(P>0.05)。见表 2。
2.5 TGF-β1和PLGF阳性表达率与GTN高危因素的关系按FIGO 2000滋养细胞肿瘤解剖学分期及FIGO/WHO预后评分系统,对妊娠滋养细胞肿瘤进行TGF-β1和PLGF的阳性表达率比较,当GTN患者临床分期和FIGO预后评分越高时,TGF-β1表达减弱而PLGF表达增强(P<0.05)。见表 3。
| Risk factor | n | TGF-β1 | χ2 | P | PLGF | χ2 | P | ||
| Positive number | Positive rate(η/%) | Positive number | Positive rate(η/%) | ||||||
| Anatomical stage(stage) | |||||||||
| Ⅰ-Ⅱ Ⅲ-Ⅳ |
15 11 |
7 1 |
46.7 9.1 |
4.045* | 0.044* | 10 11 |
66.7 100.0 |
4.365* | 0.037* |
| FIGO score(score) | |||||||||
| ≤6 ≥7 |
8 18 |
5 3 |
62.5 16.7 |
5.252* | 0.022* | 4 17 |
50.0 94.4 |
6.772* | 0.009* |
| * Fisher’s exact probability method. | |||||||||
TGF-β1与PLGF在葡萄胎组中表达呈中度负相关关系(r=-0.585,P<0.01); TGF-β1与PLGF在GTN组中表达呈中度负相关关系(r=-0.479,P=0.015)。
3 讨论妊娠滋养细胞疾病是一类严重影响妇女身心健康的疾病,侵蚀性葡萄胎、绒毛膜癌和胎盘部位滋养细胞肿瘤统称为GTN,侵蚀性葡萄胎基本都由葡萄胎恶变而来,绒毛膜癌可来源于葡萄胎、早产、足月产、异位妊娠及各种类型的流产等,其中葡萄胎来源约占50%。绒毛膜癌的恶性程度很高,而且具有高度亲血管性,很早就可以发生全身广泛转移,在化疗药物问世以前,其死亡率>90%,随着化疗药物的广泛应用,仍有20%的绒毛膜癌患者因对化疗耐药而达不到痊愈[1-3]。目前,妊娠滋养细胞疾病的发生发展机制仍不十分明确,国内外许多学者从基因表达谱和分子生物学水平来研究妊娠滋养细胞疾病的发生发展机制,TGF-β1和PLGF在妊娠期高血压、宫颈癌等妇产科多种疾病的发生发展过程中发挥作用;也有学者[4-7]发现:TGF-β1和PLGF在妊娠滋养细胞疾病的发生发展中也具有一定作用,该结论为妊娠滋养细胞疾病发病机制的研究提供了一个新的研究方向和靶点。
TGF-β1主要由胎盘通过自分泌和旁分泌方式分泌,其在妊娠胎盘绒毛细胞滋养层的细胞浆、绒毛附近及蜕膜组织等都有表达,在滋养细胞的生长分化、内分泌和免疫功能等方面也有重要作用。正常妊娠胎盘需要足够的胎盘血供,这就需要妊娠滋养细胞在蜕膜中正常增殖、迁移和浸润,TGF-β1不仅可以影响子宫内膜-滋养细胞的功能,还可以控制滋养细胞的浸润,若TGF-β1表达异常,可通过抑制细胞外基质的分解和下调滋养细胞的迁移能力,影响滋养细胞端粒酶活性,从而阻碍滋养细胞的增生、迁移、浸润及正常胎盘血供的形成,导致病理性妊娠[4]。在参与滋养细胞侵入调节的细胞因子中,TGF-β1是目前研究最热门的因子。本研究结果显示:正常对照组TGF-β1阳性表达率高于葡萄胎组和GTN组,葡萄胎组TGF-β1阳性表达率高于GTN组,与国外Bolat等[5]报道的研究结果一致。研究[6]显示:TGF-β1在肿瘤发展过程中具有双向调节的作用。在肿瘤早期,TGF-β1可抑制细胞过度增殖,促进细胞凋亡,从而阻止肿瘤的发生,妊娠滋养细胞肿瘤组织中TGF-β1表达减弱,可能因此导致抑制滋养细胞侵蚀能力减弱,抑制细胞外基质溶解的作用也减弱,从而促进了滋养细胞的增殖、浸润和转移;在肿瘤晚期,肿瘤细胞自身会分泌大量TGF-β1,增强肿瘤细胞的侵袭、转移能力,进而转变为促进肿瘤细胞增殖和侵袭的物质。刘绍晨等[7]通过JEG-3绒毛膜癌细胞体外实验研究发现:外源性TGF-β1能够促进绒毛膜癌细胞的增殖,增加其侵袭力,且表现出某种程度的浓度依附效应。因此推测TGF-β1参与妊娠滋养细胞疾病发生发展的可能机制如下[8-11]:①影响细胞周期;②促使滋养细胞分化成侵袭能力较弱的合体滋养细胞;③使整合素表达升高,减少滋养细胞的迁移;④降低滋养细胞降解基底膜关键酶的活性,抑制纤维蛋白溶酶的表达,减少胶原酶合成;⑤抑制新生血管的形成,减少滋养细胞营养物质的来源;⑥促进机体免疫细胞对滋养细胞的杀伤作用,减少滋养细胞的入侵。
PLGF是一种分泌型同源二聚体糖蛋白,是血管内皮生长因子(vascular endothelial growth factor, VEGF)家族中的一员,是由Maglione首次从人类妊娠胎盘cDNA文库里分离纯化出来的。mRNA的拼接方式不同可产生不同的蛋白亚型PLGF,不同蛋白亚型的PLGF可以通过与各自的受体特异性结合来介导内皮细胞和基质细胞作用,诱导血管生成,增加VEGF活性,从而发挥生物学作用[12]。1997年Vuorela等[13]首先证实PLGF主要来源于妊娠绒毛合体滋养层,其可以通过旁分泌和自分泌机制促进滋养细胞的增殖与分化,拮抗内皮细胞凋亡,增强血管的通透性,促进血管生长。PLGF在白细胞浸润、内皮细胞生长及迁移、基质细胞迁移、血管形成、缺血组织血管再通、胎盘绒毛膜的血管形成和肿瘤生长等多方面都有重要作用[16]。研究[17]显示:PLGF蛋白在正常妊娠妇女血清中,4~14周呈低水平表达,15~25周表达水平迅速上升,26~30周表达水平达最高峰,31周后表达水平明显下降。在正常未孕女性和男性血清中检测不到PLGF(7 ng·L-1),在病理状态下(外伤、肿瘤和炎症反应等)PLGF是血管生成的关键因子[16]。本研究结果显示:正常对照组研究对象PLGF阳性表达率低于葡萄胎组和GTN组;葡萄胎组PLGF阳性表达率低于GTN组,与李润花等[17]报道的结果一致。Oranratanaphan等[18]的研究也得出了类似的结果。De Falco等[19]的体外实验亦证实:阻止PLGF与其受体结合,可以增加滋养细胞的凋亡率。PLGF参与妊娠滋养细胞疾病发生发展的可能作用机制[20-23]:①PLGF与其受体结合后影响滋养细胞的增生和分化,导致滋养细胞恶性转化;②PLGF促进新生血管形成和血管生长,促进滋养细胞增殖浸润;③PLGF与其受体结合后能诱导炎症反应,而炎症介质浸润是肿瘤生长和血管形成的良好环境,炎性因子还可以活化致癌基因、降解抑癌基因,从而促进妊娠滋养细胞疾病的发生发展。
综上所述,TGF-β1和PLGF的阳性表达与葡萄胎恶变高危因素有关,提示TGF-β1的低表达而PLGF高表达可能有助于预测葡萄胎恶变;TGF-β1和PLGF的阳性表达与GTN的临床分期也有关,提示TGF-β1低表达而PLGF高表达可能有助于了解GTN进展,判断GTN的预后并指导化疗。本研究针对TGF-β1与PLGF在葡萄胎及妊娠滋养细胞肿瘤中相关性进行了研究,在葡萄胎组及GTN组中TGF-β1与PLGF阳性表达均呈负相关关系,其原因可能是TGF-β1表达减弱,其对滋养细胞增生、转移和浸润能力的抑制作用减弱,同时低水平的TGF-β1还可促进新生血管形成,增加滋养细胞营养物质来源,因此细胞分泌PLGF增多,进而又可以促进滋养细胞异常增生和分化,介导新生血管及其分支形成,因而低水平的TGF-β1协同高水平PLGF对妊娠滋养细胞疾病的发生发展起促进作用。但关于TGF-β1和PLGF在妊娠滋养细胞疾病中的具体作用机制仍有待进一步研究。
| [1] | 向阳, 赵峻. 妊娠滋养细胞疾病诊治进展[J]. 中国实用妇科与产科杂志, 2017, 33(1): 14–18. |
| [2] | Braga A, Maesta L, Short D, et al. Hormonal contraceptive ust before hcg remission does not increase the risk of gestational trophoblastic neoplasia following complete hydatidiform mole:a historical database review[J]. BJOG, 2016, 123(8): 1330–1335. DOI:10.1111/1471-0528.13617 |
| [3] | Lu B, Zhang X, Liang Y. Clinicopathologic analysis of postchemotherapy gestational trophoblastic neoplasia:an entity overlapping with epithelioid trophoblastic tumor[J]. Int J Gynecol Pathol, 2016, 35(6): 516–524. DOI:10.1097/PGP.0000000000000259 |
| [4] | Brooks SA, Martin E, Smeester L, et al. miRNAs as common regulators of the transforming growth factor (TGF)-β pathway in the preeclamptic placenta and cadmium-treated trophoblasts:Links between the environment, the epigenome and preeclampsia[J]. Food Chem Toxicol, 2016, 98(Pt A): 50–57. |
| [5] | Bolat F, Haberal N, Tunali N, et al. Expression of vascular endothelial growth factor (VEGF), hypoxia inducible factor 1 alpha (HIF-1a), and transforming growth factors β1(TGFβ1) and β3(TGFβ3) in gestational trophoblastic disease[J]. Pathol Res Prac, 2010, 206(1): 19–23. DOI:10.1016/j.prp.2009.07.017 |
| [6] | Singh MK, Bhattacharya D, Chaudhuri S, et al. T11TS inhibits glioma angiogenesis by modulation of MMPs, TIMPs, with related integrin αv and TGF-β1 expressions[J]. Tumour Biol, 2014, 35(3): 2231–2246. DOI:10.1007/s13277-013-1296-8 |
| [7] | 刘绍晨, 许倩, 岳志领. TGF-β1对人绒癌JEG-3细胞株TβRⅠ、TβRⅡ、Smad4 mRNA表达的影响及意义[J]. 中国妇幼保健, 2015, 30(5): 758–763. |
| [8] | Fu G, Ye G, Nadeem L, et al. MicroRNA-376c impairs transforming growth factor-β and nodal signaling to promote trophoblast cell proliferation and invasion[J]. Hypertension, 2013, 61(4): 864–872. DOI:10.1161/HYPERTENSIONAHA.111.203489 |
| [9] | Singh MK, Bhattacharya D, Chaudhuri S, et al. T11TS inhibits glioma angiogenesis by modulation of MMPs, TIMPs, with related integrin αv and TGF-β1 expressions[J]. Tumour Biol, 2014, 35(3): 2231–2246. DOI:10.1007/s13277-013-1296-8 |
| [10] | Wu Y, Fu Y, Zheng L, et al. Nutlin-3 inhibits epithelial-mesenchymal transition by interfering with canonical transforming growth factor-β1-Smad-Snail/Slug axis[J]. Cancer Lett, 2014, 342(1): 82–91. DOI:10.1016/j.canlet.2013.08.039 |
| [11] | Wu XD, Chen LL, Shen T, et al. Curative effects and influenced factors of primary chemotherapy with single-agent methotrexate on low-risk gestational trophoblastic neoplasia[J]. Zhonghua Yi Xue Za Zhi, 2017, 97(23): 1769–1772. |
| [12] | Schneider K, Weyerbrock A, Doostkam S, et al. Lack of evidence for PLGF mediating the tumor resistance after anti-angiogenic therapy in malignant gliomas[J]. J Neuro Oncol, 2015, 121(2): 269–278. DOI:10.1007/s11060-014-1647-3 |
| [13] | Vuorela P, Hatva E, Lymboussaki A, et al. Expression of vascular endothelial growth factor and placenta growth factor in human placenta[J]. Biol Reprod, 1997, 56(2): 489–494. DOI:10.1095/biolreprod56.2.489 |
| [14] | Xiang L, Varshney R, Rashdan NA, et al. Placental growth factor and vascular endothelial growth factor-A have differential, cell-type specific patterns of expression in vascular cells[J]. Microcirculation, 2014, 21(5): 368–379. DOI:10.1111/micc.2014.21.issue-5 |
| [15] | Tsiakkas A, Duvdevani N, Wright A, et al. Serum placental growth factor in the three trimesters of pregnancy:effects of maternal characteristics and medical history[J]. Ultrasound Obstet Gynecol, 2015, 45(5): 591–598. DOI:10.1002/uog.14811 |
| [16] | Song N, Liu H, Ma X, et al. Placental growth factor promotes metastases of ovarian cancer through MiR-543-regulated MMP7[J]. Cell Physiol Biochem, 2015, 37(3): 1104–1112. DOI:10.1159/000430235 |
| [17] | 李润花, 郑兆祥, 武明霞, 等. 胎盘生长因子及瘦素在早孕绒毛及妊娠滋养细胞疾病中的表达及意义[J]. 中华妇幼临床医学杂志:电子版, 2012, 8(4): 485–488. |
| [18] | Oranratanaphan S, Wongwathanavikrom R, Lertkhachonsuk R. Correlation levels of serum placental growth factor and human chorionic gonadotropin in gestational trophoblastic disease patients[J]. J Reprod Med, 2011, 56(7/8): 333–338. |
| [19] | De Falco S. The discovery of placenta growth factor and its biological activity[J]. Exp Mol Med, 2012, 44(1): 1–9. DOI:10.3858/emm.2012.44.1.025 |
| [20] | Singh M, Kindelberger D, Nagymanyoki Z, et al. Vascular endothelial growth factors and their receptors and regulators in gestational trophoblastic diseases and normal placenta[J]. J Reprod Med, 2012, 57(5/6): 197–203. |
| [21] | Incio J, Tam J, Rahbari NN, et al. PLGF/VEGFR-1 signaling promotes macrophage polarization and accelerated tumor progression in obesity[J]. Clin Cancer Res, 2016, 22(12): 2993–3004. DOI:10.1158/1078-0432.CCR-15-1839 |
| [22] | Shamshiri Milani H, Abdollahi M, Torbati S, et al. Risk factors for hydatidiform mole:Is husband's job a major risk factor[J]. Asian Pac J Cancer Prev, 2017, 18(10): 2657–2662. |
| [23] | Giorgione V, Bergamini A, Cioffi R, et al. Role of surgery in the management of hydatidiform mole in elderly patients:a single-center clinical experience[J]. Int J Gynecol Cancer, 2017, 27(3): 550–553. DOI:10.1097/IGC.0000000000000903 |
 2018, Vol. 44
2018, Vol. 44


