扩展功能
文章信息
- 赵燕, 张新, 张剑, 田石琦, 常英霞
- ZHAO Yan, ZHANG Xin, ZHANG Jian, TIAN Shiqi, CHANG Yingxia
- 杞菊地黄丸对青光眼模型大鼠视网膜结构的保护作用及其机制
- Protective effect of Qijudihuang Pill on retinal structures of glaucoma model rats and its mechanism
- 吉林大学学报(医学版), 2018, 44(05): 994-998
- Journal of Jilin University (Medicine Edition), 2018, 44(05): 994-998
- 10.13481/j.1671-587x.20180519
-
文章历史
- 收稿日期: 2018-01-19
2. 佳木斯大学附属第一医院眼科, 黑龙江 佳木斯 154002
2. Department of Ophthalmology, First Affiliated Hospital, Jiamusi University, Jiamusi 154002, China
青光眼是仅次于白内障的第二大致盲眼病,严重威胁着人眼的视力健康,眼内压力呈现间断性或者持续性升高是其发病过程中的主要因素[1-2]。研究[3-4]表明:视网膜神经节细胞凋亡是导致青光眼的发病机制之一。因此,通过药物有效抑制视网膜神经节细胞凋亡是治疗青光眼的一个重要靶点。杞菊地黄丸具有滋补肝肾、益精养血明目的功效。研究[5]表明:玄府闭塞和精血不足是导致青光眼视神经损害的主要病机,以开通玄府和益气活血的方法作为青光眼视神经保护的首要治则。目前国内外尚未见有关杞菊地黄丸对视网膜神经保护机制研究的报道,因此,本研究通过观察杞菊地黄丸对高眼压大鼠模型视网膜神经节细胞中B淋巴细胞瘤2(Bcl-2)、Bcl-2相关X蛋白(Bax)及含胱氨酸的天冬氨酸蛋白水解酶3(caspase-3)mRNA和蛋白表达的影响,探讨杞菊地黄丸对青光眼视网膜神经的保护作用及其相关机制,旨在为研究杞菊地黄丸对视网膜神经细胞损伤的保护作用提供实验依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器雌性SD大鼠50只,10~12周龄,体质量180~220 g,购于河北医科大学实验动物学部,动物合格证号:SYXK(冀)2013-0023。适应性饲养1周,饲养温度22℃~25℃,相对湿度55%~72%。杞菊地黄丸(北京同仁堂科技发展股份有限公司制药厂),山羊抗大鼠Bcl-2、山羊抗大鼠Bax和兔抗大鼠caspase-3(美国Santa Cruz公司)。Tonolab动物眼压计(芬兰爱科公司),HM 355S石蜡切片机(美国赛默飞世尔科技有限公司),DS-Ri2显微成像系统(日本尼康公司),ABI Veriti96 PCR仪(美国应用生物系统公司),Powerpac Univeal电泳仪和VersaDoc凝胶成像系统(美国伯乐公司)。
1.2 青光眼大鼠模型制备和实验动物分组50只SD大鼠随机分为空白对照组,模型组,低、中和高剂量杞菊地黄丸组;除空白对照组外,其余各组大鼠采用烙闭上巩膜静脉法进行单眼造模[6]。以10%水合氯醛(0. 4 mL·100 g-1)腹腔注射,麻醉,将奥布卡因滴眼液(4 g·L-1)滴入双眼结膜囊内,使双眼表面麻醉。以右眼为对照眼,左眼为实验眼,将大鼠头部置于裂隙灯显微镜头架处,用532二极管激光行左眼270°角膜缘血管网和角膜缘颞上、颞下3条浅层巩膜静脉血管光凝,双眼滴入诺氟沙星滴眼液,隔日在裂隙灯显微镜下观察结膜的充血情况以及角膜水肿情况,测量双眼的眼压,若左眼眼压高于右眼眼压10 mmHg表示造模成功。药物剂量按成人给药剂量采用体表面积换算,低、中和高剂量杞菊地黄丸组分别灌胃给予剂量为1、2和4 g·kg-1的杞菊地黄丸,空白对照组和模型组大鼠分别口服给予等体积生理盐水,每天1次。
1.3 大鼠眼压检测于给药12周后,以0.5%盐酸丙美卡因滴眼液表面麻醉后,采用眼压计检测眼压,连续检测3次取平均值。
1.4 组织切片制备和HE染色于给药12周后处死大鼠,立即摘除眼球(含球后视神经2 mm),角膜贯穿一小切口, 于15%甲醛组织固定液中浸泡24 h,沿视神经连线对剖眼球,去除眼前节和玻璃体,梯度脱水、透明、石蜡包埋,切片(4 μm)。蒸馏水洗涤,采用苏木素染色10 min,冲洗后,于10 g·L-1盐酸乙醇分化30 s,于蒸馏水中浸泡15 min,伊红复染5 min,采用不同浓度乙醇梯度脱水,二甲苯洗涤1 min,中性树脂封固,显微镜下观察眼球组织形态表现。
1.5 TUNEL法检测视网膜神经节细胞凋亡指数分离视网膜在内的后半部分眼杯,于15%甲醛组织固定液中浸泡,4℃固定24 h,梯度脱水、透明、包埋、切片。采用40 g·L-1多聚甲醛/免疫染色固定溶液染色15 min,滴入20 mg·L-1蛋白酶K工作液,室温孵育10 min,40 g·L-1多聚甲醛固定5 min,100 μL平衡液8 min,滴加反应液并于湿盒中孵育1 h,37℃,避光,终止反应,KPBS洗涤,滴入DAPI染液,孵育15 min,封片。于光学显微镜下,每张切片随机选取6个视野,观察视网膜神经节细胞凋亡情况,正常视网膜神经节细胞核呈蓝色,凋亡细胞核呈棕褐色,分别计数每个视野中阳性着色细胞数,计算出视网膜神经节细胞的凋亡指数,取平均值。凋亡指数计算公式:凋亡指数=阳性细胞数/总细胞数×100%。
1.6 RT-PCR法检测大鼠视网膜组织中Bcl-2、Bax和caspase-3 mRNA表达水平取各组大鼠视网膜组织,按照Trizol说明书提取总RNA,逆转录合成cDNA,采用PCR仪进行扩增,所用引物序列:Bcl-2,上游引物5′-TTCTTTGAGTTCGGTGGGGTC-3′,下游引物5′-TTCTTTGAGTTCGGTGGGGTC-3′;Bax,上游引物5′-TCCACCAAGAAGCTGAGCGAG-3′,下游引物5′-GTCCAGCCCATGATGGTTCT-3′;caspase-3,上游引物5′-TGGAGAGAAGATGGTTTGAGC-3′,下游引物5′-CCCTATTGCTGGATGCTTTC-3′;GAPD,上游引物5′-GATGCTGGTGCTGAGTATGCCG-3′,下游引物5′-GTGGTGCAGGATGC-3′。扩增条件:92℃、30s,65℃、30s,72℃、54s,共32个循环;74℃延伸3min。所得结果直接在荧光定量操作系统中进行比较分析,分别以Bcl-2、Bax和caspase-3 mRNA条带与GAPD条带的灰度比值表示mRNA表达水平,测定平均值。
1.7 免疫组织化学法检测大鼠视网组织中Bcl-2、Bax和caspase-3蛋白表达水平取大鼠视网膜组织切片,采用免疫组织化学法染色,使用Motic图像系统进行图像处理,每张切片取4个视野,每个视野面积为0.2 mm×0.2 mm。测定吸光度(A)值,对阳性染色细胞予以半定量分析,以A值表示视网膜组织中Bcl-2、Bax和caspase-3蛋白表达水平。
1.8 统计学分析采用SPSS 17. 0统计软件进行统计学分析。大鼠眼压,大鼠视网膜神经节细胞凋亡指数,视网膜组织中Bcl-2、Bax和caspase-3 mRNA和蛋白表达水平均以x±s表示;多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠眼压与空白对照组比较,模型组大鼠眼压明显升高(P < 0.05)。与模型组比较,低、中和高剂量杞菊地黄丸组大鼠眼压明显降低(P < 0.05)。见表 1。
| (n=10, x±s, P/mmHg) | ||
| Group | Intraocular pressure | |
| Before administration | After administration | |
| Blank control | 22.85±2.45 | 21.09±2.96 |
| Model | 35.67±2.57 | 34.33±3.49* |
| Qijudihuang Pill | ||
| Low dose | 34.83±1.62 | 29.38±3.25△ |
| Medium dose | 34.85±2.03 | 26.68±4.68△ |
| High dose | 35.60±1.26 | 24.38±1.85△ |
| * P < 0.05 compared with blank control group;△ P < 0.05 compared with model group. | ||
空白对照组大鼠视网膜神经纤维排列整齐,神经节细胞间隙清楚。模型组大鼠视网膜神经纤维排列不整齐,纤维间质水肿,细胞层呈空泡样,视网膜神经节细胞数目明显减少。低剂量杞菊地黄丸组大鼠视神经纤维排列不整齐,纤维间质部分水肿,偶见空泡。中剂量杞菊地黄丸组大鼠细胞形态大致正常。高剂量杞菊地黄丸组大鼠眼视网膜神经节细胞数目多于模型组。低和中剂量杞菊地黄丸组大鼠眼视网膜神经纤维细胞排列整齐,神经节细胞形态正常。见图 1(插页三)。
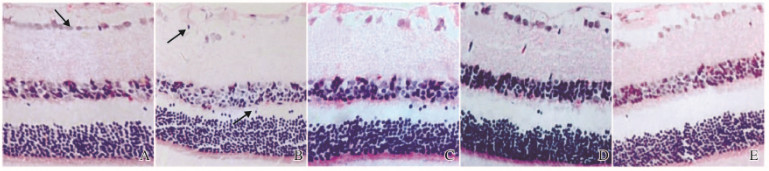
|
| A: Blank control group; B: Model group; C: Low dose of Qijudihaung Pill group; D: Medium dose of Qijudihaung Pill group; E: High dose of Qijudihaung Pill group. 图 1 各组小鼠视网膜组织HE染色结果(×400) Figure 1 HE staining results of retina tissue of rats in various groups(×400) |
|
|
与空白对照组比较,模型组大鼠视网膜神经节细胞凋亡指数明显升高(P < 0.05)。与模型组比较,低、中和高剂量杞菊地黄丸组大鼠视网膜神经节细胞凋亡指数明显降低(P < 0.05)。见表 2和图 2(插页三)。
| (n=10, x±s, η/%) | |
| Group | Apoptotic index |
| Blank control | 3.28±0.52 |
| Model | 55.83±6.28* |
| Qijudihuang Pill | |
| Low dose | 21.46±4.81△ |
| Medium dose | 17.88±3.92△ |
| High dose | 10.26±2.30△ |
| * P < 0.05 compared with blank control group;△ P < 0.05 compared with model group. | |
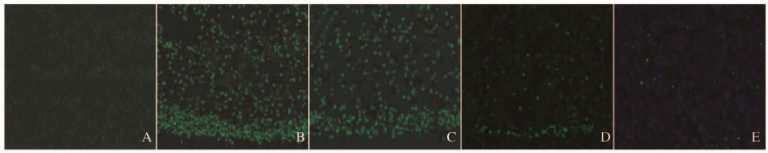
|
| A:Blank control group; B: Model group; C: Low dose of Qijudihaung Pill group; D: Medium dose of Qijudihaung Pill group; E: High dose of Qijudihaung Pill group. 图 2 各组小鼠视网膜组织TUNEL染色结果(×400) Figure 2 TUNEL staining results of retina tissue of rats in various groups(×400) |
|
|
与空白对照组比较,模型组大鼠视网膜组织中Bcl-2 mRNA、Bax和caspase-3 mRNA表达水平明显升高(P < 0.05)。与模型组比较,低、中和高剂量杞菊地黄丸组大鼠Bcl-2 mRNA表达水平明显升高(P < 0.05),Bax和caspase-3 mRNA表达水平明显降低(P < 0.05)。见图 3和表 3。

|
| Lane 1:Blank control group; Lane 2: Model group; Lane 3-5: Low, medium, and high doses of Qijudihuang Pill groups. 图 3 各组大鼠视网膜组织中Bcl-2、Bax和caspase-3 mRNA表达电泳图 Figure 3 Electrophoregram of expressions of Bcl-2, Bax and caspase-3 mRNA in retina tissue of rats in various groups |
|
|
| (n=10, x±s) | |||
| Group | Bcl-2 mRNA | Bax mRNA | Caspase-3 mRNA |
| Blank control | 0.628±0.058 | 0.503±0.093 | 0.574±0.043 |
| Model | 1.122±0.084* | 1.439±0.325* | 1.285±0.285* |
| Qijudihuang Pill | |||
| Low dose | 1.323±0.115△ | 1.256±0.251△ | 1.009±0.318△ |
| Medium dose | 1.562±0.123△ | 1.185±0.244△ | 0.974±0.045△ |
| High dose | 1.624±0.094△ | 0.982±0.103△ | 0.604±0.006△ |
| * P < 0.05 compared with blank control group;△ P < 0.05 compared with model group. | |||
与空白对照组比较,模型组大鼠Bcl-2、Bax和caspase-3蛋白表达水平明显升高(P < 0.05)。与模型组比较,低、中和高剂量杞菊地黄丸组大鼠Bcl-2蛋白表达水平明显升高(P < 0.05),Bax和caspase-3蛋白表达水平明显降低(P < 0.05)。见图 4(插页四)和表 4。
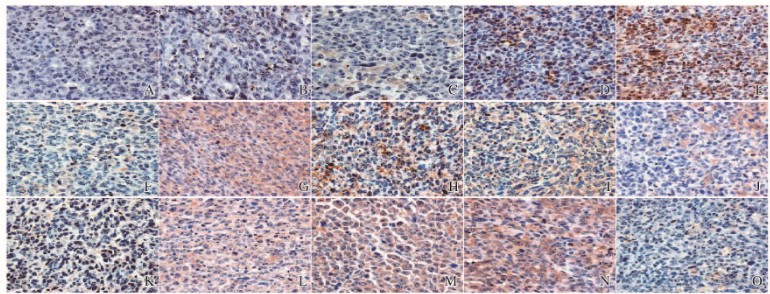
|
| A-E:Bax; F-J:Bcl-2;K-O:Caspase-3;A, F, K:Blank control group; B, G, L: Model group; C, H, M: Low dose of Qijudihuang Pill group; D, I, N: Medium dose of Qijudihuang Pill group; E, J, O: High dose of Qijudihuang Pill group. 图 4 各组大鼠视网膜组织中Bcl-2、Bax和caspase-3蛋白免疫组织化学染色结果(×400) Figure 4 Immunohistochemical staining results of Bcl-2, Bax, and caspase-3 proteins in retina tissue of rats in various groups(×400) |
|
|
| (n=10, x±s) | |||
| Group | Bcl-2 | Bax | Caspase-3 |
| Blank control | 0.036±0.010 | 0.028±0.004 | 0.020±0.003 |
| Model | 0.075±0.017* | 0.114±0.024* | 0.121±0.027* |
| Qijudihuang Pill | |||
| Low dose | 0.082±0.024△ | 0.086±0.016△ | 0.102±0.021△ |
| Medium dose | 0.099±0.015△ | 0.078±0.028△ | 0.099±0.016△ |
| High dose | 0.112±0.032△ | 0.074±0.012△ | 0.078±0.018△ |
| * P < 0.05 compared with blank control group;△ P < 0.05 compared with model group. | |||
研究[7]认为:青光眼属五风内障,五风内障主要由于玄府闭塞、经脉不利、珠内气血津液不行和神水瘀积所致。临床上主要通过滋养肝肾、活血化瘀的方法作为中医的基本治则防治青光眼视神经损害[8-9]。杞菊地黄丸由枸杞子、菊花、熟地黄、山茱萸、牡丹皮、山药、茯苓和泽泻组成,方中熟地黄补血养阴、填精益髓;山茱萸补益肝肾、敛阴;泽泻利水渗湿,泄热,兼防熟地滋腻;茯苓健脾利水;牡丹皮,清热凉血、活血祛瘀。以上6种中药共同配伍,起补肝肾活性的作用。菊花清热解毒,清疏上焦头目风热,利于滋养阴精;枸杞子滋补肝肾、益精明目。菊花、枸杞子二者均入肝经,具有滋阴养肝、明目的功效。
视网膜神经节细胞是构成视网膜神经元的主要细胞,青光眼的发生常伴随视网膜神经节细胞凋亡,该过程不可逆,其凋亡程度通常作为治疗青光眼药物疗效的评价指标[10-12]。机体细胞凋亡过程受到Bcl-2、Bax和caspase-3等多种基因调控[13]。Bcl-2可抑制细胞凋亡,Bax是凋亡促进基因,二者在细胞凋亡调控过程中是相互对立的一对调控基因[13-15]。caspase-3是凋亡途径的共同下游部分,直接促使细胞凋亡[16-17]。Bcl-2和Bax为caspase-3的上游调控机制,Bcl-2和Bax的表达能调节外环境诱发的caspase-3的激活和调亡;caspase-3亦可作为Bcl-2和Bax的上游调控机制。近年来研究[18-20]显示:Bcl-2、Bax可作为caspase-3的直接底物而作用于caspase-3的下游,加速凋亡的发生。
本研究组织病理学结果表明:模型组大鼠视网膜结构不完整,神经纤维排列不整齐,纤维间质水肿且可见空泡,视网膜神经节细胞数量减少,低、中和高剂量杞菊地黄丸组大鼠视网膜组织神经均得到不同程度改善,说明杞菊地黄丸可以减轻青光眼视网膜损伤;TUNEL检测结果表明:杞菊地黄丸可有效减少青光眼模型大鼠视网膜神经节细胞凋亡;此外,模型组大鼠视网膜神经节细胞中Bcl-2 mRNA和蛋白表达水平有所升高,Bax和caspase-3mRNA及蛋白表达水平明显提高。本研究结果表明:杞菊地黄丸可通过抑制网膜神经节细胞的凋亡,调控Bcl-2、Bax和caspase-3mRNA及蛋白的表达水平,对青光眼大鼠的视网膜起保护作用。
| [1] | 杨路, 王丽. 新生血管性青光眼的治疗新进展[J]. 现代实用医学, 2017, 29(9): 1126–1128. DOI:10.3969/j.issn.1671-0800.2017.09.003 |
| [2] | 韩艳秋. 药物治疗同时进行青光眼手术的新进展及疗效分析[J]. 中国继续医学教育, 2015, 7(5): 68–69. DOI:10.3969/j.issn.1674-9308.2015.05.056 |
| [3] | Almasieh M, Wilson A M, Morquette B, et al. The molecular basis of retinal ganglion cell death in glaucoma[J]. Pro Retin Eye Res, 2012, 31(2): 152–181. DOI:10.1016/j.preteyeres.2011.11.002 |
| [4] | Cueva Vargas JL, Belforte N, Di Polo A. The glial cell modulator ibudilast attenuates neuroinflammation and enhances retinal ganglion cell viability in glaucoma through protein kinase A signaling[J]. Neurobiol Dis, 2016, 93: 156–171. DOI:10.1016/j.nbd.2016.05.002 |
| [5] | 肖君华.益气活血、开通玄府法对原发青光眼视神经保护的研究[D].武汉: 湖北中医药大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10507-2008118055.htm |
| [6] | 吴真真, 朱益华. 烙闭上巩膜静脉建立大鼠慢性高眼压模型[J]. 福建医科大学学报, 2012, 46(6): 415–418. DOI:10.3969/j.issn.1672-4194.2012.06.009 |
| [7] | 李涵. 浅析整体护理在青光眼手术患者中的应用[J]. 世界最新医学信息文摘, 2017(94): 200–201. |
| [8] | 郭明. 针刺联合滋补肝肾中药对青光眼视功能损害的临床效果观察[J]. 医学信息, 2017, 30(19): 116–117. DOI:10.3969/j.issn.1006-1959.2017.19.055 |
| [9] | 王晓霞. 益气养阴活血化瘀中药对青光眼术后视神经保护作用的研究[J]. 医药卫生:引文版, 2016, 2(5): 360–361. |
| [10] | 陈莲, 石晶明. 青光眼患者视网膜神经节细胞凋亡机制的研究进展[J]. 眼科新进展, 2013, 33(4): 384–388. |
| [11] | 谭可, 谭蕾, 王莹, 等. 尿激酶对慢性青光眼大鼠视神经保护机制研究[J]. 现代中西医结合杂志, 2016, 25(15): 1626–1628. DOI:10.3969/j.issn.1008-8849.2016.15.009 |
| [12] | 刘娴, 王兵, 付珂. 银杏内酯B联合视网膜干细胞移植对青光眼大鼠的影响及机制研究[J]. 国际眼科杂志, 2017(11): 2024–2027. DOI:10.3980/j.issn.1672-5123.2017.11.08 |
| [13] | 董雅洁, 高维娟. bcl-2、bax、caspase-3在细胞凋亡中的作用及其关系[J]. 中国老年学杂志, 2012, 32(21): 4828–4830. DOI:10.3969/j.issn.1005-9202.2012.21.123 |
| [14] | Korsmeyer SJ, Shutter JR, Veis DJ, et al. Bcl-2/Bax:a rheostat that regulates an anti-oxidant pathway and cell death[J]. Semin Cancer Biol, 1993, 4(6): 327–332. |
| [15] | Yee YH, Chong SJ, Pervaiz S. The anti-oxidant and pro-oxidant dichotomy of Bcl-2[J]. Biol Chem, 2016, 397(7): 585–593. |
| [16] | Venkatesan RS, Sadiq AM. Effect of morin-5'-sulfonic acid sodium salt on the expression of apoptosis related proteins caspase 3, Bax and Bcl 2 due to the mercury induced oxidative stress in albino rats[J]. Biomed Pharmacother, 2017, 85: 202–208. DOI:10.1016/j.biopha.2016.09.090 |
| [17] | Porter AG, Jänicke RU. Emerging roles of caspase-3 in apoptosis[J]. Cell Death Differ, 1999, 6(2): 99–104. DOI:10.1038/sj.cdd.4400476 |
| [18] | Yan J, Zhang Y, She Q, et al. Long Noncoding RNA H19/miR-675 axis promotes gastric cancer via FADD/caspase 8/caspase 3 signaling pathway[J]. Cell Physiol Biochem, 2017, 42(6): 2364–2376. DOI:10.1159/000480028 |
| [19] | Fang J, Zhang Y. Icariin, an anti-atherosclerotic drug from Chinese medicinal herb horny goat weed[J]. Front Pharmacol, 2017, 8: 734. DOI:10.3389/fphar.2017.00734 |
| [20] | Ma P, Zhang S, Su X, et al. Protective effects of icariin on cisplatin-induced acute renal injury in mice[J]. Am Transl Res, 2015, 7(10): 2105–2114. |
 2018, Vol. 44
2018, Vol. 44


