2. 沈阳大学区域污染环境生态修复教育部重点实验室, 沈阳 110044
2. Key Lab of Eco-Restoration of Regional Contaminated Environment, Shenyang University, Ministry of Education, Shenyang 110044, China
0 引言
苯酚是水环境中重要的有机污染物,主要来源于冶金、煤气、造纸、石油化工等工业生产产生的含酚废水中[1]。近些年来,这些含酚废水的随意排放对人体健康和生态环境造成了严重威胁,美国环保署已经将苯酚列为优先去除污染物[2]。苯酚的去除手段多种多样,一种是通过物理或物化方法处理,另一种是微生物处理。尽管这些方法有效和实用,但却有诸多的缺点,如成本高、净化不完全、产生有毒的副产物,以及处理的酚类化合物浓度范围有限等[3-4]。因此这就要求发展一种成本低、效率高且具有无毒副产物的处理方法。
酪氨酸酶是一种多酚氧化酶,存在于动物、植物与微生物体内,易于提取,活力较高,因此近年来国外众多学者对于酪氨酸酶处理含酚废水的研究特别关注[5-7]。它能利用水中的溶解氧,使单酚类化合物羟基化生成邻苯二酚,邻苯二酚脱氢生成醌类化合物,经过一系列非酶聚合过程,形成不溶于水的聚合物,最后通过过滤、沉淀而去除[8-9]。然而游离酶在去除酚类化合物过程中存在一些缺点,如在反应过程中容易失活、很难回收利用且处理成本高等,这都限制了游离酶的广泛应用[10]。Dincer等[11]和Bayramoglu等[12]分别将酪氨酸酶固定到壳聚糖黏土复合珠和硅材料上进行实验,固定化酶能够有效防止酶的流失,而且可以重复使用,克服了游离酶的缺点[13];所以,通过物理或化学的方法将酶固定于载体后不仅能够保留酶原有的活性及高度选择性,而且还会提高酶的处理效率、延长酶的使用寿命和降低处理成本。
氧化石墨烯是一种由碳原子组成的六角型呈蜂巢晶格的平面薄膜,是只有一个碳原子厚度的二维材料[14],不仅合成简单、成本低,且由于其表面附有丰富的羧基,很容易通过共价结合的方式在表面固定酶等蛋白分子[15]。另外,氧化石墨烯具有比表面积大、生物兼容性好等优点,因此其既能加载大量的酶,又能够较好地保存酶原有的催化活性。Zhang等[16]将辣根酶以物理吸附法固定于氧化石墨烯表面,使得固定酶具有更好的活性和稳定性。Zhou等[17]将葡萄糖氧化酶固定于多巴修饰的氧化石墨烯表面,使固定酶的稳定性以及对变性剂的抵抗性显著提高。
酶的共价结合法是酶固定化的有效方法,酶活性稳定且不容易漏出。本试验拟选用氧化石墨烯为载体,利用共价结合法将酪氨酸酶和磁颗粒固定于氧化石墨烯表面,探讨酶的加载特性和酶活性,以及共价结合酪氨酸酶催化降解苯酚的最优条件及储存稳定性,为处理含酚废水提供新的理论依据。
1 材料与方法 1.1 实验材料氧化石墨烯 (粒径1~5 μm,购于南京先丰纳米材料科技有限公司);氨基修饰的磁颗粒 (粒径10 nm,购于北京格加纳米技术有限公司);酪氨酸酶 (Tyrosinase,来源于蘑菇,活性约为2 687 U/mg)、苯酚和左旋多巴 (L-DOPA, 99%)(购于西格玛奥德里奇 (上海) 贸易有限公司);其他试剂均为分析纯。本次实验中,将1 min使1 μmol L-DOPA转化成多巴胺所需酶的量作为1个酶活单位 (U)[18]。
1.2 酪氨酸酶固定化磁性氧化石墨烯复合物的制备将2 mg氧化石墨烯分散于1 mL超纯水中进行超声1 h,获得分散良好的氧化石墨烯溶液;取1 mg氧化石墨烯分散液,加入含有N-羟基硫代琥珀酰亚胺 (Sulfo-NHS,434 mmol) 和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐 (EDC,53.2 mmol) 的2 mL超纯水溶液中,充分混匀,在25 ℃、100 rpm摇床中培养15 min,离心分离出固体;用磷酸盐缓冲溶液 (50 mmol,pH 7.0) 彻底清洗3次,去掉过量的N-羟基硫代琥珀酰亚胺和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐,得到活化状态的氧化石墨烯;将其加入含有四氧化三铁磁颗粒 (0.9 mg/mL) 和酪氨酸酶 (7 mg/mL) 的溶液中,在10 ℃、100 rpm下培养12 h;磁铁分离出的固体用Tris-HCl (100 mmol,pH 7.4) 快速清洗,并在Tris-HCL溶液中培养1 h,随后使用磷酸盐缓冲溶液清洗3次至上清液中检测不到酪氨酸酶,定容至1 mL,即得到可磁性分离的酪氨酸酶固定化氧化石墨烯复合物,并于4 ℃下保存。
1.3 酶活性和酶固定量的测定为了测定固定酶的活性,将0.1 mg/mL质量浓度的30 μL酶样品加入到含L-DOPA (1.5 mg/mL) 底物的磷酸盐缓冲溶液 (50 mmol,pH 7.0) 中,使最终反应体积为3 mL;在室温下反应3 min,通过紫外可见分光光度仪 (UV-2450,日本岛津) 记录475 nm波长处的吸光度值变化。
酪氨酸酶的固定量利用酪氨酸酶初始量与固定后洗脱出的酶量之间的差值来计算,其中洗脱出的酶浓度根据朗伯比尔定律通过280 nm波长处的吸光度值进行计算。
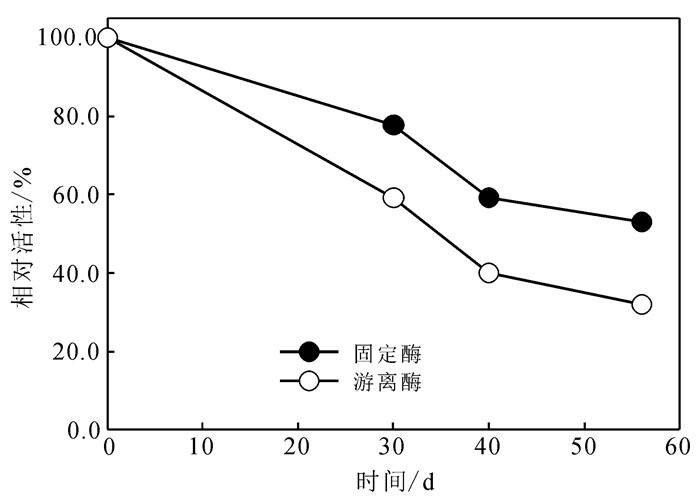
1.4 苯酚的催化降解将0.1 mg/mL的固定化酪氨酸酶加入到1 mL含有47.06 mg/L (0.5 mmol) 的苯酚缓冲溶液中,放入摇床中培养 (110 rpm);每隔一段时间取样60 μL,磁铁分离,取上清液,用紫外可见吸收光谱法测定反应前后苯酚的浓度。苯酚的降解率P为
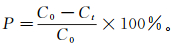
式中,C0和Ct分别表示反应初始和t时刻苯酚的浓度。
2 结果与讨论 2.1 酪氨酸酶加载特性及复合物的磁性分离性能带有氨基的酪氨酸酶分子和氨基修饰的磁颗粒利用EDC和Sulfo-NHS作为交联剂,通过共价作用的方式固定于羧基化的氧化石墨烯表面,形成酪氨酸酶固定化氧化石墨烯复合物。利用紫外分光光度法测定固定化酪氨酸酶的活性和固定量,结果得到单位质量载体的酶固定量为1.78 mg/mg,单位质量载体的酶活性为1 880.6 U/mg。
在室温条件下对分散在磷酸盐缓冲溶液 (pH=7.0) 中的固定化酪氨酸酶施加一个磁铁,每隔20 s用数码摄像记录固定酪氨酸酶的分离回收状态。由于磁颗粒的加载,固定化酪氨酸酶在外加磁场条件下能够快速分离,使固定酶的制备过程和可回收利用变得简单。如图 1所示,起初固定化酪氨酸酶溶液表现为深棕色,当磁铁分离60 s后,固液分离,溶液颜色完全透明;表明在外界磁场存在的条件下,酪氨酸酶固定化磁性氧化石墨烯复合物在60 s内可完全分离,这极大地加快了固定酶分离的效率。为了保证固定酪氨酸酶能够无损失彻底回收,实验过程中将磁性分离的时间延长到了2 min。此时回收经磁铁分离之后的固定酪氨酸酶,加入磷酸盐缓冲溶液至质量浓度为1 mg/mL,并通过紫外分光光度法测定该固定酪氨酸酶的活性,得到单位质量载体的酶活性为1 877.8 U/mg;表明磁铁分离对固定酪氨酸酶的活性没有太大影响。该结果与Ispas等[19]利用酪氨酸酶固定化生物磁胶囊去除苯酚的研究结果一致,即磁颗粒的存在不会影响苯酚的去除能力。

|
| 图 1 酪氨酸酶固定化磁性氧化石墨烯的磁分离过程 Figure 1 Magnetic separation process of enzyme immobilized magnetic graphene oxide |
|
|
考察不同反应时间对苯酚降解率的影响,结果如图 2所示。由图 2a可以看出:47.06 mg/L苯酚在270 nm波长处有最大特征吸收峰,而且在0 h时,苯酚的特征吸收峰峰值最高;随着催化反应时间的增加,270 nm处的吸收峰峰值逐渐降低。所以苯酚的残留浓度随催化反应时间的增加逐渐降低,表明固定化酪氨酸酶对苯酚有催化降解效果。由图 2b可知,随着催化反应时间的增加,苯酚的降解率逐渐增加:在催化反应进行4 h时苯酚的降解率可达66.3%;反应进行10 h时可达73.3%;30 h时降解率达到86.3%。Ispas等[19]报道利用三颗酪氨酸酶包埋的生物磁胶囊 (质量未确定) 在39 h内可降解28.23 mg/L苯酚的95%,相当于单位时间可降解苯酚0.69 mg/(L·h)。Bayramoglu等[12]将酪氨酸酶共价固定于改性的硅材料上,单位质量载体酶的固定量达到0.024 8 mg/mg (酶活性为37.99 U/mg),利用10 mg该酶固定材料处理20 mg/L苯酚,在12 h可降解87%,相当于单位质量酶固定材料降解苯酚0.15 mg/(L·h)。Dincer等[11]将酪氨酸酶固定在壳聚糖黏土复合珠上,单位质量载体酶固定量达到0.67 mg/mg (酶活性为1.40 U/mg),利用1 g该材料处理10 mg/L苯酚,在3 h可降解100%,相当于单位质量酶固定材料降解苯酚0.003 mg/(L·h)。而本研究中,利用氧化石墨烯为载体共价固定酪氨酸酶的方法进行苯酚降解,单位质量酶固定氧化石墨烯可降解苯酚13.54 mg/(L·h)。可见,酪氨酸酶固定化磁性氧化石墨烯复合物对苯酚的催化降解效果优于其他研究结果,这归结于氧化石墨烯具有极大的比表面积和较高的酶加载性能。
|
| 图 2 不同反应时间的苯酚吸收光谱 (a) 和催化反应时间对苯酚降解率的影响 (b) Figure 2 Phenol absorption spectra of different reaction time (a) and effect of catalytic reaction time on the degradation efficiency of phenol (b) |
|
|
在不同pH条件下构建0.1 mg/mL的固定化酪氨酸酶催化降解47.06 mg/L苯酚的反应体系,考察pH对苯酚降解率的影响,结果见图 3。如图 3所示,当pH分别为5.0、6.0、7.0、10.0时,固定化酪氨酸酶对苯酚的降解率分别为27.1%、48.8%、76.7%、68.2%,即pH=7.0时苯酚降解率达到最高。相比较pH为7.0时的最高苯酚降解率,pH=5.0和pH=6.0时的降解率分别降低了49.6%和27.9%,而碱性苯酚 (pH=10.0) 的降解率比pH=7.0时仅降低了8.5%;所以固定化酪氨酸酶在偏碱性环境下仍有较好的催化降解效果。这种耐碱性很可能是因为酶表面可利用的氨基官能团与氧化石墨烯表面的羧基官能团发生共价结合,而碱性pH条件有利于中和固定化酶的酸性基团,从而起到酶稳定化的作用[20]。这个结果与Dincer等[11]报道的酪氨酸酶固定在壳聚糖黏土复合珠上的结果类似,固定酶在pH=7.0获得最大活性,pH=8.0条件下的活性比pH为5.0和6.0的活性高。而苯酚的降解率取决于固定酶的活性,活性高则降解率也高[9]。由此,pH=7.0是固定化酪氨酸酶对苯酚降解的最适pH条件,应选择pH=7.0为固定酪氨酸酶降解苯酚的条件。

|
| 图 3 不同pH条件下的苯酚降解效果 Figure 3 Phenol degradation efficiencies at various pH conditions |
|
|
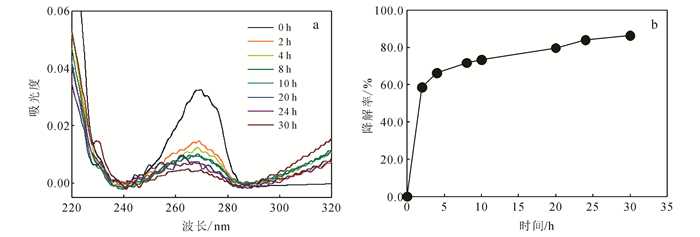
在中性pH和不同温度条件下构建0.1 mg/mL的固定化酪氨酸酶催化降解47.06 mg/L苯酚的反应体系,考察温度对苯酚降解率的影响。如图 4所示,在10、18、25、35 ℃下固定化酪氨酸酶对苯酚降解率分别表现为54.5%、80.9%、91.4%和84.2%,在25 ℃具有最佳的苯酚降解率,而在18、35℃时固定化酪氨酸酶对苯酚降解率也能达到80%以上,表现出较好的降解能力;表明固定化酪氨酸酶具有较广的工作温度范围。这是因为此温度范围内固定化酪氨酸酶比较稳定,能够保持较好的活性。由此选择25 ℃作为苯酚降解的最适温度。
|
| 图 4 不同温度条件下的苯酚降解效果 Figure 4 Phenol degradation efficiencies at various temperature conditions |
|
|
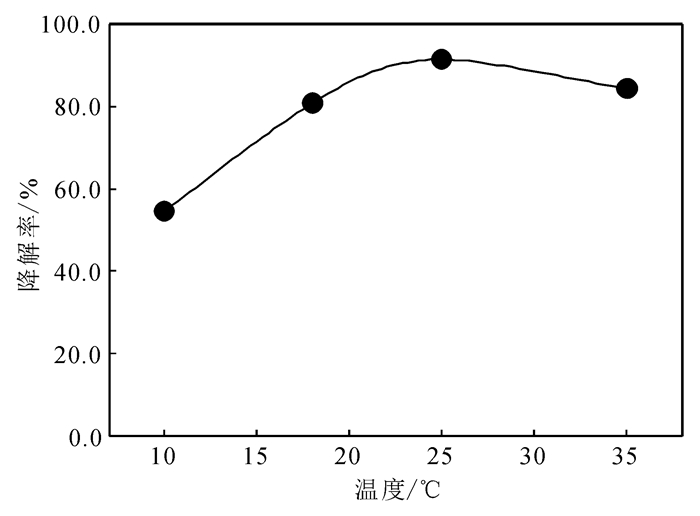
相同活性的固定酪氨酸酶和游离酪氨酸酶在4 ℃条件下储存一段时间,定期分阶段测试酶的残留活性。由储存时间与残留活性的关系 (图 5) 可知:游离酶的活性下降幅度很快,固定酶的活性相对下降较慢;存放30 d后游离酶的活性只保留了初始活性的59.3%,固定酪氨酸酶保留了初始活性的77.7%;表明固定酪氨酸酶相比游离酶具有更好的稳定性。这是由于酪氨酸酶共价结合于氧化石墨烯表面,使酶蛋白很难受到外界环境影响而变性,从而提高了酶的稳定性。
|
| 图 5 固定酶与游离酶储存稳定性比较 Figure 5 Comparison of storage stabilities of immobilized and free tyrosinase |
|
|
此外,苯酚的质量浓度会对固定化酪氨酸酶的活性和降解性能产生影响。当苯酚初始质量浓度低 (47.06 mg/L) 时,0.1 mg/mL固定化酪氨酸酶30 h降解86.3%的苯酚;随着苯酚质量浓度的增加,固定化酪氨酸酶对苯酚的降解率逐渐下降。Xu等[20]在利用交联结构的酪氨酸酶 (CLEAs) 作为催化剂处理苯酚废水的研究中也曾报道类似的结果。该结果可能与高浓度的苯酚存在时反应产物积累使得酪氨酸酶失活有关。尽管经过固定化之后酪氨酸酶的稳定性显著提高,但是其仍会受到底物和产物抑制的影响[5]。因此,当底物苯酚浓度增加时,为了不影响苯酚的降解效能,固定酶的投加量也应该相应地增加。
3 结论1) 氧化石墨烯作为酪氨酸酶固定化的载体,具有良好的生物相容性、大的比表面积以及丰富的官能团,可为酪氨酸酶的固定化提供良好的环境。
2) 通过共价结合的方法制备的酪氨酸酶固定化磁性氧化石墨烯复合物,单位质量载体的酶固定量为1.78 mg/mg,单位质量载体的酶活性为1 880.6 U/mg。
3) 磁颗粒的引入不仅使酶固定程序简便化,而且使固定化酶能够回收利用。固定化酪氨酸酶在pH=7.0和25 ℃条件下具有最优的苯酚催化降解效果,并且在30 h内对苯酚的降解率达到86.3%。
4) 固定化酪氨酸酶在4 ℃条件下30 d后的残留活性是初始的77.7%,是游离酶残留活性的1.31倍,表明其稳定性优于游离酪氨酸酶。
| [1] | Huang Q, Tang J, Weber Jr W J. Precipitation of Enzyme-Catalyzed Phenol Oxidative Coupling Products:Background Ion and pH Effects[J]. Water Research, 2005, 39(13): 3021-3027. DOI:10.1016/j.watres.2005.05.005 |
| [2] | Dotto G L, Costa J A V, Pinto L A A. Kinetic Studies on the Biosorption of Phenol by Nanoparticles from Spirulina sp LEB 18[J]. Journal of Environmental Chemical Engineering, 2013, 1(4): 1137-1143. DOI:10.1016/j.jece.2013.08.029 |
| [3] | 康春莉, 冯淑霞, 郭平, 等. 模拟太阳光条件下草酸钠-Fenton试剂降解苯酚[J]. 吉林大学学报 (理学版), 2006, 44(4): 658-662. Kang Chunli, Feng Shuxia, Guo Ping, et al. Degradation of Phenol by Sodium Oxalate-Fenton Reagent Under Simulated Sunlight[J]. Journal of Jilin University (Science Edition), 2006, 44(4): 658-662. |
| [4] | 邹东雷, 李婷婷, 高梦薇, 等. 基于响应面的可见光催化材料制备与优化[J]. 吉林大学学报 (地球科学版), 2015, 45(6): 1833-1838. Zou Donglei, Li Tingting, Gao Mengwei, et al. Preparation and Optimization of the Photocatalytic Materials Under Visible Light with Response Surface Methodology[J]. Journal of Jilin University (Earth Science Edition), 2015, 45(6): 1833-1838. |
| [5] | Xu D, Yang Z. Cross-Linked Tyrosinase Aggregates for Elimination of Phenolic Compounds from Wastewater[J]. Chemosphere, 2013, 92(4): 391-398. DOI:10.1016/j.chemosphere.2012.12.076 |
| [6] | Ba S, Haroune L, Cruz-Morato C, et al. Synthesis and Characterization of Combined Cross-Linked Laccase and Tyrosinase Aggregates Transforming Acetaminophen as a Model Phenolic Compound in Wastewaters[J]. Science of the Total Environment, 2014, 487(14): 748-755. |
| [7] | Ikehata K, Nicell J A. Characterization of Tyrosinase for the Treatment of Aqueous Phenols[J]. Bioresource Technology, 2000, 74(3): 191-199. DOI:10.1016/S0960-8524(00)00025-0 |
| [8] | Aytar B S, Bakir U. Preparation of Cross-Linked Tyro-sinase Aggregate[J]. Process Biochemistry, 2008, 43(2): 125-131. DOI:10.1016/j.procbio.2007.11.001 |
| [9] | Seetharam G B, Saville B A. Degradation of Phenol Using Tyrosinase Immobilized on Siliceous Supports[J]. Water Research, 2003, 37(2): 436-440. DOI:10.1016/S0043-1354(02)00290-7 |
| [10] | Zhu J, Sun G. Lipase Immobilization on Glutaral-dehyde-Activated Nanofibrous Membranes for Improved Enzyme Stabilities and Activities[J]. Reactive and Functional Polymers, 2012, 72(11): 839-845. DOI:10.1016/j.reactfunctpolym.2012.08.001 |
| [11] | Dincer A, Becerik S, Aydemir T L. Immobilization of Tyrosinase on Chitosan-Caly Composite Beads[J]. International Journal of Biological Macromolecules, 2012, 50(3): 815-820. DOI:10.1016/j.ijbiomac.2011.11.020 |
| [12] | Bayramoglu G, Akbulut A, Arica M Y. Immobiliza-tion of Tyrosinase on Modified Diatom Biosilica:Enzymatic Removal of Phenolic Compounds from Aqueous Solution[J]. Journal of Hazardous Materials, 2013, 244/245(2): 528-536. |
| [13] | 杨雪梅, 张兰英, 张蕾, 等. 固定化酶在高浓度有机废水处理中的应用[J]. 吉林大学学报 (地球科学版), 2005, 35(3): 398-402. Yang Xuemei, Zhang Lanying, Zhang Lei, et al. Application of Immobilized Proteases in Treating Water with High Concentration Organic Substances[J]. Journal of Jilin University (Earth Science Edition), 2005, 35(3): 398-402. |
| [14] | 张林, 赵宏伟, 杨倚寒, 等. 单层石墨烯薄膜材料纳米压痕过程的分子动力学解析[J]. 吉林大学学报 (工学版), 2013, 43(6): 1558-1565. Zhang Lin, Zhao Hongwei, Yang Yihan, et al. Molecular Dynamics Simulation of Nanoindentation of Single-Layer Graphene Sheet[J]. Journal of Jilin University (Engineering and Technology Edition), 2013, 43(6): 1558-1565. |
| [15] | Hermanova S, Zarevucka M, Bousa D, et al. Gra-phene Oxide Immobilized Enzymes Show High Thermal and Solvent Stability[J]. Nanoscale, 2015, 7(13): 5852-5858. DOI:10.1039/C5NR00438A |
| [16] | Zhang F, Zheng B, Zhang J, et al. Horseradish Pe-roxidase Immobilized on Graphene Oxide:Physical Properties and Applications in Phenolic Compound Removal[J]. The Journal of Physical Chemistry C, 2010, 114(18): 8469-8473. DOI:10.1021/jp101073b |
| [17] | Zhou Liya, Jiang Yanjun, Gao Jing, et al. Graphene Oxide as a Matrix for the Immobilization of Glucose Oxidase[J]. Applied Biochemistry and Biotechnology, 2012, 168(6): 1635-1642. DOI:10.1007/s12010-012-9884-4 |
| [18] | Kampmann M, Boll S, Kossuch J, et al. Efficient Im-mobilization of Mushroom Tyrosinase Utilizing Whole Cells from Agaricus Bisporus and Its Application for Degradation of Bisphenol A[J]. Water Research, 2014, 57(5): 295-303. |
| [19] | Ispas C R, Ravalli M T, Steere A, et al. Multifunc-tional Biomagnetic Capsules for Easy Removal of Phenol and Bisphenol A[J]. Water Research, 2010, 44(6): 1961-1969. DOI:10.1016/j.watres.2009.11.049 |
| [20] | Xu D, Yang Y, Yang Z. Activity and Stability of Cross-Linked Tyrosinase Aggregates in Aqueous and Nonaqueous Media[J]. Journal of Biotechnology, 2011, 152(1/2): 30-36. |



