2. 成都理工大学沉积地质研究院, 成都 610059;
3. 中国石油西南油气田分公司川东北气矿, 四川 达州 635000
2. Institute of Sedimentary Geology, Chengdu University of Technology, Chengdu 610059, China;
3. Northeast Gas Field of Southwest Oil & Gas Company, PetroChina, Dazhou 635000, Sichuan, China
0 前言
核形石 (又称藻灰结核) 与藻类活动密切相关, 常具不规则的球状外形, 核心是骨屑或其他异化颗粒, 围绕核心为不规则的同心纹状包壳[1], 主要由蓝绿藻类的丝状及被丝状体粘结的灰泥组成, 是典型的微生物岩。核形石长期受到地质学家的广泛关注[2-10], 它不仅可作为区域地层划分和对比的标志层, 也是恢复古地理环境的重要指标[11-12]。龙门山前的北川甘溪地区泥盆系剖面, 在第30届国际地质大会上被确定为中国的泥盆系标准剖面[13], 针对这一典型地质剖面, 先后有多位学者开展过研究工作[14-16], 但对于泥盆系金宝石组顶部古暴露面下发育的一套具同心圈层结构的核形石微生物岩层, 未曾开展过相关研究。笔者通过对研究区微生物岩剖面详细的描述和采样, 利用常规薄片、阴极发光、微量元素以及稳定同位素分析等手段, 对该微生物岩宏观和微观特征、地球化学特征进行研究, 分析其成因机制及环境意义, 揭示龙门山地区泥盆纪海平面变化、造山运动及古气候变化等地质信息。
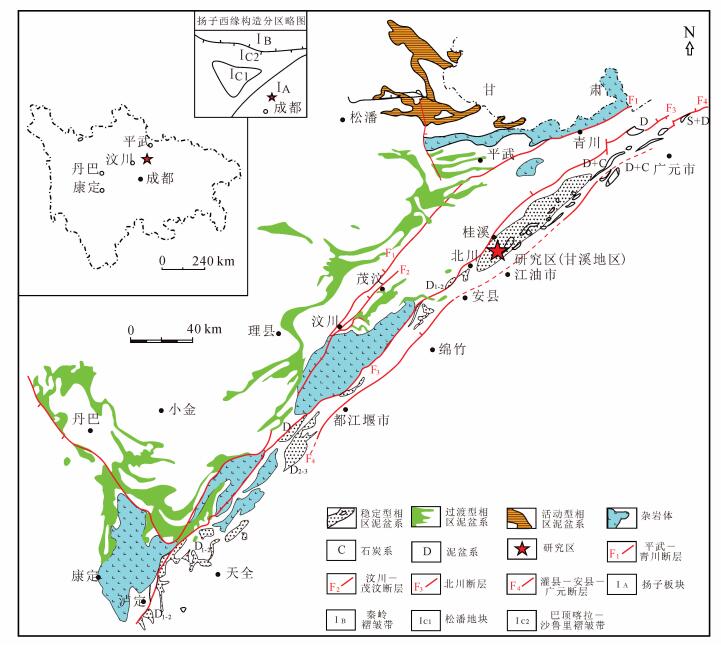
1 区域地质背景龙门山地区介于扬子板块与松潘地块之间, 是著名的逆冲推覆带, 它呈NE—SW向展布, 北接西秦岭褶皱带, 南邻康滇构造带 (图 1), 同属印支燕山构造期的产物。该区泥盆系自东向西可分为稳定型、过渡型和活动型3种地层类型[16-17], 研究区位于代表龙门山前泥盆系稳定型的甘溪地区, 为滨岸-浅海陆棚沉积环境[17]。
|
| 图 1 龙门山地区泥盆系相区分布地质图 Figure 1 Sketchmap showing the distribution of Devonian lithofacies in the Longmenshan area |
|
|
甘溪地区中泥盆统金宝石组顶部 (吉维特阶) 发育一套2~3 m的灰-深灰色微生物岩层, 由粒径0.1~4.0 cm大小的核形石组成, 体积分数10%~85%, 宏观特征 (图 2) 表现为核形石呈球状、帽状或变形状镶嵌于泥岩中 (图 2a、b)。

|
| a—c.密集分布的核形石微生物岩, 镶嵌于泥岩中, 粒径1.0~3.0 cm, 剖面1第5层中上部; d.泥岩中分布的核形石微生物岩粒径1.0~2.0 cm, 滑塌角砾岩中的核形石微生物岩粒径0.5~1.0 cm, 剖面1第4层中部。 图 2 研究区核形石微生物岩宏观特征 Figure 2 Macro-characteristics of oncolites in the study area |
|
|
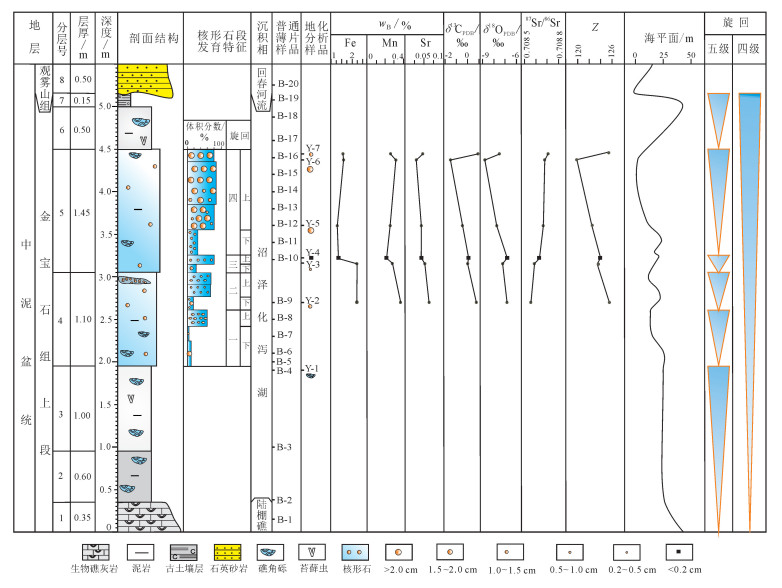
本文实测该套微生物岩层野外剖面4条, 以剖面1为例 (图 3), 垂向上具"礁灰岩层→苔藓虫发育的泥岩层→核形石发育的泥岩层→苔藓虫发育的泥岩层→古土壤层"的沉积演化特征, 进一步将核形石层分为4个旋回:① 旋回一核形石粒径0.5~1.5 cm, 以1.0 cm为主, 厚0.65 m, 下部体积分数3%~10%, 顶部增多至60%;② 旋回二下部核形石粒径0.5~1.5 cm, 以1.0 cm为主, 体积分数20%~25%, 厚0.15 m; 上部粒径以0.7cm为主, 体积分数40%~50%, 厚0.25 m; ③ 旋回三下部核形石粒径以1.0 cm为主, 体积分数10%, 厚0.1 m; 上部粒径以0.5cm为主, 体积分数80%, 厚0.1 m; ④ 旋回四下部核形石粒径以1.0 cm为主, 体积分数30%, 厚0.3 m; 上部粒径0.5~4.0 cm, 以2.0 cm为主, 体积分数70%~85%, 厚1.0 m。总体来看, 核形石发育层段从下往上粒度、密度有变大、变密的趋势, 其中旋回四核形石粒度、丰度最大。
|
| Z.盐度指数。 图 3 研究区中泥盆统金宝石组顶部核形石微生物岩层综合柱状图 Figure 3 Intergrative oncolites stratigraphic column of Middle Devonian Jinbaoshi Formation in the study area |
|
|
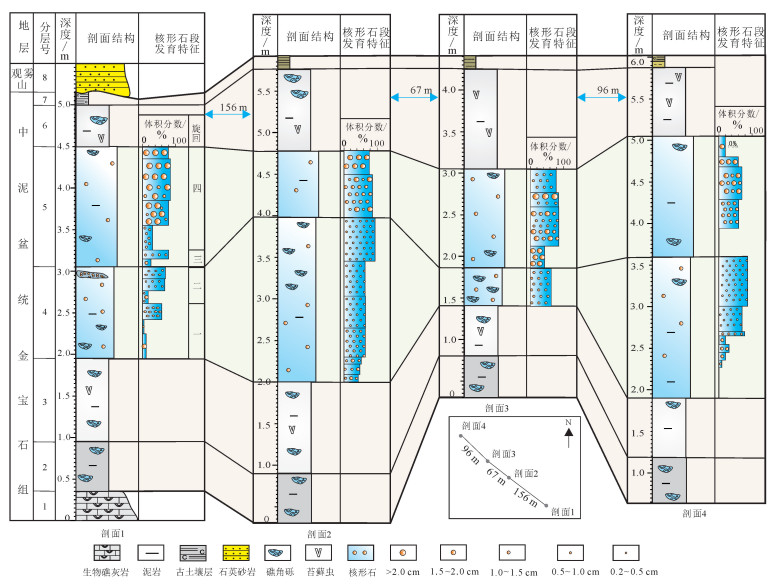
通过4条野外剖面对比分析, 横向上微生物岩层发育层位、粒径和丰度等方面表现出一定相似性:① 核形石微生物岩都发育于剖面中部的灰黑色泥岩中, 消失于枝状苔藓虫发育的下部及顶部泥岩层, 与富含苔藓虫的泥岩层段呈此消彼长; ② 所有剖面核形石均表现为下部核形石粒径小、含量少, 上部粒径大、含量多的特点 (图 4)。
|
| 图 4 研究区核形石微生物岩层剖面对比图 Figure 4 Comparison of oncolites sections in the study area |
|
|
剖面对比显示核形石微生物岩层厚度、粒径和丰度等方面也表现出一定差异性:① 在相距不到300 m的范围内, 泥岩层越厚, 核形石微生物岩越发育, 如剖面1—4泥岩分别厚5.5、4.1、5.6和4.8 m, 其核形石层段分别厚2.6、1.6、2.7和2.6 m; ② 核形石微生物岩局部区域丰度、密度变化较大, 表现为角砾岩不发育 (图 2c)、泥质滑塌角砾岩 (图 2d) 不发育的区域, 核形石微生物岩丰度更大, 如剖面1中第5层下部礁角砾岩发育的区域, 核形石微生物岩体积分数为10%, 而在横向延伸不足1.0 m的地方, 体积分数可达到60%(图 2c)。研究认为角砾岩相对较少的中上部剖面, 大粒径、高丰度的核形石微生物岩可代表一种稳定、高能、生长持续时间长的沉积环境; 角砾岩相对较发育的中下部剖面, 小粒径、低丰度核形石微生物岩可代表一种低能、持续时间短不稳定的沉积环境。
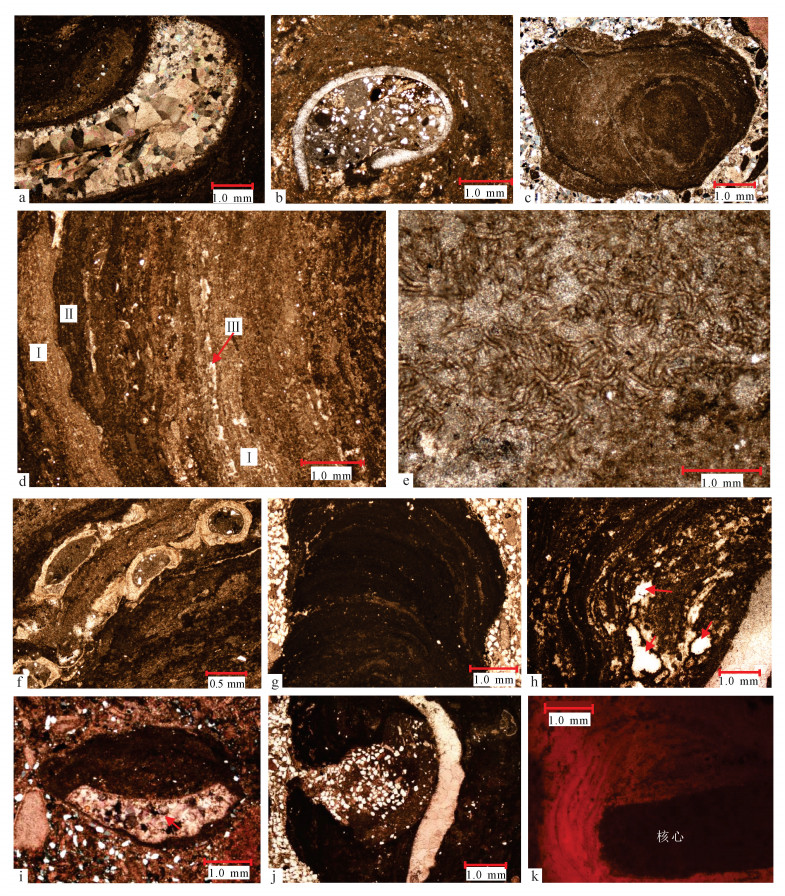
3 核形石微生物岩岩石学特征 3.1 核心核形石核心包括生物碎屑 (图 5a、b)、球粒或早期核形石微生物岩组成的球状体以及含藻泥晶结构体3类 (图 5c), 主要由瓣鳃、介壳、苔藓虫、有孔虫等生物碎屑组成。
|
| a.核心为瓣鳃的核形石, 剖面1第5层中上部, (+); b.核心为介壳的核形石, 剖面1第5层中部, (-); c.核心为藻球粒的核形石, 剖面2第4层底部, (-); d.泥-粉晶纹层 (Ⅰ) 和泥晶纹层 (Ⅱ) 互层, 夹粉晶纹层 (Ⅲ), 剖面4第5层顶部, (-); e.泥-粉晶结构亮色纹层中的葛万藻, 剖面3第4层中部, (-); f.含生物纹层, 剖面1第4层中上部, (-); g.凝块状纹层, 剖面3第4层下部, (-); h.微生物纹层, 红色箭头所指为鸟眼构造, 剖面1第4层中部, (-); i.帽状核形石, 红色箭头所指为海百合碎片, 剖面1第4层底部, (+); j.不规则状核形石, 剖面1第4层底部, (-); k.核形石微生物岩阴极发光照片, 剖面1第5层中部。 图 5 研究区核形石微生物岩微观特征 Figure 5 Micro-characteristics of oncolites in the study area |
|
|
研究区核形石微生物岩纹层具同心圈层结构, 由亮色和暗色2类纹层交织叠覆。
1) 亮色纹层:由粉晶方解石组成 (图 5d), 多数为连续、等厚状纹层, 少数为半连续、不等厚状纹层, 部分粉晶纹层呈凹凸状与泥晶纹层接触。亮色纹层中发育长约100 μm、宽10 μm的模糊丝状体 (图 5e), 这种模糊不清或模糊的丝状交错结构的微生物为葛万藻[18]。
2) 暗色纹层可分为泥晶纹层、凝块状纹层和藻纹层:① 泥晶纹层矿物成分主要由泥晶方解石组成, 多数呈半连续、不等厚状分布, 纹层厚0.1~1.0 mm, 交织出现于核形石微生物岩包壳的各个圈层中 (图 5d), 局部可由微生物捕获或黏结腹足、有孔虫和腕足等生物碎片 (图 5f), 纹层中葛万藻发育; ② 凝块状纹层由杂乱的含藻类泥晶方解石组成, 呈不规则团块状, 无明显圈层结构 (图 5g), 富含有机质; ③ 藻纹层由泥晶方解石组成, 藻丝体明显 (图 5h), 纹层厚0.2~1.0 mm, 藻体向外呈放射状生长, 边缘波状起伏, 主要为藻依靠光合作用吸附和捕获碳酸盐质点而形成。暗色纹层中的泥晶方解石, 大部分被认为是葛万藻管道中或管道外的矿物沉淀及被葛万藻捕获或粘结的环境沉积物, 其中少部分是埋藏演化中风化后的葛万藻丝体, 这些藻丝体结构的完整程度取决于整个埋藏沉积过程中先期钙化与风化及之后的成岩作用过程[19]。
3.3 核心与纹层的关系核形石微生物岩核心组分、粒径、形态及水动力条件等共同影响核心呈悬浮状或固着水底状态, 进而影响核形石微生物岩纹层发育以及核形石微生物岩的整体形态。研究区核形石微生物岩核心与纹层发育存在如下关系:
1) 核心组分与纹层的关系:当核心为生物碎屑时, 生物碎屑骨骼的核心密度相对低, 易悬浮于水中, 藻类、微生物等围绕生物碎屑核心生长, 捕获和粘附碳酸盐质点, 表现为全方位生长, 受沉积水动能条件影响, 亮色纹层与暗色纹层交互生长。当核心为球粒或早期核形石微生物岩组成的球状体和含藻泥晶结构体时, 核心物质密度相对较大, 易于沉入水底。若水动能较低时, 颗粒未能连续翻动, 藻类、微生物等吸附和捕获碳酸盐质点, 易形成暗色纹层; 若沉积水动能条件较强时, 核心也可悬浮于水中, 形成亮色纹层。
2) 核心大小与纹层的关系:在相同的沉积水动力条件下, 小核心更易悬浮于水中, 发育亮色纹层和暗色纹层交替的同心纹层; 大核心不易悬浮发生滚动或较少发生滚动, 易形成暗色纹层。研究区核形石微生物岩纹层以暗色纹层与亮色纹层交替发育为主, 较少发育单一的暗色纹层, 显示核形石微生物岩形成时总体具较强劲的水动力条件。
3) 核心形状与纹层的关系:核心形状多样, 以长条状为主, 但核形石都以球状或椭球状为主, 可见核形石微生物岩在形成过程中已抵消核心原始外形对最终外形发育的影响, 随着纹层厚度增大, 核形石微生物岩呈现出一定程度的圆化或椭圆化趋势。
3.4 核形石微生物岩类型目前核形石微生物岩分类主要按照"形"[20]、组分及"形"+成因环境[21]3种分类方法。本文以Dahanayake[20]按"形"分类为主线, 根据核形石微生物岩的形态、核心结构、位置和纹层特征, 将研究区核形石微生物岩分为球状、帽状和变形状3类核形石微生物岩。
1) 球状核形石微生物岩 (图 5a、b、c):形态以球状为主, 部分椭球状, 直径0.1~4.0 cm, 含量最多, 可占所有核形石微生物岩体积分数的70%。这类核形石微生物岩核心以瓣鳃、腹足和苔藓虫等浅水生物为主, 包壳纹层由含陆源石英砂的暗色纹层和亮色纹层交替组成, 粒径越大, 亮色纹层所占纹层比例越高。
2) 帽状核形石微生物岩 (图 5i):形态为似半球状或帽状, 分布极少, 主要发育于核形石微生物岩层段的中下部。核心以固着生长为主, 有纹层包绕整个核心, 但核心明显偏于一侧, 由于光合作用、藻类的捕获和粘附作用影响, 层层向上生长, 纹层类型单调, 以微生物纹层、凝块状纹层和泥晶纹层为主, 形成于低能环境。
3) 变形状核形石微生物岩 (图 5j):外形极其不规则, 凹凸不平, 周围被陆源碎屑入侵, 还可见部分核形石微生物岩被陆源碎屑入侵后继续生长现象, 说明该变形状核形石微生物岩的形成, 既有波浪淘洗作用, 也有藻丝体本身对于环境沉积物的吸附作用。
3.5 核形石微生物岩纹层组合及外部形态的环境意义一般说来, 具同心纹层的普通核形石微生物岩代表着水体充分搅动的高能环境, 同心纹层密集, 外形近于圆形的能量较高, 层纹数量少或外形不规则以及扁平者代表能量较低的环境[13]。形态学特征的差异性在一定程度上取决于沉积环境的稳定程度[14]。研究区球状核形石微生物岩具浅水生物核心、圆形的形态、暗色纹层与亮色纹层互层以及纹层密集的特点, 表明其形成于持续高能环境中, 核形石粒径越大, 表明其经历的高能环境持续时间越长; 帽状核形石微生物岩具帽状形态、暗色纹层为主的特点, 表明其形成于水体能量较低的环境。
4 核形石微生物岩地球化学特征地球化学特征在反映沉积环境各方面特征的研究中具有重要意义[21-23]。本文对核形石微生物岩层段全岩样品Fe、Mn、Sr微量元素和C、O、Sr稳定同位素, 以及亮色、暗色纹层的C、O同位素进行了分析。
4.1 样品采集及测试数据 4.1.1 全岩样品采集及测试数据所有样品均以显微镜下的岩石学鉴定分析为依据, 地球化学样品采用微区取样, 尽量避开杂质和胶结物, 以保证样品的纯度及其可靠性与代表性。Sr同位素测试由南京大学现代分析中心同位素质谱室分析完成, 测定误差小于0.02%;δ13C和δ18O值由西南大学地理科学学院地球化学与同位素实验室分析完成, δ13C的分析误差范围为0.006‰~0.042‰, δ18O的分析误差范围为0.009‰~0.043‰; Fe, Mn, Sr质量分数由中国地质科学院矿产综合利用研究所分析测试中心分析, 测试误差小于0.002‰。测试结果见表 1。
| 序号 | 样品名称 | 位置/m | 粒径/cm | w(Fe)/% | w(Mn)/% | w(Sr)/% | δ13CPDB/‰ | δ18OPDB/‰ | 87Sr/86Sr |
| Y-7 | 核形石 | 4.5 | 1.5 | 1.56 | 0.26 | 0.048 | 0.92 | -7.52 | 0.708 703 |
| Y-6 | 核形石 | 4.4 | 3.0 | 1.60 | 0.32 | 0.030 | -1.52 | -8.77 | 0.708 671 |
| Y-5 | 核形石 | 3.6 | 2.0 | 1.32 | 0.26 | 0.042 | -0.46 | -7.72 | 0.708 662 |
| Y-4 | 围岩 | 3.2 | 1.37 | 0.22 | 0.043 | 0.05 | -6.79 | 0.708 625 | |
| Y-3 | 核形石 | 3.1 | 0.5 | 2.22 | 0.28 | 0.052 | 0.02 | -7.22 | 0.708 586 |
| Y-2 | 核形石 | 2.7 | 1.0 | 2.21 | 0.37 | 0.063 | 0.80 | -6.85 | 0.708 552 |
| Y-1 | 礁角砾 | 1.8 | 30~50 | 2.04 | 0.10 | 0.008 | 0.11 | -6.20 | 0.708 513 |
对显微镜下亮色和暗色纹层分别激光取样[24], C、O同位素分析由中国石油西南油气田分公司勘探开发研究院实验中心测试完成, 所得结果见表 2, 测试误差为±2‰。
| 纹层类型 | 矿物成分 | 样号 | δ13CPDB/‰ | δ18OPDB/‰ | Z=2.048(δ13C+50)+0.498(δ18O+50) |
| 暗色 | 泥晶方解石 | 1 | 0.61 | -9.52 | 123.808 |
| 泥晶方解石 | 2 | 0.01 | -10.44 | 122.080 | |
| 泥晶方解石 | 4 | 0.14 | -10.79 | 122.213 | |
| 泥晶方解石 | 6 | 0.31 | -8.93 | 123.488 | |
| 亮色 | 粉晶方解石 | 3 | -1.06 | -11.52 | 119.392 |
| 泥-粉晶方解石 | 5 | -0.69 | -9.65 | 121.081 | |
| 注:以Z=120为咸水和淡水分界线, Z值越高反映的流体盐度越高[22]。 | |||||
核形石微生物岩样品微量元素Sr/ Mn都小于2, 在阴极灯照射下, 核心呈暗色, 但纹层发光明显, 呈紫红色 (图 5k), 表明核形石纹层已遭受成岩作用影响; 前人取该地区金宝石组顶部上、下相邻层位的样品, 样品分析均表现为未受后期成岩作用影响[25-26], 推断同为新鲜面、避开杂质和胶结物的核形石微生物岩样品, 经历的成岩蚀变主要时期为准同生期—古表生期, 核形石顶部的古风化壳也是其证据之一。因此, 本项目核形石微生物岩样品地球化学特征可反映沉积时期海水与准同生期古表生期综合地球化学特征。
4.3 Fe、Mn、Sr微量元素地球化学特征现今研究证实微生物岩中微量元素含量变化或许反映其沉积背景和生物膜内的新陈代谢等重要信息, 其丰度特征反映最为明显[27-28]。
研究区核形石微生物岩Fe质量分数1.32%~2.22%, 平均1.78%, Mn质量分数0.26%~0.37%, 平均0.3%, Sr质量分数0.030%~0.063%, 平均0.047%;围岩Fe质量分数1.37%, Mn质量分数0.22%, Sr质量分数0.043%;礁角砾灰岩Fe质量分数2.04%, Mn质量分数0.10%, Sr质量分数为0.008%。总体来说, 研究区核形石微生物岩层段样品Fe、Mn、Sr质量分数整体都偏高, Fe质量分数偏高的原因可能是作为微生物新陈代谢中氢化酶极需金属元素Fe[29], Mn质量分数偏高是因为葛万藻在进行光合作用时, 其水解络合物极需Mn元素[30]。
4.4 C、O同位素地球化学特征 4.4.1 全岩C、O同位素地球化学特征核形石微生物岩δ13CPDB值为-1.52‰~0.92‰, 平均-0.048‰, δ18OPDB值为-8.77‰~-6.85‰, 平均-7.616‰; 围岩δ13CPDB值为0.05‰, δ18OPDB值为-6.79‰; 礁角砾灰岩δ13CPDB值为0.11‰, δ18OPDB值为-6.20‰。
同前人研究蓝藻类碳酸盐岩的成果相似[31], 研究区核形石微生物岩表现出一定的宽δ13C (变化范围:2.44), 窄δ18O (变化范围:1.92) 的特征 (图 6), 前人认为特别明显的宽窄特征是蓝藻生存的水体因不断有新的水体注入, 而分馏程度不够高造成[32], 而研究区宽窄现象不那么明显, 或许是因为新水体注入量不足, 因而产生水体分馏效应。其中, 碳同位素通常被用来区别微生物岩与非生物成因的碳酸盐岩, 并用来反映有机活跃度[33], 与研究区该时期腕足化石δ13C值 (0~+1‰)[25]相比, 2~3 cm大小的核形石微生物岩δ13C明显偏负, 可以被认为是葛万藻新陈代谢中有机活跃度极高的佐证; 与研究区该时期腕足化石δ18O值 (-4‰~-6‰)[25]相比, 微生物岩层样品δ18OPDB值都具明显负偏移特征, 可能与金宝石组末期海平面下降, 微生物岩暴露接受大气淡水的淋滤有关。
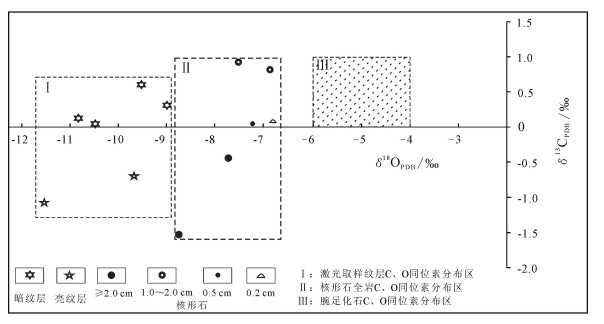
|
| 图 6 研究区核形石微生物岩层样品碳、氧同位素分布图 Figure 6 Distribution of δ13C and δ18O of oncolites in the study area |
|
|
亮色纹层δ13CPDB值为-1.06‰、-0.69‰, 平均为-0.875‰, δ18OPDB值为-11.52‰、-9.65‰, 平均为-10.585‰; 暗色纹层δ13CPDB值为0.01‰~0.61‰, 平均0.27‰, δ18OPDB值为-10.79‰~-8.93‰, 平均-9.866‰。亮色纹层相对于暗色纹层δ13CPDB值和δ18OPDB值具明显偏负特征 (图 6), 认为亮色纹层形成时期可代表葛万藻新陈代谢中有机活跃度极高、海平面下降幅度最大的时期。
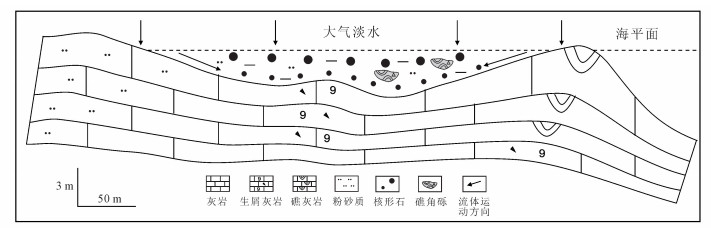
|
| 图 7 研究区核形石微生物岩发育沉积模式 Figure 7 Sedimentary pattern of oncolites in the study area |
|
|
球状核形石微生物岩样品87Sr/86Sr值分布于0.708 552~0.708 703, 平均为0.708 635;围岩样品87Sr/86Sr为0.708 625;礁角砾灰岩样品87Sr/86Sr为0.708 513。该地区中泥盆统金宝石组时期海水87Sr/86Sr为0.707 775~0.707 892[26], 与之对比, 核形石微生物岩层样品87Sr/86Sr都偏高。一种可能的解释是核形石微生物层形成过程中, 海平面下降, 受到了大气淡水淋滤而被富含87Sr的陆源物质的混入, 以及成岩之后的微生物岩层于古表生期受到了大气水淋滤而被富含87Sr的陆源物质的混入, 这同龙门山海域该时期海平面下降的认识相一致[34]。剖面从下到上, 核形石微生物岩87Sr/86Sr逐渐升高, 可能是受壳源锶影响渐强所致。
5 讨论 5.1 纹层成因讨论对核形石微生物岩中暗色纹层成因大多一致认为是富藻层[2-4], 然而对亮色纹层成因的解释主要有两种观点:一种认为其为富屑纹层, 是贫藻阶段产物, 以平邑盆地、松辽盆地为例[3-4]; 另一种观点认为亮色纹层是成岩重结晶的产物, 仍为富藻纹层, 以四川秀山为例[2]。
龙门山甘溪地区中泥盆统核形石微生物岩亮色纹层富含残余葛万藻丝体, 富藻特征明显, 应为富藻阶段的产物, 结合亮色纹层δ13CPDB值和δ18OPDB值最大负偏的同位素数据, 显示亮色纹层形成于海平面下降、大气淡水参与、水动力强且富藻的时期。暗色纹层成因与前人观点一致, 主要为富藻纹层, 颜色越深越富藻, 表现为凝块石纹层最富藻, 其次为藻纹层, 泥晶纹层最少, 但暗色纹层正常的δ13CPDB值、偏负的δ18OPDB值表明暗色纹层形成过程中仍有大气淡水参与。
5.2 成因机制探讨总的来说, 微生物岩有两种基本形成模式[35]:1) 微生物直接捕获和粘合环境沉积物; 2) 微生物新陈代谢过程中自身诱导并集中各种不同的矿物沉淀。
研究区核形石微生物岩皆由呈圈层状分布的葛万藻作为包壳环绕生物碎屑核心组成, 因此, 我们从葛万藻的特点入手研究。葛万藻在微生物岩建造中的角色很多:1) 在微生物岩礁中, 可以是框架间的粘合剂或外壳甚至是造礁生物的框架[18, 36]; 2) 在核形石微生物岩中, 主要作为外壳的组成部分; 3) 在叠层石中, 作为叠层石的夹层或粘合剂[37]。目前已知的地质历史记录中, 葛万藻属于营底栖生长的藻类植物[22], 被报道在古生代时期普遍生存于一套"泥丘系统 (mud-mounds systems)"中, 这套系统可以存在于浅水环境, 也可以是深水环境[38]。从薄片照片 (图 2i, j) 中, 可以明显看到微生物岩受到了陆源碎屑的入侵, 因此, 此地的微生物岩可能形成于一个具陆源碎屑供给, 水深较浅 (葛万藻生存环境决定), 适宜葛万藻生长以及钙质沉淀的环境。
根据剖面实测, 核形石微生物岩发育于礁后泻湖相中, 在海平面下降的过程中, 先期海水深度适宜苔藓虫等生物繁殖, 随着海平面下降, 当海水深度适宜葛万藻繁殖时, 由于混有大气淡水的海水的动荡以及葛万藻丝体的粘附性, 造成藻丝体以某些相对稳定的颗粒为核心裹成藻球, 这便为核形石微生物岩的形成提供了先期的条件。随着海平面的快速下降, 下部刚刚包裹成球的葛万藻还没来得及继续生长, 便被陆源碎屑掩埋或被高处掉落的礁灰岩角砾压迫, 在核形石微生物岩层段, 可见直径30~50 cm的不规则生物礁角砾于下部密集分布、上部稀疏排列, 便是该时期海水剥蚀滨岸礁石或高位陆棚以及频繁区域地质运动所致。因此, 剖面下半段的核形石微生物岩丰度普遍较低, 粒径普遍较小, 且形态多被破坏。在相对海平面相对平稳期, 长时间的适宜条件促进了更大更完整的葛万藻球的形成。依据对核形石微生物岩核心物质、富含葛万藻等微生物的纹层和核形石微生物岩类型的研究, 结合核形石微生物岩全岩稳定同位素和不同纹层碳、氧同位素分析, 认为研究区核形石微生物岩是在葛万藻发育、水流扰动及大气淡水参与的环境下, 葛万藻包覆于生屑的外缘而成 (图 7); 核形石微生物岩发育主要受控于核心物质组分、葛万藻发育程度、水体能量高低、持续时间长短等因素, 其藻类越发育、水体能量越高、沉积环境越稳定, 形成的核形石微生物岩粒径就越大、丰度越高。
5.3 形成的古环境意义微生物岩本身便是一种连续的微生物岩沉积建造[39], 其形成将受到周围环境的影响。因海平面急剧下降, 部分本来是被海水淹没的滨海区域海水急剧浓缩, 分馏效应加强, 礁后泻湖环境中的海水富营养化加重, 造成葛万藻过渡生长, 动荡的海水环境为葛万藻黏附包裹其他营底栖动物 (如腹足、苔藓虫等) 创造可能, 除此之外, 葛万藻本身便会捕获和粘合环境沉积物。海平面的下降及少量陆源碎屑的入注, 为底栖动物的生长带来需要的养分, 满足了葛万藻包裹成球的条件, 为核形石微生物岩的形成提供了可能。然而相对海平面急剧下降, 区域构造的频繁活动, 会导致陆源碎屑大量入侵, 并伴随有高位陆棚和滨岸礁石的掉落, 影响微生物岩粒径、丰度和结构。总体来看, 上部微生物岩粒径、丰度等方面总体优于下部, 以及显示为泥岩层发育越厚, 微生物岩层段厚度就越大的特点, 这或许可以与相对海平面的升降有关。由此可见, 多个旋回的微生物岩发育可反映出, 海平面下降大, 区域构造的活动性频繁。
Johnson对泥盆纪全球海平面变化研究表明, 中泥盆统艾菲尔阶—吉维特期为海平面上升期, 然而龙门山地区金宝石组末期海平面表现为大幅下降而暴露于地表, 金宝石组顶部发育10 cm厚的古土壤层[35]。从核形石微生物岩剖面中可以看到, 核形石微生物岩由小到大、丰度由低到高的沉积旋回, 反映出海平面具有快速下降→缓慢下降→持续平稳的变化特点, 具大气淡水成因的核形石微生物岩进一步证实了龙门山地区金宝石组末期发生了海平面下降事件, 核形石微生物岩粒径越大、丰度越高表现为其受大气淡水影响越强烈。据此, 将核形石微生物岩层进一步划分出6个次一级海平面下降的旋回 (图 3), 第1旋回为从陆棚向泻湖过渡的向上变浅环境, 第2—5旋回表现为核形石微生物岩发育层段中4个核形石微生物岩旋回, 第6旋回表现为核形石微生物岩发育的泥岩层段向苔藓虫发育的泥岩层段过渡。研究表明金宝石组末期古构造抬升不是一撮而就的, 应为脉动式抬升, 至少可以分为6期次一级构造抬升期, 构造作用逐渐加强, 水体逐渐变浅, 直至完全暴露于地表遭受风化剥蚀。
6 结论1) 川西北甘溪地区吉维特阶发育一套厚2~3 m灰-深灰色微生物岩, 由直径0.1~4.0 cm的核形石组成, 可分为球状、帽状和变形状3类核形石微生物岩, 垂向上可分4个旋回, 从底到顶核形石密度和粒径总体变密、变大, 平面上呈不均匀发育。
2) 核形石微生物岩的形成受葛万藻和大气淡水的双重控制作用, 生物碎屑不断地被水流扰动, 使得葛万藻包覆于生屑的外缘而成藻灰结核, 是有机成因和无机成因共同作用的产物, 其葛万藻发育的沉积环境控制了微生物岩发育的位置, 水动能大小、环境持续稳定时间控制了微生物岩的大小和丰度。
3) 核形石微生物岩在纵、横向分布特征, 表明在全球中泥盆统艾菲尔期—吉维特期海平面上升背景下, 龙门山地区吉维特金宝石组末期表现为至少6期次脉动式且逐渐强烈的构造抬升作用, 造成该地区金宝石组末期海平面大幅下降而暴露于地表遭受大气淡水的淋滤作用。
| [1] | 杨仁超, 樊爱萍, 韩作振, 等. 核形石研究现状与展望[J]. 地球科学进展, 2011, 26(5): 465-474. Yang Renchao, Fan Aiping, Han Zuozhen, et al. Status and Prospect of Studies on Oncoid[J]. Advances in Earth Science, 2011, 26(5): 465-474. |
| [2] | 侯奎, 陈延成. 四川秀山下寒武统清虚洞组的骨骼葛万藻藻鲕及岩石学意义[J]. 岩石学报, 1990, 6(4): 85-90. Hou Kui, Chen Yancheng. Skeletal Girvanella Oolites and Its Petrological Significance in Lower Cambrean of Xiushan, Sichuan Province[J]. Acta Petrologica Sinica, 1990, 6(4): 85-90. |
| [3] | 杨玉芳, 钟建华, 曾石岐, 等. 松辽盆地早白垩世青山口组核形石的特征及其环境意义[J]. 地质学报, 2009, 83(4): 558-569. Yang Yufang, Zhong Jianhua, Zeng Shiqi, et al. Characteristics of Oncoids in the Early Cretaceous Qingshankou Formation, Songliao Basin and Its Environmental Significance[J]. Acta Geologica Sinica, 2009, 83(4): 558-569. |
| [4] | 李熙哲, 管守锐, 谢庆宾, 等. 平邑盆地下第三系官中段核形石成因分析[J]. 岩石学报, 2000, 16(2): 261-268. Li Xizhe, Guan Shourui, Xie Qingbin, et al. The Oncoids Genesis in the Middle Member of the Guanzhuang Formation of Eocene in Pingyi Basin[J]. Acta Petrologica Sinica, 2000, 16(2): 261-268. |
| [5] | 王小敏, 陈昭年, 樊太亮, 等. 巴麦地区晚石炭世碳酸盐岩台内滩储层综合评价[J]. 吉林大学学报 (地球科学版), 2013, 43(2): 371-381. Wang Xiaomin, Chen Zhaonian, Fan Tailiang, et al. Integrated Reservoir Characterization of Late Carboniferous Carbonate Inner Platform Shoals in Bamai Region, Tarim Basin[J]. Journal of Jilin University (Earth Science Edition), 2013, 43(2): 371-381. |
| [6] | Johnson J H. A Permian Algal-Foraminiferal Consor-tium from West Texas[J]. Journal of Paleontology, 1950, 24: 61-62. |
| [7] | Toomey D F, Lowenstein T K, Mitchell R W. Re-Examination of Laminated Osagid Grains from a Lower Permian Mid-Continent Limestone[J]. Palaios, 1989, 4: 51-62. DOI:10.2307/3514733 |
| [8] | Elicki O. Palaeoecological Significance of Calcimicro-bial Communities During Ramp Evolution:An Example from the Lower Cambrian of Germany[J]. Facies, 1999, 41: 27-40. DOI:10.1007/BF02537458 |
| [9] | Whalen M T, Day J, Eberli G, et al. Microbial Car-bonates as Indicators of Environmental Change and Biotic Crises in Carbonate Systems:Example from the Late Devonian, Alberta Basin, Canada[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2002, 181: 127-151. DOI:10.1016/S0031-0182(01)00476-X |
| [10] | Batten Hender K L, Dix G R. Facies Development of a Late Ordovician Mixed Carbonate-Siliclastic Ramp Proximal to the Developing Taconic Orogen:Lourdes Formation, Newfoundland, Canada[J]. Facies, 2008, 54: 121-149. DOI:10.1007/s10347-007-0126-0 |
| [11] | Glass S W. The Peterson Limestone-Early Cretaceous Lacustrine Carbonate Deposition in Western Wyoming and Southeastern Idaho[J]. Sedimentary Geology, 1980, 27(2): 143-160. DOI:10.1016/0037-0738(80)90034-2 |
| [12] | Peryt T M. Oncoids-Acomment to Recent Develop-ments[C]//Peryt T M, Coated Grains. New York:Springer Berlin Heidelberg, 1983:273-275. |
| [13] | 侯鸿飞, 王士涛. 中国的泥盆系:中国地层[M]. 北京: 地质出版社, 1988: 166-177. Hou Hongfei, Wang Shitao. Devonian of China:China Stratigraphic[M]. Beijing: Geological Publishing House, 1988: 166-177. |
| [14] | 刘文均, 陈源仁, 郑荣才, 等. 四川龙门山泥盆系:Ⅱ:层序地层[M]. 成都: 成都科技大学出版社, 1996: 1-11. Liu Wenjun, Chen Yuanren, Zheng Rongcai, et al. Sichuan Devonian in Longmen Mountain:Ⅱ:Sequence Stratigraphy[M]. Chengdu: Chengdu Science and Technology University Press, 1996: 1-11. |
| [15] | 郑荣才, 刘文均. 龙门山泥盆纪层序地层的碳、锶同位素效应[J]. 地质论评, 1997, 43(3): 264-272. Zheng Rongcai, Liu Wenjun. Carbon and Strontium Isotopic Effects of the Devonian Sequence in the Longmen Mountains Area[J]. Geological Review, 1997, 43(3): 264-272. |
| [16] | 李祥辉, 曾允浮. 扬子西缘泥盆纪碳酸盐与陆源碎屑的混积层序和层序混积模式[J]. 沉积学报, 1999, 17(3): 339-344. Li Xianghui, Zeng Yunfu. Sequence Stratigraphy of Mixed Carbonate and Siliciclastic Sediments in Devonian Along the Western Margin of Yangtze Plate[J]. Acta Sedimentologica Sinica, 1999, 17(3): 339-344. |
| [17] | 刘文均, 郑荣才, 李祥辉. 龙门山泥盆纪沉积盆地的古地理和古构造重建[J]. 地质学报, 1999, 73(2): 109-119. Liu Wenjun, Zheng Rongcai, Li Xianghui. Reconstruction of Palaeogeography and Palaeotectonics of a Devonian Sedimentary Basin in the Longmen Mountain Area, Sichuan[J]. Acta Geologica Sinica, 1999, 73(2): 109-119. |
| [18] | Shen J W, Webb G E. The Role of Microbes in Reef-Building Communities of the Cannindah Limestone (Missis-Sipian), Monto Region, Queensland, Australia[J]. Facies, 2008, 54: 89-105. DOI:10.1007/s10347-007-0116-2 |
| [19] | Riding R, Fan J. Ordovician Calcified Algae and Cya-nobacteria, Northern Tarim Basin Subsurface, China[J]. Palaeontology, 2001, 44: 783-810. DOI:10.1111/pala.2001.44.issue-4 |
| [20] | Dahanayake K. Sequential Position and Environmental Significance of Different Types of Oncoids[J]. Sedimentary Geology, 1978, 20: 301-316. DOI:10.1016/0037-0738(78)90060-X |
| [21] | Flügel E. Microfacies of Carbonate Rocks[M]. New York: Springer Berlin Heidelberg, 2004. |
| [22] | Keith M L, Weber J N. Carbon and Oxygen Isotopic Composition of Mollusk Shells from Marine and Fresh-Water Environments[J]. Geochimica et Cosmochimica Acta, 1964, 28(10/11): 1786-1816. |
| [23] | Veizer J, Hoefs J. The Nature of O18/O16 and C13/C12 Secular Trends in Sedimentary Carbonate Rocks[J]. Geochim Cosmochim Acta, 1976, 40(11): 1387-1395. DOI:10.1016/0016-7037(76)90129-0 |
| [24] | 罗平, 苏立萍, 罗忠, 等. 激光显微取样技术在川东北飞仙关组鲕粒白云岩碳氧同位素特征研究中的应用[J]. 地球化学, 2006, 35(3): 221-226. Luo Ping, Su Liping, Luo Zhong, et al. Application of Laser Micro-Sampling Technique to Analysis of C and O Isotopes of Oolitic Dolomites in Feixianguan Formation, Northeast Sichuan[J]. Geochimica, 2006, 35(3): 221-226. |
| [25] | 程红光, 李心清, 袁洪林, 等. 泥盆纪海水的碳、氧同位素变化:来自腕足化石的同位素记录[J]. 地球学报, 2009, 30(1): 79-88. Cheng Hongguang, Li Xinqing, Yuan Honglin, et al. Carbon and Oxygen Isotope Variations of Devonian Seawater:Isotpic Records from Brachiopod Shell[J]. Acta Geoscientica Sinica, 2009, 30(1): 79-88. |
| [26] | 程红光, 李心清, 袁洪林, 等. 龙门山泥盆纪腕足化石锶同位素组成特征及其古环境意义[J]. 地球化学, 2009, 38(2): 187-194. Cheng Hongguang, Li Xinqing, Yuan Honglin, et al. Strontium Isotope Composition and Paleoenvironmental Implication of Devonian Brachiopod Shells from Longmen Mountains[J]. Geochimica, 2009, 38(2): 187-194. |
| [27] | Webb G E, Kamber B S. Rare Earth Elements in Holocene Reefal Microbialites:A New Shallow Seawater Proxy[J]. Geochim Cosmochim Acta, 2000, 64: 1557-1565. DOI:10.1016/S0016-7037(99)00400-7 |
| [28] | Nothdurft L D, Webb G E, Kamber B S. Rare Earth Element Geochemistry of Late Devonian Reefal Carbonates, Canning Basin, Western Australia:Confirmation of a Seawater REE Proxy in Ancient Limestones[J]. Geochim Cosmochim Acta, 2004, 68: 263-283. DOI:10.1016/S0016-7037(03)00422-8 |
| [29] | Fortin D, Langley S. Formation and Occurrence of Biogenic Iron-Rich Minerals[J]. Earth Sci Rev, 2005, 75: 1-19. |
| [30] | Sigel A, Sigel H, Sigel R K O. Nickel and Its Surprising Impact in Nature:Metal Ions in Life Sciences[M].[S.l.]:John Wiley & Sons Ins, 2007:323-356. |
| [31] | Ordóñez S, González Martín J A, García del Cura M A, et al. Temperate and Semi-Arid Tufas in the Pleistocene to Recent Fluvial Barrage System in the Mediterranean Area:The Ruidera Lakes Natural Park (Central Spain)[J]. Geomorphology, 2005, 69: 332-350. DOI:10.1016/j.geomorph.2005.02.002 |
| [32] | Leng M J, Marshall J D. Palaeoclimate Interpretation of Stable Isotope Data from Lake Sediment Archives[J]. Quaternary Science Reviews, 2004, 23: 811-831. DOI:10.1016/j.quascirev.2003.06.012 |
| [33] | Andres M S, Sumner D Y, Reid R P, et al. Isotopic Fingerprints of Microbial Respiration in Aragonite from Bahamas Stromatolites[J]. Geology, 2005, 34: 973-976. |
| [34] | 李祥辉, 刘文均, 郑荣才. 龙门山地区泥盆纪海平面升降规程、频幅及对比[J]. 成都理工学院学报, 1998, 25(4): 495-502. Li Xianghui, Liu Wenjun, Zheng Rongcai. Frequency, Amplitude and Pattern of Sea-Level Changes in Devonian in Longmen Mountains, Western Yangtze[J]. Journal of Chengdu University of Technollogy, 1998, 25(4): 495-502. |
| [35] | Dupraz C, Visscher P T. Microbial Lithification in Marine Stromatolites and Hypersaline Mats[J]. Trends Microbiol, 2005, 13: 429-438. DOI:10.1016/j.tim.2005.07.008 |
| [36] | Riding R. Abiogenic, Microbial and Hybrid Authi-genic Carbonate Crusts:Components of Precambrian Stromatolites[J]. Geologia Croatica, 2008, 61: 73-103. |
| [37] | Adachi N, Ezaki Y, Pickett J W. Marked Accumu-lation Patterns Characteristic of Lower Devonian Stromatoporoid Bindstone:Palaeoecological Interactions Between Skeletal Organisms and Microbes[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2006, 231: 331-346. DOI:10.1016/j.palaeo.2005.09.002 |
| [38] | Pratt B R. Calcification of Cyanobacterial Filaments:Girvanella and the Origin of Lower Paleozoic Lime Mud[J]. Geology, 2001, 29: 763-766. DOI:10.1130/0091-7613(2001)029<0763:COCFGA>2.0.CO;2 |
| [39] | Riding R. Classification of Microbial Carbonates[C]//Riding R. Calcareous Algae and Stromatolites. Berlin:Springer, 1991:21-51. |


