0 前言
阿特拉津(2-氯-4-乙胺基-6-异丙胺基-均三嗪)又称莠去津, 是均三氮苯类农药[1], 可消除一年生禾本科杂草和阔叶杂草, 对某些多年生杂草也具有一定的抑制作用[2]。阿特拉津自1959年投入商业生产以来, 由于其价格低廉、除草效果好等特点, 目前仍在世界范围内得到广泛使用。但研究表明, 阿特拉津能够影响人体免疫系统和生殖系统, 还可诱发脑癌[3]; 同时阿特拉津水溶性强、结构稳定、具有较强的迁移性能, 残留在土壤中的阿特拉津可通过径流作用进入地表水, 通过渗滤作用污染地下水。DeNoyelles和Davies等[4-5]分别发现美国和澳大利亚河流中阿特拉津的质量浓度高达1 mg/L。在我国, 阿特拉津污染形势同样严峻, 如:洋河下游农灌区污染导致大面积农作物死亡[6]、辽宁省特大水田污染事故[7]、官厅水库上游大面积农田污染事件[8]等均对环境造成了严重的危害。因此, 有效控制阿特拉津在环境中的迁移以及修复被阿特拉津污染的环境一直是环境领域研究的热点问题。
近年来, 随着研究的深入, 比较常用的阿特拉津处理技术包括:高级氧化工艺(advanced oxidation processes, AOPs)[9]、生物处理(生物添加)[10]、吸附去除法[11]等。其中吸附去除法是指目标物存在于某一相位, 污染物通过该相位与另一相位在交界面处的聚集作用而被去除[12]。相对于高级氧化工艺, 吸附去除法运行成本较为低廉、易于控制管理, 被认为是一种较为有效的处理方法[13]。
生物质炭是由生物残体在缺氧的情况下, 经高温慢热解(通常<700℃)产生的一类难熔、稳定、高度芳香化的、富含碳素的固态物质[14]。从微观结构上看, 生物质炭表面多孔性特征显著, 比表面积大, 表面羧基、酚羟基、羰基等官能团构成了生物质炭良好的吸附特性, 可有效吸附去除一些污染物质[15]。另外, 在农业上, 生物质炭不仅能够增加土壤肥力、有效调控土壤中营养元素的循环、提高土壤的持水能力和供水能力, 还可通过减少水溶性营养离子的溶解迁移避免营养元素的淋失[16]。生物质炭施加到土壤中, 势必会对阿特拉津的迁移产生影响, 因此有必要研究生物质炭对阿特拉津的吸附性能。
响应曲面设计(RSM)是一种统计学和数学技术的分析方法, 近年来广泛应用于实验设计中。如:利用Minitab、Stat Ease、Design-expert等软件中的RSM法确定测试和去除目标污染物的最佳实验条件, 如优化活性炭与NH2-MCM-41的质量浓度去除六价铬[18-19]; RSM与ANNs(人工神经网络)联合优化复合纳米氧化铁材料去除磷酸盐[20]; RSM优化纳米0价铁去除水溶液中的2价镉以及Fenton工艺治理垃圾渗滤液等[21-22]。以上研究表明, RSM法可大大减少工作量并可准确地对最佳实验条件进行快速筛选。本实验以东北盛产大豆的秸秆作为原料制备生物质炭, 在对生物质炭进行理化分析的基础上, 利用Minitab软件RSM法优化生物质炭吸附阿特拉津的影响因素, 以获得大豆秆生物质炭对阿特拉津的最佳吸附条件; 以期为评价施加生物质炭后土壤中阿特拉津的迁移规律及污染水环境中阿特拉津的去除提供参考。
1 实验材料与方法 1.1 实验材料实验所用阿特拉津、氢氧化钠、盐酸均为分析纯, 购置于国药集团化学试剂有限公司; 甲醇和乙腈均为色谱纯, 分别购置于国药集团化学有限公司和天津市福晨化学试剂厂; 大豆秸秆来源于吉林大学农业学院试验田。
1.2 生物质炭的制备及理化性质分析生物质炭的制备原料为大豆秆, 将大豆秆放入马弗炉(SX2-8-13, 上海意丰电炉有限公司)隔绝空气加热, 待炉内温度升至450℃开始计时, 热解2 h; 自然冷却后取出并进行研磨, 过0.6 mm标准筛, 备用。
采用元素分析仪(vario EL cube CHNS, Hanau, 德国)测定生物质炭总C、N、H、S、O的质量分数, 每个样品重复测定2次。生物质炭中的灰分质量分数可由公式(1)计算:
 (1)
(1) 生物质炭含水量根据美国测试与材料协会出版的D1762-84中的标准(ASTM)[23]进行测试。生物质炭的等电点即(pHZPC)的测定步骤为:1)准备一系列0.01 mol/L的NaCl溶液; 2)利用0.1 mol/L的HCl或NaOH将上述溶液的pH值调节到3.0~11.5;3)将20 mL已调节好pH的0.01mol/L的NaCl溶液倒入100 mL盛有0.2 g生物质炭的锥形瓶中, 并放入全温振荡箱(HZO-F160, 哈尔滨东联电子技术开发公司)中震荡48 h[24]; 4)震荡后, 用pH计(PHS-3C, 上海雷磁)测定上述NaCl溶液的终止pH, 并根据测定结果做初始pH对终止pH的曲线图。生物质炭pH值的测定方法:按生物质炭与去离子水质量比为1∶5混合并摇匀, 静置5 min后用pH计测定溶液的pH值。
实验中, 利用物理化学吸附分析仪(SSA-4200C, 北京奥德电子技术)结合BET(brunauer-emmett-teller)方法, 通过测定被生物质炭吸附的N2的质量分数来确定生物质炭的比表面积、平均孔径、总孔隙体积; 利用电子扫描显微镜(SEM)(JSM-6700F, JEOL, 日本)来表征生物质炭的表观机构; 利用X射线光电子能谱(XPS)通过射线能量散射光谱仪(ESCALAB250X, Thermo Fisher Scientific, USA)(包含AlKα发射源和一个10-7 Pa的真空管)对生物质炭进行界面化学性质分析; 利用傅里叶红外光谱仪(Nicolet Avatar 370DTGS, Thermo, USA)来测定生物质炭表面的官能团在吸附实验发生前后的变化。
1.3 实验设计与优化本实验是由响应曲面设计下的中心法(CCD)控制, 并通过优化确定大豆秆生物质炭去除阿特拉津的最佳条件。中心法设计矩阵包括2k个阶乘点、2k个轴或者星点、nc个中心点, 共得到N个实验, 其公式[25]如下:
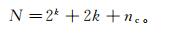 (2)
(2) 其中:k是变量数; nc是中心点的数量。
每个变量的值被编码成χi进行科学统计计算, 其公式[26]如下:
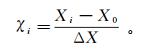 (3)
(3) 其中:X0是Xi在中心点处的值; △X为步长。表 1显示了4个因素(初始pH(X1)、吸附剂质量浓度(X2, g/L)、阿特拉津初始质量浓度(X3, mg/L)、温度(X4, ℃))中每个因素的5个水平(-2、-1、0、1、2)的编码结果。
| X1 | X2 | X3 | X4 | |
| -2 | 3 | 0.75 | 5 | 12 |
| -1 | 5 | 2.50 | 10 | 17 |
| 0 | 7 | 4.25 | 15 | 22 |
| 1 | 9 | 6.00 | 20 | 27 |
| 2 | 11 | 7.75 | 25 | 32 |
实验中CCD最优化响应值与变量的关系可用下式表示:
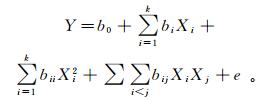 (4)
(4) 其中:b0为常数系数; bi, bii和bij分别为线性回归系数、二次方程的回归系数和二阶项的回归系数; Xi和Xj为独立变量; e为随机误差。
按照上述优化设计完成实验, 对实验后溶液中残留的阿特拉津质量浓度进行测试, 采用的方法[27-28]为:高效液相色谱仪(SIL-10F, 岛津, 日本)配用ECLIPSE XDB-C18反相色谱柱(直径4.6 mm, 柱长150 mm, 颗粒直径5 μm, 安捷伦科技, 圣克拉拉, 美国); 流动相为乙腈和超纯水, 流量比为40%:60%;流动相流速为0.1 mL/min; 紫外检测波长λ=218 nm; 柱中停留时间7.44 min。
吸附后阿特拉津的去除效率(RE)计算公式为
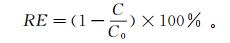 (5)
(5) 式中, C0和C分别是阿特拉津的初始浓度和吸附后的质量浓度(mg/L)。
2 结果与讨论 2.1 生物质炭的物化性质大豆秆生物质炭的元素组成和理化性质如表 2所示。生物质炭含有大量的C, 其质量分数可达57.52%, H、N、O、S质量分数分别为2.63%、1.38%、17.64%、0.05%, 含水量3.09%, 灰分的质量分数达17.69%。生物质炭中:O、N的质量分数会影响生物质炭的吸附性能; (O+N)/C或O/C会影响生物质炭表面的极性[29], 从而影响生物质炭的吸附能力。而灰分质量分数对生物质炭吸附能力的影响说法不一, 如:Lehmann等[30]认为, 灰分质量分数高的生物炭对重金属吸附能力较低; 也有研究[31-32]表明灰分质量分数对生物质炭的吸附能力影响并不明显。
| 参数 | 值 |
| 颗粒尺寸/mm | < 0.6 |
| 比表面积/(m2/g) | 17.52 |
| 总孔隙体积/(cm3/g) | 0.19 |
| 孔隙半径/Å | 63.30 |
| pH | 9.21 |
| pHZPC | 9.20 |
| w(C)/% | 57.52 |
| w(O)/% | 17.64 |
| w(N)/% | 1.38 |
| w(S)/% | 0.05 |
| w(灰分)/% | 17.69 |
| w(H2O)/% | 3.09 |
大豆秆生物质炭的等电点(pHZPC)为9.20(表 2), 其自身pH值为9.21, 即生物质炭pH值与pHZPC大致相同; 因此大豆秆生物质炭表面电位基本为0。由BET-N2测定数据可知, 生物质炭的比表面积为17.524 m2/g、平均孔隙半径为63.3Å、微孔体积0.024 cm3/g、总孔隙体积0.19 cm3/g。大豆秆生物质炭的比表面积较其他材料生物质炭, 如蔗糖渣(259 m2/g)[33]、角木屑(32 m2/g)[34]生物质炭偏低, 较松木生物质炭(8.32 m2/g)[35]稍高; 这主要与其原材料的组成、结构及热解温度有关。
如扫描电镜图(×1 500, 放大, 图 1)所示, 大豆秆生物质炭具有明显的粗糙表面和多孔结构, 这种多孔结构为阿特拉津被截留及富集提供可能。

|
| 图 1 生物质炭的扫描电镜图(SEM) Figure 1 SEM of the biochar |
|
|
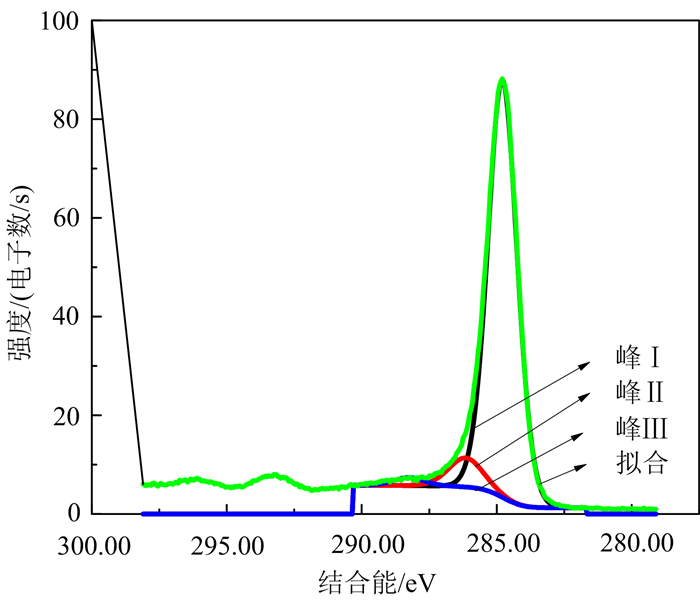
光电子能谱(XPS)(图 2)所示为生物质炭能谱中的C1s电子, 可以清楚看出:峰I的结合位能为284.7 eV, 属于碳组分(C=C/C-C/CHx, 芳香碳/脂肪碳); 峰II的结合位能286.04 eV, 为-C-OR、乙醚、羟基/苯酚[36-37]; 峰III的结合位能为287.5 eV, 属于-COOR[38]。这些含氧官能团的存在能够增加生物质炭与阿特拉津之间的结合能, 从而促使二者形成氢键[39], 达到吸附的目的。
|
| 图 2 生物质炭的光电子能谱图(XPS) Figure 2 XPS of the biochar |
|
|
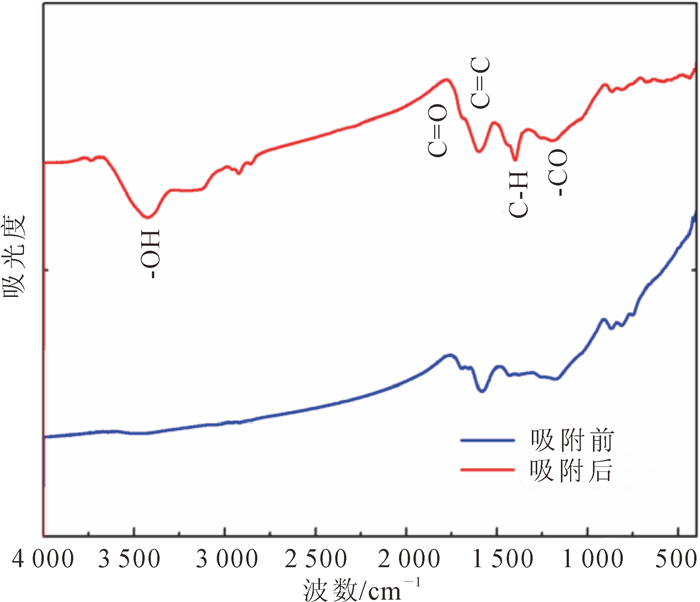
利用傅里叶红外光谱(FTIR)分析确定生物质炭表面的官能团, 结果见生物质炭吸附阿特拉津前后的傅里叶红外光谱图(图 3)。由图 3可见:在3 340 cm-1、1 800 cm-1、1 500 cm-1和1 275 cm-1处产生的吸收峰分别是是羟基(-OH)[40]、C=O键[41]、C=C键和C-H键[42]; 很明显, 在反应后, 羟基位置产生了新的吸收峰。这是由于阿特拉津本身既是氢键供体又是氢键受体[41], 因此可推测生物质炭表面的含氧官能团羟基与阿特拉津之间形成氢键[23], 从而达到吸附阿特拉津的效果。
|
| 图 3 生物质炭吸附前后傅里叶红外光谱图(FTIR) Figure 3 FTIR of the biochar before and after adsorption |
|
|
用中心合成设计法(CCD)研究4个因素对大豆秆生物质炭吸附阿特拉津的影响。4个因素的中心合成设计矩阵和实验结果如表 3所示, 同时表 3中还包括实验变量和中心合成设计响应值。根据实验结果, 响应值与被编码的独立变量之间常用二阶多项方程式表述:
| 运行次数 | X1 | X2 | X3 | X4 | 响应效率/% | |
| 实际值 | 预测值 | |||||
| 1 | 7 | 0.75 | 15 | 22 | 43.95 | 45.20 |
| 2 | 7 | 4.25 | 15 | 22 | 75.22 | 75.18 |
| 3 | 5 | 2.50 | 10 | 17 | 67.01 | 62.23 |
| 4 | 7 | 4.25 | 25 | 22 | 61.23 | 58.87 |
| 5 | 7 | 4.25 | 5 | 22 | 89.60 | 90.40 |
| 6 | 7 | 4.25 | 15 | 22 | 75.47 | 75.18 |
| 7 | 7 | 4.25 | 15 | 22 | 75.75 | 75.18 |
| 8 | 9 | 6.00 | 20 | 27 | 62.81 | 70.99 |
| 9 | 5 | 6.00 | 20 | 27 | 89.86 | 84.46 |
| 10 | 9 | 2.50 | 10 | 17 | 60.40 | 63.95 |
| 11 | 9 | 2.50 | 20 | 27 | 53.60 | 53.64 |
| 12 | 9 | 6.00 | 20 | 17 | 60.61 | 59.44 |
| 13 | 7 | 4.25 | 15 | 22 | 75.39 | 75.18 |
| 14 | 5 | 6.00 | 10 | 17 | 87.41 | 85.52 |
| 15 | 5 | 2.50 | 10 | 27 | 71.53 | 70.85 |
| 16 | 5 | 2.50 | 20 | 27 | 59.63 | 63.62 |
| 17 | 5 | 6.00 | 10 | 27 | 88.67 | 96.50 |
| 18 | 7 | 4.25 | 15 | 22 | 74.62 | 75.18 |
| 19 | 7 | 4.25 | 15 | 22 | 74.62 | 75.18 |
| 20 | 9 | 6.00 | 10 | 17 | 84.33 | 83.74 |
| 21 | 7 | 4.25 | 15 | 12 | 58.61 | 61.50 |
| 22 | 7 | 7.75 | 15 | 22 | 88.64 | 85.83 |
| 23 | 7 | 4.25 | 15 | 32 | 86.10 | 81.66 |
| 24 | 9 | 2.50 | 10 | 27 | 71.17 | 71.01 |
| 25 | 5 | 2.50 | 20 | 17 | 51.37 | 52.88 |
| 26 | 9 | 6.00 | 10 | 27 | 96.52 | 93.16 |
| 27 | 11 | 4.25 | 15 | 22 | 64.62 | 64.35 |
| 28 | 5 | 6.00 | 20 | 17 | 67.80 | 71.36 |
| 29 | 3 | 4.25 | 15 | 22 | 77.41 | 76.11 |
| 30 | 7 | 4.25 | 15 | 22 | 75.18 | 75.18 |
| 31 | 9 | 2.50 | 20 | 17 | 48.89 | 44.46 |
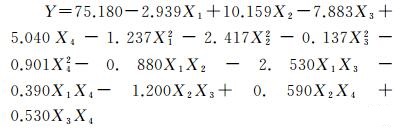 (6)
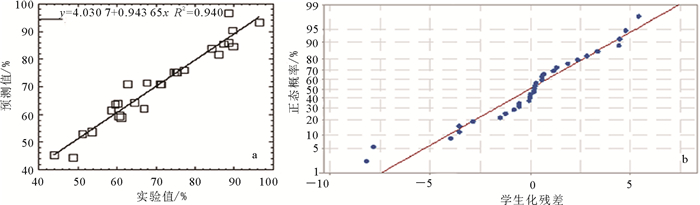
(6) 方差分析不但可以确定方程系数和残差, 也可以检验中心合成模型是否合适。通过F-检验解释模型的均方与残差之间的关系。表 4为生物质炭吸附去除阿特拉津二次模型响应值回归结果的方差分析。如表 4所示, 在95%可信度的条件下, 失拟项的值F=169.660、P=0.000( < 0.05), 说明二次模型是有意义的[18-19]。同时, 图 4a所示二次模型实验值与预测值高度一致(R2=0.940, R为相关系数), 进一步说明模型的可用性。从图 4b可以清楚看出, 数据点多集中在残差为0附近且沿直线向两端下降, 表明实验数据与残差遵循正态分布。
| 来源 | 自由度 | 平方和 | 均方 | F值 | P值 |
| 模型 | 14 | 5 141.28 | 367.23 | 19.160 | 0.000 |
| 残差 | 16 | 306.67 | 19.17 | - | - |
| 失拟项 | 10 | 305.59 | 30.56 | 169.660 | 0.000 |
| 纯误差 | 6 | 1.08 | 0.18 | - | - |
| 总计 | 30 | 5 447.95 | - | - | - |
| 注:R2=0.940。均方=平方和/自由度。 | |||||
|
| a.实验值与预测值相关性; b.阿特拉津去除率残差分布。 图 4 阿特拉津去除率及残差分析 Figure 4 Analysis of the atrazine removal rate and residual analysis |
|
|
通过方差分析可知, 二次回归方程可表达各因素对生物质炭吸附阿特拉津的影响。表 5验证了二次回归模型中各项系数的有效性。通过各项所对应的P值可判断该项对模型是否有效, 即当P < 0.050时, 该项对二次方程是有效的。如表 5示:初始pH(X1, P=0.005)、吸附剂质量浓度(X2, P=0.000)、阿特拉津初始质量浓度(X3, P=0.000)、温度(X4, P=0.000)4个一次项对于阿特拉津的吸附去除率具有线性意义; 二阶相同项X2(P=0.009)、二阶不同项X1X3(P=0.034)同为响应曲面的有效项; 模型中其他二阶项的P值大于0.050, 因此为无效项。综上分析, 响应曲面模型可以简化成如下形式(式7):
| 项目 | 系数 | SE | T值 | P值 |
| 常数 | 75.180 | 1.650 | 45.43 | 0.000 |
| X1 | -2.939 | 0.894 | -3.29 | 0.005 |
| X2 | 10.159 | 0.894 | 11.37 | 0.000 |
| X3 | -7.883 | 0.894 | -8.82 | 0.000 |
| X4 | 5.040 | 0.894 | 5.64 | 0.000 |
| X1X1 | -1.237 | 0.819 | -1.51 | 0.150 |
| X2X2 | -2.417 | 0.819 | -2.94 | 0.009 |
| X3X3 | -0.137 | 0.819 | -0.17 | 0.869 |
| X4X4 | -0.901 | 0.819 | -1.10 | 0.288 |
| X1X2 | -0.880 | 1.090 | -0.80 | 0.436 |
| X1X3 | -2.530 | 1.090 | -2.32 | 0.034 |
| X1X4 | -0.390 | 1.090 | -0.36 | 0.727 |
| X2X3 | -1.200 | 1.090 | -1.10 | 0.288 |
| X2X4 | 0.590 | 1.090 | 0.54 | 0.596 |
| X3X4 | 0.530 | 1.090 | 0.48 | 0.634 |
| 注:SE为效应系数; T值为显著性检验值。 | ||||
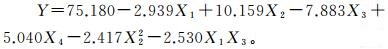 (7)
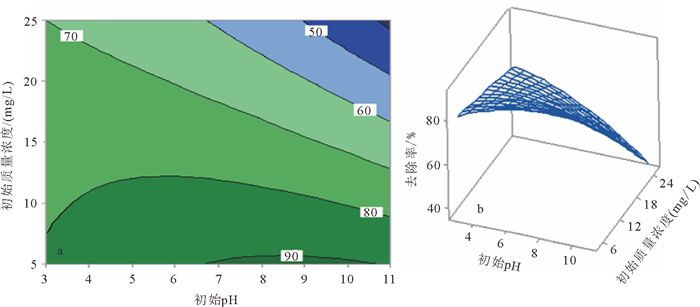
(7) 为了更加形象地解释响应曲面设计, 可应用轮廓图与相应的3D响应面图。其中, 3D图被广泛应用于解析各独立因素间的相互作用, 以及各因素对响应值的影响。由上述分析可知, 不同因素对响应曲面的影响是否存在取决于该二次项所对应P值的大小, 通过分析可知, 仅有X1X3对二次模型的影响是有意义的。图 5a、b所示为因素X1与X3对阿特拉津去除效率影响的轮廓图与相应的3D图。从图 5可知, 阿特拉津的初始质量浓度越低, 生物质炭吸附去除阿特拉津的效率越高。出现这种现象的原因是随着阿特拉津浓度的升高, 生物质炭表面的有效官能团在吸附一定量阿特拉津后达到饱和, 从而无法吸附更多的阿特拉津, 因此随着阿特拉津质量浓度的升高其去除效率下降[43]。
|
| 图a中, 等值线中数字代表去除率, %。 图 5 不同因素对阿特拉津去除率轮廓图(a)和不同因素对阿特拉津去除率3D图(b) Figure 5 Contour plots (a) and response surface (b) of the effect by different factors to atrazine removal |
|
|
RSM分析通过使用DOE(design of experiment)模型进行引导, 以确定生物质炭吸附去除阿特拉津最优化的初始pH、吸附剂的质量浓度、初始阿特拉津质量浓度和温度, 并应用已建立的二阶模型(公式(7))使阿特拉津的去除率达到最大值。DOE模型显示的最佳运行条件为初始pH=6.67、吸附剂质量浓度为7.75 g/L、阿特拉津初始质量浓度5 mg/L、温度为32℃, 此时阿特拉津的最大去除率为92.18%。为确定最优化条件的有效性, 对DOE模型给出的优化条件进行实验。如表 6所示, 实验结果显示阿特拉津在优化条件下的实际去除效率为90.17%。实际去除效率与模型预测去除效率之间误差为2.01%, 标准偏差为1.42%。
| 吸附去除率(实验值)/% | 模型响应/% | 误差 | 标准偏差 |
| 90.17 | 92.18 | 2.01 | 1.42 |
1)利用响应曲面设计优化生物质炭对阿特拉津吸附, 获得其最佳条件为:pH=6.67、吸附剂质量浓度为7.75 g/L、初始阿特拉津质量浓度5 mg/L、温度为32℃, 在此条件下去除率达到92.18%。
2)通过对二阶模型进行方差分析可知, 二阶模型可有效表达生物质炭吸附阿特拉津的效果。同时, 通过对二阶模型中各项所对应的P值的大小分析, 认为初始pH和阿特拉津浓度是二次模型的二次有效项。
3)将廉价且易得农业废弃物大豆秆制备成生物质炭, 可有效吸附去除难降解污染物。从傅里叶红外光谱图可知, 吸附后产生了新的吸收峰——羟基(-OH), 因此推测羟基(-OH)官能团在生物质炭吸附阿特拉津的过程中起到重要作用。
| [1] | Basfar A A, Mohamed K A, Al-Abduly A J, et al. Radiolytic Degradation of Atrazine Aqueous Solution Containing Humic Substances[J]. Ecotoxicol Environ Saf , 2009, 72 (3) : 948-953. DOI:10.1016/j.ecoenv.2008.05.006 |
| [2] | Gao Y, Fang J, Zhang J, et al. The Impact of the Herbicide Atrazine on Growth and Photosynthesis of Seagrass, Zostera Marina (L), Seedlings[J]. Mar Pollut Bull , 2011, 62 (8) : 1628-1631. DOI:10.1016/j.marpolbul.2011.06.014 |
| [3] | Lasserre J P, Fack F, Revets D, et al. Effects of the Endocrine Disruptors Atrazine and PCB 153 on the Protein Expression of MCF-7 Human Cells[J]. J Proteome Res , 2009, 8 : 5485-5496. DOI:10.1021/pr900480f |
| [4] | DeNoyelles F, Kettle W D, Sinn D E. The Responses of Plankton Communities in Experimental Ponds to Atrazine, the Most Heavily Used Pesticide in the United States[J]. Ecology , 1982, 63 (5) : 1285-1293. DOI:10.2307/1938856 |
| [5] | Davies P E, Cook L S J, Goenarso D. Sublethal Responses to Pesticides of Several Species of Australian Freshwater Fish and Crustaceans and Rainbow Trout[J]. Environ Toxicol Chem , 1994, 13 (8) : 1341-1354. DOI:10.1002/etc.v13:8 |
| [6] | 李萃义, 焦晓娟. 洋河下游农灌区农作物受灾与水质污染的关系[J]. 中国环境监测 , 1996, 12 (4) : 49-51. Li Cuiyi, Jiao Xiaojuan. Relation of Plants Injury in Yang River's Irrigation with Water Pollution[J]. Environmental Monitoring in China , 1996, 12 (4) : 49-51. |
| [7] | 王立仁, 赵明宇. 阿特拉津在农田灌溉水及土壤中的残留分析方法及影响的研究[J]. 农业环境保护 , 2000, 19 (2) : 111-113. Wang Liren, Zhao Mingyu. An Analytical Method for Determination of Atrazine Residue in Irrigation Water and Soil, and Its Potential Effects[J]. Agriculture Environmental Protection , 2000, 19 (2) : 111-113. |
| [8] | 任晋, 蒋可, 周怀东. 官厅水库水中阿特拉津残留的分析及污染来源[J]. 环境科学 , 2002, 23 (1) : 126-128. Ren Jin, Jang Ke, Zhou Huaidong. The Concentraion and Source of Atrazine Rdsidue in Water of Guanting Reservoir[J]. Enviromental Science , 2002, 23 (1) : 126-128. |
| [9] | Khan J A, He X, Khan H M, et al. Oxidative Degradation of Atrazine in Aqueous Solution by UV/H2O2/Fe2+, UV//Fe2+ and UV//Fe2+ Processes: A Comparative Study[J]. Chem Eng J , 2013, 218 : 376-383. DOI:10.1016/j.cej.2012.12.055 |
| [10] | Benner J, Helbling D E, Kohler H P, et al. Is Biological Treatment a Viable Alternative for Micropollutant Removal in Drinking Water Treatment Processes?[J]. Water Res , 2013, 47 (16) : 5955-5976. DOI:10.1016/j.watres.2013.07.015 |
| [11] | Rojas R, Morillo J, Usero J, et al. Adsorption Study of Low-Cost and Locally Available Organic Substances and a Soil to Remove Pesticides from Aqueous Solutions[J]. J Hydrol , 2015, 520 : 461-472. DOI:10.1016/j.jhydrol.2014.10.046 |
| [12] | Ezazi N Z. Biofunctionalization of Zirconia Based Materials by Immobilization of Alp in Tissue Enginee-ring Applications[D]. Tampere :Tampere University of Technology, 2014. |
| [13] | Wang S, Wang K, Dai C, et al. Adsorption of Pb2+ on Amino-Functionalized Core-Shell Magnetic Mesoporous SBA-15 Silica Composite[J]. Chem Eng J , 2015, 262 : 897-903. DOI:10.1016/j.cej.2014.10.035 |
| [14] | Srinivasan P, Sarmah A K. Characterisation of Agricultural Waste-Derived Biochars and Their Sorption Potential for Sulfamethoxazole in Pasture Soil: A Spectroscopic Investigation[J]. Sci Total Environ , 2015, 502 : 471-480. DOI:10.1016/j.scitotenv.2014.09.048 |
| [15] | 曹美珠, 潘丽萍, 张超兰, 等. 四种生物质炭的表面特性及其对水溶液中镉-阿特拉津的吸附性能研究[J]. 农业环境科学学报 , 2014, 33 (12) : 2350-2358. Cao Meizhu, Pan Liping, Zhang Chaolan, et al. Surface Characteristics of Four Biochars and Their Adsorption of Cd and Atrazine in Aqueous Solution[J]. Journal of Agro-Environment Science , 2014, 33 (12) : 2350-2358. |
| [16] | 武玉, 徐刚, 吕迎春, 等. 生物炭对土壤理化性质影响的研究进展[J]. 地球科学进展 , 2014, 29 (1) : 68-79. Wu Yu, Xu Gang, Lü Yingchun, et al. Effects of Biochar Amendment on Soil Physical and Chemical Properties: Current Status and Knowledge Gaps[J]. Advancesin Earth Science , 2014, 29 (1) : 68-79. |
| [17] | 杨放, 李心清, 王兵, 等. 生物炭在农业增产和污染治理中的应用[J]. 地球与环境 , 2012, 40 (1) : 100-107. Yang Fang, Li Xinqing, Wang Bing, et al. The Application of Biochar to Improving Agricultural Production and Pollution Abatement[J]. Earth and Envirnment , 2012, 40 (1) : 100-107. |
| [18] | Anupam K, Dutta S, Bhattacharjee C, et al. Adsorptive Removal of Chromium (VI) from Aqueous Solution over Powdered Activated Carbon: Optimisation Through Response Surface Methodology[J]. Chem Eng J , 2011, 173 (1) : 135-143. DOI:10.1016/j.cej.2011.07.049 |
| [19] | Cao J, Wu Y, Jin Y, et al. Response Surface Methodology Approach for Optimization of the Removal of Chromium(VI) by NH2-MCM-41[J]. J Taiwan Inst Chem Eng , 2014, 45 (3) : 860-868. DOI:10.1016/j.jtice.2013.09.011 |
| [20] | Zhang Y, Pan B. Modeling Batch and Column Phosphate Removal by Hydrated Ferric Oxide-Based Nanocomposite Using Response Surface Methodology and Artificial Neural Network[J]. Chem Eng J , 2014, 249 : 111-120. DOI:10.1016/j.cej.2014.03.073 |
| [21] | Savasari M, Emadi M, Bahmanyar M A, et al. Optimization of Cd (II) Removal from Aqueous Solution by Ascorbic Acid-Stabilized Zero Valent Iron Nanoparticles Using Response Surface Methodology[J]. J Industr Chem Eng , 2015, 21 : 1403-1409. DOI:10.1016/j.jiec.2014.06.014 |
| [22] | Wu Y, Zhou S, Qin F, et al. Modeling Physical and Oxidative Removal Properties of Fenton Process for Treatment of Landfill Leachate Using Response Surface Methodology (RSM)[J]. J Hazard Mater , 2010, 180 (1/2/3) : 456-465. |
| [23] | Liu N, Charrua A B, Weng C H, et al. Characterization of Biochars Derived from Agriculture Wastes and Their Adsorptive Removal of Atrazine from Aqueous Solution: A Cmparative Study[J]. Bioresource Technology , 2015, 198 : 55-62. DOI:10.1016/j.biortech.2015.08.129 |
| [24] | Srivastava V, Weng C H, Singh V K, et al. Adsorption of Nickel Ions from Aqueous Solutions by Nano Alumina: Kinetic, Mass Transfer, and Equilibrium Studies[J]. J Chem Eng Data , 2011, 56 (4) : 1414-1422. DOI:10.1021/je101152b |
| [25] | Kasiri M B, Khataee A R. Removal of Organic Dyes by UV/H2O2 Process: Nodelling and Optimization[J]. Environmental Technology , 2012, 33 (12) : 1417-1425. DOI:10.1080/09593330.2011.630425 |
| [26] | Khataee A R. Optimization of UV-Promoted Peroxydisulphate Oxidation of CI Basic Blue 3 Using Response Surface Methodology[J]. Environmental Technology , 2010, 31 (1) : 73-86. DOI:10.1080/09593330903358302 |
| [27] | Zhao X, Ouyang W, Hao F, et al. Properties Comparison of Biochars from Corn Straw with Different Pretreatment and Sorption Behaviour of Atrazine[J]. Bioresour Technol , 2013, 147 : 338-344. DOI:10.1016/j.biortech.2013.08.042 |
| [28] | Zheng W, Guo M, Chow T, et al. Sorption Properties of Greenwaste Biochar for Two Triazine Pesticides[J]. J Hazard Mater , 2010, 181 (1/2/3) : 121-126. |
| [29] | Chun Y, Sheng G, Chiou C T, et al. Compositions and Sorptive Properties of Crop Residue-Derived Chars[J]. Environmental Science & Technology , 2004, 38 (17) : 4649-4655. |
| [30] | Ahmad M, Rajapaksha A U, Lim J E, et al. Biochar as a Sorbent for Contaminant Management in Soil and Water: A Review[J]. Chemosphere , 2014, 99 : 19-33. DOI:10.1016/j.chemosphere.2013.10.071 |
| [31] | Zhang P, Sun H, Yu L, et al. Adsorption and Catalytic Hydrolysis of Carbaryl and Atrazine on Pig Manure-Derived Biochars: Impact of Structural Properties of Biochars[J]. J Hazard Mater , 2013, 244/245 : 217-224. DOI:10.1016/j.jhazmat.2012.11.046 |
| [32] | Ji L, Wan Y, Zheng S, et al. Adsorption of Tetracycline and Sulfamethoxazole on Crop Residue-Derived Ashes: Implication for the Relative Importance of Black Carbon to Soil Sorption[J]. Environ Sci Technol , 2011, 45 (13) : 5580-5586. DOI:10.1021/es200483b |
| [33] | Carrier M, Hardie A G, Uras U, et al. Production of Char from Vacuum Pyrolysis of South-African Sugar Cane Bagasse and Its Characterization as Activated Carbon and Biochar[J]. Journal of Analytical and Applied Pyrolysis , 2012, 96 : 24-32. DOI:10.1016/j.jaap.2012.02.016 |
| [34] | Ates F, Un U T. Production of Char from Hornbeam Sawdust and Its Performance Evaluation in the Dye Removal[J]. Journal of Analytical and Applied Pyrolysis , 2013, 103 : 159-166. DOI:10.1016/j.jaap.2013.01.021 |
| [35] | Alberto Bento Charrua, Wang Hang, Lü Chunxin, et al. Adsorption Properties of Pinus Derived Biochar for Atrazine at Different Temperature[J]. Ecology and Environmental Sciences , 2015, 24 (3) : 505-510. |
| [36] | Azargohar R, Nanda S, Kozinski J A, et al. Effects of Temperature on the Physicochemical Characteristics of Fast Pyrolysis Bio-Chars Derived from Cana-dian Waste Biomass[J]. Fuel , 2014, 125 : 90-100. DOI:10.1016/j.fuel.2014.01.083 |
| [37] | Zielke U, Huttinger K J, Hoffman W P. Surface-Oxydazed Carbon Fibers: I:Surface Struture and Chemistry[J]. Carbon , 1996, 34 (8) : 983-998. DOI:10.1016/0008-6223(96)00032-2 |
| [38] | LeCroy C, Masiello C A, Rudgers J A, et al. Nitrogen, Biochar, and Mycorrhizae: Ateration of the Symbiosis and Oxidation of the Char Surface[J]. Soil Biol Biochem , 2013, 58 : 248-254. DOI:10.1016/j.soilbio.2012.11.023 |
| [39] | 孟冠华, 李爱民, 张全兴. 活性炭的表面含氧官能团及其对吸附影响的研究进展[J]. 离子交换与吸附 , 2007, 23 (1) : 88-94. Meng Guanhua, Li Aimin, Zhang Quanxing. Studies on the Oxygen-Containing Groups of Activated Carbon and Their Effects on the Adsoption Character[J]. Ion Exchange and Adsorption , 2007, 23 (1) : 88-94. |
| [40] | Chia C H, Gong B, Joseph S D, et al. Imaging of Mineral-Enriched Biochar by FTIR, Raman and SEM-EDX[J]. Vibrational Spectroscopy , 2012, 62 : 248-257. DOI:10.1016/j.vibspec.2012.06.006 |
| [41] | Zhang G, Zhang Q, Sun K, et al. Sorption of Simazine to Corn Straw Biochars Pepared at Different PyrolyticTemperatures[J]. Environmental Pollution , 2012, 159 : 2594-2601. |
| [42] | Zhang P, Sun H, Yu L, et al. Adsorption and Catalytic Hydrolysis of Carbaryl and Atrazine on Pig Manure-Derived Biochars: Impact of Structural Properties of Biochars[J]. Journal of Hazardous Materials , 2013, 244 (244/245) : 217-224. |
| [43] | Weng C H, Lin Y T, Hong D Y, et al. Effective Removal of Copper Ions from Aqueous Solution Using Base Treated Black Tea Waste[J]. Ecological Engineering , 2014, 67 : 127-133. DOI:10.1016/j.ecoleng.2014.03.053 |



