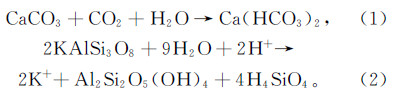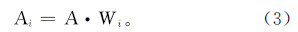0 引言
随着社会经济的高速发展,能源和环境问题日益受到人们的关注。地热资源由于其可再生性和地域分布的广泛性,已成为世界各国重点研究开发的可再生清洁能源。干热岩是一种低渗透性高温岩体,主要包括各种变质岩或结晶岩类岩体。干热岩普遍埋藏于距地表3~10 km的深处,其温度范围很广,为150~650 ℃。现阶段,干热岩地热资源是专指埋深较浅、温度较高、有开发经济价值的热岩体,保守估计地壳中干热岩(3~10 km深处)所蕴含的能量相当于全球所有石油、天然气和煤炭所蕴藏能量的30倍。增强型地热系统(enhanced geothermal systems,EGS)是采用人工形成地热储层的方法,从低渗透性岩体中经济地采出深层热能的人工地热系统,即从干热岩中开发地热的工程。以CO2为载热流体的增强地热能系统(即CO2-EGS)使得CO2地质封存的同时实现了地热资源的利用,是目前研究的一个热点。CO2-EGS涉及复杂的地下物理、化学、热力学和水动力学过程,系统中的水-岩-气相互作用对热储层的矿物组分、水化学成分、物理特征(如孔隙度、渗透率等)有重要的影响,最终影响储层的产能和净热提取效率。
国内外学者对CO2-EGS热储层中CO2、水和岩石之间的化学反应做了大量研究。Liu等[1]用电子显微镜和化学分析相结合的方法,研究了100~350 ℃条件下砂岩和花岗岩在富CO2液相环境中的化学反应,结果表明在250 ℃以上的温度下矿物的溶解和沉淀作用明显;Ueda等[2]通过室内实验,研究了200 ℃环境下花岗闪长岩、水和CO2的化学反应,结果表明CO2使花岗闪长岩中的钙长石释放Ca2+,导致次生碳酸矿物的沉淀;日本学者[3]在一个干热岩现场进行了CO2注入花岗岩初步试验研究,探讨了CO2注入后与花岗岩石可能发生的反应以及矿物的溶解沉淀情况;万玉玉等[4]以美国内达华州Desert Peak地热田为研究区,应用TOUGHREACT软件研究了CO2-EGS运行中岩体矿物成分的时空演变特征;许天福等[5]根据CO2-EGS热储层的共有特征,利用TOUGHREACT软件建立了具有代表性的一维反应性溶质运移模型,探讨了CO2注入后储层的矿物组分变化特征及矿物溶解和沉淀对地层孔隙度、渗透性的影响。但前人对高温环境下的岩石-水-CO2相互作用的研究较少。
笔者采用室内实验和数值模拟相结合的方法,研究热储层-盐水-CO2的相互作用,以及热储层矿物成分、反应液化学成分的变化规律,进一步探讨热储层水-岩-气作用机理,以及对储层流体渗透性的影响,以期对我国CO2-EGS工作的开展提供理论基础和技术支持。
1 水-岩-气相互作用实验 1.1 实验设备及材料本实验采用FYX-1型高压釜,其容量为1.0 L,最高工作温度为350 ℃,压力为 30 MPa。利用恒温控制仪和气-液增压泵对实验的温度和压力进行控制(图1)。
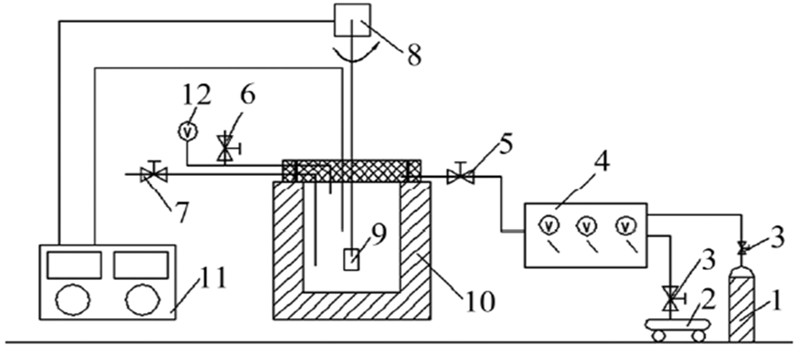 |
| 1.CO2气瓶;2.空气压缩机;3.阀门;4.气-液增压泵;5.进气阀;6.放气阀;7.液体取样阀;8.永磁搅拌仪;9.样品框;10.高温高压反应釜;11.反应釜控制器;12.气压表。 图 1 实验系统图 Fig. 1 Experimental system |
| |
本次研究以我国松辽盆地徐家围子地区营城组三段流纹岩作为目标储层。该岩层的埋深大于3 500 m,地层温度可达到180 ℃,满足地热开采的需求。营城组三段流纹岩天然裂隙发育,适用于EGS工程的水力压裂技术,是松辽盆地重要的EGS潜在目标热储层。研究采用的流纹岩样品取自长春地区营城组三段流纹岩露头,其主要矿物成分为石英、碱性长石、斜长石,质量分数分别为70%,10%,20%。区域地质资料表明徐家围子地区井下3 500 m营城组三段流纹岩的主要矿物成分除了石英(70%)、碱性长石(8%)、斜长石(12%)外,还有质量分数为10%的方解石,且石英和长石同露头岩样相近。考虑到方解石是EGS热储层天然裂隙最常见的填充物,本次实验样品由质量分数为10%的天然方解石晶体和90%的营城组三段流纹岩露头岩样构成。对岩样进行破碎、筛选、磨样,加工成粒径范围为140~200 目的岩粉。为了便于分析,再向实验岩样中分别加入流纹岩和方解石的切片(1 mm×1 mm×1 mm)各一。参考EGS热储层地下水化学成分的实际情况[6, 7],本次研究将由NaCl和蒸馏水配置的1 mol/L NaCl溶液作为实验反应溶液。
1.2 实验分析仪器用SSA-3200C 型物理及化学吸附分析仪测定岩石样品比表面积;用X射线荧光光谱射线衍射仪测定样品的化学成分;岩样的表面矿物用JSM-6700F型扫描电子显微镜观察。利用 PHS-3C型pH计测量溶液pH值的变化;用准溶液滴定法测定 HCO3-、CO32-的浓度;溶液中主要阳离子的测量,先用质量分数3%的HNO3调节反应液pH=2(防止沉淀) ,再用AA-6300C 型原子吸收仪测定 K+、Na+、Mg2+和Ca2+的浓度,最后用7500A 型ICP-MS测定TFe的浓度。
1.3 实验步骤将岩样用蒸馏水冲洗、烘干(80 ℃,8 h),称量其比表面积。将30 g岩样及600 mL的实验溶液(固液质量比为1∶20)放入反应釜内,密闭。通过气-液增压泵通入超临界CO2,使釜内压力到达20 MPa,利用恒温控制仪使釜内温度达到180 ℃,反应时间分别为5、10、15 d。当实验结束后打开反应釜,取出样品和反应剩余溶液。待反应液冷却至室温,对其化学成分进行测定。将反应时间为15 d的岩样用蒸馏水冲洗,进行扫描电镜分析。
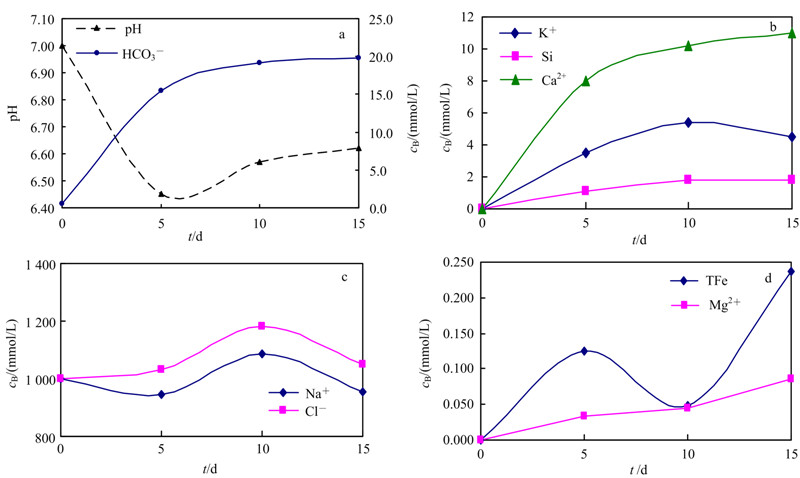
1.4 实验结果与讨论 1.4.1 反应液组分的变化超临界状态CO2被注入后,溶于水形成碳酸进而解离生成H+ 、HCO3-,5 d后反应液pH值由7.00降低至6.45;随着样品中的可溶性矿物和碳酸发生反应消耗H,溶液酸性减弱,15 d后pH值回升至6.62。H++的消耗会促进碳酸分解为HCO3-,原生碳酸盐矿物的溶解也会增加HCO3-的浓度,导致溶液HCO3-浓度随反应的进行而增大,至第15 天达到19.8 mmol/L(图2a)。
 |
| 图 2 水化学成分随时间t变化图 Fig. 2 Brine chemistry as a function of time |
| |
如图2b所示,反应液中的K+和Ca2+浓度随着反应的进行而增加,Ca2+的浓度明显高于K+。这说明岩样中的钾长石和方解石发生溶蚀作用,且方解石的溶蚀作用强于钾长石。10~15 d K+的浓度有所下降,这可能是因为反应时间为10 d和15 d时实验中岩样矿物的非均质性特征所致。前人研究成果[8]表明,随着原生矿物对H+的消耗,反应液pH值回升,溶液中的Ca2+会以次生碳酸盐的形式析出。但是本实验中反应液Ca2+的浓度并未出现降低现象,这说明原生方解石(反应液Ca2+的主要来源)的溶蚀作用远强于次生方解石、白云石等含钙碳酸盐的沉淀作用。反应液中的Si浓度随着反应的进行而增加(图2b),这表明岩样中的含硅矿物以溶蚀作用为主。Cl-具有较强的化学稳定性,注入CO2后其浓度略高于初始浓度(图2c),这表明在高温环境下反应液发生了“盐析效应”,一部分水会转化成水蒸汽和超临界CO2混合,导致离子浓度增加[9]。由此可见,在高温环境下的水-岩-CO2相互作用过程中不仅发生了碳酸对矿物的溶蚀作用,还发生了因“盐析效应”导致的蒸发浓缩作用。Na+的浓度小于Cl-(图2c),表明一部分Na+从反应液析出,原有的Na+、Cl-平衡被打破。反应液中TFe的最大浓度达到0.237 mmol/L(图2d),可能来自于岩样中微量含铁矿物(由于其浓度过低并未被检测出)[2]。溶液中的Mg2+可能是干冰或者蒸馏水中的MgSO4杂质所致[10]。
1.4.2 储层成分的变化方解石的稳定存在环境主要为偏碱性条件,CO2注入后反应液的酸性增强,使得岩样中的方解石发生剧烈溶蚀,原本平滑的方解石表面出现密集的溶蚀坑(图3a)。钾长石发生溶蚀作用,沿晶体表面出现溶蚀坑和凹槽(图3b)。方解石、钾长石发生的溶蚀反应为
 |
| 图 3 反应后矿物溶蚀、析出的电镜照片 Fig. 3 SEM images of minerals after reaction |
| |
钠长石发生了沉淀作用,一部分次生钠长石在钾长石溶蚀坑中析出(图3c) ,与Wandrey等[11]研究成果一致,其主要原因[12]为:①钠长石的溶蚀作用是放热反应,在180 ℃的实验高温下不宜于进行。②反应液含有大量的Na+,有利于钠长石沉淀。这一现象说明钠长石在高温、高盐度的CO2酸性流体中易于沉淀。石英是稳定的矿物,在碱性环境下的溶解度取决于反应液的pH值,但是在酸性环境下溶解度基本不受反应液pH值的影响[13]。然而本次实验中石英发生微弱溶蚀,在其节理形成少量溶缝(图3d),这主要是因为反应液中的Na+、K+打断了石英表面的Si-O键,形成了Si-O-Na+和Si-O-K+[14]。
随着可溶性矿物对H+的消耗,反应液pH值和HCO3-浓度逐渐升高,有利于次生碳酸盐矿物的形成。方解石的强烈溶蚀作用使反应液的Ca2+富集,但是流纹岩、方解石表面上并没观测到明显的方解石(最常见的碳酸盐矿物)沉淀现象,只是在极少量的溶蚀坑出现方解石次生加大现象(图3e)。主要原因是本次实验时间较短,而原生碳酸盐矿物在CO2酸性流体中以溶蚀作用为主,在很长的地质时期内不易转化成相关的次生碳酸盐矿物[15];而溶蚀坑中Ca2+较为富集,利于次生方解石析出。
本次实验并未见菱铁矿、菱镁矿、片钠铝石、白云石、铁白云石等次生碳酸盐矿物沉淀,但是发现了少量近似菱形的新矿物(图3f),能谱分析其主要元素为Fe、Si、C、O,判断其为菱铁矿的中间态。如果反应时间足够长,这种新矿物可能以菱铁矿的沉淀形式析出。含“C”新矿物的析出表明,在CO2-EGS运行的水-岩-气相互作用中,一部分超临界CO2可以转化为碳酸盐矿物,实现了矿物捕集。岩石表面并没发现高岭石、伊利石、蒙脱石等次生黏土矿物沉淀。
CO2-EGS热储层由裂隙和基质两部组成。裂隙的渗透率较高,是载热流体的主要流动通道,系统运行时裂隙中地层水被CO2快速驱替,水-岩-气相互作用的时间较短。基质的渗透率较小(一般比裂隙小几个数量级),CO2的运移速度较慢,液体饱和度保持较大值,可为矿物的溶解和沉淀提供充足的水作为化学载体,通过实验后矿物溶蚀、析出现象可做如下推论:在EGS热储层裂隙通道短时间尺度的水-岩-气作用中,原生碳酸盐矿物以溶蚀作用为主有利于裂隙渗透率的增加,不会大规模转化为相应的次生碳酸盐矿物堵塞裂隙通道;在EGS热储层基质长时间的水-岩-气作用中,一部分CO2会转化为碳酸盐矿物,被封存于地下介质当中,在CO2资源利用化的同时实现地质储存化。
2 数值模拟通过建立反应性溶质运移模型,模拟上述实验的化学反应过程,并将计算结果和实验数据进行对比,探讨热储层岩体-盐水-CO2相互作用的反应机理。
2.1 数值模型建立 2.1.1 概念模型本次研究参照反应釜的实际尺寸(直径8 cm,总长度20 cm),设计了2个网格(图4),上部网格代表注入到反应釜中的CO2,气体饱和度Sg为1.00,下部网格代表釜内30 g固体岩样和600 mL盐水的混合体,根据岩样的密度计算该网格盐水的饱和度Sl为0.98,岩样的饱和度为0.02。根据反应釜的实际情况,模型边界被设定为隔绝边界。岩石的基本物性参数见表1。模拟条件与室内实验的条件一致,即反应温度180 ℃,压力为20 MPa。
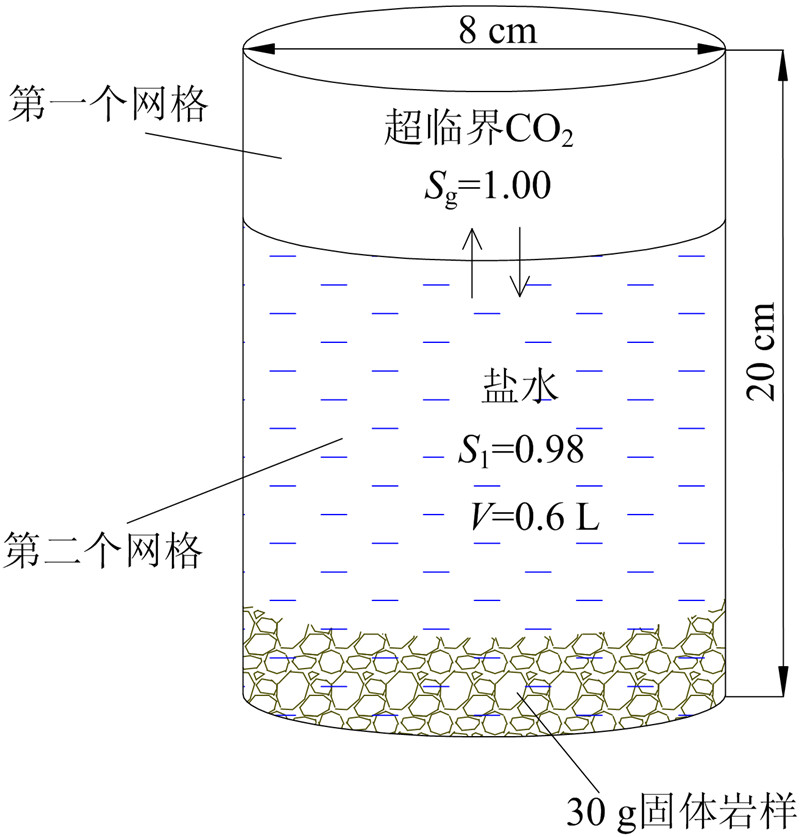 |
| 图 4 水-岩-气作用模型示意图 Fig. 4 Schematic of interaction among water, rock and gas |
| |
| 模拟参数 | 取值 |
| 岩石骨架密度/(kg/m3) | 2 600 |
| 岩石比热/(J/(kg·℃)) | 1 000 |
| 岩石导热系数/(W/(m·℃)) | 2.9 |
| 温 度/℃ | 180 |
| 压 力/MPa | 20 |
模型中矿物组成见表2。原生矿物为X射线衍射所检测到的方解石和流纹岩矿物,次生矿物考虑了注入的CO2与围岩矿物质发生化学反应时可能产生的几乎所有的碳酸盐矿物和黏土矿物。模拟中使用的反应动力学公式参考文献[5],并参考前人研究成果[15, 16, 17, 18, 19]对影响矿物反应速率的活化能Ea和25℃时速率常数k25进行了适当的调整,各项参数见表3。在调整参数时主要以反应液离子浓度实验值和模拟计算值进行比较,经过多次反复调整,当水相化学组分浓度的计算值与实验反应液的浓度值拟合较好时,将其反应速率常数k25和活化能Ea作为模型的最终输入值。经物理化学吸附分析仪测定,方解石、流纹岩混合岩粉的比表面积为2 m2/g。流纹岩矿物的比表面积Ai计算公式为
式中:A为岩样的比表面积(m2/g);Wi为岩样中单矿物的体积分数(%)。| 矿物 | 占颗粒骨架的体积分数/% | 矿物 | 占颗粒骨架的体积分数/% |
| 方解石 | 10.81 | 钙蒙脱石 | 0 |
| 石英 | 69.7 | 白云石 | 0 |
| 钾长石 | 12.3 | 菱铁矿 | 0 |
| 钠长石 | 7.04 | 菱镁矿 | 0 |
| 伊利石 | 0 | 片钠铝石 | 0 |
| 高岭石 | 0 | 铁白云石 | 0 |
| 钠蒙脱石 | 0 |
| 矿物 | 比表面积/(m2/g) | 中性机理 | 酸性机理 | 碱性机理 | |||||
| k25/(mol/m2/s) | Ea/(KJ/mol) | k25/(mol/m2/s) | Ea/ (KJ/mol) | n(H+) | k25/(mol/m2/s) | Ea/(KJ/mol) | n(OH-) | ||
| 石英 | 1.827 | 1.250×10-14 | 87.5 | ||||||
| 方解石 | 2.000 | 1.050×10-10 | 23.5 | 6.018×10-3 | 14.4 | 1.00 | |||
| 钾长石 | 0.054 | 9.050×10-12 | 51.7 | 8.710×10-11 | 51.7 | 0.50 | 6.310×10-12 | 94.1 | -0.82 |
| 伊利石 | 151.600×10-4 | 1.660×10-13 | 35.0 | 1.047×10-11 | 23.6 | 0.34 | 3.020×10-17 | 58.9 | -0.40 |
| 高岭石 | 151.600×10-4 | 6.918×10-14 | 22.2 | 4.898×10-12 | 65.9 | 0.78 | 8.913×10-18 | 17.9 | -0.47 |
| 钠长石 | 0.118×10-4 | 9.120×10-13 | 69.7 | ||||||
| 菱铁矿 | 9.800×10-4 | 1.260×10-9 | 62.8 | 6.450×10-4 | 36.1 | 0.50 | |||
| 白云石 | 9.800×10-4 | 2.951×10-8 | 52.2 | 6.457×10-4 | 36.1 | 0.50 | |||
| 菱镁矿 | 9.800×10-4 | 4.571×10-11 | 23.5 | 4.169×10-11 | 14.4 | 1.00 | |||
| 铁白云石 | 9.800×10-4 | 1.260×10-9 | 62.8 | 6.457×10-4 | 36.1 | 0.50 | |||
| 片钠铝石 | 9.800×10-4 | 1.260×10-9 | 62.8 | 6.457×10-4 | 36.1 | 0.50 | |||
| 钠蒙脱石 | 151.600×10-4 | 1.660×10-13 | 35.0 | 1.047×10-11 | 23.6 | 0.34 | 3.020×10-17 | 58.9 | -0.40 |
| 钙蒙脱石 | 151.600×10-4 | 1.660×10-13 | 35.0 | 1.047×10-11 | 23.6 | 0.34 | 3.020×10-17 | 58.9 | -0.4 |
| 注:n(H+)和n(OH-)分别为酸性和碱性机制常数。 | |||||||||
次生矿物比表面积的选取参照前人研究成果[15]。
2.2 模拟工具本文采用的模拟软件为美国劳伦斯伯克利国家重点实验室开发的多相流多组分软件TOUGHREACT[16]。目前该软件使用的数据库是EQ3/6,适用于不同温度(0~300℃)、压力(0.1 MPa到几十MPa之间)、水饱和度、离子强度(最高可达到6 mol/kg)、pH值和氧化还原电位(Eh)等水文地质和地球化学条件下的热、物理和化学的耦合过程;还可以应用于一维、二维或三维非均质多孔介质中的相关数值模拟研究。
2.3 模拟结果与讨论如图5a所示:CO2注入后和盐水发生反应,模型的反应液pH值快速降低至3.5;随着溶蚀矿物对H+的消耗,第15 天后pH值可回升至5.0左右。pH值的实测值明显大于模拟值,这是因为由于溶液的pH值是从反应釜(高温高压)环境移至室内(常温常压)环境后测量得到的,期间会有CO2气体溢出,故不能精确反映反应釜中的数值。反应液pH值的变化导致矿物的溶解和沉淀,使反应液的化学成分发生变化。反应液的Si、Na+、Ca2+、K+的计算值和实测值拟合较好(图5b)。随着钾长石等含硅矿物的溶蚀,K+和Si的浓度随着反应的进行而增加。反应13 d后Ca2+浓度达到11.6 mmol/L,并在以后的反应时间无明显变化;这表明CO2注入后方解石发生剧烈溶蚀,13 d后在反应液中达到饱和状态。实验中钠长石发生沉淀作用(图3c),然而Na+浓度在数值模型中基本不变,这可能是因为钠长石沉淀作用较弱,并且“盐析效应”增加了Na+的浓度。
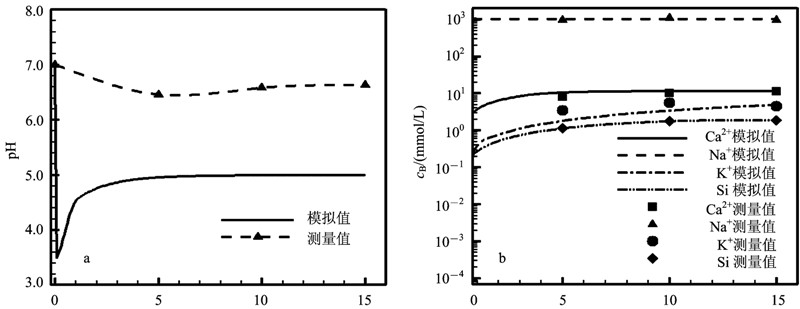 |
| 图 5 水化学成分实验值与模拟值对比图 Fig. 5 Comparison of predicted solution composition with measured experimental values |
| |
如图6a所示:模型反应液中的钠长石处于过饱和状态,石英、钾长石处于非饱和状态,和实验中的钠长石析出、石英和钾长石溶解的现象相符;方解石开始处于溶解状态,随后为饱和状态,和实验中方解石溶蚀坑发育、次生方解石微弱沉淀的现象相近。
 |
| 图 6 模型矿物饱和指数随时间变化图 Fig. 6 Corresponding predicted mineral saturation indices |
| |
如图6b所示:黏土矿物中伊利石、蒙脱石处于非饱和状态,同实验中并没发现这两种矿物的沉淀现象一致;高岭石处于过饱和状态,主要是因为长石等矿物溶解的Si、Al等组分发生络合反应形成的,但是实验中却并没发现高岭石的沉淀作用;菱铁矿、白云石、菱镁矿、铁白云石处于非饱和状态,片钠铝石在反应前一天为过饱和状态,随后为非饱和状态,同实验中并没发现这些矿物的沉淀现象一致;实验中出现菱铁矿的中间产物,然而模型中菱铁矿的SI值(饱和指数)并未随反应的进行而增加。
本次研究的模拟结果和室内实验结果总体上拟合较好,数值模拟技术可真实地揭示CO2-EGS水-岩-气相互作用机理,为工程的实施提供地球化学数据。然而本次研究中模型运行结果和实验观测值并非完全一致。反应液中Si和Ca2+浓度的模拟值较好地刻画了实验值,第5、10天的K+浓度模拟值小于实验值,模型中高岭石和菱铁矿的饱和指数变化和实验岩样观测有所差异,其原因如下:①模型数据库中的岩石热、动力学数据主要参考单一矿物的测量数据,和实验岩样的多矿物系统参数有所差异。②实验结束时打开反应釜,一部分水蒸气会随CO2溢出,对实验结果产生影响。③由于矿物检测技术的限制,XRD技术并没检测到微量含铁矿物,无法在模型中对其进行设置,导致岩样不能提供Fe和HCO-3发生络合反应生成菱铁矿。④矿物沉淀的化学机理比较复杂,SI值判断矿物沉淀往往不甚可靠[20, 21],高岭石的SI值为正值处于过饱和状态时,也可能不沉淀。
3 结论与建议1)CO2注入后形成碳酸对岩样进行溶蚀,导致岩体的矿物成分发生变化。实验岩样的钠长石发生沉淀作用,方解石、石英和钾长石发生溶蚀作用,且方解石溶蚀剧烈。
2)岩样的次生方解石沉淀现象不明显,说明CO2注入后裂隙通道原生碳酸盐矿物以溶蚀作用为主,至少短期内不会大规模转化为相应的次生碳酸盐矿物堵塞裂隙。
3)反应后岩样有含“C”的新矿物析出,新矿物的元素主要为Fe、Si、C、O,是固碳矿物菱铁矿的中间产物,表明CO2-EGS热储层对超临界CO2进行矿物捕集的可行性。
由于CO2-EGS水-岩-气作用受到矿物组分、地层水化学成分、地层温度、系统控制模式等多因素控制,这些因素对水-岩-气作用的影响程度及特征需要在以后的工作中进一步开展研究。
| [1] | Liu L,Suto Y,Bignall G,et al.CO2 Injection to Granite and Sandstone in Experimental Rock/Hot Water Systems[J]. Energy Conversion & Management, 2003, 44:1399-1410. |
| [2] | Ueda A, Kato K, Ohsumi T, et al. Experimental Studies of CO2-Rock Interaction at Elevated Temperatures Under Hydrothermal Conditions[J]. Geochem, 2005, 39:417-425. |
| [3] | Kaieda H, Ueda A, Kubota K, et al. Field Experiments for Studying on CO2 Sequestration in Solid Minerals at the Ogachi HDR Geothermal Site, Japan[C]// Proceedings 34th Workshop on Geothermal Reservoir Engineering. Stanford:Stanford University, 2009. |
| [4] | Wan Yuyu, Pruess K, Xu Tianfu. Impact of Fluid-Rock Interactions on Enhanced Geothermal Systems With CO2 as Heat Transmission Fluid[C]//Procee-dings 36th Workshop on Geothermal Reservoir Engineering. Stanford:Stanford University, 2011. |
| [5] | Xu T, Pruess K. Reactive Transport Modeling to Study Fluid-Rock Interactions in Enhanced Geothermal Systems (EGS) with CO2 as Working Fluid[C]//World Geothermal Congress. Bali: International Geothermal Association, 2010: 25-29. |
| [6] | 刘伟.大庆徐家围子地区水性分布规律及预测[D].杭州:浙江大学, 2010.Liu Wei. Water Distribution and Prediction in Xujiaweizi,Daqing[D]. Hangzhou: Zhejiang University, 2010. |
| [7] | 杨晓辉.徐家围子断陷地层水地化特征与油气藏的关系[D].大庆:大庆石油学院, 2009.Yang Xiaohui. Chemical Features of Formation Water and the Relationships with Oil/Gas Pool in Xujiaweizi Fault Depression[D]. Daqing:Daqing Petroleum Institute, 2009. |
| [8] | 王广华, 赵静, 张凤君, 等.砂岩储层中CO2-地层水-岩石的相互作用[J].中南大学学报:自然科学版, 2013(3):1167-1173.Wang Guanghua, Zhao Jing, Zhang Fengjun,et al. Interactions of CO2-Brine-Rock in Sandstone Reservoir[J]. Journal of Central South University:Science and Technology, 2013(3): 1167-1173. |
| [9] | Borgia A, Pruess K, Kneafsey T J, et al. Numerical Simulation of Salt Precipitation in the Fractures of a CO2 Enhanced Geothermal System[J]. Geothermics, 2012, 44(3): 13-22. |
| [10] | 朱焕来, 曲希玉, 刘立, 等. CO2流体-长石相互作用实验研究[J]. 吉林大学学报:地球科学版,2011, 41(3):697-706.Zhu Huanlai, Qu Xiyu, Liu Li, et al.Study on Inter-action Between the Feldspar and CO2 Fluid[J]. Journal of Jilin University:Earth Science Edition,2011, 41(3):697-706. |
| [11] | Wandrey M, Fischer S, Zemke K, et al. Monitoring Petrophysical, Mineralogical, Geochemical and Microbiological Effects of CO2 Exposure:Results of Long-Term Experiments Under in Situconditions[J]. Energy Procedia, 2011, 4: 3644-3650. |
| [12] | 于志超, 杨思玉, 刘立.饱和CO2地层水驱过程中的水-岩相互作用实验[J].石油学报,2012, 33(6):1032-1042.Yu Zhichao, Yang Siyu, Liu Li. An Experimemtal Study on Water-Rock Interaction During Water Flooding in Formations Saturated with CO2[J]. Acta Petrolei Sinica, 2012, 33(6): 1032-1042. |
| [13] | Huq F,Blum P,Marks M A W,et al.Chemical Chan-ges in Fluid Composition Due to CO2 Injection in the Altmark Gas Field: Preliminary Results from Batch Experiments[J]. Environmental Earth Sciences, 2012, 67(2): 385-394. |
| [14] | Dove P M, Crerar D A. Kinetics of Quartz Dissolution in Electrolyte Solutions Using a Hydrothermal Mixed Flow Reactor[J]. Geochimica et Cosmochimica Acta, 1990, 54(4): 955-969. |
| [15] | 万玉玉.鄂尔多斯盆地深部咸水层CO2地质储存中的迁移转化特征[D].长春:吉林大学,2012.Wan Yuyu. Migration and Transformation of CO2 in CO2 Geological Sequestration Process of Shiqianfeng Saline Aquifers in Orods Basin[D]. Changchun: Jilin University, 2012. |
| [16] | 许天福, 金光荣, 岳高凡, 等.地下多组分反应溶质运移数值模拟:地质资源和环境研究的新方法[J]. 吉林大学学报:地球科学版, 2012, 42(5): 1410-1425.Xu Tianfu, Jin Guangrong, Yue Gaofan, et al. Subsurface Reactive Transport Modeling :A New Research Approach for Geo-Resources and Evironment[J]. Journal of Jilin University:Earth Science Edition, 2012, 42(5): 1410-1425. |
| [17] | Xu T. Numerical Simulation to Study the Feasibility of Using CO2 as a Stimulation Agent for Enhanced Feothermal Systems[R].Berkeley: Lawrence Berkeley National Laboratory, 2010. |
| [18] | Xu T, Rose P, Fayer S, et al. On Modeling of Chemical Stimulation of an Enhanced Geothermal System Using a High pH Solution with Chelating Agent[J]. Geofluids, 2009, 9(2): 167-177. |
| [19] | Labus K,Bujok P.CO2 Mineral Sequestration Mechanisms and Capacity of Saline Aquifers of the Upper Silesian Coal Basin (Central Europe)-Modeling and Experimental Verification[J]. Energy, 2011, 36(8): 4974-4982. |
| [20] | 沈照理, 朱宛华. 水文地球化学基础[M].北京:地质出版社,1993.Shen Zhaoli, Zhu Wanhua. Hydrogeochemical Basis[M]. Beijing: Geology Publishing House, 1993. |
| [21] | 侯大力,罗平亚,王长权, 等.高温高压下CO2在水中溶解度实验及理论模型[J]. 吉林大学学报:地球科学版,2015,45(2):564-572.Hou Dali,Luo Pingya,Wang Changquan, et al. Experimental Reseachandthe TheoreticalModelforCO2 Solubility in WaterUnderHighTemperatureand HighPressure[J]. Journal of Jilin University:Earth Science Edition, 2015,45(2):564-572. |