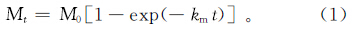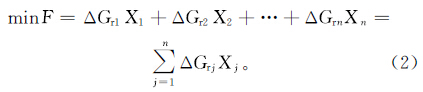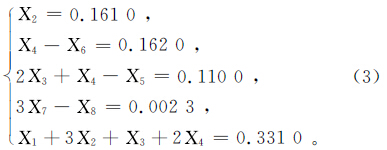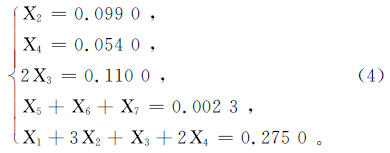2. 长沙理工大学水利工程学院, 长沙 410000;
3. 长白山自然保护区, 吉林 白山 135200
2. Shool of Hydraulic Engineering, Changsha University of Science&Technology, Changsha 410000, China;
3. Changbai Mountain Natural Nature Reserve, Baishan 135200, Jilin, China
0 引言
矿泉水是一种宝贵的地下水资源,具有广泛的社会应用价值。矿泉水的形成机理主要是水-岩反应[1, 2],并且水-岩反应受pH值、催化剂等因素的影响[3, 4]。近年来,国内外学者对水-岩反应的研究主要集中在云母矿物以及碳酸盐等层面。Oelkers等[5]研究了实验室条件下白云母矿物的溶解并建立了反应速率方程。Pachana等[6]研究了不同pH值和温度下云母矿物的反应,认为pH值和温度对云母矿物反应有较大影响。周锦铭[7]研究了卧龙含硅饮用矿泉水的化学成因,主要是由于含硅和钙的长石石英砂岩、微斜长石、纳长石的水解,使地下水中产生硅酸和锶。张念龙等[8]探讨了富锂、锌矿泉水形成的原因,主要是富含锂、锌矿物的溶解。陈振东等[9]认为长白山地区玄武岩呈现弱碱性,且玄武岩f区矿泉水为硅酸型矿泉水。但前人对于长白山玄武岩地区矿泉水的研究仅仅局限于矿泉水特征、开发潜力方面,而对玄武岩区矿泉水特征组分H2SiO3成因的研究尚处空白。笔者以靖宇县典型泉(王大山泉)岩样为实验材料,考虑了野外状况下腐植酸和大气中CO2的影响,设计了相关实验,并对矿物反应机理进行了分析,研究了靖宇县矿泉水特征组分H2SiO3的成因。 1 材料和方法 1.1 供试岩样
供试岩样采自靖宇县典型泉眼王大山泉。岩石为玄武岩,斑状结构,气孔或块状构造;矿物成分主要为斑晶橄榄石、斜长石;基质为间粒结构,主要由细粒的斜长石、单斜辉石和磁铁矿组成,长板状的斜长石局部呈半定向排列,其中充填有辉石、磁铁矿颗粒。岩石成分见表 1。
| 成分 | 质量分数/% | 成分 | 质量分数/% |
| SiO2 | 48.30 | K2O | 2.20 |
| Al2O3 | 19.05 | Na2O | 3.42 |
| Fe2O3 | 10.88 | TiO2 | 2.32 |
| FeO | 2.69 | P2O5 | 0.67 |
| CaO | 5.58 | MnO | 0.17 |
| MgO | 2.54 | 烧失量 | 1.74 |
将王大山泉岩样研磨成粉末,颗粒粒径约为200目,称取岩石粉末300 g,放入2 L的大烧杯中,按水、岩质量比5∶1,加入1.5 L去离子水(离子质量分数为0),加盖密封。根据王大山泉水样实测pH值以及含腐植酸土浸泡水样的pH值,设计4组实验,编号分别为W1、W2、W3和W4。其中:W1和W2仅考虑pH值影响,W1初始pH值为7.25,W2初始pH值为8.10;W3和W4同时考虑pH值和CO2影响,W3初始pH值为6.64,W4初始pH值为8.15,并且在实验开始7 d后,向反应溶液中通入CO2使反应溶液pH保持在弱酸性(5.8 < pH < 6.2)。
实验在常温密封下进行,实验于反应第1、2、3、5、7、10、15、20、25、30、40、50、60、70、80、100、120、140、160、180 天取样测定。每次取水样25 mL,测定溶液中H2SiO3质量分数,并在每次取样后向容器中注入相同体积的去离子水,恢复原水位。 2 结果与分析 2.1 实验结果
图 1为4组实验溶液中H2SiO3质量分数随时间的变化曲线。由图 1结合平均释放速率的计算可知:W1实验中,溶液中H2SiO3质量分数在反应0~75 d增加缓慢,在反应第75 天为1.55 mg/kg,平均释放速率为0.02 mg/(kg·d),此后溶液中H2SiO3质量分数趋于稳定(重复实验结果表明W1实验溶液中H2SiO3质量分数增加,但增加量较小)。W2实验中,溶液中H2SiO3质量分数在反应开始后缓慢增加,在反应第60 天为185.00 mg/kg,平均释放速率为3.08 mg/(kg·d),此后溶液中H2SiO3质量分数趋于稳定。W3实验中,在反应0~7 d,溶液中H2SiO3质量分数升高较快,在第7 天,溶液中H2SiO3质量分数为130.00 mg/kg,平均释放速率为18.57 mg/(kg·d);在第7天通入CO2,溶液中H2SiO3质量分数升高速率增加,在反应第25天溶液中H2SiO3质量分数为243.00 mg/kg,此后溶液中H2SiO3质量分数趋于稳定。W4实验中,溶液中H2SiO3质量分数在反应0~7 d缓慢增加,反应第7天,溶液中H2SiO3质量分数30.05 mg/kg,平均释放速率为4.29 mg/(kg·d);在反应第7天,溶液中通入CO2,溶液中H2SiO3质量分数迅速升高,此时平均释放速率为12.00 mg/(kg·d),在反应第30天,溶液中H2SiO3质量分数为225.00 mg/kg,此后溶液中H2SiO3质量分数趋于稳定。
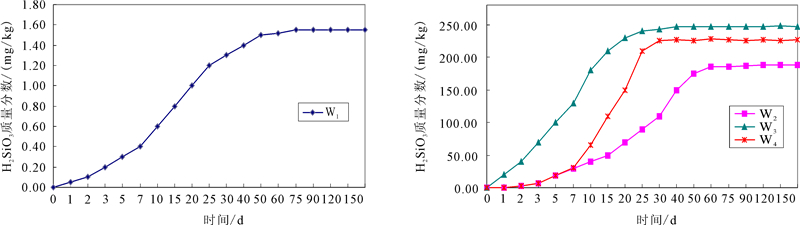 |
| 图 1 实验溶液中H2SiO3质量分数变化曲线Fig. 1 Curve of H2SiO3 of experiment solution |
由实验结果可以看出,反应溶液的初始pH值和CO2的加入对H2SiO3的释放有较大的影响;同时也证明,在野外实际条件下,降水在渗入玄武岩含水层前,溶解大气中的CO2和黏性土中的腐殖酸,对H2SiO3的形成有较好的促进作用。在实验室条件下,上述实验溶液中矿物释放H2SiO3的规律以及发生的矿物溶解反应由化学反应动力学和矿物反应机理进行分析。 2.2 化学动力学分析
根据各实验溶液中H2SiO3质量分数变化曲线趋势,采用Stanford等[10, 11]的一阶反应动力学模型来拟合W1、W2、W3和W4实验中H2SiO3质量分数随时间的变化过程
式中:M0为潜在释放势,mg/kg;km为一阶释放速率常数,d-1;Mt为累积释放量,mg/kg;t为反应时间,d。实验参数拟合结果见表 2。| 编号 | 初始pH值 | M0/(mg/kg) | km/d-1 | 拟合方程 | R2 |
| W1 | 7.25 | 1.58 | 0.02 | Mt=1.58[1-exp(-0.02t)] | 0.99 |
| W2 | 8.10 | 201.07 | 0.03 | Mt=201.07[1-exp(-0.03t)] | 0.97 |
| W3 | 6.64 | 249.31 | 0.11 | Mt=249.31[1-exp(-0.11t)] | 0.99 |
| W4 | 8.15 | 237.57 | 0.05 | Mt=237.57[1-exp(-0.05t)] | 0.95 |
| 注:R2为决定系数。 | |||||
由表 2可以看出,溶液初始pH值对溶液中H2SiO3释放有较大影响。在弱酸性条件下,H2SiO3释放量最大,反应速率最大;在中性条件下,H2SiO3释放量最小,反应速率也最小。W2实验和W4实验对比可以得出,CO2对H2SiO3释放有较好的促进作用,由于CO2的作用,W4实验中H2SiO3最大释放量和释放速率常数比W2实验有较大的提高。 3 矿物反应机理分析 3.1 模型构建
实验分析得出了溶液中H2SiO3的释放量以及释放规律。现利用能量最低原则和化学热力学的基本原理构建数学模型,分析实验岩样中矿物释放H2SiO3的反应机理。
由于通入CO2后,W4条件与W2相同,因此仅选择W1,W2和W3实验进行分析。将W1、W2和W3实验最终平衡溶液进行全分析,先利用能量最低原则和化学热力学的基本原理建立数学模型,再利用Matlab优化工具箱提供的函数linprog对模型进行求解。
目标函数根据热力学原理,化学反应的自由能变化ΔGr越小,正反应趋势就越大。据此,设定实验反应溶液系统各化学反应的反应自由能变化ΔG之和的最小值为目标函数,即
式中:F为目标函数,kJ/L;ΔGr为化学反应自由能的变化量,kJ/mol;Xj为第j个化学反应的反应量(mol/L);n为反应物数。当Xj > 0时,反应向正方向进行;Xj < 0时,表示反应向逆反应方向进行;Xj=0时,表示反应在系统中处于平衡状态。模型的约束条件有质量守恒原理、电荷守恒原理和电子守恒原理。 3.2 矿物反应结果与分析表 3为W1实验中水-岩作用化学反应及自由能变化。表 4为W1实验初始液和平衡液离子浓度及其特征值。表 5为W1实验最优可行解。
| 序号 | 反应物 | 化学反应 | ΔGr/(kJ/mol) |
| 1 | SiO2 | SiO2+2H2O→H4SiO4 | -214.00 |
| 2 | 斜长石 | NaAlSi3O8+5.5H2O→Na++0.5Al2Si2O5(OH)2(高岭石)+3H4SiO4+OH- | -1 189.03 |
| 3 | 镁橄榄石 | Mg2SiO4(镁橄榄石)+4H2O→2Mg2++4OH-+H4SiO4 | 153.43 |
| 4 | 透辉石 | CaMgSi2O6(透辉石)+6H2O→Ca2++Mg2++4OH-+2H2SiO4 | 199.06 |
| 5 | Mg2+ | Mg2++2OH-→Mg(OH)2 | -66.10 |
| 6 | Ca2+ | Ca2++2OH-→Ca(OH)2 | -29.44 |
| 7 | Fe3O4 | Fe3O4+8H+→3Fe3++4H2O | 32.30 |
| 8 | Fe3+ | Fe3++3OH-→Fe(OH)3 | -214.20 |
| mmol/L | ||||||||||
| 组分 | K+ | Na+ | Ca2+ | Mg2+ | Fe3+ | HCO-3 | SO2-4 | Cl- | F- | H4SiO4 |
| 平衡液 | 0.023 5 | 0.161 0 | 0.162 0 | 0.110 0 | 0.002 3 | 1.080 0 | 0.000 0 | 0.000 0 | 0.068 4 | 0.331 0 |
| Δc | 0.023 5 | 0.161 0 | 0.162 0 | 0.110 0 | 0.002 3 | 1.080 0 | 0.000 0 | 0.000 0 | 0.068 4 | 0.331 0 |
| 注:Δc为反应前后溶液中各离子浓度的变化量。 | ||||||||||
| mmol/L | |||||||
| X1 | X2 | X3 | X4 | X5 | X6 | X7 | X8 |
| SiO2 | 斜长石 | 镁橄榄石 | 透辉石 | Mg2+ | Ca2+ | Fe3O4 | Fe3+ |
| 0.000 1 | 0.000 0 | 0.000 0 | 0.000 1 | 0.000 0 | 0.000 0 | 0.377 9 | 1.133 8 |
W1实验约束条件为
式中:X1——X8分别为表 3中的8种反应物的反应量。表 6为W2实验中水-岩作用化学反应及自由能变化。表 7为W2实验初始溶液和平衡液离子浓度及其特征值。表 8为W2实验最优可行解。| 序号 | 反应物 | 化学反应 | ΔGr/(kJ/mol) |
| 1 | SiO2 | SiO2+2H2O→H2SiO4 | -164.36 |
| 2 | 斜长石 | NaAlSi3O8+2H2O+6OH-→Na++ Al(OH)-4+3H2SiO2-4 | -613.55 |
| 3 | 镁橄榄石 | Mg2SiO4(镁橄榄石)+4H2O→2 Mg(OH)2+H4SiO4 | 21.23 |
| 4 | 透辉石 | CaMgSi2O6(透辉石)+6H2O→Ca(OH)2+Mg(OH)2+2H4SiO4 | 103.52 |
| 5 | Mg(OH)2 | Mg(OH)2→Mg2++2OH- | 66.10 |
| 6 | Ca(OH)2 | Ca(OH)2→Ca2++2OH- | 29.44 |
| 7 | Fe3O4 | Fe3O4+4H2O→Fe(OH)2+ 2Fe(OH)3 | -630.00 |
| 8 | Fe(OH)2 | Fe(OH)2→Fe2++2OH- | -66.70 |
| 9 | Fe(OH)3 | Fe(OH)3→Fe3++3OH- | -25.50 |
| mmol/L | ||||||||||
| 组分 | K+ | Na+ | Ca2+ | Mg2+ | Fe3+ | HCO-3 | SO2-4 | Cl- | F- | H4SiO4 |
| 平衡液 | 0.016 5 | 0.099 0 | 0.054 0 | 0.110 0 | 0.002 3 | 1.945 0 | 0.000 0 | 0.000 0 | 0.136 8 | 0.275 0 |
| Δc | 0.016 5 | 0.099 0 | 0.054 0 | 0.110 0 | 0.002 3 | 1.945 0 | 0.000 0 | 0.000 0 | 0.136 8 | 0.275 0 |
| mmol/L | |||||||
| X1 | X2 | X3 | X4 | X5 | X6 | X7 | |
| SiO2 | 斜长石 | 镁橄榄石 | 透辉石 | Fe3O4 | Fe(OH)2 | Fe(OH)3 | |
| 0.000 0 | 0.099 0 | 0.055 0 | 0.054 0 | 0.502 9 | 0.000 2 | 0.053 2 | |
W2实验约束条件为
式中:X1——X9分别为表 6中9种反应物的反应量。表 9为W3实验中水-岩作用化学反应及自由能变化。表 10为W3实验初始溶液和平衡液离子浓度及其特征值。表 11为W3实验的最优可行解。
| 序号 | 反应物 | 化学反应 | ΔGr/(kJ/mol) |
| 1 | 镁橄榄石 | Mg2SiO4(镁橄榄石)+4CO2+4H2O→2Mg2++4HCO-3+H4SiO4 | -322.98 |
| 2 | 斜长石 | NaAlSi3O8+CO2+5.5H2O→0.5Al2Si2O5(OH)4(高岭石)+Na++2H4SiO4+HCO-3 | 81.87 |
| 3 | 透辉石 | CaMgSi2O6(透辉石)+4CO2+6H2O→Ca2++Mg2++4HCO-3+2H2SiO4 | 51.06 |
| 4 | SiO2 | SiO2+2H2O→H4SiO4 | -214.00 |
| 5 | HCO-3 | HCO-3→H++CO2-3 | 58.90 |
| 6 | Ca2+ | Ca2++CO2-3→CaCO3 | -47.36 |
| 7 | Fe3O4 | Fe3O4+8H+→3Fe3++4H2O | 32.30 |
| mmol/L | ||||||||||
| 组分 | K+ | Na+ | Ca2+ | Mg2+ | Fe3+ | HCO-3 | SO2-4 | Cl- | F- | H4SiO4 |
| 平衡液 | 0.020 8 | 0.097 0 | 1.458 0 | 1.518 0 | 0.009 5 | 3.241 0 | 0.218 0 | 2.377 0 | 0.015 6 | 0.390 0 |
| Δc | 0.020 8 | 0.097 0 | 1.458 0 | 1.518 0 | 0.009 5 | 3.241 0 | 0.218 0 | 2.377 0 | 0.015 6 | 0.390 0 |
| mmol/L | |||||||
| X1 | X2 | X3 | X4 | X5 | X6 | X7 | |
| 镁橄榄石 | 斜长石 | 透辉石 | SiO2 | HCO-3 | Ca2+ | Fe3O4 | |
| 2.074 3 | 0.097 0 | 1.438 1 | 1.406 6 | 0.000 0 | 0.000 0 | 0.003 2 | |
W3实验约束条件为
式中: X1——X7分别为表 9中7种反应物的反应量。经过分析可知:溶液中H2SiO3由玄武岩中矿物的水-岩反应产生,并且H2SiO3的产生在中性条件下最弱,玄武岩中矿物(主要为斜长石、镁橄榄石、透辉石)基本不发生反应;在碱性条件下,玄武岩中矿物发生水解;在弱酸性条件下,特别是加上CO2的参与,玄武岩中矿物与H+和CO2发生反应,H2SiO3的释放量最大。在野外条件下,大气降水溶解CO2,经过地表腐殖层渗入到玄武岩含水层,H2SiO3的形成主要由玄武岩中矿物与H+和CO2反应产生。在玄武岩裸露地区,大气降水直接渗入到玄武岩含水层,但由于研究区玄武岩为碱性岩石,则H2SiO3的形成由玄武岩矿物H+、CO2以及水解综合反应产生。 4 结论
1)pH值对H2SiO3的形成影响较大,弱酸性条件下H2SiO3的形成较碱性条件下容易,反应速率快,释放量大;在中性条件下H2SiO3很难形成。CO2有利于溶液中H2SiO3的形成。
2)实验溶液中H2SiO3释放规律符合Stanford一阶反应动力学方程。
3)在碱性条件下,H2SiO3主要是玄武岩中矿物(斜长石、镁橄榄石、辉石)的水解产生;在酸性和CO2共同作用下,H2SiO3主要是玄武岩中矿物与H+和CO2反应产生。
4)靖宇矿泉水中H2SiO3的形成是地下水与玄武岩中矿物长期反应的结果。
| [1] | 虞鹏鹏. 水-岩反应及其研究意义[J].中山大学研究生学刊,2012,33(4):25-30. Yu Pengpeng.Water Rock Reaction and Its Significance[J]. Journal of Zhongshan University Graduate, 2012,33(4):25-30. |
| [2] | 林学钰,张文静,何海洋,等. 人工回灌对地下水水质影响的室内模拟实验[J].吉林大学学报:地球科学版,2012,42(5):1404-1409. Lin Xueyu, Zhang Wenjing, He Haiyang, et al. Experiment on Impact of Groundwater Quality During Artificial Recharge Process[J]. Journal of Jilin University: Earth Science Edition,2012,42(5):1404-1409. |
| [3] | Giuseppe D, Saldin G D, Schott J, et al. An Experimental Study of Magnesite Precipitation Rates at Neutral to Alkaline Conditions and 100-200 ℃ as a Function of pH, Aqueous Solution Composition and Chemical Affinity[J]. Geochimica et Cosmochimica Acta,2002,83:93-109. |
| [4] | Christoskova S T, Stoyanova M. Catalytic Oxidation of Cyanides in an Aqueous Phase over Individual and Manganese-Modified Cobalt Oxide Systems[J].Journal of Hazardous Materials,2009,165:690-695. |
| [5] | Oelkers E H, Schott J, Gauthier J M. An Experimental Study of the Dissolution Mechanism and Rates of Muscovite[J]. Geochimica et Cosmochimica Acta,2008,72:4948-4961. |
| [6] | Pachana K, Zuddas P, Censi P. Influence of pH and Temperature on the Early Stage of Mica Alteration[J]. Applied Geochemistry,2012,27:1738-1744. |
| [7] | 周锦铭.天然含硅饮用矿泉水的化学成因与开发前景[J].资源开发与保护,1992,8(2):135-136. Zhou Jinming. The Chemical Genesis and Development of Natural Silicon Mineral Water[J]. Resources Development and Conservation,1992,8(2):135-136. |
| [8] | 张念龙,李剑平,李世忠.山西省饮用天然矿泉水有益元素分析[J].资源开发与市场,1999, 15(3):177-178. Zhang Nianlong, Li Jianping, Li Shizhong.The Analysis of Beneficial Elements of Mineral Water in Shanxi[J]. Resource Development & Market,1999,15(3):177-178. |
| [9] | 陈振东.长白山地区玄武岩地下水基本特征[J].阜新矿业学院学报:自然科学版,1994(4):26-29. Chen Zhendong.Basic Characteristics of Groundwater in Basalt in the Changbai Mountain Area[J]. Journal of Fuxin Mining Institute:Natural Science Edition,1994(4):26-29. |
| [10] | Stanford G, Smith S J.Nitrogen Mineralization Potentials of Soil[J]. Soil Science Society of America Journal,1972,3:465-472. |
| [11] | 张先富,李卉,洪梅,等.苏打盐碱土对氮转化的影响[J].吉林大学学报:地球科学版,2012,42(4):1145-1150. Zhang Xianfu, Li Hui, Hong Mei, et al. Effects of Saline-Alkali Soil on Nitrogen Transformations[J]. Journal of Jilin University:Earth Science Edition,2012,42(4):1145-1150. |