2. 吉林大学水资源与环境研究所, 长春 130021;
3. 沈阳地质矿产研究所/中国地质调查局沈阳地质调查中心, 沈阳 110034
2. Institute of Water Resources and Environment, Jilin University, Changchun 130021, China;
3. Shenyang Institute of Geology and Mineral Resources/Shenyang Center of Geological Survey, China Geological Survey, Shenyang 110034, China
地面沉降在世界各地非常普遍,在城市尤为显著[1]。上海是我国发生地面沉降最早、影响最大的城市[2],地面沉降已使上海区域地貌形态发生显著变化,威胁着上海城市安全,并制约着上海经济社会的可持续发展[3]。人工回灌是防止和控制地面沉降的重要手段,同时在增加地下水资源量、防止海水入侵及储能等方面得到广泛的应用[4, 5, 6, 7]。然而,由于采用的回灌水源与地下水之间存在明显的环境系统条件和水质差异[4],回灌水的注入会使原有含水层地下水环境发生改变,而含水层中原有微生物群落结构会随着环境的改变而发生改变,进而导致微生物作用下的地下水水化学组分可能会发生不同程度的变化。人工回灌后地下水中微生物群落结构变化对地下水的水质安全存在着潜在的重要影响。
路莹等[8]对地下水人工回灌过程中微生物堵塞的预测中提到,回灌水源中有机碳、氮、磷等营养物质浓度是形成微生物堵塞的关键因素,同时地下环境的温度、pH及氧化还原条件也是影响微生物活动的因素。姜桂华等[9]研究表明,天然状态下微生物活动相对稳定,当回灌水注入后,入渗介质中的微生物可能在回灌水刺激下迅速繁殖,其生物体或代谢产物会导致微生物堵塞,造成渗透介质导水能力降低。然而,目前针对人工回灌过程中地下水中微生物群落变化的具体情况的研究相对较少。
变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)法是Muyzer等[10, 11]于1993年首次应用于微生物生态学研究领域的,这一方法克服了传统微生物的分离、培养和鉴定等工作无法客观反映环境微生物实际情况的局限性。目前,DGGE技术已广泛应用于地表水、地下水以及土壤介质中微生物群落多样性和种群差异性等方面的分析。DGGE技术能够提供群落中优势种类信息和同时分析多个样品,具有操作方便快捷、结果可靠性高、重复性好等特点,适合于调查种群的时空变化[12, 13, 14, 15, 16, 17]。
笔者以上海市某人工回灌试验场为研究场地,结合场地地质、水文地质条件,采用DGGE技术,考察人工回灌前后场地地下水中的微生物群落结构特征,同时鉴定人工回灌前后地下水中优势菌属(种),分析微生物群落结构变化对地下水水文地球化学作用的潜在影响,以期为评价人工回灌对地下水水质安全的影响提供科学的理论依据。
1 材料与方法 1.1 材料 1.1.1 回灌场地概况
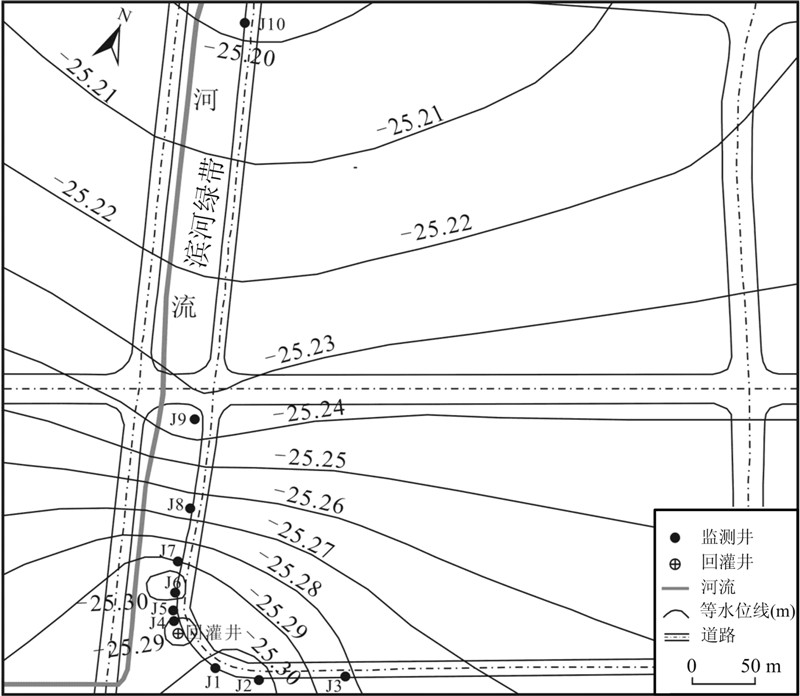
研究区位于上海市某人工回灌试验场地,场地面积约75 000 m2,采用定流量连续回灌,回灌目的层位为第IV承压含水层。该含水层在试验场区发育较厚(约为46 m),产状近水平,岩性为含砾中粗砂夹细砂,含水层富水性较好,与上覆第III承压含水层和下伏的第V承压含水层间分布有较为稳定的黏性土隔水层,水力联系较弱[18, 19, 20]。回灌场地共布设有1口回灌井、10口监测井(J1——J10),平面上各监测井均以回灌井为中心,沿近南北和近东西2个方向排列,并且回灌井与监测井间距离按自然对数等间距原则布置。本次微生物试验取样点主要集中在近南北方向的7口监测井(J4——J10),其距离回灌井最远为475 m,距西侧中心河为10~15 m,监测井布置近似垂直于第Ⅳ承压含水层地下水等水位线(图 1)。监测井与回灌井成井位置保持一致,即监测井的滤水管埋设位置与回灌井一致。
1.1.2 样品的采集与制备采集回灌前和回灌过程中不同时间的地下水以及回灌水源进行分析,共采集样品16件。其中包括回灌过程中的地下水样品14件、回灌前地下水样品1件以及回灌水源样品1件(各样品采集井位及回灌时间如表 1所示)。
| 取样井位 | 样品编号 | 回灌时间/h | 取样井位 | 样品编号 | 回灌时间/h |
| J4 | S1 | 10 | J6 | S9 | 360 |
| S2 | 48 | S10 | 744 | ||
| S3 | 108 | S11 | 1 440 | ||
| S4 | 360 | S12 | 2 208 | ||
| J5 | S5 | 48 | J7 | S13 | 2 208 |
| S6 | 108 | 回灌井 | S14 | 384 | |
| S7 | 360 | 回灌水源 | S15 | - | |
| S8 | 744 | 回灌前地下水 | S16 | - |
采集水样时,首先利用清洁无菌塑料桶采集地下水2.5 L;然后用无菌金属镊子将混合纤维素膜(0.22 μm孔径)夹至抽滤瓶口处,并将平底漏斗安装好;再将塑料桶中的地下水倒入平底漏斗后开始抽滤,使水样中的微生物截留在混合纤维素膜上;抽滤结束后将平底漏斗拆下,戴上无菌手套取下混合纤维素膜,将混合纤维素膜两次对折后装入经过灭菌的离心管中,贴上标签放入冰箱中冷藏保存待测。
1.1.3 试剂与仪器
1)药品试剂
试剂盒:土壤总DNA提取试剂盒(power soil DNA isolation kit,MoBio)、UNIQ-10柱式PAGE胶DNA回收试剂盒(生工生物工程,上海)。
主要生化试剂: DNA引物(GC-338F和518R)、核苷酸溶液(dNTP mixture)、高温聚合酶(Taq DNA polymerase)、标准分子量马克(DNA marker)、无水乙醇、MgCl2、超纯水、琼脂糖H(Agarose H)、6×Loading Buffer、10×PCR Buffer、1×TAE Buffer、溴化乙锭(EB)、碳酰胺、去离子甲酰胺、三羟甲基氨基甲烷(Tris)、乙二胺四乙酸(EDTA)、丙烯酰胺、亚甲基双丙烯酰胺、过硫酸铵、四甲基乙二胺(TEMED)、乙酸、异丙醇等。以上药品试剂均购于生工生物工程(上海)股份有限公司。
2)仪器设备
主要实验仪器:HI98130型便携式测试笔(意大利 哈纳)、HITACHI Z-2000原子吸收光谱仪(日本 日立)、DIONEX ICS-90离子色谱仪(美国 戴安)、SW-CJ-1D 超净工作台(中国 苏州净化)、VDRTEX-5 涡旋仪(中国 海门)、SIGMA3-18K 台式高速离心机(德国 SIGMA)、Mx3000P Stratagene实时荧光定量 PCR 仪(美国 安捷伦 Stratagene 公司)、DYY-8C电泳仪(中国 北京市六一仪器厂)、MiniBIS 凝胶成像系统(以色列 DNR 成像系统有限公司)、Dcode System 变性梯度凝胶电泳系统(美国 Bio-Rad 公司)等。
1.2 方法 1.2.1 水质分析方法
在野外现场,利用便携式测试笔对采集水样的温度、pH、Eh、DO质量浓度(ρ(DO))等指标进行测定;在实验室内,利用原子吸收法测定水样中K+、Na+、Ca2+、Mg2+的质量浓度,利用离子色谱法测定Cl-、SO2-4、HCO-3的质量浓度。
1.2.2 基因组DNA的提取
使用DNA提取试剂盒进行基因组DNA的提取。分别将待测的混合纤维素膜取出,剪碎置于PowerBead Tube中,按试剂盒中提供的操作步骤提取样品中的DNA,记录并于-20 ℃保存。
将提取后的DNA用1%琼脂糖胶电泳检查,其具体方法如下:0.5 g琼脂糖与50 mL 1×TAE Buffer混合加热至琼脂糖完全熔化,待混合液冷却至50 ℃左右时加入5 μL EB摇匀,倒入插梳子的凝胶板中;琼脂糖完全凝固(约30 min)后,将10 μL 提取的DNA产物及2 μL 6×Loading Buffer混匀后注入加样孔,在109 V、92 mA条件下电泳50 min;电泳结束后,在凝胶成像系统中观察结果。
1.2.3 基因组DNA的PCR扩增
将提取得到的DNA作为聚合酶反应(PCR)的模板,使用实时荧光定量PCR仪,采用16S rDNA V3区通用引物,上游引物GC-338F(5’-CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG GCC TAC GGG AGG CAG CAG-3’),下游引物518R(5’-ATT ACC GCG GCT GCT GG-3’)。
采用50.0 μL的PCR体系,其组成为: 模板DNA1.0 μL、10×PCR Buffer 5.0 μL、MgCl2 4.0 μL、dNTPs 2.0 μL、上下游两种引物各1 .0 μL、Taq DNA聚合酶0.2 μL,再加适量的超纯水补足50.0 μL。设定PCR的一个循环为95 ℃预变性4 min、94 ℃变性1 min、55 ℃退火1 min、72 ℃延伸1.5 min,共进行35个循环,之后于72 ℃延伸10 min。将得到的PCR的产物按1.2.1中的方法进行电泳检查,并在凝胶成像系统中观察PCR扩增结果[21, 22] 。
1.2.4 PCR产物的变性梯度凝胶电泳
采用Bio-Rad公司的变性梯度凝胶电泳系统(dcode system)对PCR产物进行电泳分离。凝胶为8%的聚丙烯酰胺,变性剂质量分数为30%~60%(其中100%的变性剂为7 mol/L的碳酰胺和40%的去离子甲酰胺的混合物),其中变性剂质量分数从凝胶的上方到下方依次递增[23, 24]。待凝胶完全凝固后,放入装有电泳缓冲液(1×TAE)的电泳槽中,取30 μL PCR产物及10 μL 6×Loading Buffer混合后,用注射器取30 μL混合液至每个加样孔中。整个电泳系统于120 V电压和60 ℃恒温状态下运行400 min。电泳结束后,将凝胶在含有EB的TAE缓冲液中染色60 min,并在凝胶成像系统中获取其指纹图谱。
1.2.5 切胶回收及测序
用超纯水对凝胶进行漂洗,在紫外光照射下,选 择凝胶上10条比较亮的条带进行切割。将含目的 DNA片段的凝胶切下,放入1.5 mL离心管中,称质量。采用UNIQ-10柱式PAGE胶DNA回收试剂盒(生工生物工程,上海)进行回收,所得到的DNA溶液置于-20 °C保存。按照1.2.2中的方法对回收的溶液进行基因组DNA的PCR扩增,将10个条带最终的PCR产物送至专业测序公司(生工生物工程,上海)进行测序,返回得到了其中8个条带的16S rDNA的V3区序列。
2 结果与讨论 2.1 人工回灌过程中地下水环境变化分析
S1——S16样品的测试结果如表 2所示,随着人工回灌的进行,地下水中TDS质量浓度(ρ(TDS))降低,水化学类型由Cl·HCO3-Na型向HCO3-Ca·Mg和HCO3-Ca·Na型转变。由此可见,人工回灌作用会对目的含水层的地下水水质产生影响。由于本次研究的人工回灌目的含水层为埋深约164 m的承压含水层,属于还原环境,Eh值和ρ(DO)均较低(分别为64.0 mV和1.12 mg/L),而回灌水的Eh值和ρ(DO)较高(分别为562.0 mV和8.01 mg/L),随着回灌的进行,目的含水层地下水的Eh值和ρ(DO)呈现缓慢的上升趋势。以J4井为例(图 2),Eh、ρ(DO)随回灌时间波动上升,至回灌360 h时分别达到534.4 mV和1.44 mg/L。回灌水的注入破坏了地下水原始的还原条件,并会促进目的含水层地下水中好氧微生物的生长与繁殖,对厌氧微生物的生长产生一定的抑制作用,从而使地下水中微生物群落结构产生变化。
| 取样井位 | 样品编号 | 温度/℃ | pH | 电导率/(μS/cm) | Eh/mV | ρ(DO)/(mg/L) | ρ(TDS)/(mg/L) | 水化学类型 |
| J4 | S1 | 23.0 | 7.44 | 1 590 | 526.4 | 0.87 | 936.22 | Cl·HCO3-Na |
| S2 | 24.1 | 7.58 | 987 | 525.1 | 1.08 | 488.33 | HCO3·Cl-Na | |
| S3 | 23.1 | 7.80 | 868 | 542.1 | 1.40 | 495.26 | HCO3·Cl-Na | |
| S4 | 24.1 | 7.81 | 357 | 534.4 | 1.44 | 222.72 | HCO3-Ca·Mg | |
| J5 | S5 | 23.8 | 7.59 | 869 | 525.1 | 0.87 | 793.10 | Cl·HCO3-Na |
| S6 | 23.1 | 7.65 | 868 | 542.1 | 1.43 | 532.83 | HCO3·Cl-Na | |
| S7 | 22.4 | 7.52 | 663 | 520.4 | 1.43 | 400.65 | HCO3·Cl-Na·Ca | |
| S8 | 22.1 | 7.73 | 384 | 574.5 | 1.18 | 227.41 | HCO3-Ca·Na | |
| J6 | S9 | 21.7 | 7.48 | 1 497 | 501.2 | 1.75 | 865.22 | Cl·HCO3-Na |
| S10 | 22.1 | 7.41 | 975 | 551.8 | 1.20 | 530.70 | HCO3·Cl-Na | |
| S11 | 22.3 | 7.53 | 778 | 508.3 | 1.40 | 441.46 | HCO3·Cl-Na·Ca | |
| S12 | 22.1 | 7.60 | 741 | 582.3 | 2.91 | 396.01 | HCO3·Cl-Na·Ca | |
| J7 | S13 | 28.0 | 7.55 | 320 | 564.7 | 3.17 | 644.84 | HCO3·Cl-Na |
| 回灌井 | S14 | 28.1 | 7.69 | 311 | 520.4 | 3.84 | 186.05 | HCO3-Ca |
| 回灌水源 | S15 | 10.2 | 7.44 | 473 | 562.0 | 8.01 | 356.00 | HCO3·Cl-Ca·Na |
| 回灌前地下水 | S16 | 23.4 | 7.51 | 1 691 | 64.0 | 1.12 | 840.00 | Cl·HCO3-Na |
 |
| 图 2 J4井ρ(DO)、Eh随回灌时间变化曲线Fig. 2 ρ(DO) and Eh value of J4 changed over time |
通过样品微生物提取的总DNA在凝胶成像系统下拍照结果可知,各样品均得到一条较为清晰的电泳条带,说明其基因组DNA提取较为有效。但是研究发现各样品中的条带亮度不尽相同,说明各样品基因组DNA的提取量有所不同。在相同实验条件和提取产率下,不同的基因组DNA提取量表明各样品中的微生物总量不同,说明人工回灌使目的含水层地下水中的微生物总量发生了变化。
对以上DNA进行PCR扩增,结果如图 3所示。由图 3可以看出,除了空白样外,其余各样品均扩增出一条鲜明的DNA条带,且条带较亮。与Marker比较可知,扩增后各样品微生物的基因片段大小约为250 bp,是16S rDNA V3区特异性片段,扩增产物可作为DGGE样品进行下一步实验。
 |
| 图 3 各样品16S rDNA PCR扩增产物琼脂糖胶电泳Fig. 3 Agarose gel electrophoresis of PCR amplified 16S rDNA of different samples |
利用Quantity one图谱分析软件对DGGE图谱(图 4)进行分析,得到各条带分布及强度的示意图如图 5所示。从图 5中可以看出:大多数地下水样品所对应泳道中的条带数目较多,表明回灌目的含水层地下水中微生物种群丰富;不同泳道间的条带存在着一定的差异,体现在条带数量、条带位置和条带亮度等方面,表明人工回灌过程使目的含水层地下水中的微生物的数量以及群落多样性发生了变化[25]。
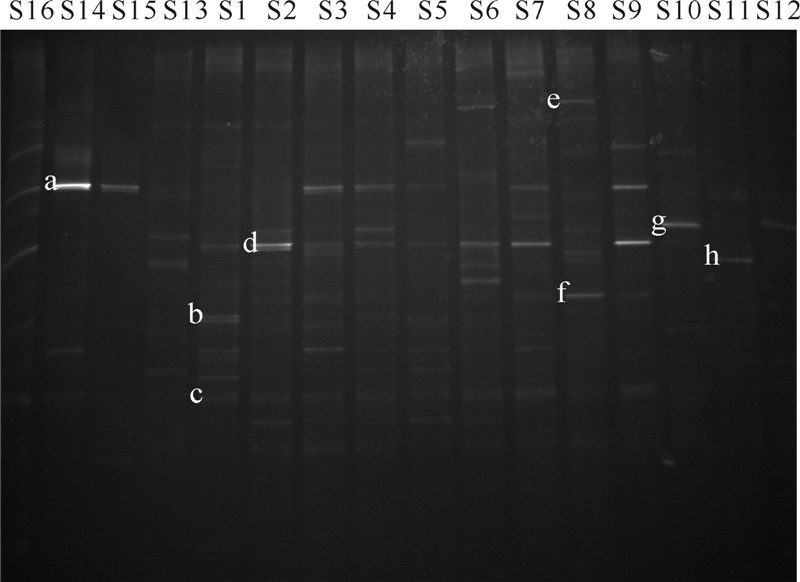 |
| 图 4 各样品中微生物的DGGE图谱Fig. 4 DGGE profile of different microorganism samples |
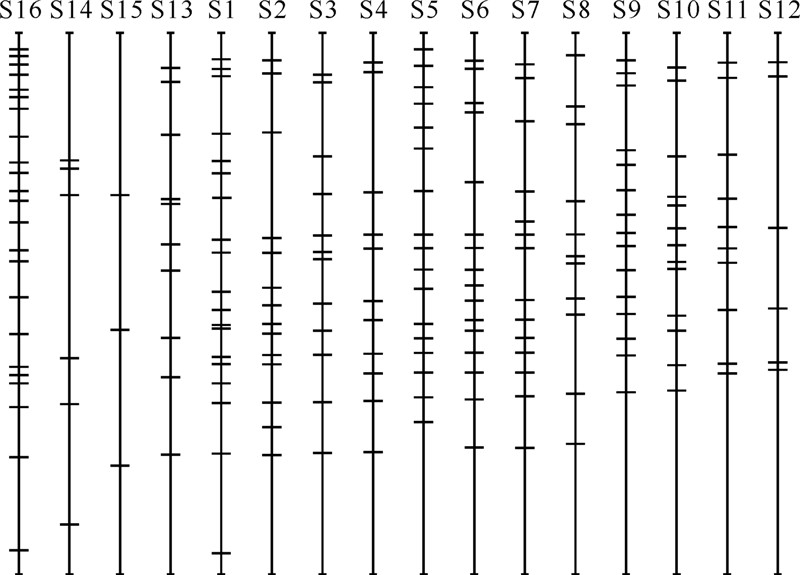 |
| 图 5 各样品中微生物DGGE图谱的条带示意图Fig. 5 DGGE sketch map of different microorganism samples samples |
根据Quantity one生成的相似矩阵(表 3),采用UPGMA法对DGGE实验结果进行聚类分析,建立场地微生物群落的系统树(图 6)。
| % | ||||||||||||||||
| 样品编号 | S16 | S14 | S15 | S13 | S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 | S11 | S12 |
| S16 | 100 | 25 | 24 | 53 | 67 | 53 | 55 | 49 | 55 | 49 | 41 | 51 | 49 | 53 | 47 | 29 |
| S14 | 25 | 100 | 45 | 11 | 32 | 12 | 48 | 34 | 23 | 24 | 9 | 19 | 29 | 29 | 46 | 13 |
| S15 | 24 | 45 | 100 | 23 | 20 | 11 | 40 | 29 | 18 | 15 | 12 | 21 | 18 | 16 | 34 | 0 |
| S13 | 53 | 11 | 23 | 100 | 42 | 48 | 37 | 52 | 47 | 43 | 49 | 35 | 45 | 37 | 37 | 15 |
| S1 | 67 | 32 | 20 | 42 | 100 | 66 | 62 | 63 | 53 | 59 | 49 | 53 | 62 | 56 | 39 | 28 |
| S2 | 53 | 12 | 11 | 48 | 66 | 100 | 53 | 64 | 56 | 62 | 56 | 58 | 52 | 55 | 38 | 39 |
| S3 | 55 | 48 | 40 | 37 | 62 | 53 | 100 | 66 | 44 | 54 | 46 | 46 | 60 | 59 | 57 | 31 |
| S4 | 49 | 34 | 29 | 52 | 63 | 64 | 66 | 100 | 47 | 62 | 61 | 50 | 54 | 57 | 52 | 49 |
| S5 | 55 | 23 | 18 | 47 | 53 | 56 | 44 | 47 | 100 | 60 | 53 | 56 | 60 | 44 | 40 | 26 |
| S6 | 49 | 24 | 15 | 43 | 59 | 62 | 54 | 62 | 60 | 100 | 63 | 61 | 64 | 42 | 41 | 29 |
| S7 | 41 | 9 | 12 | 49 | 49 | 56 | 46 | 61 | 53 | 63 | 100 | 48 | 60 | 51 | 35 | 30 |
| S8 | 51 | 19 | 21 | 35 | 53 | 58 | 46 | 50 | 56 | 61 | 48 | 100 | 52 | 43 | 44 | 28 |
| S9 | 49 | 29 | 18 | 45 | 62 | 52 | 60 | 54 | 60 | 64 | 60 | 52 | 100 | 59 | 47 | 33 |
| S10 | 53 | 29 | 16 | 37 | 56 | 55 | 59 | 57 | 44 | 42 | 51 | 43 | 59 | 100 | 54 | 57 |
| S11 | 47 | 46 | 34 | 37 | 39 | 38 | 57 | 52 | 40 | 41 | 35 | 44 | 47 | 54 | 100 | 51 |
| S12 | 29 | 13 | 0 | 15 | 28 | 39 | 31 | 49 | 26 | 29 | 30 | 28 | 33 | 57 | 51 | 100 |
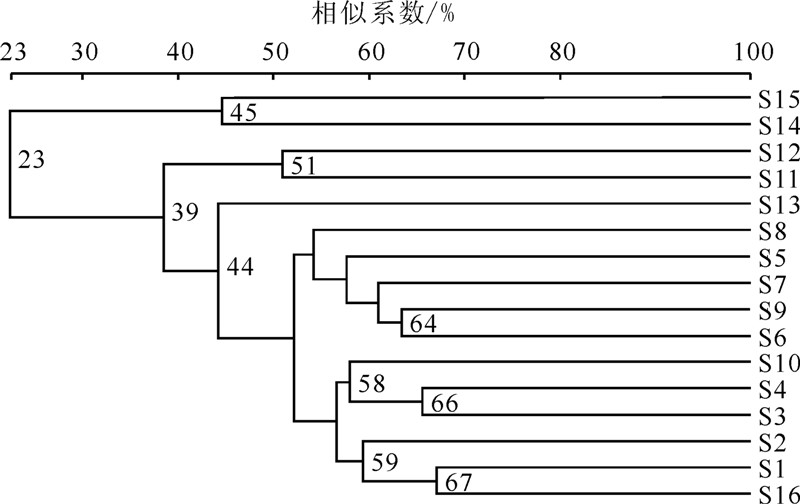 |
| 图 6 各样品微生物种群相似性的UPGMA聚类分析Fig. 6 Cluster analysis (UPGMA) of the similarity of different |
由聚类分析可知,16个样品共分为两大族群,族群间相似性为23%。其中:S15与S14族群内相似性为45%,二者分别为回灌水和回灌井样品;其余为原始地下水和各监测井地下水样品,在相似性39%以上的水平上相似。后者中的S1与S16的相似性最高,为67%,其中S16表征回灌目的含水层地下水的原始状态,S1则是J4在回灌10 h后所取的地下水样品,即距回灌井最近且回灌时间最短的样品。这二者的相似度高说明,回灌初始目的含水层地下水中的微生物群落结构虽然已发生变化,但是由于回灌时间较短,J4位置的微生物群落结构仍与原始地下水的具有较高的相似性。
以J4为例,研究每口井在不同回灌时间相对S16的相似系数的变化趋势,结果如图 7所示。由图 7可知,随着人工回灌的进行,J4目的含水层地下水中微生物相对S16的相似系数呈现下降的趋势,
 |
| 图 7 J4井相似系数随回灌时间变化曲线Fig. 7 Similarity coefficient of J4 changed over time |
即同一位置处地下水中微生物群落结构随回灌时间的延长与原始地下水状态的相似性降低。由此说明,人工回灌作用使目的含水层地下水中微生物生存环境发生了改变,原始状态下的一些微生物无法适应新的环境而逐渐被抑制、淘汰,同时可能会产生某些新的微生物,故其与原始地下水中微生物群落结构的相似性降低。同时由图 7可知,J4井各时间点的相似系数在前48 h内减小速率快,随后减缓。分析其原因则是随着人工回灌时间的延长,地下水中回灌水的比例逐渐增高,待一定时间后地下水几乎全部被回灌水所代替,微生物生存环境变化的程度及速率均减小,因此J4地下水中微生物群落结构相对原始地下水的相似性变化减缓。
不同监测井在同一回灌时刻(以360 h为例)相对S16的相似系数空间变化规律如图 8所示。由图 8可以看出,在人工回灌进行了一定时间后,随着与回灌井距离的增加,其相似系数也呈上升的趋势,即同一时刻,距离回灌井越远的井目的含水层地下水中微生物群落结构越接近于原始地下水状态。这是因为在相同的回灌时刻,距离回灌井越远的井,其目的含水层地下水接受回灌水混合作用的时间相对越短,微生物生存环境变化越微弱,微生物群落结构多样性改变越小,所以会显示出比距离较近的监测井更为接近原始地下水的的微生物群落结构特征。
 |
| 图 8 360 h时各井相似系数随距离变化曲线Fig. 8 Similarity coefficient of 360 h changed with distance |
利用GenBank数据库的BLAST 进行序列同源性比对,结果如表 4所示。
| 条带号 | GenBank 数据库中最相近的菌种名称 | 登录号 | 同源性/% |
| a | Acinetobacter sp. ADP1 chromosome | 005966.1 | 95 |
| b | Rhodoferax ferrireducens T118 chromosome | 007908.1 | 96 |
| c | Candidatus Accumulibacter phosphatis clade IIA str. UW-1 chromosome | 013194.1 | 96 |
| d | Rubrivivax gelatinosus IL144 | 017075.1 | 97 |
| e | Riemerella anatipestifer ATCC 11845=DSM 15868 chromosome | 014738.1 | 95 |
| f | Sphingobium sp. SYK-6 chromosome | 015976.1 | 98 |
| g | Candidatus Saccharimonas aalborgensis | 021219.1 | 95 |
| h | Sphingobium sp. SYK-6 chromosome | 015976.1 | 98 |
一般微生物16S rDNA序列同源性小于95%,可认为属于不同属;同源性小于98%,可认为属于不同种[26]。本次人工回灌过程中,目标含水层地下水中优势菌属(种)共有7种,包括Acinetobacter sp.,Rhodoferax ferrireducens,Candidatus Accumulibacter phosphatis clade IIA str.,Rubrivivax gelatinosus,Riemerella anatipestifer,Sphingobium sp.和Candidatus Saccharimonas aalborgensis。
由表 4可知,f和h条带与GenBank中已有菌种同源性为98%,三者属同一种,即Sphingobium sp.,它对芳香族化合物能起到有效的降解作用[27],在场地地下水样品中分布广泛。Acinetobacter sp.在各地下水样品中几乎均有分布,在回灌水样品中也有清晰的条带,说明该菌属在场地的地下水系统和研究区的自来水中占有一定优势[28]。Riemerella anatipestifer在S6和S8样品中有清晰的条带,Candidatus Saccharimonas aalborgensis在S10、S11和S12样品中有清晰的条带,说明二者分别集中分布于J5、J6监测井位置处的地下水中。
Rubrivivax gelatinosus是一种兼性异养菌,它除了具有进行光合作用的能力外,在厌氧条件下还可以进行反硝化作用,可将NO-2还原成N2,却不能还原NO-3[29]。该菌属在地下水样品中有清晰的条带,并且在各监测井回灌初期和原始地下水样品中,条带的光密度强度较弱,随着回灌的进行其强度变强,最后减弱。说明在回灌过程中,该菌属存在一个富集到衰退的过程,即其反硝化作用随着人工回灌的进行先增强后减弱,会对目的含水层地下水中三氮的含量及转化产生影响。在地下水样品中广泛分布的Candidatus Accumulibacter phosphatis clade IIA str.同样也具有一定的反硝化能力。
Rhodoferax ferrireducens是一种兼性厌氧菌,它在土壤和沉积物的碳以及金属循环中起着重要的作用。它可在地下低温环境中生存,并利用Fe3+作为电子受体对有机物进行氧化,实现土壤及沉积物中Fe3+的还原[30]。该菌属在回灌水样品中条带清晰度较差,在地下水样品中分布较广,尤其在S1和S5中较为清晰,说明J4和J5监测井回灌最初该菌属较为富集,随后其光密度强度减弱。林学钰等[18]在人工回灌对地下水水质影响的室内模拟实验研究中发现,回灌后Fe质量浓度明显升高并超过回灌水中的质量浓度值,说明地下水中的Fe质量浓度受到了回灌过程中混合作用和含水层矿物组分溶出的影响。石旭飞[31]在不同微生物条件下的人工回灌室内模拟试验中发现,模拟地下水溶液中,未灭菌溶液总Fe和Fe2+达到平衡时的质量浓度高于灭菌后的质量浓度,即微生物的存在有助于介质中含Fe矿物的溶出。通过笔者对微生物菌属(种)的鉴定及分析研究也可验证,目的含水层地下水中微生物的存在会对水中Fe的质量浓度变化产生影响。
3 结论
1)人工回灌过程中,目的含水层地下水中微生物群落结构变化研究和微生物种类的分布及作用研究,可通过PCR-DGGE及相应技术实现。
2)随着人工回灌的进行,地下水中TDS质量浓度降低,水化学类型由Cl·HCO3-Na型向HCO3-Ca·Mg和HCO3-Ca·Na型转变,人工回灌对目的含水层的地下水水质产生影响。同时,地下水的Eh值和DO质量浓度随着回灌的进行而逐渐增加,地下水环境发生改变,从而使地下水中微生物群落结构产生变化。
3)随着人工回灌的进行,同一监测井处目的含水层地下水中微生物群落结构与原始地下水状态的相似性降低;同一时刻,距离回灌井越远的监测井目的含水层地下水中微生物群落结构越接近于原始地下水状态。人工回灌作用使目的含水层地下水中微生物生存环境发生了改变,回灌时间越长改变越大;距离回灌井越远,受回灌水混合作用的时间相对越短,微生物生存环境变化越微弱。
4)人工回灌过程中,目的含水层地下水中微生物种类较多,优势菌属(种)包括Acinetobacter sp,Rhodoferax ferrireducens,Candidatus Accumulibacter phosphatis clade IIA str. ,Rubrivivax gelatinosus,Riemerella anatipestifer,Sphingobium sp和Candidatus Saccharimonas aalborgensis。其中: Candidatus Accumulibacter phosphatis clade IIA str. 和Rubrivivax gelatinosus的反硝化能力会对回灌目的含水层地下水中三氮的转化产生影响;Rhodoferax ferrireducens还原地下水中的Fe3+,结合回灌过程中混合作用和含水层矿物组分溶出作用,使地下水中Fe的质量浓度发生变化。
| [1] | 杨新安, 于敏, 程军.中国沿海城市地质环境灾害及其防治对策[J].辽宁工程技术大学学报:自然科学版, 1999, 18(5): 497-499. Yang Xin'an, Yu Min, Cheng Jun.Geological Hazards and Countermeasures in Coastai Cities[J].Journal of Liaoning Technical University: Natural Science, 1999, 18(5):497-499. |
| [2] | 龚士良, 李培超, 吴继红, 等.上海地面沉降地下水渗流场与地层应力场分析[J].辽宁工程技术大学学报:自然科学版, 2009, 28(增刊): 232-235. Gong Shiliang, Li Peichao, Wu Jihong, et al.Analysis of Groundwater Seepage Field and Stratum Stress Field of Land Subsidence in Shanghai[J].Journal of Liaoning Technical University:Natural Science, 2009, 28(Sup.):232-235. |
| [3] | 魏子新, 王寒梅, 吴建中, 等.上海地面沉降及其对城市安全影响[J].上海地质, 2009, 30(1):34-39. Wei Zixin, Wang Hanmei, Wu Jianzhong, et al.Land Subsidence and Its Influences on Urban Security of Shanghai[J].Shanghai Geology, 2009, 30(1):34-39. |
| [4] | 苏小四, 谷小溪, 孟婧莹, 等.人工回灌条件下多组分溶质的反应迁移模拟[J].吉林大学学报:地球科学版, 2012, 42(2):485-491. Su Xiaosi, Gu Xiaoxi, Meng Jingying, et al. Fate and Transport Simulation of Multi-Component Solute Under Artificial Recharge Conditions[J]. Journal of Jilin University: Earth Science Edition, 2012, 42(2):485-491. |
| [5] | 杜新强, 齐素文, 廖资生, 等.人工补给对含水层水质的影响[J].吉林大学学报:地球科学版, 2007, 37(2):293-297. Du Xinqiang, Qi Suwen, Liao Zisheng, et al. Influence of Artificial Recharge on Groundwater Quality[J]. Journal of Jilin University: Earth Science Edition, 2007, 37(2):293-297. |
| [6] | 张学真.地下水人工补给研究现状与前瞻[J].地下水, 2005, 27(1):25-28. Zhang Xuezhen. Research Situation and Prospective of Artificial Groundwater Recharge[J].Groundwater, 2005, 27(1):25-28. |
| [7] | 谢娟, 姜凌, 李泉.地下水人工补给水质的研究:以西安市回灌为例[J].西安工程学院学报, 2002, 24(4):67-72. Xie Juan, Jiang Ling, Li Quan. The Quality of Artificially Recharged Groundwater: Taking Artificially Recharged Groundwater in Xi'an as an Example[J]. Journal of Xi'an Engineering University, 2002, 24(4):67-72. |
| [8] | 路莹, 杜新强, 范伟, 等.地下水人工回灌过程中微生物堵塞的预测[J].湖南大学学报:自然科学版, 2012, 39(1): 77-80. Lu Ying, Du Xinqiang, Fan Wei, et al.Prediction of Microbial Clogging in Groundwater Artificial Recharge[J]. Journal of Hunan University: Natural Sciences, 2012, 39(1): 77-80. |
| [9] | 姜桂华, 廖资生, 徐凌云, 等.人工微生物脱氮过程中含水层堵塞问题的实验研究[J].长春科技大学学报, 1998, 28(2): 67-71. Jiang Guihua, Liao Zisheng, Xu Lingyun, et al.The Experimental Study on Clogging of Aquifer During the Treatment of Nitric Pollution by Synthetic Microorganism[J].Journal of Changchun University of Science and Technology, 1998, 28(2): 67-71. |
| [10] | Muyzer G, De Waal E C, Uitterlinden A G. Profiling of Complex Microbial Populations by Denaturing Gradient Gel Electrophoresis Analysis of Polymerase Chain Reaction-Amplified Genes Coding for 16S rRNA[J]. Applied and Environmental Microbiology, 1993, 59(3): 695-700. |
| [11] | Muyzer G, Smalla K. Application of Denaturing Gradient Gel Electrophoresis (DGGE) and Temperature Gradient Gel Electrophoresis (TGGE) in Microbial Ecology[J]. Antonie van Leeuwenhoek, 1998, 73(1): 127-141. |
| [12] | 马悦欣, Holmstrm C, Webb J, 等.变性梯度凝胶电泳(DGGE)在微生物生态学中的应用[J].生态学报, 2003, 23(8):1561-1569. Ma Yuexin, Holmstrm C, Webb J, et al.Application of Denaturing Gradient Gel Eletrophoresis(DGGE) in Microbial Ecology[J].Acta Ecologica Sinica, 2003, 23(8):1561-1569. |
| [13] | 卢永, 陈秉娟, 申世峰, 等.PCR-DGGE在水处理微生物群落多样性分析中的应用[J].化学与生物工程, 2009, 26(5): 55-59. Lu Yong, Chen Bingjuan, Shen Shifeng, et al.The Application of PCR-DGGE in the Abalysis of Microbial Community Diversity in Water Treatment System[J].Chemistry & Bioengineering, 2009, 26(5):55-59. |
| [14] | 李怀, 关卫省, 欧阳二明, 等.DGGE技术及其在环境微生物中的应用[J].环境科学与管理, 2008, 33(10):93-96, 99. Li Huai, Guan Weisheng, Ouyang Erming, et al.DGGE(Denaturing Gradient Gel Eletrophoresis) and Its Application in the Research of Environnmental Microbiology[J].Environmental Science and Management, 2008, 33(10):93-96, 99. |
| [15] | 刘正辉.东江氨氮污染河段的微生物群落特征[D].广州:华南理工大学, 2011. Liu Zhenghui. Microbial Community Characteristics in the Water Column Contaminated with Ammonia-Nitrogen Along the Dongjiang River[D].Guangzhou:South China University of Technology, 2011. |
| [16] | 王威.浅层地下水中石油类特征污染物迁移转化机理研究[D].长春:吉林大学, 2012. Wang Wei.Research on the Migration and Transformation Mechanism of Petroleum Characteristic Contaminants in Sallow Groundwater[D].Changchun:Jilin University, 2012. |
| [17] | 安永磊.原位生物修复硝基苯污染地下水微生物群落结构及修复效能[D].长春:吉林大学, 2012. An Yonglei.The Microbial Community Structure and Remediation Efficiency in In-Situ Bioremediation of Nitrobenzene Contaminated Groundwater[D]. Changchun:Jilin University, 2012. |
| [18] | 林学钰, 张文静, 何海洋, 等.人工回灌对地下水水质影响的室内模拟实验[J].吉林大学学报:地球科学版, 2012, 42(5): 1404-1409, 1433. Lin Xueyu, Zhang Wenjing, He Haiyang, et al. Experiment on Impact of Groundwater Quality During Artificial Recharge Process[J]. Journal of Jilin University: Earth Science Edition, 2012, 42(5): 1404-1409, 1433. |
| [19] | 石旭飞, 张文静, 王寒梅, 等.人工回灌过程中的水-岩相互作用模拟[J].吉林大学学报:地球科学版, 2013, 43(1): 220-227, 234. Shi Xufei, Zhang Wenjing, Wang Hanmei, et al. Modeling of Water-Rock Interaction During the Artificial Recharge[J]. Journal of Jilin University: Earth Science Edition, 2013, 43(1): 220-227, 234. |
| [20] | 石旭飞, 王寒梅, 焦珣, 等.人工回灌条件下的水岩作用室内实验研究[J].上海国土资源, 2012, 33(2):21-24, 73. Shi Xufei, Wang Hanmei, Jiao Xun, et al.Experimental Study of Water-Rock Interaction During Artificial Recharge[J].Shanghai Land & Resources, 2012, 33(2):21-24, 73. |
| [21] | 罗海峰, 齐鸿雁, 薛凯, 等.PCR-DGGE技术在农田土壤微生物多样性研究中的应用[J].生态学报, 2003, 23(8):1570-1575. Luo Haifeng, Qi Hongyan, Xue Kai, et al.A Preliminary Applicationg of PCR-DGGE to Study Microbial Diversity in Soil[J].Acta Ecologica Sinica, 2003, 23(8):1570-1575. |
| [22] | 吕新, 陈丽华, 李玥仁.4种不同土壤微生物DNA提取方法对DGGE分析微生物群落的影响[J].福建农业学报, 2012, 27(4): 367-372. Lü Xin, Chen Lihua, Li Yueren.Effect of DNA Extraction on DGGE Analysis of Microbial Community in Soil[J].Fujian Journal of Agricultural Sciences, 2012, 27(4): 367-372. |
| [23] | 殷峻, 陈英旭, 刘和, 等.应用PCR-DGGE技术研究处理含氨废气的生物滤塔中微生物多样性[J].环境科学, 2004, 25(6): 11-15. Yin Jun, Chen Yingxu, Liu He, et al.Preliminary Application of PCR-DGGE to Analyzing Microbial Diversity in Biofilters Treating Air Loaded with Ammonia[J].Environmental Science, 2004, 25(6): 11-15. |
| [24] | 刘新春, 吴成强, 杨清香, 等.PCR-DGGE方法的建立及其在微生物生态群落分析中的应用探讨[C]//张洪勋, 庄绪亮. 微生物生态学研究进展:第五届微生物生态学术研讨会论文集.北京:中国生态学学会, 2003:32-40. Liu Xinchun, Wu Chengqiang, Yang Qingxiang, et al.The Discussion of the Establishment of the PCR-DGGE Method and Its Application in the Analysis of Microbial Community[C]//Zhang Hongxun, Zhuang Xuliang.The Progress of Microbial Ecology Research: The Collected Papers of the Fifth Microbial Ecology Seminar. Beijing: Ecological Society of China, 2003: 32-40. |
| [25] | 蒙嵘, 浦跃武, 任敦建, 等.PCR-DGGE技术分析染整废水微生物群落多样性[J].生物技术通报, 2012(10): 137-141. Meng Rong, Pu Yuewu, Ren Dunjian, et al.Application of PCR-DGGE to Analysis of Microbial Community Diversity in Dyeing Wastewater[J].Biotechnology Bulletin, 2012(10): 137-141. |
| [26] | 郑昭贤.石油污染浅层地下水中氯代烷烃降解的微生物响应规律研究[D].长春:吉林大学, 2012. Zheng Zhaoxian.Microbial Response Law of Natural Biodegradation of Chloralkane Solvents in a Petroleum Hydrocarbon Contaminated Shallow Groundwater[D].Changchun:Jilin University, 2012. |
| [27] | Masai E, Katayama K, Fukuda M. Genetic and Biochemical Investigations on Bacterial Catabolic Pathways for Lignin-Derived Aromatic Compounds[J]. Bioscience, Biotechnology, and Biochemistry, 2007, 71(1): 1-15. |
| [28] | Bifulco J, Shirey J, Bissonnette G.Detection of Acine-tobacter Spp in Rural Drinking Water Supplies[J]. Applied and Environmental Microbiology, 1989, 55(9): 2214-2219. |
| [29] | Nagashima S, Kamimura A, Shimizu T, et al.Complete Genome Sequence of Phototrophic Betaproteobacterium Rubrivivax Gelatinosus IL144[J]. Journal of Bacteriology, 2012, 194(13): 3541-3542. |
| [30] | Risso C, Sun Jun, Zhuang Kai, et al. Genome-Scale Comparison and Constraint-Based Metabolic Reconstruction of the Facultative Anaerobic Fe(III)-Reducer Rhodoferax Ferrireducens[J]. BMC Genomics, 2009, 10(1): 447-465. |
| [31] | 石旭飞. 人工回灌过程中地下水重金属迁移转化机理:以上海某回灌场地为例[D].长春:吉林大学, 2013. Shi Xufei. Migration and Transformation Mechanism of Heavy Metals During the Process of Artificial Recharge:A Case Study in an Artificial Recharge Test Site in Shanghai[D].Changchun:Jilin University, 2013. |