2. 教育部地下水资源与环境重点实验室(吉林大学), 长春 130021;
3. 吉林大学材料科学与工程学院, 长春 130022;
4. 教育部汽车材料实验室(吉林大学), 长春 130022
2. Key Laboratory of Groundwater Resources and Environment(Jilin University), Ministry of Education, Changchun 130021, China;
3. School of Materials Science and Engineering, Jilin University, Changchun 130022, China;
4. Key Laboratory of Automobile Materials(Jilin University), Ministry of Education, Changchun 130022, China
0 引言
全氟化合物由于其热稳定性和疏水性,被广泛应用于造纸业和纺织品的防水防污、热稳定润滑剂、惰性表面活性剂、药物、水性成膜泡沫和石油化工等生产过程中[1-3]。然而因全氟化合物含有高能C-F键[4-6]、较长的疏水碳氟链和极性官能团[3],其在水中表现出高度持久性和生物累积性等特征[1, 7],同时其在环境中的毒性和迁移特性又对人类构成了巨大威胁[8]。其中,全氟辛酸(perfluorooctanoic acid, PFOA)作为一种新兴污染物,是全氟化合物中最常见的污染物代表,近年来受到人们的广泛关注。PFOA自然降解性差,可在人体内积累,被环境保护署(EPA)定义为“可能致癌物”[2]。据估计,氟聚合物制造厂排放的污水中PFOA的浓度超过3 mmol/L,就会导致水环境受到严重威胁[9-10]。因此,研究环境友好型高效去除PFOA的方法刻不容缓。
目前,应用于水溶液中PFOA去除的方法涉及多个领域,包括光催化[11]、高级氧化工艺[12-13]、紫外-芬顿反应[14-15],以及材料吸附去除[16-18]等。由PFOA的高化学稳定性可知,C-F键很难因化学作用断裂,故光催化和高级氧化等化学去除方法很难在较短时间内达到较高的去除水平;而材料吸附去除因操作简单、去除效率高,近年来受到广泛关注。许多研究已经报道,活性炭[6]、介孔三聚氰胺-甲醛[19]、氧化铝[20]、沙子、黏土和氧化铁[21]等材料在PFOA吸附去除方面具有巨大的优势;但是,这些材料普遍存在吸附容量低、合成成本高、合成过程复杂、稳定性差等问题。近年来有研究者在生物质炭吸附去除PFOA方面进行了研究,如采用针叶木制备生物质炭对PFOA进行吸附去除,结果表明生物质炭在48 h达到吸附平衡时PFOA吸附容量为61.75 μmol/g,吸附效果明显欠佳[22];还有研究表明生物质炭和纳米零价铁材料结合仅可以去除部分PFOA,去除效果有限[23]。因此,迫切需要研制一种吸附容量高、成本低的环境友好型吸附材料。
煤化工渣一般被认为是经过工业加工利用后,由碳和金属氧化物组成的固体废物,已无经济价值。然而,煤化工渣特有的孔隙和形貌使其在环境治理方面发挥了一定作用。有研究者[24-25]证明,回收的煤化工渣对水中磷酸盐具有很好的去除效果。此外,煤化工渣被发现还可用于合成新型多孔和介孔二氧化硅材料,从而具有高效吸附有机污染物的性能[26-27]。而且这种具有高吸附能力的经济环保材料具有产量大、廉价、易获取等优势,在去除水中PFOA方面具有巨大的潜力。但一直以来,关于煤化工渣吸附PFOA的报道还较为极为罕见。
本研究采用不同处理方法制备了4种煤化工渣,对其理化性质及结构特征进行检测,并对4种煤化工渣去除PFOA的性能进行对比分析,模拟吸附等温模型和吸附动力模型,得到了吸附性能最好的一种材料;考察了吸附前后的扫描电子显微镜(SEM)、傅里叶变换红外光谱(FTIR)和X射线光电子能谱(XPS)的结构表征变化,以阐明煤化工渣对PFOA的吸附机制,为PFOA实际场地修复提供参考。
1 实验材料及方法 1.1 实验药品及仪器PFOA(96%)购自阿拉丁试剂(上海)有限公司,甲醇和乙腈(色谱纯度)均来自美国赛默飞世尔公司,醋酸铵(分析纯)由国药化学试剂有限公司提供,所有化学品在使用时未经进一步纯化。配制浓度为3 mmol/L的醋酸铵溶液,用甲醇作为溶剂制备10 g/L的PFOA储备液。若无特殊说明,本研究使用水均为超纯水。
煤化工渣外貌形态采用扫描电子显微镜(JSM-IT300LA,日本)检测,采用拉曼显微光谱仪(inVia-Reflex,雷尼绍,英国)在525 nm处确定煤化工渣的晶格结构。采用美国赛默飞世尔公司的Nicolet iS5型红外光谱仪对样品的官能团进行检验,材料的比表面积通过Brunauer-Emmett-Teller(BET)法(SSA-3600,中国北京建筑公司)获得,用X射线光电子能谱(Escalab 250,赛默飞世尔,美国)分析吸附前后表面氟元素的变化。pH值由美国赛默飞世尔pH计(Orion star A221)测量,用Zeta-sizer纳米系列(马尔文帕纳科,美国)测定煤化工渣在水溶液中的带电情况。
1.2 材料的制备本研究选用的煤化工渣由内蒙古伊泰集团有限公司提供。煤化工渣在80 ℃下干燥,分别经800、1 000、3 000、5 000目筛分,得到不同粒径的4种材料,将800目的煤化工渣在550 ℃下煅烧至质量恒定以去除材料含有的碳,最终获得4种煤化工渣,分别标记为CGA1、CGA2、CGA3、CGA4,其主要成分如表 1所示,4种材料平均粒径分别为17.38 μm(CGA1)、13.31 μm(CGA2)、4.52 μm(CGA3)、2.55 μm(CGA4),其主要成分均为SiO2,且CGA1→CGA2→CGA3→CGA4, 碳质量分数逐渐增加。用烧失量法(LOI)测定每种材料的碳质量分数,即材料烧至恒定质量后所减少的质量。
| 分组 | wB/% | 平均粒径/μm | ||||||||
| SiO2 | Al2O3 | TiO2 | CaO | MgO | TFe 2O3 | K2O | Na2O | C | ||
| CGA1 | 52.81 | 20.03 | 0.77 | 14.25 | 1.83 | 5.35 | 1.29 | 2.82 | 0.08 | 17.38 |
| CGA2 | 50.02 | 18.97 | 0.73 | 13.50 | 1.74 | 5.07 | 1.23 | 2.67 | 5.29 | 13.31 |
| CGA3 | 42.20 | 17.77 | 0.79 | 12.78 | 1.79 | 4.66 | 1.19 | 2.84 | 14.40 | 4.52 |
| CGA4 | 38.34 | 17.09 | 0.93 | 13.05 | 1.71 | 4.61 | 1.06 | 2.73 | 17.53 | 2.55 |
本研究实验部分均在50 mL圆底离心管中进行,设置3组平行样,数据中给出了相对标准偏差。为研究煤化工渣在PFOA水溶液中的吸附动力学,将4种煤化工渣各50 mg分别添加到PFOA水溶液(20 mL,pH=5)中,在恒温振荡箱中以120 r/min持续震荡,温度为25 ℃,并在5~60 min的特定时间间隔内取样,测定溶液中剩余的PFOA质量浓度。为研究PFOA初始质量浓度对吸附过程的影响,先配制不同质量浓度的PFOA溶液(10~80 mg/L) 分别加入4种煤化工渣,然后在120 r/min条件下25 ℃恒温振荡60 min。为研究pH对吸附过程的影响,设置溶液初始pH值为2~9,溶液pH值用1 mol/L的HCl和1 mol/L的NaOH进行调节。分析之前,将样品通过0.22 μm有机滤膜(艾那涞特仪器设备有限公司)过滤后抽取1 mL放入高效液相色谱瓶待检测。
1.4 分析方法PFOA检测采用高效液相色谱(LC-U3000)-质谱/质谱(TSQ,赛默飞世尔,美国)联用系统(HPLC-MS/MS),选用C18分离柱(100 mm×2.1 mm,1.9 μm)反向连接进行分离,柱温40 ℃。流动相由乙腈和3 mmol/L乙酸铵按照体积比为4∶6的比例进行冲洗,流速为0.10 mL/min,进样量为10 μL,采用等度洗脱程序,样品检测时间为15 min。电喷雾离子源处于负电压模式,喷雾电压为2 800 V,选用多反应监测模型,具体参数为:毛细管电压320 ℃、汽化温度300 ℃、鞘气压力1 500 kPa、辅助气体压力200 kPa、碰撞气体压力150 kPa[3]。
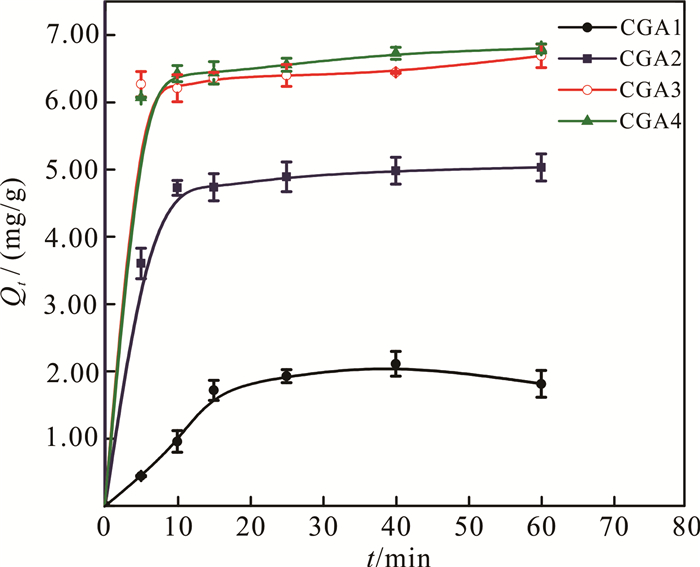
2 结果与讨论 2.1 吸附动力学为确定4种煤化工渣的吸附效率和平衡时间,本研究探讨了煤化工渣对PFOA的吸附动力学。在吸附实验的同时设置了空白加标实验组,即未经滤膜过滤且无吸附材料的和经滤膜过滤且无吸附材料的两种PFOA溶液,分别探究离心管和有机滤膜对PFOA吸附的影响。结果显示,两组实验样品中PFOA的回收率分别为99.989%和99.983%,因此离心管和有机滤膜对PFOA吸附的影响几乎可以忽略不计。如图 1所示,在相同条件下,4种煤化工渣对PFOA的吸附速率顺序从大到小为CGA4、CGA3、CGA2、CGA1。观察结果可以看出:PFOA在10 min快速吸附,随后反应逐渐变缓,在40 min左右达到平衡,在60 min内CGA1、CGA2、CGA3和CGA4的吸附容量(Qt)分别为1.82、5.03、6.69和6.80 mg/g。
|
| 图 1 煤化工渣去除全氟辛酸的吸附动力学 Fig. 1 Kinetics for removal of PFOA using chemical coal slag |
|
|
为讨论影响吸附速率的因素,采用伪一级动力模型和伪二级动力模型对吸附过程进行描述,模型表达式[28]为:
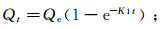 (1)
(1) 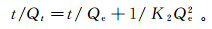 (2)
(2) 式中:Qe为平衡时每克吸附剂吸附的污染物的质量(mg/g);Qt为t时刻每克吸附剂吸附的污染物的质量(mg/g);K1和K2分别为伪一级动力学模型和伪二级动力学模型的动力学常数。
两个动力模型的动力学参数如表 2所示。比较伪一级动力学模型和伪二级动力学模型的决定系数R2可以发现,伪二级动力学模型的R2更接近于1,说明实验数据与伪二级动力学模型的拟合具有更高的相关性;同时,表 2给出了两种模型计算所得的Qe值与实际Qe标准方差,发现伪二级动力学模型的计算结果与实际吸附效果更相符。综上得出伪二级动力学模型可以更好地对吸附过程进行描述。由前人研究的模型特征可知,伪二级动力模型中的吸附速率主要由化学过程控制[29],因此得出,化学反应过程在煤化工渣吸附PFOA的过程中起主导作用。
| 分组 | 伪一级动力学模型 | 伪二级动力学模型 | 实际Qe/ (mg/g) | |||||||
| R2 | K1 | Qe / (mg/g) | Qe标准方差/% | R2 | K2 | Qe / (mg/g) | Qe标准方差/% | |||
| CGA1 | 0.880 2 | 0.08 | 2.07 | 1.45 | 0.887 5 | 2.43 | 0.03 | 2.67 | 1.82 | |
| CGA2 | 0.970 7 | 0.27 | 4.96 | 2.30 | 0.999 6 | 5.17 | 0.13 | 2.70 | 5.03 | |
| CGA3 | 0.146 3 | 0.73 | 6.43 | 3.97 | 0.999 3 | 6.71 | 0.18 | 0.30 | 6.69 | |
| CGA4 | 0.703 8 | 0.49 | 6.61 | 2.86 | 0.999 9 | 6.88 | 0.17 | 1.18 | 6.80 | |
| 注:R为相关系数。 | ||||||||||
4种煤化工渣的孔隙特征如表 3所示,其中,CGA4具有最大比表面积(148.40 m2/g)和最大孔体积(0.20 cm3/g)。图 2的SEM图谱显示出煤化工渣的主要形貌为球形结构,且4种材料之间粒径大小有明显区别。
| 分组 | 比表面积/(m2/g) | 总孔体积/(cm3/g) | 平均孔径/nm |
| CGA1 | 1.26 | 0.01 | 11.87 |
| CGA2 | 33.41 | 0.04 | 4.46 |
| CGA3 | 105.63 | 0.13 | 5.11 |
| CGA4 | 148.40 | 0.20 | 5.35 |

|
| a. CGA1; b. CGA2; c. CGA3; d. CGA4。 图 2 煤化工渣的SEM图谱 Fig. 2 SEM of coal chemical slag |
|
|
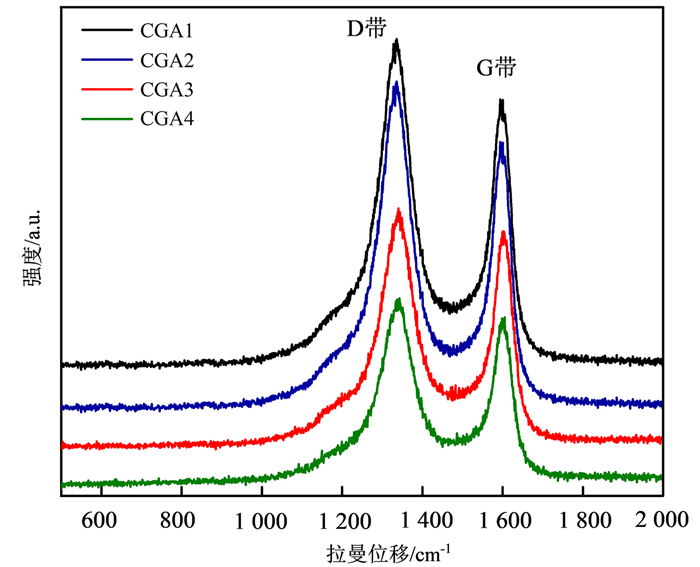
图 3为4种煤化工渣的拉曼光谱,由图 3看出4种煤化工渣分别在约1 350 cm-1和1 600 cm-1处显示2个衍射峰。位于1 350 cm-1处的峰代表D带,是由碳原子Sp3缺陷引起;位于1 600 cm-1处的峰代表G带,是由于2个相邻的碳原子在相反方向移动引起[30],用D带与G带响应值之比(ID/IG)评价材料的缺陷程度,4种材料的ID/IG值分别为1.219、1.216、1.102和1.100;其中CGA3和CGA4具有相对较小的比值,表明两者的晶格缺陷较大,为提高吸附性能提供了更多的反应位点。
|
| 图 3 煤化工渣的拉曼图谱 Fig. 3 Raman spectras of coal chemical slag |
|
|
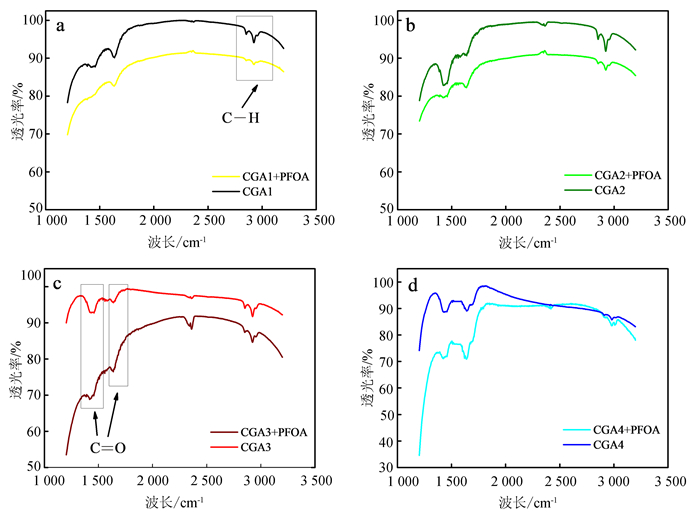
本研究通过FTIR分析获得了反应前后煤化工渣的表面官能团。如图 4所示,2 920~2 925 cm-1处的特征峰代表煤化工渣中的C-H[31],1 633~1 643 cm-1和1 440 cm-1的衍射峰是由羧基C=O键的拉伸振动引起[32]。通过对比发现:吸附后1 633~1 643 cm-1处的C=O峰宽和面积明显增大,这归因于PFOA吸附在煤化工渣表面[33]; 并且1 440 cm-1处特征峰响应值下降并且位置向前移动,说明PFOA的羧基与煤化工渣上表面形成了氢键,例如,PFOA的羧基中的氧原子可以作为氢键受体,与煤化工渣表面的含碳羧基或金属氧化物相互作用形成氢键(RCOO…H…O-CGAs)[34]。
|
| a. CGA1; b. CGA2; c.CGA3; d. CGA4。 图 4 煤化工渣对全氟辛酸吸附前后的红外图谱 Fig. 4 FTIR of coal chemical slag before and after adsorption of PFOA |
|
|
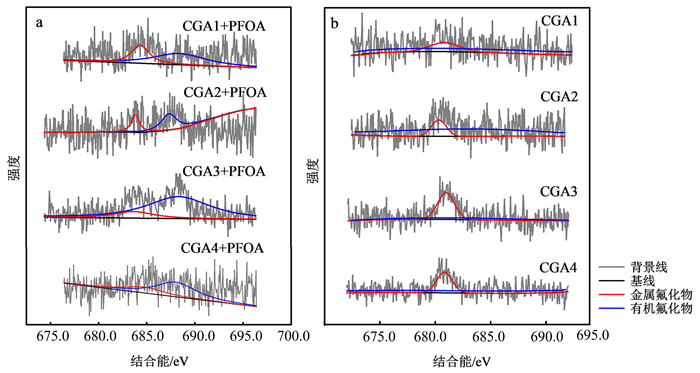
图 5给出了吸附反应前后煤化工渣表面氟元素的XPS在1s峰位(F1s)的光电子图谱,其中684.5 eV和688.5 eV处的峰分别对应于金属氟化物和有机氟化物中的C-F[35]。与吸附前相比,吸附后有机C-F含量明显增加,证实了PFOA吸附在煤化工渣表面。为直观表示吸附前后特征峰的变化,计算了煤化工渣吸附前后金属氟化物和有机C-F的峰面积占比,结果如表 4所示。由表 4可以看出,CGA3和CGA4中有机氟化物XPS图谱面积所占比例显著增加,说明两者对PFOA吸附量较大,因此得出,CGA3和CGA4(粒径较小的煤化工渣)具有更优越的PFOA吸附性能。
|
| 图 5 煤化工渣对全氟辛酸吸附前(a)、后(b)氟元素的XPS在1s峰位的光电子图谱 Fig. 5 XPS spaxtra of F1s in coal chemical slag before (a) and after (b) adsorption of PFOA |
|
|
| 分组 | 金属氟化物比例 | 有机氟化物比例 |
| CGA1+PFOA | 0.35 | 0.65 |
| CGA1 | 0.64 | 0.36 |
| CGA2+PFOA | 0.35 | 0.65 |
| CGA2 | 0.45 | 0.55 |
| CGA3+PFOA | 0.16 | 0.84 |
| CGA3 | 0.94 | 0.06 |
| CGA4+PFOA | 0.28 | 0.72 |
| CGA4 | 1.00 | 0.00 |
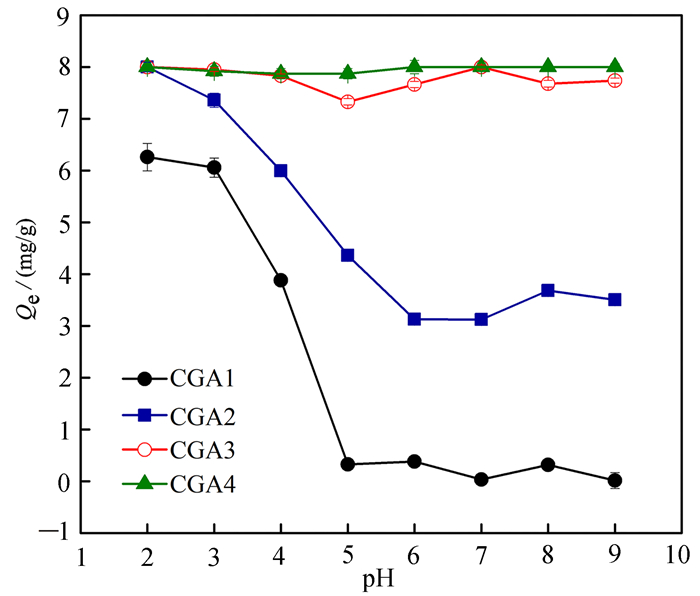
初始pH值是影响吸附过程的重要因素之一。不同初始pH条件下PFOA的吸附结果见图 6。由图 6吸附曲线可知CGA3和CGA4的吸附过程与pH无关,在酸性、中性和碱性条件下PFOA吸附效率都很高,而CGA1和CGA2的PFOA吸附量随着pH的升高而降低。
|
| 图 6 不同初始pH条件下煤化工渣对全氟辛酸的吸附效率 Fig. 6 Different absorbed efficiency of PFOA with different initial pH using coal chemical slag |
|
|
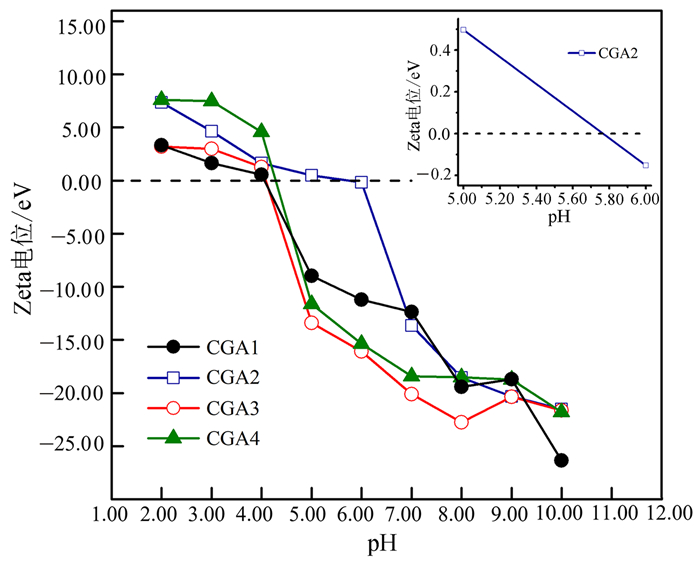
为进一步探究原因,用Zeta电位对4种材料在水溶液中的带电情况进行检测,结果见图 7。由图 7可知,对于CGA1和CGA2而言,两种材料等电点处pH分别为4.06和5.76,低于此pH值时材料在水中带正电荷。PFOA的酸离解常数为2.8[19],说明PFOA在本研究的pH范围内以阴离子形式存在;因此由于静电力作用,在酸性环境中CGA1和CGA2对PFOA显示出较高的吸附能力。CGA1和CGA2中含有较多的SiO2,而SiO2四面体基表面在碱性环境中存在同构晶格取代使其显示负电,故在高于等电点的pH范围内与PFOA发生相互排斥而不利于吸附过程的进行[36];因此CGA1和CGA2与PFOA之间的静电吸引作用导致在酸性条件下吸附效率最优。由图 7可见,CGA3和CGA4亦显示出等电点,与CGA1和CGA2在酸性条件下的原理相同,在酸性环境中显示出高PFOA吸附效率,然而CGA3和CGA4含有较少的SiO2,且具有较高的含碳量;由图 4分析可知,氢键的形成与煤化工渣表面的含碳羧基有关,故CGA3和CGA4的高含碳量有利于PFOA的吸附,从而使得CGA3和CGA4在碱性环境中也保持高于CGA1和CGA2的PFOA吸附能力。此外,PFOA含有疏水C-F,使得PFOA倾向于向水中煤化工渣靠近,故吸附过程中也涉及疏水作用,而疏水作用与PFOA和煤化工渣的接触面积有关,CGA3和CGA4因其小粒径和大比表面积而具有巨大的接触面积,受较强疏水作用的影响,显示出比CGA1和CGA2高的PFOA吸附去除能力。
|
| 图 7 煤化工渣在水溶液中的Zeta电位 Fig. 7 Zeta potential of coal chemical slag in water |
|
|
吸附等温线描述了吸附过程达到平衡状态时吸附分子在吸附剂上的平衡和分布。图 8给出了不同初始质量浓度的PFOA溶液在恒温25 ℃条件下的吸附过程,结果显示, 随着PFOA初始质量浓度的增加,煤化工渣的吸附容量逐渐增加,在0~80 mg/L的质量浓度范围内CGA3和CGA4表现出比CGA1和CGA2更好的吸附能力。

|
| 图 8 煤化工渣去除全氟辛酸的吸附等温线 Fig. 8 Isotherms for removal of PFOA using coal chemical slag |
|
|
为了更好地描述吸附性能与底物质量浓度之间的关系,本研究拟合了Langmuir和Freundlich两种吸附等温模型,计算模型参数见表 5。各吸附点具有相同的吸附质亲和力, 用Langmuir模型表示均相吸附体系; 由于吸附位点的多样性,用Freundlich模型描述非均相吸附的经验方程。Langmuir模型表示为
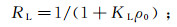 (4)
(4) | 分组 | Langmuir | Freundlich | ||||||
| R2 | Qm /(mg/g) | KL/(L/mg) | R2 | Kf/(10-3(mg/L)1/n) | 1/n | n | ||
| CGA1 | 0.914 3 | -0.96 | -0.02 | 0.986 3 | 155.78 | 2.82 | 0.36 | |
| CGA2 | 0.948 9 | 6.32 | 0.20 | 0.919 0 | 8.31 | 0.28 | 3.59 | |
| CGA3 | 0.941 5 | 13.97 | 0.31 | 0.621 0 | 11.22 | 0.01 | 77.52 | |
| CGA4 | 0.996 1 | 25.51 | 0.11 | 0.793 8 | 16.52 | 0.11 | 8.86 | |
Freundlich模型表示为
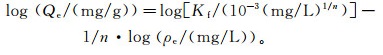 (5)
(5) 式中:Qm为每克吸附剂可最大吸附的污染物的质量,mg/g;KL为Langmuir常数,L/mg;ρe为溶液中污染物的平衡质量浓度,mg/L;RL为模型吸附参数;Kf为Freundlich等温线分布系数,10-3(mg/L)1/n;n为吸附强度。
表 5中,CGA1-CGA4的Langmuir模型的R2分别为0.914 3、0.948 9、0.941 5、0.996 1,CGA1-CGA4的Freundlich模型的R2分别为0.986 3、0.919 0、0.621 0、0.793 8,可见CGA2、CGA3和CGA4的数据与Langmuir有更高的相关性,而CGA1的数据与Freundlich的相关性更高;因此,Langmuir更适合CGA2、CGA3和CGA4,而Freundlich更适合CGA1。由Langmuir模型得出,CGA2、CGA3和CGA4在25 ℃下最大吸附容量分别可达6.32、13.97和25.51 mg/g。煤化工渣吸附能力的不同,应归因于其结构特性的不同。式(4)中的RL是Langmuir的一个重要参数。当RL>1时不利于吸附进行,当RL介于0~1之间则有利于吸附的进行;如果RL接近1表明过程是线性的,如果RL越接近0表明过程越不易发生[37]。对于CGA2、CGA3和CGA4,KL>0,RL值介于0~1之间,说明3种材料在水中分散良好,并更易发生吸附作用。在Freundlich中,1/n < 1意味着体系中煤化工渣与PFOA更易发生吸附作用,1/n>1意味着吸附过程溶质在液相和固相之间的分配是一致的[31],1/n值接近于1,说明污染物在液相和固相的分布与吸附剂浓度无关[3]。CGA1的1/n值为2.82,说明PFOA在水中和煤化工渣上的分配量是相当的,故CGA1对PFOA的吸附量最少。
3 结论1) 煤化工渣对PFOA有良好的吸附去除性能,而且小粒径煤化工渣比大粒径的吸附性能更好,其中粒径为2.55 μm的煤化工渣吸附性能最优,其最大吸附容量可达25.51 mg/g。小粒径煤化工渣吸附动力学可以用伪二级动力学模型很好地描述,吸附等温线参数遵循Langmuir等温模型。
2) 小粒径煤化工渣对PFOA的吸附过程几乎不受pH条件影响,其在酸性、中性和碱性条件下均具有较高的PFOA吸附去除效率。
3) 随着全氟辛酸溶液初始质量浓度升高,煤化工渣对全氟辛酸的吸附容量逐渐增加。
4) 煤化工渣对PFOA的吸附与氢键的形成、电荷之间的静电力作用和C-F键的疏水作用有关。
| [1] |
Qian J, Shen M, Wang P, et al. Perfluorooctane Sulfonate Adsorption on Powder Activated Carbon: Effect of Phosphate (P) Competition, pH, and Temperature[J]. Chemosphere, 2017, 182: 215-222. DOI:10.1016/j.chemosphere.2017.05.033 |
| [2] |
Santos A, Rodríguez S, Pardo F, et al. Use of Fenton Reagent Combined with Humic Acids for the Removal of PFOA from Contaminated Water[J]. Science of the Total Environment, 2016, 563: 657-663. |
| [3] |
Zhang D, Luo Q, Gao B, et al. Sorption of Perfluorooctanoic Acid, Perfluorooctane Sulfonate and Perfluoroheptanoic Acid on Granular Activated Carbon[J]. Chemosphere, 2016, 144: 2336-2342. DOI:10.1016/j.chemosphere.2015.10.124 |
| [4] |
Maimaiti A, Deng S, Meng P, et al. Competitive Adsorption of Perfluoroalkyl Substances on Anion Exchange Resins in Simulated Afff-Impacted Groundwater[J]. Chemical Engineering Journal, 2018, 348: 494-502. DOI:10.1016/j.cej.2018.05.006 |
| [5] |
Appleman T D, Dickenson E R V, Bellona C, et al. Nanofiltration and Granular Activated Carbon Treatment of Perfluoroalkyl Acids[J]. Journal of Hazardous Materials, 2013, 260: 740-746. DOI:10.1016/j.jhazmat.2013.06.033 |
| [6] |
Du Z, Deng S, Bei Y, et al. Adsorption Behavior and Mechanism of Perfluorinated Compounds on Various Adsorbents: A Review[J]. Journal of Hazardous Materials, 2014, 274: 443-454. DOI:10.1016/j.jhazmat.2014.04.038 |
| [7] |
Zhi Y, Liu J. Surface Modification of Activated Carbon for Enhanced Adsorption of Perfluoroalkyl Acids from Aqueous Solutions[J]. Chemosphere, 2016, 144: 1224-1232. DOI:10.1016/j.chemosphere.2015.09.097 |
| [8] |
Ochoa-Herrera V, Sierra-Alvarez R. Removal of Perfluorinated Surfactants by Sorption onto Granular Activated Carbon, Zeolite and Sludge[J]. Chemosphere, 2008, 72(10): 1588-1593. DOI:10.1016/j.chemosphere.2008.04.029 |
| [9] |
Yang B, Han Y, Yu G, et al. Efficient Removal of Perfluoroalkyl Acids (PFAAS) from Aqueous Solution by Electrocoagulation Using Iron Electrode[J]. Chemical Engineering Journal, 2016, 303: 384-390. DOI:10.1016/j.cej.2016.06.011 |
| [10] |
Guo H, Liu Y, Ma W, et al. Surface Molecular Imprinting on Carbon Microspheres for Fast and Selective Adsorption of Perfluorooctane Sulfonate[J]. Journal of Hazardous Materials, 2018, 348: 29-38. DOI:10.1016/j.jhazmat.2018.01.018 |
| [11] |
Hisao H, Ari Y, Etsuko H, et al. Efficient Decomposition of Environmentally Persistent Perfluorocarboxylic Acids by Use of Persulfate as a Photochemical Oxidant[J]. Environmental Science & Technology, 2005, 39(7): 2383-2388. |
| [12] |
Xue A, Yuan Z W, Sun Y, et al. Electro-Oxidation of Perfluorooctanoic Acid by Carbon Nanotube Sponge Anode and the Mechanism[J]. Chemosphere, 2015, 141: 120-126. DOI:10.1016/j.chemosphere.2015.06.095 |
| [13] |
Kucharzyk K H, Darlington R, Benotti M, et al. Novel Treatment Technologies for Pfas Compounds: A Critical Review[J]. Journal of Environmental Management, 2017, 204: 757-764. DOI:10.1016/j.jenvman.2017.08.016 |
| [14] |
Liu J, Li C, Qu R, et al. Kinetics and Mechanism Insights into the Photodegradation of Hydroperfluorocarboxylic Acids in Aqueous Solution[J]. Chemical Engineering Journal, 2018, 348: 644-652. DOI:10.1016/j.cej.2018.05.055 |
| [15] |
Tang H, Xiang Q, Lei M, et al. Efficient Degradation of Perfluorooctanoic Acid by Uv-Fenton Process[J]. Chemical Engineering Journal, 2012, 184: 156-162. DOI:10.1016/j.cej.2012.01.020 |
| [16] |
Park S, Zenobio J E, Lee L S. Perfluorooctane Sulfonate (PFOS) Removal with Pd0/nFe0 Nanoparticles: Adsorption or Aqueous Fe-Complexation, Not Transformation?[J]. Journal of Hazardous Materials, 2018, 342: 20-28. DOI:10.1016/j.jhazmat.2017.08.001 |
| [17] |
Zaggia A, Conte L, Falletti L, et al. Use of Strong Anion Exchange Resins for the Removal of Perfluoroalkylated Substances from Contaminated Drinking Water in Batch and Continuous Pilot Plants[J]. Water Research, 2016, 91: 137-146. DOI:10.1016/j.watres.2015.12.039 |
| [18] |
Deng S, Yu Q, Huang J, et al. Removal of Perfluorooctane Sulfonate from Wastewater by Anion Exchange Resins: Effects of Resin Properties and Solution Chemistry[J]. Water Research, 2010, 44(18): 5188-5195. DOI:10.1016/j.watres.2010.06.038 |
| [19] |
Li J, Li Q, Li L, et al. Removal of Perfluorooctanoic Acid from Water with Economical Mesoporous Melamine-Formaldehyde Resin Microsphere[J]. Chemical Engineering Journal, 2017, 320: 501-509. DOI:10.1016/j.cej.2017.03.073 |
| [20] |
Wang F, Shih K. Adsorption of Perfluorooctane Sulfonate (PFOS) and Perfluorooctanoate (PFOA) on Alumina: Influence of Solution pH and Cations[J]. Water Research, 2011, 45(9): 2925-2930. DOI:10.1016/j.watres.2011.03.007 |
| [21] |
Johnson R L, Anschutz A J, Smolen J M, et al. The Adsorption of Perfluorooctane Sulfonate onto Sand, Clay, and Iron Oxide Surfaces[J]. Journal of Chemical & Engineering Data, 2007, 52(4): 1165-1170. |
| [22] |
Zhang D, He Q, Wang M, et al. Sorption of Perfluoroalkylated Substances (PFASs) onto Granular Activated Carbon and Biochar[J]. Environmental Technology, 2019. DOI:10.1080/09593330.2019.1680744 |
| [23] |
Liu Y, David W B, Carol J P, et al. Removal of Pharmaceutical Compounds, Artificial Sweeteners, and Perfluoroalkyl Substances from Water Using a Passive Treatment System Containing Zero-Valent Iron and Biochar[J]. Science of the Total Environment, 2019, 691: 165-177. DOI:10.1016/j.scitotenv.2019.06.450 |
| [24] |
Johansson L, Gustafsson J P. Phosphate Removal Using Blast Furnace Slags and Opoka-Mechanisms[J]. Water Research, 2000, 34(1): 259-265. DOI:10.1016/S0043-1354(99)00135-9 |
| [25] |
Yang J, Wang S, Lu Z, et al. Converter Slag-Coal Cinder Columns for the Removal of Phosphorous and Other Pollutants[J]. Journal of Hazardous Materials, 2009, 168(1): 331-337. DOI:10.1016/j.jhazmat.2009.02.024 |
| [26] |
Tang W, Huang H, Gao Y, et al. Preparation of a Novel Porous Adsorption Material from Coal Slag and Its Adsorption Properties of Phenol from Aqueous Solution[J]. Materials & Design, 2015, 88: 1191-1200. |
| [27] |
Yang X, Tang W, Liu X, et al. Synthesis of Mesoporous Silica from Coal Slag and CO2 for Phenol Removal[J]. Journal of Cleaner Production, 2019, 208: 1255-1264. DOI:10.1016/j.jclepro.2018.10.212 |
| [28] |
Tran H N, You S J, Hosseini-Bandegharaei A, et al. Mistakes and Inconsistencies Regarding Adsorption of Contaminants from Aqueous Solutions: A Critical Review[J]. Water Research, 2017, 120: 88-116. DOI:10.1016/j.watres.2017.04.014 |
| [29] |
孙博, 马军. 离子交换树脂对水中全氟羧酸的吸附去除[J]. 水处理技术, 2017, 43(1): 22-26. Sun Bo, Ma Jun. Adsorption and Removal of Perfluorocarboxylic Acid in Water by Ion Exchange Resin[J]. Water Treatment Technology, 2017, 43(1): 22-26. |
| [30] |
刘娜, 张朋朋, 丁隆真, 等. 氮掺杂碳材料活化过硫酸盐降解4-氯苯酚[J]. 吉林大学学报(地球科学版), 2020, 50(4): 1173-1181. Liu Na, Zhang Pengpeng, Ding Longzhen, et al. Nitrogen-Doped Carbon Material Activate Persulfate to Degrade 4-Chlorophenol[J]. Journal of Jilin University (Earth Science Edition), 2020, 50(4): 1173-1181. |
| [31] |
Fagbayigbo B O, Opeolu B O, Fatoki O S, et al. Removal of PFOA and PFOS from Aqueous Solutions Using Activated Carbon Produced from Vitis Vinifera Leaf Litter[J]. Environmental Science & Pollution Research, 2017, 24(14): 1-14. |
| [32] |
Chang P H, Jiang W T, Li Z. Removal of Perfluorooctanoic Acid from Water Using Calcined Hydrotalcite: A Mechanistic Study[J]. Journal of Hazardous Materials, 2019, 368: 487-495. DOI:10.1016/j.jhazmat.2019.01.084 |
| [33] |
Xu C, Chen H, Jiang F. Adsorption of Perflourooctane Sulfonate (PFOS) and Perfluorooctanoate (PFOA) on Polyaniline Nanotubes[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2015, 479: 60-67. |
| [34] |
Li X, Pignatello J J, Wang Y, et al. New Insight into Adsorption Mechanism of Ionizable Compounds on Carbon Nanotubes[J]. Environmental Science & Technology, 2013, 47(15): 8334-8341. |
| [35] |
Zhou Y, He Z, Tao Y, et al. Preparation of a Functional Silica Membrane Coated on Fe3O4 Nanoparticle for Rapid and Selective Removal of Perfluorinated Compounds from Surface Water Sample[J]. Chemical Engineering Journal, 2016, 303: 156-166. DOI:10.1016/j.cej.2016.05.137 |
| [36] |
Shao Q, Xu C, Wang Y, et al. Dynamic Interactions Between Sulfidated Zerovalent Iron and Dissolved Oxygen: Mechanistic Insights for Enhanced Chromate Removal[J]. Water Research, 2018, 135: 322-330. DOI:10.1016/j.watres.2018.02.030 |
| [37] |
Inyang M, Dickenson E R V. The Use of Carbon Adsorbents for the Removal of Perfluoroalkyl Acids from Potable Reuse Systems[J]. Chemosphere, 2017, 184: 168-175. DOI:10.1016/j.chemosphere.2017.05.161 |



