0 引言
近年来,由于含有氮、磷等元素污染物的大量排放,水体富营养化程度日趋严重,产生了大量藻类毒素[1],引起了包括饮用水和水库在内的淡水体系蓝藻水华频繁发生[2]。微囊藻毒素(microcystin, MCs) 是一类由淡水蓝细菌分泌的天然环状七肽毒素,其中,微囊藻毒素-LR (Microcystin-LR)是最常见、毒性最大的一种[3]。微囊藻毒素-LR在水华水体中具有极强的化学稳定性, 可保持7 d不发生降解[4]。据报道,微囊藻毒素-LR对于哺乳动物的肝脏、心脏、肾脏等主要器官具有极大的伤害[5-7]。由于其高毒性,世界卫生组织对饮用水中微囊藻毒素-LR的质量浓度限定为低于1 μg/ L[8-9]。
我国地域广泛,河流众多,是蓝藻水华分布最广,同时也是受其影响最严重的国家之一。已有多项研究调查报道国内各种水体遭受微囊藻毒素的污染情况,如:徐海滨等[10]在对江西鄱阳湖的水样调查中得出,该水体中微囊藻毒素最大质量浓度达到了1.036 9 μg/L,并且在鱼类等水生生物体内也发现了毒素的积累;吴和岩等[11]对上海市供水系统进行了微囊藻毒素检测,发现检测样品中均含有微囊藻毒素,表明日常饮用地下水体已受到污染;何岸檐等[12]对重庆市城镇集中式供水水源中的微囊藻毒素污染进行了评估,发现微囊藻毒素的污染已经进入微量化。
目前,检测水体中微囊藻毒素-LR的常规方法主要有液相色谱/质谱法(HPLC-MS)[13]、薄层色谱法(TLC)[14]、酶联免疫吸附分析法(ELISA)[15]、蛋白磷酸酶抑制分析法(PPIA)等[16]。这些检测方法虽然具有较高的检测灵敏度,但由于分析成本高、仪器昂贵[17]、检测时间长等弊端[18],已不能满足如今对微囊藻毒素-LR现场快速检测的要求。因此,为了能够准确迅速判断水体被微囊藻毒素-LR污染的情况,需研制一种简单、快速、准确的微囊藻毒素-LR检测方法来进行水体质量检测。
电化学检测法具有简单、成本低、灵敏度高以及可进行现场检测的优点,可运用于毒素的快速现场检测[19-20]。在电化学检测中放大电化学信号是高灵敏检测的关键[21]。最近,多种应用了高导电性[22]和大比表面积[22]等特性材料的修饰电极用来进行微囊藻毒素-LR的电化学检测,如石墨烯修饰的电极[24]、单壁碳纳米管修饰的荧光适体电极[25]、硫化物/金纳米复合物修饰的电极[26]等。生物炭材料作为一种新型的绿色环保碳材料,可通过高温热解木材或废弃生物质如甘蔗渣、树叶等而简单获得,具有廉价、环保的特点[18, 20, 27-28]。因此,可考虑利用废弃生物质合成高导电性的生物炭材料,并用其制备生物模板电极。
基于此,本研究利用废弃甘蔗渣合成了高导电性生物炭,结合电化学的高灵敏性和免疫反应的特异性的优点,构建了用于微囊藻毒素-LR进行电化学免疫检测的绿色生物模板电极,以期实现对环境中微囊藻毒素-LR的快速、准确、低成本检测。
1 实验部分 1.1 试剂与仪器试剂:磷酸二氢钠(NaH2PO4·2H2O)、磷酸氢二钠(Na2HPO4·12H2O)、氯化钾(KCl)、硝酸钠(NaNO3)、硫酸镁(MgSO4), 均购于国药集团化学试剂有限公司;磷酸(H3PO4)、盐酸(HCl), 购于北京化工厂;铁氰化钾(K3[Fe(CN)]6, 99%)、牛血清蛋白(BSA)、N-Hydro-xysuccinimide (NHS)、N-(3-Dimethylaminopropyl)-N‘-ethylcarbo-diimidehydrocholoride (EDC)、2-(4-Morpholino)ethanesulfonic acid (MES), 购于西格玛奥德里奇(上海)贸易有限公司;微囊藻毒素抗原(微囊藻毒素-LR(MCLR)、微囊藻毒素-RR(MCRR))、微囊藻毒素抗体(Anti-MCLR), 购于北京伊普瑞斯科技有限公司;甘蔗渣,购于长春市永昌市场。本研究实验用水均为超纯水。
仪器:管式炉(OTF-1200X,合肥科晶材料技术有限公司,中国);行星式球磨机(UV-2600,南昌市恒顺化验设备制造有限公司,中国);精密天平(ME104,梅特勒-托利多(上海)有限公司);pH计(Five Easy Plus,梅特勒-托利多(上海)有限公司);电化学工作站(CHI660E,上海辰华仪器有限公司, 中国)。
1.2 生物炭的制备生物炭由甘蔗渣于氮气保护下缓慢热解而获得。首先将干燥脱糖的甘蔗渣放入管式炉中,并通入氮气进行热解制备生物炭,热解温度为900 ℃,加热速率和预热时间分别设置为7 ℃/min和60 min;之后用球磨机将获得的生物炭研磨至粉末状,将制备的1 g生物炭粉末分散在1 L超纯水中,通过超声处理使其均匀分散;然后,将生物炭溶液在转速为5 000 r/min的条件下离心3 min,并用滤膜(尺寸为220 nm)收集上清液中的生物炭颗粒;最后,将1 g生物炭颗粒均匀分散于20 mL浓度为1 mol/L的磷酸溶液中,室温下搅拌24 h,经过过滤冲洗至pH值为7,获得的生物炭颗粒置于真空干燥箱中干燥,留置待用。
1.3 生物模板电极制备将上述获得的生物炭颗粒(2 g/L) 均匀分散于包含10 g/L EDC和50 g/L NHS的100 mmol/L MES缓冲溶液(pH=6.5)中。首先在常温条件下,以200 r/min的转速摇晃培养2 h后,用大量磷酸缓冲盐溶液(PBS) 溶液洗去残余试剂;然后,将所得活化后的生物炭颗粒分散于抗体质量浓度为10 mg/L的PBS溶液中,在4 ℃条件下培养过夜(12~16 h),获得生物炭与抗体的复合物;再取上述复合物溶液0.5 mL, 加入0.5 μL HCl,经过均匀混合后,取5 μL混合液滴加于丝网印刷电极表面;之后,将电极放置于4 ℃条件下干燥;最后,将制备的生物模板电极经过1 g/L BSA封闭后,于4 ℃冷藏保存待用。
1.4 微囊藻毒素-LR的电化学检测实验中主要采用了电化学工作站三电极分析法,生物模板电极、银/氯化银电极、碳电极分别为工作电极、参比电极和辅助电极。将制备的生物模板电极放置于体积为10 mL电化学反应池中,利用循环伏安法(CV)、电化学阻抗法(EIS)和差分脉冲伏安法(DPV)进行检测分析。步骤为:先利用CV和EIS进行生物模板电极的电化学表征,将电极放在含有不同浓度的微囊藻毒素-LR的溶液中,于37 ℃条件下反应5 min;然后进行DPV分析。
CV的电压扫描范围为-0.4~0.6 V,扫描速率设为50 mV/s。EIS的检测体系与CV的相同,均为10 mL含有0.1 mol/L KCl的浓度为5 mmol/L的K3[Fe(CN)6]溶液,频率范围设置为0.01~100 000 Hz。DPV扫描时,电压范围为-0.4~0.6 V,所用的电解质溶液是10 mL浓度为0.1 mol/L的PBS (含有0.1 mol/L的KCl和5 mmol/L的K3[Fe(CN)6])。以上全部电化学实验均重复3遍以保证数据的准确性和可靠性。
2 结果与讨论 2.1 生物炭的表征首先对所制备的生物炭的分散稳定性和颗粒大小特征进行了研究。如图 1a所示,超纯水中配置的5 g/L生物炭溶液在常温条件下可以长时间(36 h)保持很好的分散性。这可以解释为,在高温热解条件下制备的生物炭在具有石墨烯结构的晶体特征和碳质量分数保持在较高的水平的同时,由于具有丰富的亲水官能团[29],所以表现为良好的亲水性和分散性。利用扫描电镜(SEM)表征生物炭的形貌特征(图 1b)发现,所制备的生物炭颗粒大小较均匀,且粒径大部分小于1 μm, 这有利于用生物炭制备稳定和均一的生物模板电极。

|
| 图 1 5 g/L生物炭分散液(a) 和生物炭扫描电镜图(b) Fig. 1 Digital image of 5 g/L biochar solution (a) and SEM image of biochar (b) |
|
|
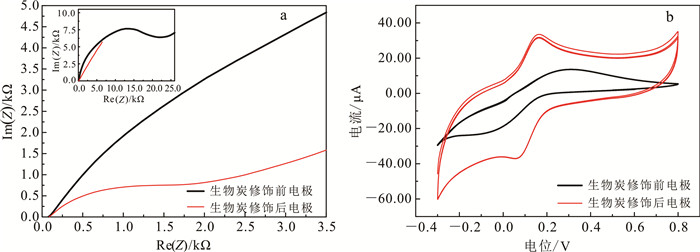
为了考察制备的生物炭是否具有良好的电催化效果,本实验将生物炭修饰的电极置于含有0.1 mol/L KCl的5 mmol/L K3[Fe(CN)6]溶液中,进行了基于EIS与CV的电化学特性分析。如图 2a所示, 生物炭修饰前电极的电子转移阻抗值(Re(Z))约为20.0 kΩ,经过生物炭修饰后, 电极的Re(Z)减小为1.5 kΩ。很明显,经过生物炭修饰后电极的阻值约减小为原来的1/13,导电性能增加。这表明所制备的生物炭具有较好的导电性。CV电化学信号的响应变化主要由K3[Fe(CN)6]的电子得失引起。其原理为,电位扫描沿着小电位值(负电位)方向开始,当电位至Fe(CN)63-可还原的析出电位时,将产生还原电流。还原电流随着电位的变小迅速增加,直至电极表面的Fe(CN)63-浓度趋近于0,此时电流达到最高峰。其公式为
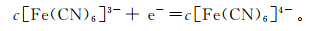 (1)
(1)
|
| a. EIS;b. CV。a中小图为0~25 kΩ范围阻抗图。Z为阻抗。 图 2 不同修饰电极在含有0.1 mol/L KCl的5 mmol/L K3Fe(CN)6溶液中的电化学特性 Fig. 2 Electrochemical characteristics of different modified electrodes in 5 mmol/L K3[Fe (CN)6] with 0.1 mol/L KCl |
|
|
式中: e- 为电子;c[Fe(CN)6]3-与c[Fe(CN)6]4-分别为铁氰化钾离子、亚铁氰化钾离子浓度。当电极电位继续正向变化至Fe(CN)64-的析出电位时,聚集在电极表面附近的还原产物Fe(CN)64-被氧化,这时产生氧化电流。氧化电流随着扫描大电位值(正电位)迅速增加,当电极表面的Fe(CN)64-浓度趋近于0时,氧化电流达到峰值。其公式为
 (2)
(2) 从CV分析图(图 2b)可以看出,生物炭修饰电极在分别在0.2 V和-0.1 V附近出现氧化电流峰和还原电流峰。这些电流峰值皆大于生物炭修饰前的电极,表明生物炭可有效增加电极的电子转移速率,提高电极的电化学性能。这主要归因于氮气保护下的高温热解促使生物质材料中的非导电性纤维素、半纤维素和木质素发生分解,将生物炭转化为高密度的石墨烯结构,导电性炭质量分数升高。此外,高温使得生物炭表面的含氧官能团减少,从而缩小了石墨烯结构的距离,使得生物炭导电性显著提高[30]。
2.3 生物模板电极对微囊藻毒素-LR的电化学响应基于生物炭制备的生物模板电极具有电子传递和识别毒素的功能。把该电极用于定量检测之前,首先对于特定浓度微囊藻毒素-LR的电化学响应效果进行了研究。实验中,将电极置于10 mL含有0.1 mol/L KCl的5 mmol/L K3[Fe(CN)6]溶液中,分别对微囊藻毒素-LR加入前和后的电化学特性进行了分析。如图 3所示,加入5.0 nmol/L微囊藻毒素-LR,在37 ℃条件下反应5 min后,氧化电流峰值约为10 μA,与未加入微囊藻毒素-LR时的电流峰值(30 μA) 相比,减小为原来的1/3左右;表明微囊藻毒素-LR与抗体的特异性结合使非导电性的毒素抗原附着于生物模板电极表面,使其电导率下降,电流峰值降低。此结果说明生物模板电极对于微囊藻毒素-LR的电化学响应灵敏,反应快速,并可用于定量检测。

|
| 图 3 生物模板电极对于微囊藻毒素-LR的电化学响应 Fig. 3 Electrochemical response of the biotemplated electrode to MCLR |
|
|
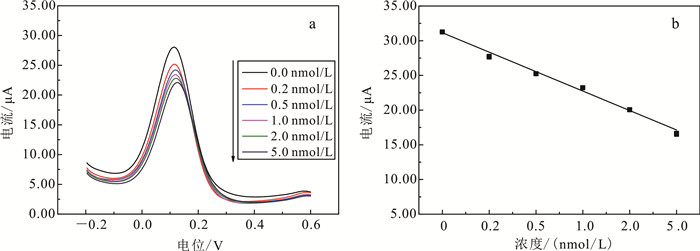
在上述研究的基础上,采用DPV方法对生物模板电极对微囊藻毒素-LR的定量检测性能进行了考察。配置了不同浓度的微囊藻毒素-LR于0.1 mol/L PBS (pH = 7.4) 溶液中,分别分析了电极对各种浓度微囊藻毒素-LR的电化学响应信号。如图 4a所示,随着微囊藻毒素-LR浓度从0.0增加到5.0 nmol/L,DPV电流峰值逐渐减小。表明随着微囊藻毒素浓度的增加,电极表面非导电性抗原的附着量增加,促使电极电导率下降和响应电流峰值降低。由微囊藻毒素-LR定量图(图 4b)可以看出,在0.0~5.0 nmol/L的检测范围内毒素浓度与响应电流值呈线性递减关系,方程关系式为
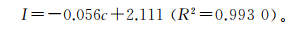 (3)
(3)
|
| 图 4 DPV方法下不同浓度微囊藻毒素-LR的检测性能 Fig. 4 Detection potential to different concentrations of MCLR with DPV method |
|
|
式中:I为电流;c为浓度。可检测的最低浓度为0.2 nmol/L。此浓度明显低于世界卫生组织规定的微囊藻毒素-LR在水中的安全浓度(1.0 nmol/L),表明此生物模板电极可用于微囊藻毒素-LR的高灵敏快速检测。
在良好的检测性能基础上对该生物模板电极的重现性进行了研究。在含有0.1 mol/L KCl和5 mmol/L K3[Fe(CN)6]的0.1 mol/L PBS(pH=7.4)溶液中,利用5个不同的生物模板电极对同一浓度的微囊藻毒素-LR的电化学响应进行了检测。结果表明,对5.0 nmol/L微囊藻毒素-LR的检测信号相对标准偏差(RSD)约为2.43%,说明此生物模板电极具有良好的重现性。
2.5 生物模板电极的检测特异性及实际水体检测效果特异性是判断电极性质的重要指标。为考察该生物模板电极在复杂水体环境中对微囊藻毒素-LR检测的特异性,本研究在PH值为7.4、浓度为0.1 mol/L的PBS(含有0.1 mol/L KCl和5 mmol/L K3[Fe(CN)6]) 溶液中分别加入浓度为5.0 nmol/L的MCLR, MCRR, BSA以及K+、Na+、Mg2+等水中常见离子,并通过利用DPV考察了电流响应,结果见图 5。由图 5可见,5.0 nmol/L微囊藻毒素-LR的响应电流达到24.85 μA,而其他几种干扰物的响应电流均在13.00 μA以下,意味着这些干扰物并没有对生物模板电极的导电性产生明显影响。说明该电极对微囊藻毒素-LR具有良好的选择性和特异性。
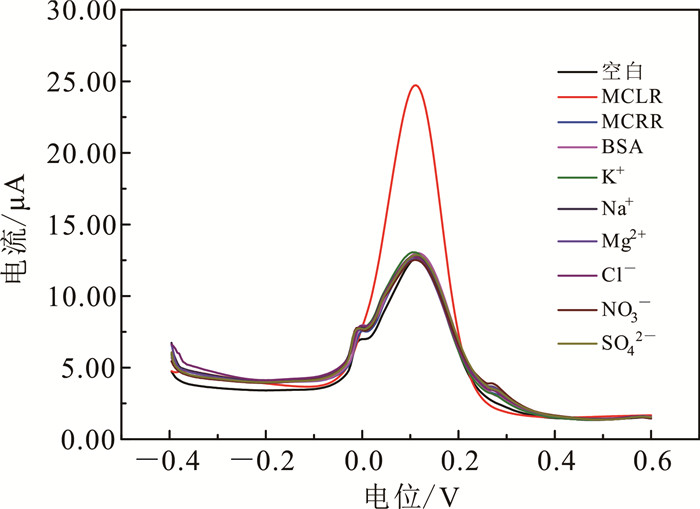
|
| 图 5 生物模板电极的特异性 Fig. 5 Specificity of the biotemplated electrode |
|
|
在此基础上,我们对于生物模板电极在实际水样中对于微囊藻毒素-LR的检测性能进行测试。在没有任何前处理的情况下,将特定浓度的微囊藻毒素-LR加入到长春某河水样品中,利用制备的生物模板电极进行了检测。结果发现对于浓度为0.1、1.0和10.0 nmol/L的微囊藻毒素-LR的加标水样,通过DPV检测获得的加标回收率分别为98.0%、103.0%和100.3%,且对应的相对标准偏差分别为1.43%、4.27%和1.83% (n= 5)。此结果表明,因为迅速、可靠的特点,本生物模板电极具有一定的在现场进行水体检测的应用前景。
3 结论1) 在进行水体中微囊藻毒素-LR检测时,DPV响应电流峰值随着微囊藻毒素-LR浓度的增大而减小,且响应电流值与微囊藻毒素-LR浓度在0.0~5.0 nmol/L范围内有良好的线性响应关系,可检测最低浓度为0.2 nmol/L。
2) 在干扰物以及水中常见的各种离子存在的复杂水体环境中,生物模板电极仍能实现对微囊藻毒素-LR的特异性检测。
| [1] |
Han J H, Zhang J P, Xia Y T, et al. Highly Sensitive Detection of the Hepatotoxin Microcystin-LR by Surface Modification and Bio-nanotechnology[J]. Colloids and Surfaces: A: Physicochemical and Engineering Aspects, 2011, 391: 184-189. |
| [2] |
宋兴良, 冯晓阳, 李娜. 分散液液微萃取气相色谱-质谱法测定水体中痕量的微囊藻毒素[J]. 临沂大学学报, 2019, 41(6): 1-8. Song Xingliang, Feng Xiaoyang, Li Na. Determination of Trace Microcystis Toxin in Water by Dispersive Liquid-Liquid Microextraction Gas Chromatography-Mass Spectrometry[J]. Journal of Linyi University, 2019, 41(6): 1-8. |
| [3] |
Wang Y, Liu H, Liu X, et al. Histone Acetylation Plays an Important Role in MC-LR Induced Apoptosis and Cycle Disorder in Sd Rat Testicular Cells[J]. Chemosphere, 2020, 241: 125073. DOI:10.1016/j.chemosphere.2019.125073 |
| [4] |
张俊, 孟宪智, 张世禄, 等. 海河流域地表水中微囊藻毒素的测定[J]. 环境监测管理与技术, 2019, 31(5): 40-42. Zhang Jun, Meng Xianzhi, Zhang Shilu, et al. Determination of Microcystin in Surface Water in Haihe River Basin[J]. Environmental Monitoring Management and Technology, 2019, 31(5): 40-42. |
| [5] |
Zanato N, Talamini L, Silva T R, et al. Microcystin-LR Label-Free Immunosensor Based on Exfoliated Graphite Nanoplatelets and Silver Nanoparticles[J]. Talanta, 2017, 175: 38-45. DOI:10.1016/j.talanta.2017.07.021 |
| [6] |
Zhao L F, Teng L, Zhang J, et al. Point-of-Care Detection of Microcystin-LR with a Personal Glucose Meter in Drinking Water Source[J]. Chinese Chemical Letters, 2019, 30(5): 1035-1037. DOI:10.1016/j.cclet.2019.01.001 |
| [7] |
Covaci O I, Sassolas A, Alonso G A, et al. Highly Sensitive Detection and Discrimination of LR and YR Microcystins Based on Protein Phosphatases and an Artificial Neural Network[J]. Analytical and Bioanalytical Chemistry, 2012, 404(3): 711-720. DOI:10.1007/s00216-012-6092-6 |
| [8] |
Loyprasert S, Thavarungkul P, Asawatreratanakul P, et al. Label-Free Capacitive Immunosensor for Microcystin-LR Using Self-Assembled Thiourea Monolayer Incorporated with Ag Nanoparticles on Gold Electrode[J]. Biosensors and Bioelectronics, 2008, 24(1): 78-86. DOI:10.1016/j.bios.2008.03.016 |
| [9] |
Zhang W, Han C S, Jia B P, et al. A 3D Graphene-Based Biosensor as an Early Microcystin-LR Screening Tool in Sources of Drinking Water Supply[J]. Electrochimica Acta, 2017, 236: 319-327. DOI:10.1016/j.electacta.2017.03.161 |
| [10] |
徐海滨, 孙明, 隋海霞, 等. 江西鄱阳湖微囊藻毒素污染及其在鱼体内的动态研究[J]. 卫生研究, 2003(3): 192-194. Xu Haibin, Sun Ming, Sui Haixia, et al. Microcystin Contamination of Fish on Poyang Lake in Jiangxi Province[J]. Journal of Hygiene Research, 2003(3): 192-194. DOI:10.3969/j.issn.1000-8020.2003.03.005 |
| [11] |
吴和岩, 郑力行, 苏瑾, 等. 上海市供水系统微囊藻毒素LR含量调查[J]. 卫生研究, 2005(2): 152-154. Wu Heyan, Zheng Lixing, Su Jin, et al. Survey on the Contamination of Microcystin-LR in Water Supply of Shanghai City[J]. Journal of Hygiene Research, 2005(2): 152-154. DOI:10.3969/j.issn.1000-8020.2005.02.009 |
| [12] |
何岸檐, 杨伟, 周倩如, 等. 重庆市城镇集中式供水水源水中微囊藻毒素污染健康风险评估[J]. 中国卫生检验杂志, 2019, 29(15): 1881-1883. He Anyan, Yang Wei, Zhou Qianru, et al. Health Risk Assessment of Microcystis Pollution in Centralized Water Source in Chongqing[J]. Chinese Journal of Health Laboratory Technology, 2019, 29(15): 1881-1883. |
| [13] |
Zhang L, Ping X, Yang Z. Determination of Microcystin-LR in Surface Water Using High-Performance Liquid Chromatography/Tandem Electrospray Ionization Mass Detector[J]. Talanta, 2004, 62(1): 191-198. DOI:10.1016/j.talanta.2003.07.001 |
| [14] |
Wang S, Ge L, Song X, et al. Paper-Based Chemiluminescence ELISA: Lab-on-Paper Based on Chitosan Modified Paper Device and Wax-Screen-Printing[J]. Biosensors and Bioelectronics, 2012, 31(1): 212-218. DOI:10.1016/j.bios.2011.10.019 |
| [15] |
Zhang G P, Li C, Wu S Q, et al. Label-Free Aptamer-Based Detection of Microcystin-LR Using a Microcantilever Array Biosensor[J]. Sensors and Actuators: B: Chemical, 2018(260): 42-47. |
| [16] |
Sassolas A, Catanante G, Fournier D, et al. Development of a Colorimetric Inhibition Assay for Microcystin-LR Detection: Comparison of the Sensitivity of Different Protein Phosphatases[J]. Talanta, 2011, 85(5): 2498-2503. DOI:10.1016/j.talanta.2011.07.101 |
| [17] |
朴云仙, 祁小丽, 王湘, 等. 基于核酸适配体功能化石墨纳米颗粒荧光探针的17β-雌二醇快速检测方法[J]. 吉林大学学报(地球科学版), 2019, 49(4): 1137-1144. Piao Yunxian, Qi Xiaoli, Wang Xiang, et al. Rapid Detection of 17β-Estradiol Based on Fluorescent Probe of Functionalized Graphite Nanoparticle with Aptamer[J]. Journal of Jilin University (Earth Science Edition), 2019, 49(4): 1137-1144. |
| [18] |
Chen X, Zhang K, Zhou J, et al. Electrochemical Immunosensor Based on Colloidal Carbon Sphere Array[J]. Biosensors and Bioelectronics, 2010, 25(5): 1130-1136. DOI:10.1016/j.bios.2009.09.038 |
| [19] |
Dong X W, He L Z, Hu H, et al. Removal of 17β-Estradiol by Using Highly Adsorptive Magnetic Biochar Nanoparticles from Aqueous Solution[J]. Chemical Engineering Journal, 2018, 352: 371-379. DOI:10.1016/j.cej.2018.07.025 |
| [20] |
He L Z, Yang Y S, Kim J B, et al. Multi-Layered Enzyme Coating on Highly Conductive Magnetic Biochar Nanoparticles for Bisphenol a Sensing in Water[J]. Chemical Engineering Journal, 2020, 384: 123276. DOI:10.1016/j.cej.2019.123276 |
| [21] |
Weller M G. Immunoassays and Biosensors for the Detection of Cyanobacterial Toxins in Water[J]. Sensors (Basel), 2013, 13(11): 15085-15112. DOI:10.3390/s131115085 |
| [22] |
Wang L B, Ma W, Xu L G, et al. Nanoparticle-Based Environmental Sensors[J]. Materials Science and Engineering: R: Reports, 2010, 70(3/4/5/6): 265-274. |
| [23] |
Wang L, Chen W, Xu D, et al. Simple, Rapid, Sensitive, and Versatile SWNT-Paper Sensor for Environmental Toxin Detection Competitive with ELISA[J]. Nano Lett, 2009, 9(12): 4147-4152. DOI:10.1021/nl902368r |
| [24] |
Eissa S, Ng A, Siaj M, et al. Label-Free Voltammetric Aptasensor for the Sensitive Detection of Microcystin-LR Using Graphene-Modified Electrodes[J]. Analytical Chemistry, 2014, 86(15): 7551-7557. DOI:10.1021/ac501335k |
| [25] |
Taghdisi S M, Danesh N M, Ramezani M, et al. A Novel Fluorescent Aptasensor for Ultrasensitive Detection of Microcystin-LR Based on Single-Walled Carbon Nanotubes and Dapoxyl[J]. Talanta, 2017, 166: 187-192. DOI:10.1016/j.talanta.2017.01.053 |
| [26] |
Zhang Y L, Chen M, Li H Y, et al. A Molybdenum Disulfide/Gold Nanorod Composite-Based Electrochemical Immunosensor for Sensitive and Quantitative Detection of Microcystin-LR in Environmental Samples[J]. Sensors and Actuators: B: Chemical, 2017, 244: 606-615. DOI:10.1016/j.snb.2017.01.030 |
| [27] |
Gao Y, Pramanik A, Begum S, et al. Multifunctional Biochar for Highly Efficient Capture, Identification, and Removal of Toxic Metals and Superbugs from Water Samples[J]. ACS Omega, 2017, 2(11): 7730-7738. DOI:10.1021/acsomega.7b01386 |
| [28] |
Tan X, Liu Y, Zeng G, et al. Application of Biochar for the Removal of Pollutants from Aqueous Solutions[J]. Chemosphere, 2015, 125: 70-85. DOI:10.1016/j.chemosphere.2014.12.058 |
| [29] |
Dong X W, He L Z, Liu Y, et al. Preparation of Highly Conductive Biochar Nanoparticles for Rapid and Sensitive Detection of 17Β-Estradiol in Water[J]. Electrochimica Acta, 2018, 292: 55-62. DOI:10.1016/j.electacta.2018.09.129 |
| [30] |
Dong X W, He L Z, Hu H, et al. Removal of 17Β-Estradiol by Using Highly Adsorptive Magnetic Biochar Nanoparticles from Aqueous Solution[J]. Chemical Engineering Journal, 2018, 352: 371-379. DOI:10.1016/j.cej.2018.07.025 |


