2. 吉林大学新能源与环境学院, 长春 130021
2. College of New Energy and Environment, Jilin University, Changchun 130021, China
0 引言
氧化石墨烯(GO)是一种由碳原子以sp2杂化轨道组成的单层六碳晶格的碳纳米薄膜[1], 由于其比表面积大、机械性能强、生物相容性好,以及具有优越的电化学和光学特性等,近年来在各种研究领域倍受关注[2-7]。据报道,氧化石墨烯对单链脱氧核糖核酸(ssDNA)具有很高的亲和力,其主要通过氢键和π—π键与单链脱氧核糖核酸结合[8-9]。因此,基于氧化石墨烯制备的传感器已被广泛地应用于检测DNA、蛋白质和小分子等[10-11]。
核酸适配体(aptamer)是用配体指数富集法系统进化技术筛选获得的寡聚核苷酸片段[12-13]。由于其合成简单、易修饰、特异性强、亲和力高等优势,被广泛地用于检测、诊断、治疗学、药物运载工具、细胞内成像、支架、基因调节和细胞工程等等[14-17]。
环境雌激素, 又称“内分泌干扰物”(endocrine disrupting chemicals), 是一类广泛存在于环境中的有机污染物, 天然类固醇激素17β-雌二醇(17β-estradiol,E2)是诸多环境雌激素中作用最强烈的一种,普遍存在于地表水、地下水以及污水中[18], 严重影响人体及生物的内分泌和生理系统,可对生物体造成长期的毒害[19]。此外,2019年度国家重点专项“场地土壤污染成因与治理技术”中也提出了关于开发地下水环境污染快速检测传感器以及建立地下水污染风险评估与安全诊断技术方法的目标与任务。因此,建立一种对17β-雌二醇污染的高灵敏、高选择性的准确检测方法至关重要。
目前,17β-雌二醇常用的检测技术主要包括高效液相色谱(HPLC)、液相色谱-质谱联用(LC-MS)、气相色谱-质谱联用(GC-MS)等色谱法,以及酶联免疫分析(ELISA)、化学发光免疫分析(CLEIA)、芯片免疫分析、电化学、光学和光电化学等的生物传感器方法[20-23]。其中色谱法虽然具有较高的检测灵敏度,但该方法操作复杂,仪器昂贵,检测时间长,且大部分检测样品需预处理步骤,影响检测准确度,难以现场检测利用[24];而生物传感器法由于反应迅速、灵敏度高、操作简单、容易小型化的特点,往往具有可在线检测的优点。孙思明等[25]采用标记有17β-雌二醇单克隆抗体的胶体金颗粒与相对应的固定在硝酸纤维膜上的雌二醇结合物相结合,利用显色法对17β-雌二醇进行了检测;张庆峰等[26]以卵清白蛋白为载体蛋白合成了17β-雌二醇的结合物并使用Cy3荧光染料标记结合物, 建立了一种免疫芯片法用于17β-雌二醇的检测;朴云仙等[27]利用核酸适配体和石墨纳米颗粒构建荧光探针,用于对水中的17β-雌二醇进行检测;Yildirim等[28]以17β-雌二醇-BSA复合物接枝作为纳米生物探针,构建了基于核酸适配体的荧光生物传感器检测模式,用于高灵敏检测水环境中的17β-雌二醇;Huang等[29]利用17β-雌二醇核酸适配体固定的二硫化钴纳米片和金纳米颗粒共同修饰的玻碳电极制备电化学核酸适配体生物传感器,通过标记的17β-雌二醇核酸适配体作为探针捕获17β-雌二醇,以及亚甲基蓝的氧化还原达到了对检测信号放大的效果。这些方法虽在检测性能上得到了一定的提高,但尚不能满足对复杂环境中17β-雌二醇的高选择性和高灵敏检测的需求。
因此,本研究通过合成荧光标记核酸适配体功能化氧化石墨烯复合物,制备成荧光生物传感器对水中17β-雌二醇进行高灵敏和特异性均相检测的研究,以期提高复杂环境水体中雌激素污染的检测性能。
1 研究思路由于氧化石墨烯具有良好的生物兼容性和荧光淬灭特性,且核酸适配体对目标物17β-雌二醇较强的选择特异性;因而,本研究通过将荧光标记核酸适配体吸附固定化于氧化石墨烯表面,制备成核酸适配体功能化氧化石墨烯复合物(GO/Apt)用于水中17β-雌二醇的检测(图 1),并对其检测性能、选择性以及在实际环境水检测中的可行性进行详细的分析,充分研究所制备的GO/Apt荧光生物传感器的优良性能。
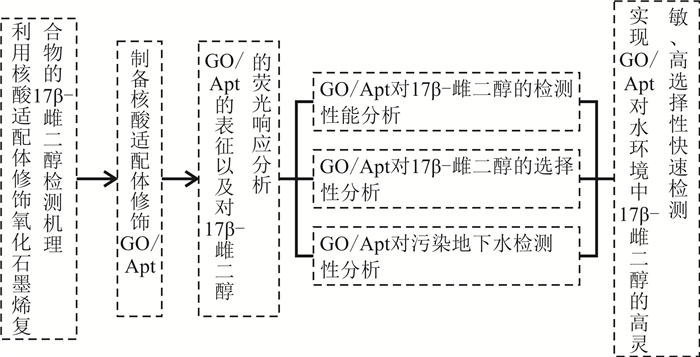
|
| 图 1 总体研究思路 Fig. 1 Research approach |
|
|
1) 样品检测材料:17β-雌二醇(E2,≥98%),双酚A(BPA,≥99%),购于西格玛奥德里奇(上海)贸易有限公司;炔雌醇(EE,≥98%),雌酮(E1,≥98%)和睾酮(T,≥98%)购于源叶生物科技有限公司(中国);K+,Na+,Mg2+,SO42-和Cl-购于北京坛墨质检科技有限公司。
2) 传感器合成材料:氧化石墨烯购于先锋纳米科技(中国);17β-雌二醇核酸适配体序列为5’-6羧基荧光素(FAM)-AAGGGATGCCGTTTG- GGCCCAAGTTCGGCATAGTG-3’,由上海生工生物工程有限公司合成[30]。
3) 缓冲溶液配制材料:Trizma盐酸盐(Tris-HCl,≥99%),氯化钠(NaCl,≥98%),氯化钾(KCl,≥99%),氯化镁六水合物(MgCl2·6H2O,≥99%),购于西格玛奥德里奇(上海)贸易有限公司。所有检测实验均在缓冲溶液(100 mmol/L Tris-HCl, 200 mmol/L NaCl, 25 mmol/L KCl,10 mmol/L MgCl2·6H2O, pH=8.0)中进行。
2.2 核酸适配体修饰氧化石墨烯复合物的制备称取2 mg的氧化石墨烯固体,放入离心管中,加入2 mL去离子水,超声4 h,以便让其充分溶解并分散于水中,配好的氧化石墨烯母液低温保存以备后续使用。在2 mL离心管中加入配好的氧化石墨烯母液(最终质量浓度为200 mg/L)和17β-雌二醇核酸适配体(最终质量浓度为3.16 mg/L),再加入去离子水配制成1 mL的反应溶液。将该反应溶液置于恒温震荡培养箱中,在200 r/min、25 ℃条件下反应2 h。为防止未与氧化石墨烯结合的核酸适配体对后续目标物检测时产生特异性结合,将反应溶液使用超速离心机在13 000 r/min转速条件下,使用去离子水彻底离心洗涤4~5次,以去除上清液中过量的核酸适配体。通过使用荧光分光光度计(RF-5301,日本,岛津公司)在激发波长为492 nm、发射波长为518 nm、激发和发射狭缝均为10 nm的条件下,分别扫描每一次的洗液,确定反应溶液中过量的核酸适配体是否洗涤彻底。洗涤彻底后,所得的GO/Apt复合物即为核酸适配体功能化的氧化石墨烯荧光探针。使用紫外-可见吸收分光光度(UV-2600,日本,岛津公司)对GO/Apt进行定性分析。并将GO/Apt放置于4 ℃储存备用。
2.3 17β-雌二醇荧光检测在2 mL的离心管中加入不同质量浓度的目标物17β-雌二醇,使得检测体系中17β-雌二醇的最终质量浓度分别达到0、10、20、50、80、100 μg/L;然后取50 μL上述GO/Apt复合物分别加入各个离心管中,再加入缓冲溶液使每个检测体系的体积为500 μL;充分混匀后,将其置于25 ℃、200 r/min条件下的摇床内反应15 min;反应后的溶液转移到1 cm的荧光石英比色皿中,用荧光分光光度计进行荧光光谱扫描(激发波长为492 nm,发射波长为518 nm,激发和发射狭缝均为10 nm)。每个17β-雌二醇质量浓度均配制3个平行样进行检测以保证数据的准确性和可靠性。
3 结果与讨论 3.1 氧化石墨烯表征及荧光淬灭特性通过透射电镜(JEM- 2200FS, 日本)表征(图 2a)可知,氧化石墨烯为微米级别的片状结构。为了将氧化石墨烯利用于17β-雌二醇的荧光检测,研究了氧化石墨烯对5-羧基荧光素(5-Carboxy fluorescein,FAM)荧光染料的荧光淬灭特性。由图 2b可见,氧化石墨烯的紫外吸收光谱与FAM荧光染料的荧光发射光谱在波长500~550 nm之间有光谱重叠,表明氧化石墨烯和FAM荧光染料之间能够发生荧光共振能量转移现象。FAM荧光染料作为荧光供体,氧化石墨烯作为荧光受体。
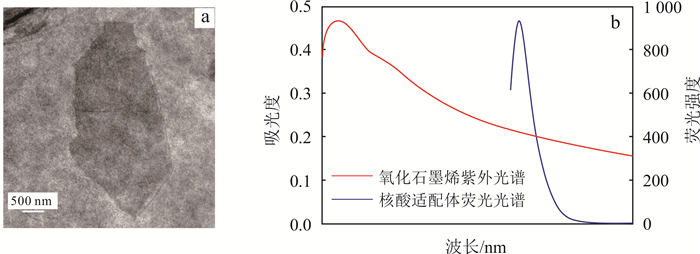
|
| 图 2 氧化石墨烯透射电镜图(a)及光谱图(b) Fig. 2 TEM image of graphene oxide(a)and spectrogram(b) |
|
|
本研究利用直接吸附法将FAM荧光标记核酸适配体直接固定于氧化石墨烯表面,经过彻底洗去未固定的核酸适配体,得到GO/Apt。利用紫外-可见吸收光谱分析法考察了核酸适配体是否成功固定于氧化石墨烯材料表面。由图 3a可见:核酸适配体在波长260 nm处有明显的特征吸收峰,该峰为DNA特征吸收峰;氧化石墨烯在230 nm处有ππ键的特征吸收峰,在300 nm处有较弱的-COOH特征吸收峰[31];而GO/Apt复合物在250 nm处呈现出一个较宽的肩峰,说明核酸适配体成功地固定到了氧化石墨烯表面,但是在该条曲线中没有表现出核酸适配体和氧化石墨烯的特征峰,原因可能是由于核酸适配体与氧化石墨烯的特征峰位置很接近,导致它们两个结合以后特征峰的位置发生偏移。
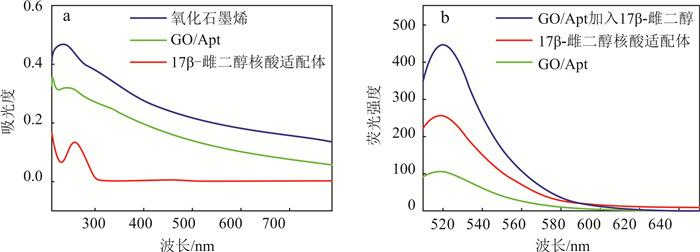
|
| 图 3 紫外光谱图(a)以及荧光光谱图(b) Fig. 3 UV-vis spectrum (a) and fluorescence spectrum (b) |
|
|
进一步通过荧光光谱扫描分析了所合成的GO/Apt的荧光特性,以及GO/Apt对目标物17β-雌二醇检测的可行性。图 3b中,单独的荧光标记核酸适配体在波长518 nm处表现为很强的荧光,合成好的GO/Apt在518 nm处的荧光强度则明显变弱,表明核酸适配体经过吸附固定于氧化石墨烯表面,其荧光标记物的荧光明显被淬灭。这是因为核酸适配体的碱基中存在的六碳环与氧化石墨烯的芳香族结构之间通过ππ结合,使核酸适配体吸附固定在氧化石墨烯表面,导致标记在核酸适配体5’端的FAM荧光基团与氧化石墨烯的距离被拉近,两者之间发生荧光共振能量转移,标记在核酸适配体一端的荧光基团被淬灭(图 4)。
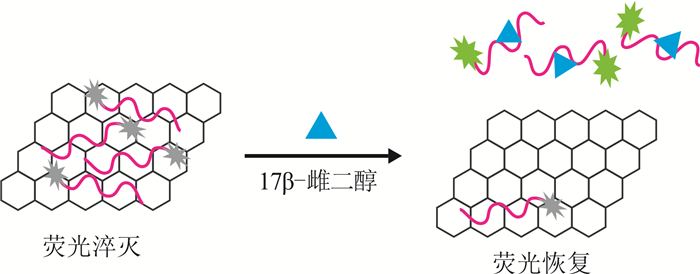
|
| 图 4 核酸适配体与氧化石墨烯复合物检测17β-雌二醇原理 Fig. 4 Schematic of aptamer and graphene oxide composite for detection of 17β-estradiol |
|
|
在此表征基础上,在GO/Apt中加入100 μg/L的17β-雌二醇,经过15 min,发现荧光强度有一定程度的恢复。这是因为加入目标物17β-雌二醇后,核酸适配体与17β-雌二醇特异性结合会使核酸适配体的结构发生改变,使核酸适配体脱离氧化石墨烯,并使荧光染料远离氧化石墨烯表面,荧光得到恢复(图 4)。说明合成的GO/Apt能够成功对目标物17β-雌二醇产生荧光响应,即该合成物能够对17β-雌二醇进行定量检测。
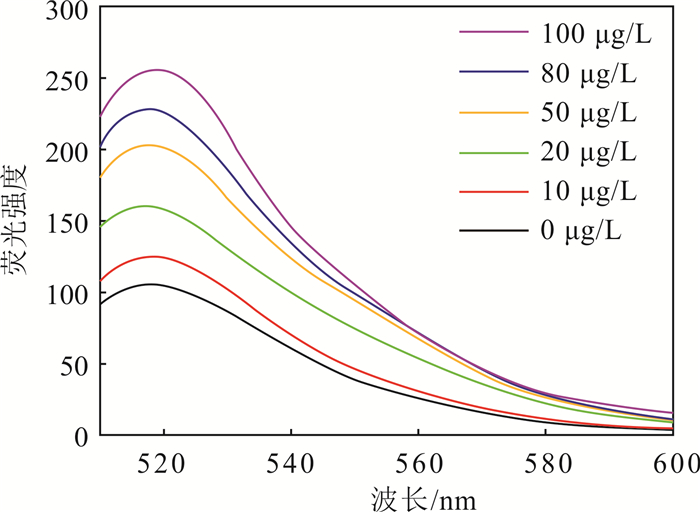
3.3 核酸适配体修饰氧化石墨烯复合物对17β-雌二醇的检测性能本研究将50 μL的GO/Apt加入到含有不同质量浓度(0~100 μg/L)的17β-雌二醇样品中,将其置于25 ℃、200 r/min转速条件下的摇床内反应15 min,直接读取荧光强度数据。如图 5所示,17β-雌二醇的质量浓度由0逐渐增加到100 μg/L时,荧光强度随着17β-雌二醇质量浓度的增加而逐渐增加。相对荧光强度是对荧光强度进行量化分析的参数,公式为
|
| 图 5 不同17β-雌二醇质量浓度下荧光光谱图 Fig. 5 Fluorescence spectrum of fluorescent probe with different concentrations of 17β-estradiol |
|
|
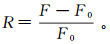
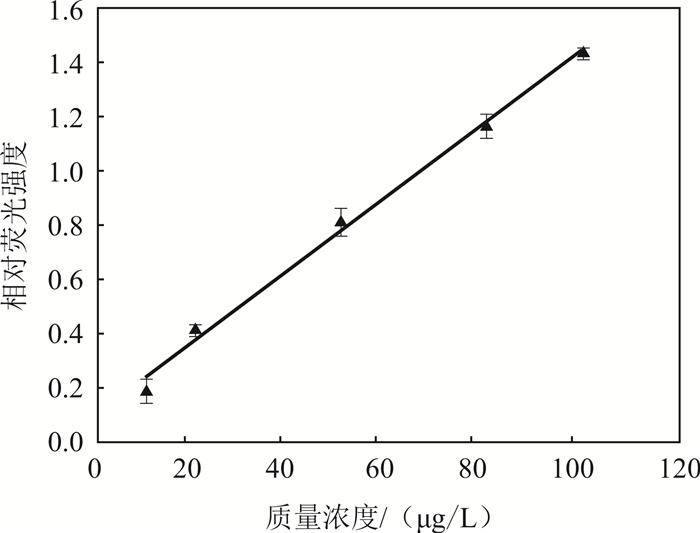
式中:R为相对荧光强度;F0和F分别代表荧光探针在没有和有17β-雌二醇存在的情况下的荧光强度。从相对荧光强度与17β-雌二醇质量浓度关系(图 6)可以看出,二者呈正比例关系,方程关系式为:y=0.01344x + 0.1027 (R2 = 0.994 6,R为相关系数),相对标准偏差小于4%(平行样品数量n=3)。检出限为6.2 μg/L (信噪比=3)。
|
| 图 6 相对荧光强度与17β-雌二醇质量浓度的线性关系 Fig. 6 Linear relationship between relative fluorescence intensity and 17β-estradiol concentration |
|
|
将本方法与现今常用的17β-雌二醇检测方法进行对比,结果见表 1,可见本研究方法的检出限最低,说明其灵敏度最高。综合灵敏度和检测线性范围来看,本研究方法都达到了较好的效果;表明本文采用的高选择特异性核酸适配体和荧光共振能量转移结合的方法在17β-雌二醇检测方面较之前的方法有了一定的提高。
为了确定GO/Apt对目标物17β-雌二醇检测的特异性和选择性,实验中选择了4种干扰物双酚A(BPA)、雌酮(E1)、炔雌醇(EE)和睾酮(T),分别对其进行检测并观察荧光强度的变化。取50 μL的GO/Apt分别加入到含有质量浓度50 μg/L目标物17β-雌二醇的样品和质量浓度100 μg/L干扰物的样品中,将其置于25 ℃,200 r/min转速条件下的摇床内反应15 min,测量其荧光强度变化。如图 7所示,GO/Apt在与干扰物BPA,E1,EE和T反应后,荧光强度只产生了微弱的变化。证明当其他干扰物存在时,该方法合成的GO/Apt也可以很容易识别其目标分子,因为GO/Apt中吸附结合的核酸适配体具有非常高的特异性。

|
| 图 7 核酸适配体与氧化石墨烯复合物特异性检测17β-雌二醇 Fig. 7 Specificity of aptamer and graphene oxide composite for E2 detection |
|
|
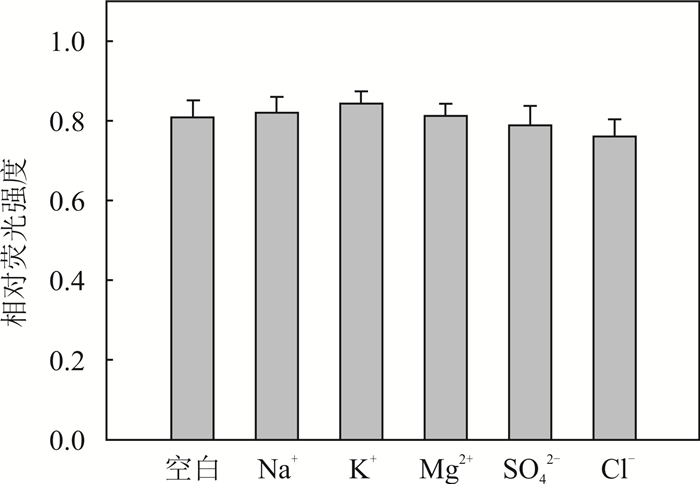
为了检测合成的GO/Apt对实际污染地下水检测17β-雌二醇的适用性,本实验选择了5种地下水中常见的离子Na+、K+、Mg2+、SO42-和Cl-,分别将其加入到检测17β-雌二醇的体系中,观察其荧光强度的变化。首先,将各种干扰离子(质量浓度1 g/L)配置在缓冲溶液中,然后,按照上述检测方法对17β-雌二醇进行检测,将其置于25 ℃、200 r/min转速条件下的摇床内反应15 min,最后测量其荧光强度变化,实验结果如图 8所示。GO/Apt在以上高质量浓度干扰离子存在的条件下,对17β-雌二醇的检测响应信号与空白样品(不含干扰离子)的检测结果相比,未见明显的差别。这表明本研究合成的GO/Apt在高浓度的地下水常见离子存在的水环境中,对目标物17β-雌二醇的检测仍具有很好的选择性。因此,GO/Apt可以适用于地下水中的17β-雌二醇检测。
|
| 图 8 核酸适配体与氧化石墨烯复合物特异性检测多种离子 Fig. 8 Specificity of aptamer and graphene oxide composite formultiple specific ion detection |
|
|
1) 依据氧化石墨烯良好的荧光淬灭特性、较大的比表面积,和核酸适配体等特性,合成了核酸适体与氧化石墨烯复合物(GO/Apt)。GO/Apt在对17β-雌二醇进行检测时,随着17β-雌二醇质量浓度的增加荧光强度逐渐增加。且相对荧光强度与17β-雌二醇质量浓度在10~100 μg/L范围内呈线性关系,最低检出限为6.2 μg/L。
2) GO/Apt在高浓度雌激素类干扰物以及地下水中常见的各种离子存在的水环境条件下表现出了良好的选择性,表明其在地下水复杂水体系中具有检测适用性。
| [1] |
Novoselov K S, Geim A K, Morozov S V, et al. Electric Field Effect in Atomically Thin Carbon Films[J]. Science, 2004, 306: 666-669. DOI:10.1126/science.1102896 |
| [2] |
Liu N, Liang G, Dong X, et al. Stabilized Magnetic al Enzyme Aggregates on Graphene Oxide for High Performance Phenol and Bisphenol Removal[J]. Chemical Engineering Journal, 2016, 306: 1026-1034. DOI:10.1016/j.cej.2016.08.012 |
| [3] |
陈晨, 张祖培, 卢文阁, 等. 工程陶瓷及特种石墨在热熔器结构设计中的应用[J]. 吉林大学学报(地球科学版), 2004, 34(4): 643-647. Chen Chen, Zhang Zupei, Lu Wenge, et al. The Application of Engineering Ceramics and Special Graphite in Construction Design of Subterrene Drills[J]. Journal of Jilin University (Earth Science Edition), 2004, 34(4): 643-647. |
| [4] |
Zeng Q O, Cheng J S, Tang L H, et al. Self-Assembled Graphene-Enzyme Hierarchical Nanostructures for Electrochemical Biosensing[J]. Advanced Functional Materials, 2010, 20(19): 3366-3372. DOI:10.1002/adfm.201000540 |
| [5] |
Wang Y, Li Z, Hu D, et al. Aptamer/Graphene Oxide Nano Complex for in Situ Molecular Probing in Living Cells[J]. Journal of the American Chemical Socoety, 2010, 132(27): 9274-9276. DOI:10.1021/ja103169v |
| [6] |
Wang Y, Lu J, Tang L, et al. Graphene Oxide Amplified Electrogenerated Chemiluminescence of Quantum Dots and Its Selective Sensing for Glutathione from Thiol-Containing Compounds[J]. Analytical Chemistry, 2009, 81(23): 9710-9715. DOI:10.1021/ac901935a |
| [7] |
刘娜, 梁刚, 董新维, 等. 酪氨酸酶固定化碳材料对苯酚的生物降解性能[J]. 吉林大学学报(地球科学版), 2017, 47(2): 573-579. Liu Na, Liang Gang, Dong Xinwei, et al. Biodegradation Property of Phenol Using the Immobilized Tyrosinase on Carbon Material[J]. Journal of Jilin University (Earth Science Edition), 2017, 47(2): 573-579. |
| [8] |
Yan H, Xu Y, Lu Y, et al. Reduced Graphene Oxide-Based Solid Phase Extraction for the Enrichment and Detection of MicroRNA[J]. Analytical Chemistry, 2017, 89(19): 10137-10140. DOI:10.1021/acs.analchem.7b03138 |
| [9] |
Wu M, Kempaiah R, Huang P J, et al. Adsorption and Desorption of DNA on Graphene Oxide Studied by Fluorescently Labeled Oligonucleotides[J]. Langmuir, 2011, 27(6): 2731-2738. |
| [10] |
Liu M, Song J, Shuang S, et al. A Graphene-Based Biosensing Platform Based on the Release of DNA Probes and Rolling Circle Amplification[J]. ACS Nano, 2014, 8(6): 5564-5573. DOI:10.1021/nn5007418 |
| [11] |
Luo Y, Shi Z, Gao Q, et al. Magnetic Retrieval of Graphene:Extraction of Sulfonamide Antibiotics from Environmental Water Samples[J]. Journal of Chromatography A, 2011, 1218(10): 1353-1358. DOI:10.1016/j.chroma.2011.01.022 |
| [12] |
Robertson D L, Joyce G F. Selection In Vitro of an RNA Enzyme that Specifically Cleaves Single-Stranded DNA[J]. Nature, 1990, 344: 467-468. DOI:10.1038/344467a0 |
| [13] |
Tuerk C, Gold L. Systematic Evolution of Ligands by Exponential Enrichment:RNA Ligands to Bacteriophage T4 DNA Polymerase[J]. Science, 1990, 249: 505-510. DOI:10.1126/science.2200121 |
| [14] |
Ellington A D, Szostak J W. In Vitro Selectionof RNA Molecules that Bind Specific Ligands[J]. Nature, 1990, 346: 818-822. DOI:10.1038/346818a0 |
| [15] |
Svobodova M, Skourodou V, Botero M, et al. The Characterizaion and Validation of 17β-Estradiol Binding Aptamers[J]. Journal of Steroid Biochemistry and Molecular Biology, 2017, 167: 14-22. DOI:10.1016/j.jsbmb.2016.09.018 |
| [16] |
Taghdisi S M, Danesh N M, Ramezani M, et al. A Novel M-Shape Electrochemical Aptasensor for Ultrasensitive Detection of Tetracyclines[J]. Biosensor and Bioelectronic, 2016, 85: 509-514. DOI:10.1016/j.bios.2016.05.048 |
| [17] |
Gijs M, Penner G, Blackler G B, et al. Improved Aptamers for the Diagnosis and Potential Treatment of HER2-Positive Cancer[J]. Pharmaceuticals, 2016, 9(2): 1-21. |
| [18] |
杨悦锁, 张戈, 宋晓明, 等. 地下水和土壤环境中雌激素运移和归宿的研究进展[J]. 吉林大学学报(地球科学版), 2016, 46(4): 1176-1190. Yang Yuesuo, Zhang Ge, Song Xiaoming, et al. Transport and Fate of Estrogens in Soil and Groundwater:A Critical Review[J]. Journal of Jilin University (Earth Science Edition), 2016, 46(4): 1176-1190. |
| [19] |
Lucas S D, Jones D L. Biodegradation of Estrone and 17β-Estradiol in Grassland Soils Amended with Animal Wastes[J]. Soil Biology and Biochemistry, 2006, 38(9): 2803-2815. DOI:10.1016/j.soilbio.2006.04.033 |
| [20] |
Dong X, He L, Liu Y, et al. Preparation of Highly Conductive Biochar Nanoparticles for Rapid and Sensitive Detection of 17β-Estradiol in Water[J]. Electrochimica Acta, 2018, 292: 55-62. DOI:10.1016/j.electacta.2018.09.129 |
| [21] |
Draisci R, Purificato I, Delli Quadri F, et al. Development of an Electrochemical ELISA for the Screening of 17β-Estradiol and Application to Bovine Serum[J]. Analyst, 125(8): 1419-1423. DOI:10.1039/b003176n |
| [22] |
Hu L, Cheng Q, Chen D, et al. Liquid-Phase Exfoliated Graphene as Highly-Sensitive Sensor for Simultaneous Determination of Endocrine Disruptors:Diethylstilbestrol and Estradiol[J]. Journal of Hazardous Materials, 2015, 283: 157-163. DOI:10.1016/j.jhazmat.2014.08.067 |
| [23] |
Fan L, Zhao G, Shi H, et al. A Femtomolar Level and Highly Selective 17β-Estradiol Photoelectrochemical Aptasensor Applied in Environmental Water Samples Analysis[J]. Environmental Science & Technology, 2014, 48(10): 5754-5761. |
| [24] |
Amorim K P, Andrade L S. Development and Application of a Cloud Point Method for the Extraction of Natural Estrogens E1 and E2 from Urine Samples and Their Simultaneous Determination by HPLC-EC Using a BDD Electrode[J]. Analytical Methods, 2017, 9: 1627-1633. DOI:10.1039/C7AY00047B |
| [25] |
孙思明, 周焕英, 房彦军, 等. 雌二醇的免疫胶体金试纸法检测[J]. 中国公共卫生, 2007, 23(1): 126-127. Sun Siming, Zhou Huanying, Fang Yanjun, et al. Detection of Estradiol by Immune Colloidal-Gold Strips Method[J]. Chinese Journal of Public Health, 2007, 23(1): 126-127. DOI:10.3321/j.issn:1001-0580.2007.01.070 |
| [26] |
张庆峰, 高志贤, 王升启. 用于雌二醇检测的免疫芯片技术[J]. 中国生物工程杂志, 2004, 24(9): 86-88. Zhang Qingfeng, Gao Zhixian, Wang Shengqi. Immunochip Techniques for Detection of 17β-Estradiol[J]. China Biotechnology, 2004, 24(9): 86-88. |
| [27] |
朴云仙, 祁小丽, 胡慧, 等. 基于核酸适配体功能化石墨纳米颗粒荧光探针的17β-雌二醇快速检测方法[J]. 吉林大学学报(地球科学版), 2019, 49(4): 1137-1144. Piao Yunxian, Qi Xiaoli, Hu Hui, et al. A Method for Rapid Detection of 17β-Estradiol Based on Aptamer-Functionalized Graphite Nanoparticle as Fluorescent Probe[J]. Journal of Jilin University (Earth Science Edition), 2019, 49(4): 1137-1144. |
| [28] |
Yildirim N, Long F, Gao C, et al. Aptamer-Based Optical Biosensor for Rapid and Sensitive Detection of 17β-Estradiol in Water Samples[J]. Environmental Science & Technology, 2012, 46(6): 3288-3294. |
| [29] |
Huang K, Liu Y, Zhang J, et al. Aptamer/Au Nanoparticles/Cobalt Sulfide Nanosheets Biosensor for 17β-Estradiol Detection Using a Guanine-Rich Complementary DNA Sequence for Signal Amplification[J]. Biosensors and Bioelectronics, 2015, 67: 184-191. DOI:10.1016/j.bios.2014.08.010 |
| [30] |
Alsager O A, Kumar S, Zhu B, et al. Ultrasensitive Colorimetric Detection of 17β-Estradiol:The Effect of Shortening DNA Aptamer Sequences[J]. Analytical Chemistry, 2015, 87(8): 4201-4209. DOI:10.1021/acs.analchem.5b00335 |
| [31] |
Ai F, Zhong Y, Hu X, et al. Characterization on the Exfoliation Degree of Graphite Oxide into Graphene Oxide by UV-Visible Spectroscopy[J]. Journal of Wuhan University of Technology-Mater, 2016, 31(3): 515-518. DOI:10.1007/s11595-016-1401-0 |


