2. 地下水资源与环境教育部重点实验室(吉林大学), 长春 130021
2. Key Laboratory of Groundwater Resources and Environment(Jilin University), Ministry of Education, Changchun 130021, China
0 引言
酚类污染物广泛存在于农业和工业废水中, 并且由于其毒性强、自然降解性差, 一直备受关注[1-3]。4-氯苯酚是一种常见的酚类污染物,也是土壤和废水中毒害最严重的污染物之一,主要来源于农药、除草剂和木材防腐剂等,当其被释放到环境中后,会因其难生物降解而持续累积,对环境和人类健康产生严重的危害[4]。
基于过硫酸盐(过二硫酸盐(PDS)和过单硫酸盐(PMS))的高级氧化法对废水的处理已经引起广泛关注。许多研究已经报道过硫酸盐氧化过程可以降解剧毒和持久性污染物[5-12],例如,氯代烃、多氯联苯、六氯环己烷(HCHs)、染料、DDT、二恶烷等污染物。Wacławek等[6]报道,与PMS相比,PDS具有成本更低、稳定性更高、运输更容易的优点,其更适用于废水和土壤修复。PDS主要通过热活化[13]、紫外光活化[14]和金属活化[15]等活化方式产生活性氧化物质,并作用于污染物来实现对污染物的降解。然而上述方法存在一定的缺点,包括有毒金属浸出造成二次污染、能耗相对较高等[16]。
目前对于PDS活化主要存在自由基和非自由基两种活化机制。长时间以来,自由基活化机制被认为是PDS氧化去除污染物的主要途径,是指PDS被活性物质激活后产生高活性硫酸根自由基,进而氧化有机污染物的过程。而近年来,科研工作者发现了活化PDS的非自由基氧化途径,且与自由基氧化途径相比显示出许多优势[17]。非自由基途径是指PDS直接氧化或被活化后产生一些其他非自由基氧化物质氧化降解污染物的过程。Zhang等[18]发现CuO可以通过非自由基氧化途径去除2, 4-二氯苯酚。此外,氮掺杂单壁碳纳米管作为非金属催化剂也可以通过非自由基反应对苯酚进行氧化去除[19]。由于活化PDS的过程中存在不同的氧化机制,因此,开发高效、稳定且经济的PDS活化方法和研究PDS的氧化机制已引起很多研究人员的关注。
有关研究报道称将杂原子(N,B或P)化学掺杂到碳骨架中可以显著提高碳的催化活性[20-23]。最近已有相关研究表明,氮掺杂碳材料,如氮掺杂碳纳米管[24]、氮掺杂石墨烯[25]和碳化聚吡咯形成的氮掺杂纳米球碳[26],都可以用来活化PDS。但由于其成本高,大规模生产和实际应用仍然受到限制。因此,对于廉价、高效且环境友好的新型催化剂的研制显得尤为重要。
废弃的工业糖浆作为一种相对廉价的碳源,具有产量大、廉价、易获取等优势。本研究以废弃工业糖浆为碳源制备氮掺杂碳材料新型催化剂,并用来活化PDS。为了阐明氮掺杂碳材料活化PDS去除4-氯苯酚的效能和机制,进行了如下4方面的研究:首先分析了氮掺杂碳材料的理化性能;其次研究了氮掺杂碳材料活化PDS去除4-氯苯酚的性能;然后考察了影响4-氯苯酚去除的关键因素,包括pH、PDS投加量、氮掺杂碳材料的投加量;最后,通过电子自旋共振(ESR)和自由基淬灭实验研究了氮掺杂碳材料活化PDS降解4-氯苯酚的氧化机制。本研究利用自主研发的氮掺杂碳材料活化过硫酸盐降解4-氯苯酚,以期进一步为实际废水中4-氯苯酚的治理提供参考。
1 实验方法及材料 1.1 材料及药品主要材料及药品包括废弃的工业糖浆(碳源)、氨水(氮源)、4-氯苯酚、柠檬酸、九水合硝酸铝、磷酸(80%)、硝酸、过硫酸钠、甲醇、叔丁醇、叠氮化钠(NaN3)、2, 2, 6, 6-四甲基-4-羟基哌啶(TEMP)、盐酸和氢氧化钠。上述化学品除废弃工业糖浆外均是分析纯,购自国药。
1.2 氮掺杂碳材料的制备材料的制作方法根据文献[27]进行改进。首先在室温下将柠檬酸、九水合硝酸铝和磷酸(80%)(物质的量之比为0.5:1.0:1.0)在500 mL含有200 mL超纯水的三颈瓶中混合,加入40 mL废弃的工业糖浆搅拌均匀;然后滴加氨水以将混合物的pH值调节至5.0,在水浴锅以90 ℃加热蒸干后,将得到的固体复合物在马弗炉中进行300 ℃预处理;再进行球磨并在氮气氛围条件下的管式炉中以800 ℃的温度进行碳化;接着用4 mol/L HNO3溶液酸洗处理,去离子水洗涤,并在105 ℃下干燥得到黑色半成品;最后,在氮气氛围条件下将一部分半成品样品分别在700、800和900 ℃下煅烧处理得到氮掺杂碳材料,分别标记为NC-700、NC-800和NC-900。
1.3 实验方法实验的反应体系为100 mL,氮掺杂碳材料(NC-700、NC-800和NC-900)用量为100 mg/L,PDS浓度为5 mmol/L(相当于质量浓度为1 190 mg/L),初始pH为6.26,4-氯苯酚的质量浓度为50 mg/L。首先,将催化剂加入溶液中,摇晃10 min以达到吸附平衡。然后,通过向含有催化剂的4-氯苯酚溶液中添加一定量的PDS开始4-氯苯酚的降解过程。反应在25 ℃的恒温摇床中进行,并在预定好的时间点进行取样。分析之前,将样品通过0.22 μm膜(艾那涞特仪器设备有限公司)过滤并取出1 mL样品加入到含有0.5 mL甲醇的高效液相色谱(HPLC)小瓶中以淬灭自由基[26]。为了研究pH对4-氯苯酚去除的影响,使用0.1 mol/L NaOH和HCl将初始pH分别调节至3,5,7和9。为了探究降解4-氯苯酚的活性物质,以甲醇和叔丁醇作为自由基淬灭剂,叠氮化钠作为单线态氧淬灭剂,设计3组实验确定NC-800/PDS/4-氯苯酚体系可能产生的活性物质。具体实验条件如下:催化剂质量浓度为100 mg/L,4-氯苯酚的初始质量浓度为50 mg/L,PDS初始浓度为5 mmol/L,温度为25 ℃。在加入PDS之前,先向3组反应液中分别加入甲醇、叔丁醇和NaN3,最终浓度分别为500、500、50 mmol/L。
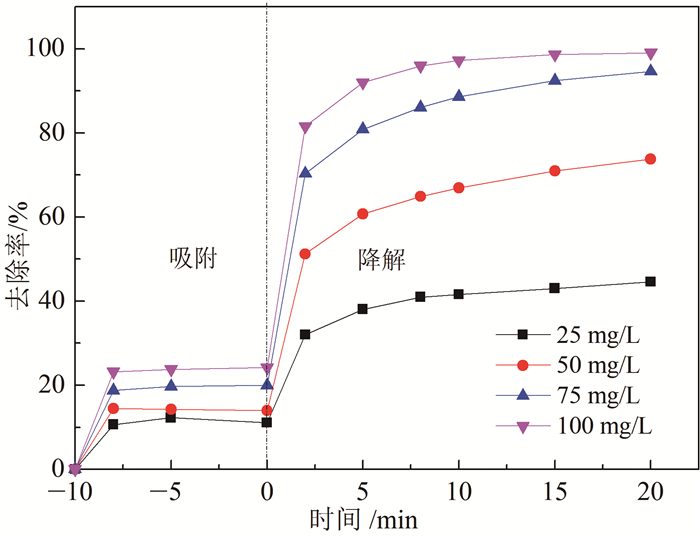
1.4 实验分析采用扫描电子显微镜SEM(日本SHIMADZU公司,SSX-550)观察NC-800的表面形态。采用LabRAM HR Evolution(Horiba)获得NC-800拉曼光谱图。利用Shimadzu XRD-6000衍射仪(40 kV,30 mA)Cu Ka辐射(Shimazu,Japan)获得NC-800 X射线衍射(XRD)光谱。利用X射线光电子能谱(XPS)(Thermo,ES-CA LAB250,US)分析NC-800中氮的不同结构。为了检测NC-800/PDS体系的活性物质,使用ESR光谱仪(JES-FA200,美国)检测被TEMP捕获的单线态氧(1O2)。采用高效液相色谱仪(LC-20AT,SHIMADZU,日本)分析4-氯苯酚浓度,分析条件为:ZORBAX SB-C18(4.6 mm×150 mm),测试温度为(30 ± 1.0)℃,流动相为V(甲醇):V(H2O)=60:40,流速为1 mL/min。4-氯苯酚的去除率计算公式为
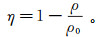 (1)
(1) 式中:η为4-氯苯酚去除率, %; ρ0和ρ分别为初始、反应过程某时刻4-氯苯酚质量浓度, mg/L。
2 结果与讨论 2.1 最佳氮掺杂碳材料的确定以及其活化性能验证图 1描述了不同氮掺杂碳材料活化PDS处理4-氯苯酚的效果。从图 1可知:1)在10 min内,3种氮掺杂碳材料(NC-700,NC-800和NC-900)对4-氯苯酚的吸附均达到平衡,且对应的吸附去除率分别为21.07 %、24.21 %和19.15 %。这说明,氮掺杂碳材料对4-氯苯酚具有一定的吸附去除能力。其中,NC-800对4-氯苯酚的吸附效果最佳。2)在吸附10 min后,向反应体系中加入了PDS。在只含有PDS的对照中,4-氯苯酚质量浓度几乎不会下降。这说明未活化的PDS对4-氯苯酚的氧化去除能力有限。3)在有氮掺杂碳材料的体系中加入PDS后,体系中4-氯苯酚质量浓度开始迅速下降。反应10 min后,加入PDS的NC-700、NC-800、NC-900对4-氯苯酚的去除效率分别为94.50 %,97.25 %和91.55 %。以上结果表明:氮掺杂碳材料可以有效地活化PDS进而降解4-氯苯酚;氮掺杂碳材料吸附性有利于4-氯苯酚的去除,吸附性越好,4-氯苯酚去除率越大。从实验结果分析,去除4-氯苯酚的最佳氮掺杂碳材料为NC-800。
|
| 图 1 不同氮掺杂碳材料活化PDS去除4-氯苯酚的效果 Fig. 1 Removal of 4-chlorophenol by PDS mediated by different nitrogen doped carbon materials |
|
|
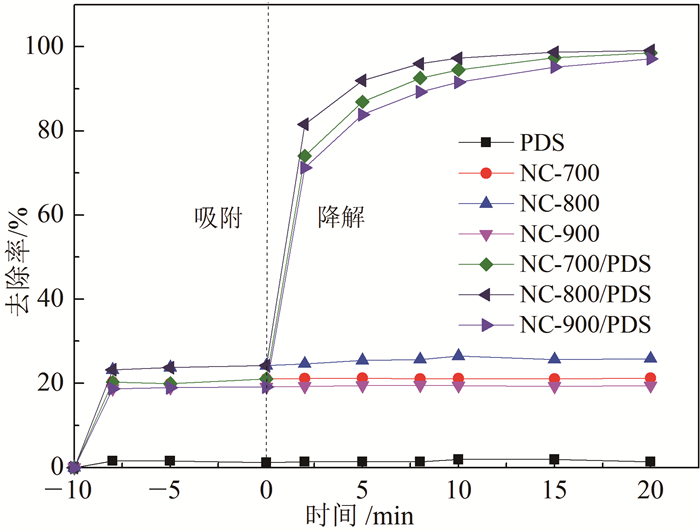
NC-800的表观结构表征结果见图 2。从NC-800的SEM(扫描电子显微镜)照片(图 2a)可以看出,NC-800颗粒细小,表面粗糙,没有固定的形状。粒度分析的结果表明材料的粒度分布范围为0.3~2.5 μm。从NC-800的XRD(X射线衍射)谱图(图 2b),可以看出,材料存在以25°和44°为中心的2种较宽的衍射峰,可分别归因于石墨的(002)和(100)结构峰。峰型较宽表明材料的石墨化程度不高,属于无定型碳结构[28-29]。图 2c给出了NC-800的Raman(拉曼)谱图,Raman光谱法是一种表示材料缺陷和无序程度的方法[30]。从图 2c可以看出,在1 342 cm-1和1 582 cm-1处有2条明显的谱带。其中,1 342 cm-1代表D带,反映了sp3碳或其他杂质原子晶格的缺陷[31];1 582 cm-1代表G带,反映了碳原子sp2杂化的面内伸缩振动[31]。NC-800中D带的强度比较强表明材料中含有大量无定型碳,G带具有一定强度表明存在结晶石墨碳。这与XRD的分析结果是一致的。D带强度与G带强度的比率(ID/IG)用于评估碳材料的缺陷程度,ID/IG越大缺陷程度越大[32]。NC-800的ID/IG值为0.97,这表明NC-800表面一定程度的缺陷。图 2d和2e分别给出了NC-800表面的元素组成全谱和N1s的精细扫描谱图。可以看出,NC-800主要由C、N和O组成,其中C、N、O的原子分数别为92.3 %、4.0 %和3.7 %。利用XPS分峰软件可对N1s谱图进行分峰,结果如图 2e所示。图 2e中,NC-800的N1s主要可以分为3种峰:峰1(398.3 eV)、峰2(400.2 eV)和峰3(401.2 eV),分别对应于吡啶氮(N-6),吡咯氮(N-5)和石墨氮(N-Q)结构。其中,N-6、N-5和N-Q占总氮的百分比分别为39.37 %、18.99 %和41.64 %。以上结果表明氮原子已经掺杂到NC-800的碳层中。有关研究[24-25, 33]表明,氮掺杂石墨烯、氮掺杂碳纳米管等氮掺杂碳材料对PMS和PDS具有优异的活化性能,石墨氮在催化过程中起关键作用。本论文NC-800的活化性能在前面NC-800活化PDS去除4-氯苯酚的过程中已经得到了证明,NC-800中石墨氮也可能在此催化体系中起关键作用。
|
| a. SEM图片;b. XRD图谱;c. Raman图谱;d.材料表面XPS全谱;e.材料表面N 1s谱图。 图 2 NC-800的表观结构表征结果 Fig. 2 Characterization results of NC-800 |
|
|
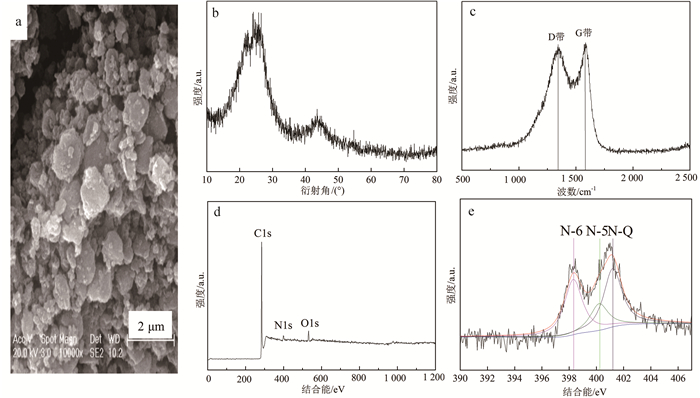
NC-800投加量对活化PDS去除4-氯苯酚效果的影响见图 3。从图 3可以看出:当NC-800投加量分别为25、50、75和100 mg/L时,对4-氯苯酚的吸附效率分别为11.08 %、13.68 %、19.96 %和24.20 %。表明NC-800投加量的增加促进了4-氯苯酚的吸附去除效果,这是因为随着材料投加量的增加,材料表面可利用的吸附位点数量也会增加,这增强了材料对于4-氯苯酚的吸附效果。当NC-800的质量浓度为25 mg/L,加入PDS反应20 min后,4-氯苯酚的去除率为44.62 %;当NC-800的投加量增加到50、75和100 mg/L后,4-氯苯酚的去除率分别显著提高到73.78 %,94.62 %和99.10 %。以上结果表明,NC-800的投加量的增加有利于对PDS的活化和4-氯苯酚的氧化去除;NC-800的最佳投加的质量浓度为100 mg/L, 这可能是因为NC-800活化PDS与材料表面的活性位点有关,而投加量的提高使得材料表面活性位点数量显著提高。
|
| 图 3 NC-800投加量对NC-800/PDS/4-氯苯酚体系中4-氯苯酚去除率的影响 Fig. 3 Effect of NC-800 dosage on the removal efficiency of 4-Chlorophenol in NC-800/PDS/4-chlorophenol system |
|
|
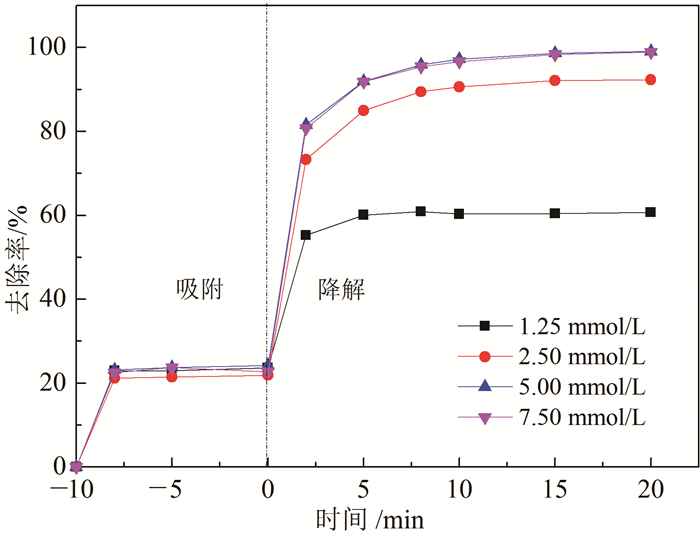
图 4主要考察PDS投加量对活化PDS去除4-氯苯酚效果的影响。可以看出PDS的浓度为1.25~7.50 mmol/L时均可有效去除4-氯苯酚。当PDS浓度从1.25 mmol/L增加至2.50和5.00 mmol/L时,加入PDS反应20 min后,4-氯苯酚去除率从60.75 %增加至92.38 %和99.10 %;而当PDS的浓度进一步增加至7.50 mmol/L时,加入PDS反应20 min后4-氯苯酚去除率和反应速率与5.00 mmol/L时相比几乎不再增加。其原因可能是,当PDS投加量过大时,NC-800表面的活性位点数量成为限制因素,致使NC-800的数量不足以传输电子,这阻碍了活性氧化物质生成速率的提高,导致了4-氯苯酚的去除率不能继续提高[34]。PDS投加量为5.00 mmol/L和7.50 mmol/L时结果相差不大,但结合经济方面考虑,PDS的投加的最佳浓度为5.00 mmol/L(即质量浓度为1 190 mg/L)。
|
| 图 4 PDS投加量对NC-800/PDS/4-氯苯酚体系中4-氯苯酚去除率的影响 Fig. 4 Effect of PDS dosage on the removal efficiency of 4-chlorophenol in NC-800/PDS/4-chlorophenol system |
|
|
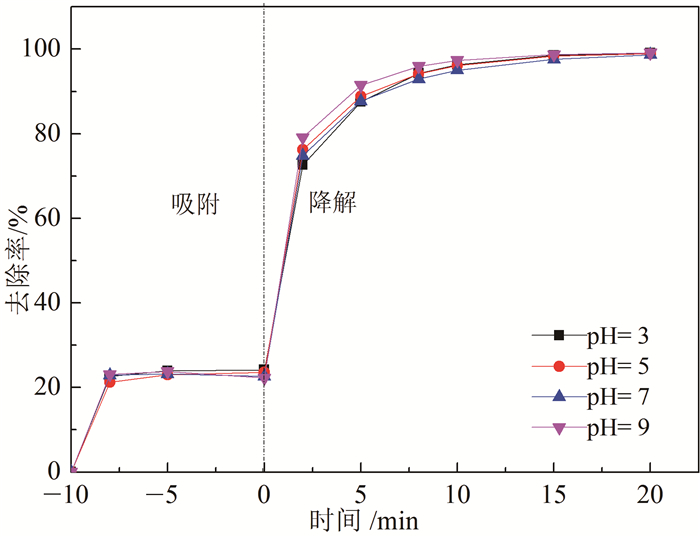
图 5考察了初始pH对活化PDS去除4-氯苯酚效果的影响。在初始pH分别为3、5、7和9时,4-氯苯酚去除率变化不大,去除率都达到99.0 %以上。结果表明,pH对NC-800/PDS/4-氯苯酚体系去除4-氯苯酚的影响不大,NC-800/PDS体系可以在宽pH(3~9)范围内起作用,可以不受初始pH的干扰;另外大多数实际废水的pH范围为5~9,这表明NC-800/PDS体系可以有效地应用于实际废水中4-氯苯酚的去除。
|
| 图 5 初始pH对NC-800/PDS/4-氯苯酚体系中4-氯苯酚去除率的影响 Fig. 5 Effect of initial pH on the removal efficiency of 4-chlorophenol in NC-800/PDS/4-chlorophenol system |
|
|
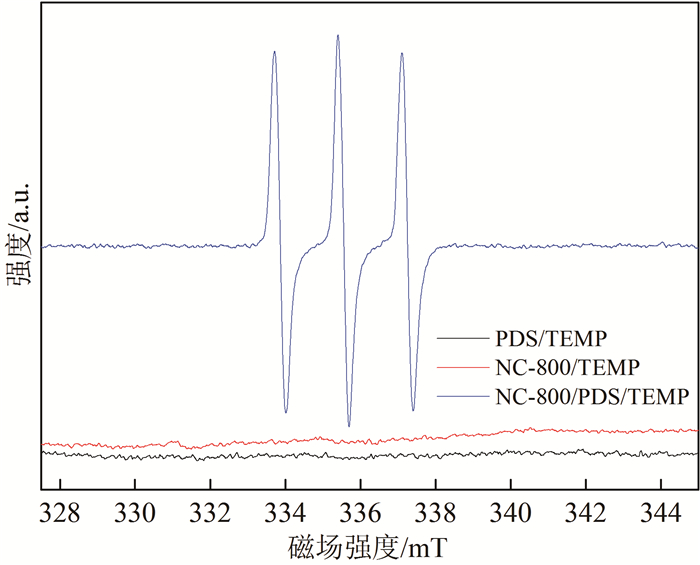
利用淬灭实验以鉴定NC-800/PDS/4-氯苯酚体系中的活性氧化性物质。甲醇是羟基自由基和硫酸根自由基的淬灭剂,而叔丁醇是羟基自由基的有效淬灭剂,但不适用于硫酸根自由基淬灭[35-37];叠氮化钠(NaN3)可以作为单线态氧的淬灭剂[38]。图 6为不同淬灭剂条件下NC-800对4-氯苯酚去除率的效果图。在NC-800/PDS/4-氯苯酚体系中,当甲醇或叔丁醇与PDS的浓度比达到100:1时,未能阻止4-氯苯酚的去除。加入PDS 20 min内,在甲醇存在的情况下,4-氯苯酚的去除率为99.10 %,在叔丁醇存在的情况下,4-氯苯酚的去除率依然达到95.39 %,表明甲醇和叔丁醇对4-氯苯酚去除的影响可以忽略不计。在甲醇存在下的4-氯苯酚去除效果略好于在叔丁醇存在下的4-氯苯酚去除效果,这可能是因为叔丁醇比甲醇更疏水,并且与NC-800具有更强的亲和力,略微阻碍了4-氯苯酚的去除,导致4-氯苯酚去除率略降低[26]。在NaN3存在情况下,4-氯苯酚降解显著被抑制,加入PDS后4-氯苯酚去除率仅降低了7.51 %。比较甲醇、叔丁醇和NaN3对4-氯苯酚降解的抑制作用,表明NC-800/PDS/4-氯苯酚体系中4-氯苯酚降解遵循非自由基途径,促进4-氯苯酚去除的活性物质可能是1O2。为了进一步验证活性物质为1O2,进行了ESR实验,TEMP作为1O2的捕获剂。图 7为ESR光谱图,在光谱中,NC-800/PDS体系的ESR光谱TEMPO(TEMP与1O2的加合物)信号强烈并且呈现相同的强度(强度比为1:1:1),其为1O2被捕获的的特征谱图。通过ESR检测到1O2的存在,表明NC-800对PDS的活化遵循非自由基机制,且1O2是氧化4-氯苯酚的活性物质。

|
| 图 6 淬灭剂对NC-800/PDS/4-氯苯酚体系中4-氯苯酚去除率的影响 Fig. 6 Effect of quenching agents on the removalefficiency of 4-chlorophenol in NC-800/PDS/4-chlorophenol system |
|
|
|
| 图 7 PDS、NC-800、NC-800/PDS体系的ESR光谱 Fig. 7 ESRspectroscopy of PDS、NC-800、NC-800/PDS system |
|
|
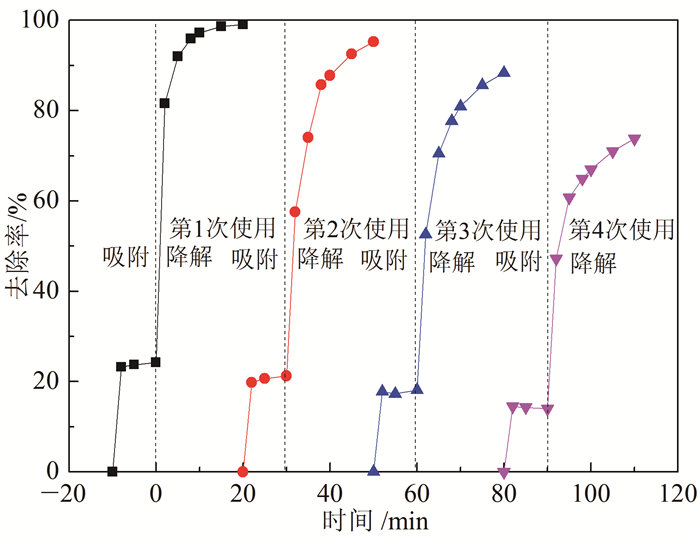
图 8考察了NC-800循环使用对4-氯苯酚去除的效果。结果表明,4-氯苯酚的去除率随着使用次数增加而降低,但在使用第4个周期4-氯苯酚依然有73.80%去除率,说明NC-800并没有完全丧失其催化活性。以上结果表明NC-800具有比较稳定的催化活性,能够重复使用。
|
| 图 8 NC-800重复使用实验 Fig. 8 Repetitive degradation of 4-chlorophenol using NC-800 as catalyst |
|
|
1) NC-800/PDS/4-氯苯酚体系能够高效去除4-氯苯酚,且4-氯苯酚的去除不受环境pH的影响。
2) NC-800投加量的增加有利于NC-800/PDS/4-氯苯酚体系中4-氯苯酚的去除,NC-800的最佳质量浓度为100 mg/L;PDS投加量的增加在一定范围内有利于4-氯苯酚的去除,PDS的最佳投加浓度为5 mmol/L(即质量浓度为1 190 mg/L)。
3) NC-800对PDS的活化遵循非自由基机制,单线态氧是氧化4-氯苯酚的活性物质。
| [1] |
Shukla P, Sun H, Wang S, et al. Nanosized Co3O4/SiO2 for Heterogeneous Oxidation of Phenolic Contaminants in Waste Water[J]. Separation and Purification Technology, 2011, 77(2): 230-236. DOI:10.1016/j.seppur.2010.12.011 |
| [2] |
Andreozzi R, Caprio V, Insola A, et al. Advanced Oxidation Processes (AOP) for Water Purification and Recovery[J]. Catalysis today, 1999, 53(1): 51-59. DOI:10.1016/S0920-5861(99)00102-9 |
| [3] |
Esplugas S, Gimenez J, Contreras S, et al. Comparison of Different Advanced Oxidation Processes for Phenol Degradation[J]. Water Research, 2002, 36(4): 1034-1042. DOI:10.1016/S0043-1354(01)00301-3 |
| [4] |
Ji K, Dai H, Deng J, et al. 3DOM BiVO4 Supported Silver Bromide and Noble Metals:High-Performance Photocatalysts for the Visible-Light-Driven Degradation of 4-Chlorophenol[J]. Applied Catalysis B:Environmental, 2015, 168: 274-282. |
| [5] |
张凤君, 刘哲华, 苏小四, 等. 土壤类型及组分对热活化过硫酸盐氧化降解土壤中挥发性氯代烃的影响[J]. 吉林大学学报(地球科学版), 2018, 48(4): 1212-1220. Zhang Fengjun, Liu Zhehua, Su Xiaosi, et al. Effects of Soil Types and Composition on Oxidative Degradation of Volatile Chlorinated Hydrocarbons by Thermally Activated Persulfate[J]. Journal of Jilin University(Earth Science Edition), 2018, 48(4): 1212-1220. |
| [6] |
Wacławek S, Lutze H V, Grübel K, et al. Chemistry of Persulfates in Water and Wastewater Treatment:A Review[J]. Chemical Engineering Journal, 2017, 330: 44-62. DOI:10.1016/j.cej.2017.07.132 |
| [7] |
Ghanbari F, Moradi M. Application of Peroxymonosulfate and Its Activation Methods for Degradation of Environmental Organic Pollutants[J]. Chemical Engineering Journal, 2017, 310: 41-62. DOI:10.1016/j.cej.2016.10.064 |
| [8] |
Fang G, Gao J, Dionysiou D D, et al. Activation of Persulfate by Quinones:Free Radical Reactions and Implication for the Degradation of PCBs[J]. Environmental Science & Technology, 2013, 47(9): 4605-4611. |
| [9] |
Wacławek S, Antoš V, Hrabák P, et al. Remediation of Hexachlorocyclohexanes by Cobalt-Mediated Activation of Peroxymonosulfate[J]. Desalination and Water Treatment, 2016, 57(54): 26274-26279. DOI:10.1080/19443994.2015.1119757 |
| [10] |
Sun H, Peng X, Zhang S, et al. Activation of Peroxymonosulfate by Nitrogen-Functionalized Sludge Carbon for Efficient Degradation of Organic Pollutants in Water[J]. Bioresource Technology, 2017, 241: 244-251. DOI:10.1016/j.biortech.2017.05.102 |
| [11] |
Zhu C, Fang G, Dionysiou D D, et al. Efficient Transformation of DDTs with Persulfate Activation by Zero-Valent Iron Nanoparticles:A Mechanistic Study[J]. Journal of Hazardous Materials, 2016, 316: 232-241. DOI:10.1016/j.jhazmat.2016.05.040 |
| [12] |
刘娜, 丁吉阳, 于庆民, 等. 超声强化零价铁活化过硫酸盐降解地下水中二恶烷[J]. 吉林大学学报(地球科学版), 2018, 48(6): 1831-1837. Liu Na, Ding Jiyang, Yu Qingmin, et al. Degradation of 1, 4-Dioxane in Groundwater by Ultrasound Enhanced ZVI Activated Persulfate Oxidation Process[J]. Journal of Jilin University(Earth Science Edition), 2018, 48(6): 1831-1837. |
| [13] |
Ji Y, Fan Y, Liu K, et al. Thermo Activated Persulfate Oxidation of Antibiotic Sulfamethoxazole and Structurally Related Compounds[J]. Water Research, 2015, 87: 1-9. |
| [14] |
Zhang R, Yang Y, Huang C H, et al. Kinetics and Modeling of Sulfonamide Antibiotic Degradation in Wastewater and Human Urine by UV/H2O2 and UV/PDS[J]. Water Research, 2016, 103: 283-292. |
| [15] |
Rastogi A, Al-Abed S R, Dionysiou D D. Effect of Inorganic, Synthetic and Naturally Occurring Chelating Agents on Fe (Ⅱ) Mediated Advanced Oxidation of Chlorophenols[J]. Water Research, 2009, 43(3): 684-694. DOI:10.1016/j.watres.2008.10.045 |
| [16] |
Oh W D, Dong Z, Lim T T. Generation of Sulfate Radical Through Heterogeneous Catalysis for Organic Contaminants Removal:Current Development, Challenges and Prospects[J]. Applied Catalysis B:Environmental, 2016, 194: 169-201. DOI:10.1016/j.apcatb.2016.04.003 |
| [17] |
Duan X, Sun H, Shao Z, et al. Nonradical Reactions in Environmental Remediation Processes:Uncertainty and Challenges[J]. Applied Catalysis B:Environmental, 2018, 224: 973-982. DOI:10.1016/j.apcatb.2017.11.051 |
| [18] |
Zhang T, Chen Y, Wang Y, et al. Efficient Peroxydisulfate Activation Process not Relying on Sulfate Radical Generation for Water Pollutant Degradation[J]. Environmental Science & Technology, 2014, 48(10): 5868-5875. |
| [19] |
Duan X, Sun H, Wang Y, et al. N-Doping-Induced Nonradical Reaction on Single-Walled Carbon Nanotubes for Catalytic Phenol Oxidation[J]. Acs Catalysis, 2014, 5(2): 553-559. |
| [20] |
Shi Q, Peng F, Liao S, et al. Sulfur and Nitrogen Co-doped Carbon Nanotubes for Enhancing Electrochemical Oxygen Reduction Activity in Acidic and Alkaline Media[J]. Journal of Materials Chemistry:A, 2013, 1(47): 14853-14857. DOI:10.1039/c3ta12647a |
| [21] |
Duan X, O'Donnell K, Sun H, et al. Sulfur and Nitrogen Co-Doped Graphene for Metal-Free Catalytic Oxidation Reactions[J]. Small, 2015, 11(25): 3036-3044. DOI:10.1002/smll.201403715 |
| [22] |
Han J S, Chung D Y, Ha D G, et al. Nitrogen and Boron Co-Doped Hollow Carbon Catalyst for the Oxygen Reduction Reaction[J]. Carbon, 2016, 105: 1-7. DOI:10.1016/j.carbon.2016.04.018 |
| [23] |
Xu J, Guan L. Toward Understanding the Active Site for Oxygen Reduction Reaction on Phosphorus-Encapsulated Single-Walled Carbon Nanotubes[J]. Rsc Advances, 2013, 3(16): 5577-5582. DOI:10.1039/c3ra20847h |
| [24] |
Sun H, Kwan C K, Suvorova A, et al. Catalytic Oxidation of Organic Pollutants on Pristine and Surface Nitrogen-Modified Carbon Nanotubes with Sulfate Radicals[J]. Applied Catalysis B:Environmental, 2014, 154: 134-141. |
| [25] |
Duan X, Ao Z, Sun H, et al. Nitrogen-Doped Graphene for Generation and Evolution of Reactive Radicals by Metal-Free Catalysis[J]. ACS Applied Materials & Interfaces, 2015, 7(7): 4169-4178. |
| [26] |
Hu P, Su H, Chen Z, et al. Selective Degradation of Organic Pollutants Using an Efficient Metal-Free Catalyst Derived from Carbonized Polypyrrole Via Peroxymonosulfate Activation[J]. Environmental Science & Technology, 2017, 51(19): 11288-11296. |
| [27] |
Liu G, Liu Y, Zhang X, et al. Characterization and Catalytic Performance of Porous Carbon Prepared Using in Situ-Formed Aluminophosphate Framework as Template[J]. Journal of Colloid and Interface Science, 2010, 342(2): 467-473. DOI:10.1016/j.jcis.2009.10.036 |
| [28] |
Rao C V, Cabrera C R, Ishikawa Y. In Search of the Active Site in Nitrogen-Doped Carbon Nanotube Electrodes for the Oxygen Reduction Reaction[J]. The Journal of Physical Chemistry Letters, 2010, 1(18): 2622-2627. DOI:10.1021/jz100971v |
| [29] |
Vazquez-Santos M B, Geissler E, László K, et al. Graphitization of Highly Porous Carbons Derived from Poly (P-Phenylene Benzobisoxazole)[J]. Carbon, 2012, 50(8): 2929-2940. DOI:10.1016/j.carbon.2012.02.062 |
| [30] |
Ferrari A C, Basko D M. Raman Spectroscopy as a Versatile Tool for Studying the Properties of Graphene[J]. Nature Nanotechnology, 2013, 8(4): 235-246. DOI:10.1038/nnano.2013.46 |
| [31] |
Cheng Z, Pan Q, Rempel G L. Modification of Multiwall Carbon Nanotubes via Soap Free Emulsion Polymerization of Acrylonitrile[J]. Journal of Polymer Science:Part A:Polymer Chemistry, 2010, 48(10): 2057-2062. DOI:10.1002/pola.23969 |
| [32] |
Long J, Xie X, Xu J, et al. Nitrogen-Doped Graphene Nanosheets as Metal-Free Catalysts for Aerobic Selective Oxidation of Benzylic Alcohols[J]. Acs Catalysis, 2012, 2(4): 622-631. DOI:10.1021/cs3000396 |
| [33] |
Xu Y, Mo Y, Tian J, et al. The Synergistic Effect of Graphitic N and Pyrrolic N for the Enhanced Photocatalytic Performance of Nitrogen-Doped Graphene/TiO2 Nanocomposites[J]. Applied Catalysis B:Environmental, 2016, 181: 810-817. DOI:10.1016/j.apcatb.2015.08.049 |
| [34] |
Liu N, Zhang L, Xue Y, et al. Nitrogen-Doped Carbon Material as a Catalyst for the Degradation of Direct Red 23 Based on Persulfate Oxidation[J]. Separation and Purification Technology, 2017, 184: 213-219. DOI:10.1016/j.seppur.2017.04.045 |
| [35] |
Duan X, Ao Z, Li D, et al. Surface-Tailored Nanodiamonds as Excellent Metal-Free Matalysts for Organic Oxidation[J]. Carbon, 2016, 103: 404-411. DOI:10.1016/j.carbon.2016.03.034 |
| [36] |
Hu P, Long M, Bai X, et al. Monolithic Cobalt-Doped Carbon Aerogel for Efficient Catalytic Activation of Peroxymonosulfate in Water[J]. Journal of Hazardous Materials, 2017, 332: 195-204. DOI:10.1016/j.jhazmat.2017.03.010 |
| [37] |
Yao Y, Chen H, Lian C, et al. Fe, Co, Ni Nanocrystals Encapsulated in Nitrogen-Doped Carbon Nanotubes as Fenton-Like Catalysts for Organic Pollutant Removal[J]. Journal of Hazardous Materials, 2016, 314: 129-139. DOI:10.1016/j.jhazmat.2016.03.089 |
| [38] |
Cheng X, Guo H, Zhang Y, et al. Non-Photochemical Production of Singlet Oxygen via Activation of Persulfate by Carbon Nanotubes[J]. Water Research, 2017, 113: 80-88. |


