2. 区域污染环境生态修复教育部重点实验室(沈阳大学), 沈阳 110044
2. Key Laboratory of Eco-Restoration of Regional Contaminated Environment(Shenyang University), Ministry of Education, Shenyang 110044, China
0 引言
环境内分泌干扰物能够模仿或干扰生物体内自身激素作用,并对生物体的生殖、神经和免疫系统等功能产生恶劣影响[1]。17β-雌二醇(E2)作为一种天然类固醇雌激素,与许多生理过程密切相关[2]; 但其同时也是一种环境内分泌干扰物,主要通过牲畜粪便和污水排放进入水体环境进而进入生物体内干扰其正常的内分泌功能,且即使是在较低的质量浓度下也可对生物体造成毒害作用[3-8]。
目前,E2常用的检测方法主要包括: 1)色谱法,分为高效液相色谱法(HPLC)[9-10]、液相色谱-质谱联用法(LC-MS)[11-12]和气相色谱-质谱联用法(GC-MS)[13-14]。虽然色谱法能达到较高的灵敏度,但检测仪器比较昂贵,需专业人员操作,且检测时间较长,又由于环境中E2含量相对较低,基底较为复杂,必须要采用萃取的方式对样品进行预处理,所以该方法不适于大规模现场检测样品。2)免疫分析法,主要分为酶联免疫测定法(ELISA)[15]、化学发光免疫分析法(CLEIA)[16]和免疫芯片检测方法[17]等。此类方法灵敏度高,但缺乏特异性,且对外界环境的抗干扰能力较弱。3)电化学分析法[18-20],该方法操作简单、灵敏度高,但实验的特异性、重现性相对较弱;另外,雌二醇本身电活性相对较弱,该方法在检测过程中对氧化电位要求较高,且可能存在电极钝化的现象。因此,开发一种简单、快速、灵敏度高、特异性好,且可实现现场检测雌二醇的方法非常有必要。
核酸适配体(aptamer)是用配体指数富集法系统进化(SELEX)技术筛选获得的寡聚核苷酸片段(包括DNA或RNA),通常由25~80个碱基组成,具有亲和性强、特异性高、合成简单、稳定性好等优点[21-22]。基于核酸适配体作为分子识别元素的传感器表现出广阔的应用前景。目前,核酸适配体传感器已被广泛应用于金属离子、有机分子、胺肽、蛋白质,以及整个细胞等的检测,且皆表现出良好的检测效果[23-25]。
石墨纳米颗粒(GN)是粒径为5 nm的球形碳纳米颗粒,由石墨烯片层层堆叠而成,具有大小均匀、比表面积大、合成简单、成本低及表面可修饰等特点,且已被证明对荧光染料有良好的淬灭特性,可作为新型纳米淬灭基团[26-27]。
本实验采用1-芘丁酸N-羟基琥珀酰亚胺酯(1-Pyrenebutyric acid N-hydroxysuccini-mide ester,Pyrene-NHS ester)作为异型双功能交联剂,把荧光标记的核酸适配体固定到GN表面,基于荧光共振能量转移的原理构建新型荧光纳米探针,以实现E2的快速、特异性检测。
1 材料与方法 1.1 实验材料17β-雌二醇(E2,≥98%)、Trizma盐酸盐(Tris-HCl,≥99%)、氯化钠(NaCl,≥98%)、氯化镁六水合物(MgCl2·6H2O,≥99.0%)、氯化钾(KCl,≥99%)、二甲基亚砜(DMSO,≥98%)购于西格玛奥德里奇(上海)贸易有限公司;石墨纳米颗粒(93%,比表面积540~650 m2/g,平均粒径大小3~4 nm)购于Sky Spring纳米材料公司(美国);特异性识别E2的核酸适配体序列为5’-6羧基荧光素(FAM)-AAGGGATGCCGTTTGGGCCCAA-GTTCGGCATAGTG -NH2 -3’, 由上海生工生物工程有限公司合成。所有检测实验均在缓冲溶液(100 mmol/L Tris-HCl, 200 mmol/L NaCl, 25 mmol/L KCl和10 mmol/L MgCl2·6H2O, pH=8.0)中进行。
1.2 核酸适配体功能化石墨纳米颗粒荧光探针的制备将5 nmol核酸适配体和50倍过量核酸适配体的Pyrene-NHS ester(母液配制在DMSO中)加入到缓冲盐(Na2CO3/NaHCO3, pH=9.0)中,最终反应体系为150 μL。充分混匀后,设置摇床温度为25 ℃,在转速为200 r/min条件下,将上述混合溶液在摇床内避光震荡培养16 h。混合液中过量的Pyrene-NHS ester采用PD10-Column技术分离去除,并将纯化后的溶液置于真空干燥箱中干燥,得到Pyrene官能团化的核酸适配体(Pyr/aptamer),最后用超纯水配制成母液并在-20 ℃条件下储存备用。
荧光探针制备前先取少量Pyr/aptamer溶液进行紫外-可见吸收分光光度计(UV-2600,日本,岛津公司)定性分析。然后取200 μL GN(1 mg/mL)溶液和25 μL Pyr/aptamer(40 μmol/L)溶液加入到超纯水中,使最终反应体系达到1 mL。充分混匀后,设置摇床温度为25 ℃,在转速为200 r/min的条件下,将上述混合溶液在摇床内避光震荡培养2 h。反应后的混合溶液用超速离心机在13 000 r/min的转速条件下,使用超纯水彻底离心洗涤4次,去除上清液中过量的未反应的Pyr/aptamer溶液,然后用超纯水将剩余溶液定容至1 mL,即得到核酸适配体功能化石墨纳米颗粒荧光探针(GN/Pyr/aptamer),并在4 ℃条件下保存。
2 结果与讨论 2.1 荧光共振能量转移特性分析对实验所用的GN进行了透射电镜(TEM)(JEM-2200FS, 日本)表征。如图 1所示,从透射电镜图可以看出GN的粒径大小约为4 nm,并具有球形结构。

|
| 图 1 GN的透射电镜图 Fig. 1 TEM image of GN |
|
|
荧光共振能量转移(fluorescence resonance energy transfer,FRET)是两个荧光基团中一个荧光基团(供体)的发射光谱与另一个基团(受体)的吸收光谱有一定的重叠,且当两个基团的距离接近(一般小于10 nm)时,能量即可由供体向受体转移,发生供体荧光减弱或完全淬灭的现象[28]。为验证纳米荧光探针的初始状态是淬灭状态,实验中采用紫外-可见吸收分光光度计和荧光分光光度计定性分析GN与FAM的化学特性和光学特性。根据GN的吸收光谱与FAM的发射光谱的重叠程度,分析GN与FAM之间荧光共振能量转移的可能性。如图 2所示,GN的吸收光谱与FAM的发射光谱之间部分重叠,表明GN可以成为FAM的能量转移受体,产生荧光共振能量转移现象。

|
| 图 2 GN的吸收光谱与FAM的发射光谱 Fig. 2 Absorption spectra of GN and Fluorescence spectra of FAM |
|
|
首先核酸适配体的3’端修饰的NH2与Pyrene-NHS ester的N-羟基琥珀酰亚胺酯键结合,得到Pyr/aptamer;然后,GN和Pyr/aptamer上的Pyrene通过π-π堆积作用,将核酸适配体固定在GN表面形成GN/Pyr/aptamer。而GN和Pyrene的π-π堆积作用可使FAM和GN之间的距离拉近,促使两者发生荧光能量转移现象,导致FAM的荧光信号被GN淬灭;当E2存在时,核酸适配体与E2的特异性结合引起核酸适配体构型的变化,导致了FAM远离GN表面,FAM荧光恢复,从而实现对E2的特异性检测。
为验证核酸适配体是否成功固定在GN的表面,本实验采用紫外-可见吸收光谱分析法分析其相对应的吸收光谱图。如图 3所示:单纯的GN无明显的特征吸收峰;游离核酸适配体在260,460和490 nm左右均有明显的特征吸收峰,其中260 nm对应DNA的特征吸收峰,460 nm和490 nm处对应FAM的特征吸收峰;相比较游离的核酸适配体,Pyr/aptamer在322 nm和341 nm左右出现新的特征吸收峰,该峰对应Pyrene的特征吸收峰,说明核酸适配体和Pyrene-NHS ester成功偶联;而相比较单纯的GN,GN/Pyr/aptamer在260 nm处呈现出一个较宽的肩峰,说明Pyr/aptamer成功结合到了GN表面,但GN/Pyr/aptamer并未表现出Pyrene和FAM的特征吸收峰,原因可能是GN掩盖了Pyrene和FAM的吸收光谱图,所以GN/Pyr/aptamer复合物的紫外吸收光谱图上没有出现Pyrene和FAM的特征吸收峰。
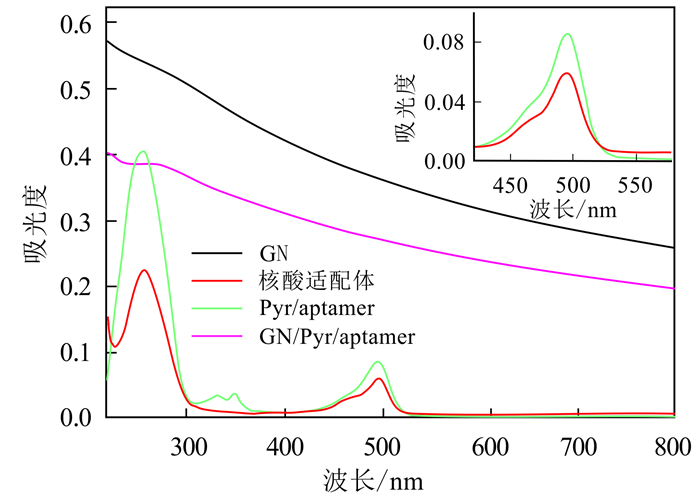
|
| 图 3 GN, 核酸适配体, Pyr/aptamer, GN/Pyr/aptamer的紫外-可见吸收光谱图 Fig. 3 UV-vis absorption spectra of GN, aptamer, Pyr/aptamer and GN/Pyr/aptamer |
|
|
为获得最佳的E2检测效果,本实验探究了核酸适配体和GN/Pyr/aptamer的投加量对E2(50 ng/mL)检测效果的影响。E2的检测效果用相对荧光强度表示,计算公式如下:
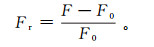
式中:Fr代表相对荧光强度;F0、F分别代表E2投加前、投加后的荧光信号强度;F-F0代表荧光恢复量。
2.3.1 GN/Pyr/aptamer投加量对E2检测效果的影响分别投加质量浓度为2 μg/mL和4 μg/mL的GN/Pyr/aptamer,其对E2检测效果的影响见图 4。由图 4可知,当GN/Pyr/aptamer的投加量为4 μg/mL时,相对荧光强度为0.14,是2 μg/mL(0.08)时的1.75倍。原因可能是,GN/Pyr/aptamer质量浓度较低时,检测相同质量浓度的E2,能够特异性识别E2的GN/Pyr/aptamer的量有限,即荧光恢复量相对较低,所以相对荧光强度也较低。但探针浓度较高时,本底荧光强度(未投加E2时的荧光信号强度)可能会增加。由图 4中的角图可知,GN/Pyr/aptamer的投加量为4 μg/mL时,本底荧光强度是2 μg/mL时的3.3倍;所以为防止本底荧光强度增加过大造成实验误差增加,后续E2检测时,荧光探针的投加量采用4 μg/mL。
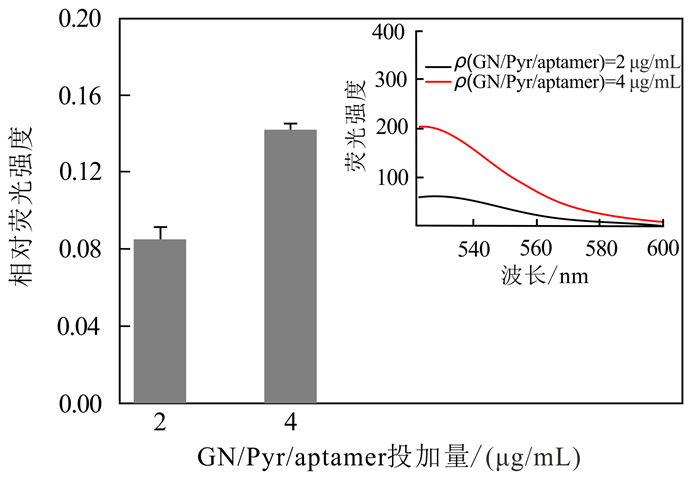
|
| 图 4 GN/Pyr/aptamer的投加量对E2检测的影响 Fig. 4 E2 detection profiles depending on the change of GN/aptamer concentration |
|
|
不同质量浓度核酸适配体对E2检测效果的影响见图 5。由图 5可见:核酸适配体投加量在0.2~1.0 μmol/L范围内时,相对荧光强度随着核酸适配体投加量的增加而增加;当核酸适配体的投加量为5.0 μmol/L时,相对荧光强度反而大幅度降低。原因可能是在核酸适配体浓度较低时(如0.2 μmol/L),构建的GN/Pyr/aptamer探针单个GN表面上核酸适配体的数量有限,GN表面裸露的区域可能会非特异性吸附E2,导致核酸适配体特异性识别E2的量减少,使得相对荧光强度较低;当核酸适配体浓度逐渐增加至1.0 μmol/L时,GN表面核酸适配体的数量增加,从而特异性识别E2的量增加,相对荧光强度升高;当采用5.0 μmol/L的核酸适配体构建GN/Pyr/aptamer探针时,单个GN表面核酸适配体数量过多,核酸适配体特异性识别E2后发生结构变化时相邻核酸适配体空间位阻增加,该现象不利于荧光信号的恢复,进而导致相对荧光强度大幅度降低。所以为获得较高的相对荧光强度,后续实验选择1.0 μmol/L核酸适配体构建的GN/Pyr/aptamer探针进行E2检测。

|
| 图 5 核酸适配体浓度对E2检测的影响 Fig. 5 E2 detection profiles depending on the change of aptamer concentration |
|
|
首先在2 mL的离心管中加入不同质量浓度的E2,使得检测体系中E2的最终质量浓度分别达到0、50、100、200、400、500、800 ng/mL;然后取4 μg/mL GN/Pyr/aptamer分别加入上述离心管中,充分混匀后,将其置于25 ℃,200 r/min转速条件下的摇床内反应15 min;最后将反应后的溶液转移到1 cm的石英比色皿中,用荧光分光光度计(RF-5301,日本,岛津公司)进行荧光光谱扫描(激发波长为492 nm,发射波长为525 nm,激发和发射狭缝均为15 nm)。检测实验均设置3个平行样以保证数据的准确性和可靠性。
该荧光探针对E2的检测性能结果见图 6。如图 6所示,E2的质量浓度由0 ng/mL逐渐增加到800 ng/mL时,体系的荧光强度随着E2质量浓度的增加逐渐增强。且在50到800 ng/mL范围内,相对荧光强度与E2浓度成正比,方程关系式为y = 0.0004x + 0.0862 (R2 = 0.975 1, R为相关系数)(S/N = 3, S为信号值,N为噪音值)[29-30]。
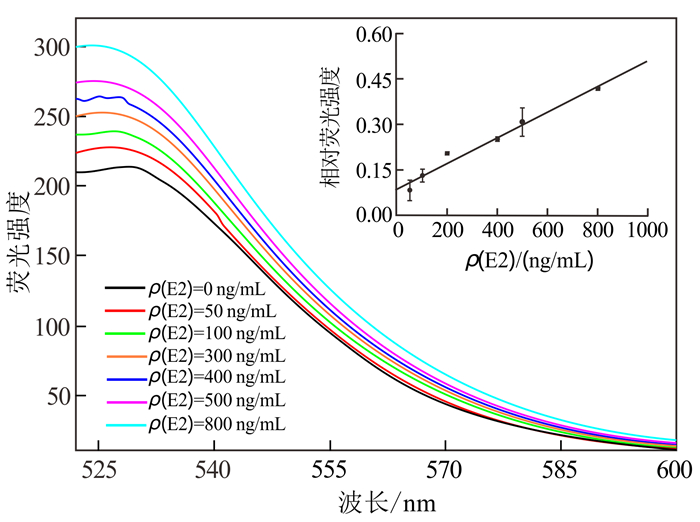
|
| 图 6 不同E2质量浓度下荧光光谱图 Fig. 6 Fluorescence spectrum of developed system with different concentrations of E2 (0~800 ng/mL) |
|
|
本研究方法与其他E2检测方法结果对比见表 1。由表 1可见, 检测限为0.80×10-7 mol/L(即34.5 ng/mL), 表明该方法具有相对较高的灵敏度。
通过评估GN/Pyr/aptamer对干扰物双酚A (BPA)和炔雌醇(EE)的响应来判断其对E2的选择特异性。在相同实验条件下,GN/Pyr/aptamer分别检测质量浓度为100 ng/mL的BPA和EE与50 ng/mL E2的相对荧光强度见图 7。如图 7所示,探针在检测干扰物BPA和EE时,相对荧光强度很低;而在检测质量浓度只有干扰物质量浓度一半的目标分子E2时,相对荧光强度却明显高于干扰物,表明探针对目标分子E2有很强的选择性。
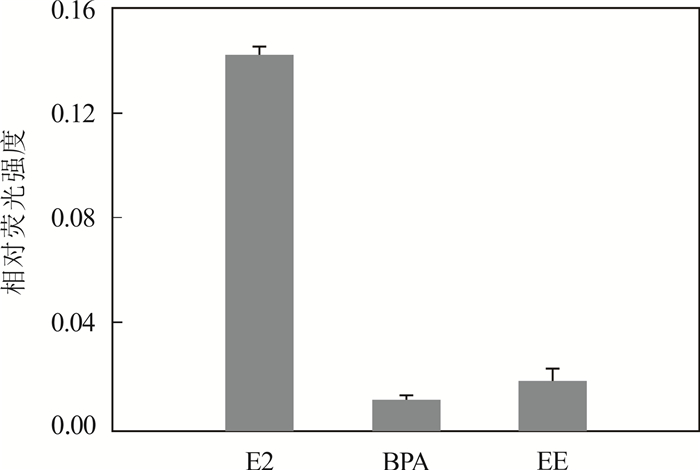
|
| 图 7 GN/Pyr/aptamer检测特异性 Fig. 7 Specificity of GN/Pyr/aptamer probe |
|
|
为评价本方法检测E2质量浓度的可靠性,我们分别利用本检测方法与通用的高效液相色谱法对E2进行检测,对其效果做了对比。结果表明:对于E2质量浓度为300、500、800 ng/mL的加标水样,本实验方法对E2的回收率分别为101.30%、102.44%和97.92%,相对标准偏差分别为2.28%、5.72%和2.58%;相同水样,高效液相色谱法回收率分别为107.6%、97.13%和99.1%,相对标准偏差分别为3.07%、1.44%和3.64%。由此可见与通用检测方法对比,本检测方法对E2的检测结果是可靠的。
3 结论1) 核酸适配体浓度为1.0 μmol/L时构建的GN/Pyr/aptamer,在投加量为4 μg/mL时,可取得最佳的E2检测效果。
2) GN/Pyr/aptamer在最佳实验条件下检测E2时,荧光强度随着E2质量浓度的增加逐渐增强,且相对荧光强度与E2的质量浓度在50~800 ng/mL范围内成正比,检测限为34.5 ng/mL。
3) 该荧光探针制备简单,操作方便,且在其他环境干扰物存在条件下,荧光探针仍能实现对E2的快速、特异性检测,表明其具有适应复杂水体的性能和检测复杂水体系的适用性,并具有与高效液相色谱法等常规E2检测方法同样的准确性和可靠性。
| [1] |
Kajta M, Wójtowicz A K. Impact of Endocrine-Disrupting Chemicals on Neural Development and the Onset of Neurological Disorders[J]. Pharmacological Reports, 2013, 65(6): 1632-1639. DOI:10.1016/S1734-1140(13)71524-X |
| [2] |
Maume D, Deceuninck Y, Pouponneau K, et al. Assessment of Estradiol and Its Metabolites in Meat[J]. Apmis, 2001, 109(1): 32-38. DOI:10.1111/apm.2001.109.issue-1 |
| [3] |
杨悦锁, 张戈, 宋晓明, 等. 地下水和土壤环境中雌激素运移和归宿的研究进展[J]. 吉林大学学报(地球科学版), 2016, 46(4): 1176-1190. Yang Yuesuo, Zhang Ge, Song Xiaoming, et al. Transport and Fate of Estrogens in Soil and Groundwater:A Critical Review[J]. Journal of Jilin University (Earth Science Edition), 2016, 46(4): 1176-1190. |
| [4] |
Fan L F, Zhao G H, Shi H J, et al. A Simple and Label-Free Aptasensor Based on Nickel Hexacyanoferrate Nanoparticles as Signal Probe for Highly Sensitive Detection of 17β-Estradiol[J]. Biosensors and Bioelectronics, 2015, 68: 303-309. DOI:10.1016/j.bios.2015.01.015 |
| [5] |
Stanczyk F Z, Archer D F, Bhavnani B R. Ethinyl Estradiol and 17β-Estradiol in Combined Oral Contraceptives:Pharmacokinetics, Pharmacodynamics and Risk Assessment[J]. Contraception, 2013, 87(6): 706-727. DOI:10.1016/j.contraception.2012.12.011 |
| [6] |
Qin L Q, Wang P Y, Kaneko T, et al. Estrogen:One of the Risk Factors in Milk for Prostate Cancer[J]. Medical Hypotheses, 2004, 62(1): 133-142. DOI:10.1016/S0306-9877(03)00295-0 |
| [7] |
Fan Z L, Hu J L, An W, et al. Detection and Occurrence of Chlorinated Byproducts of Bisphenol A, Nonylphenol, and Estrogens in Drinking Water of China:Comparison to the Parent Compounds[J]. Environmental Science Technology, 2013, 47(19): 10841-10850. DOI:10.1021/es401504a |
| [8] |
Mohammed A, 杨悦锁, 杜新强, 等. 内分泌干扰物的环境危害:雌激素及其硫酸盐在土壤中的吸附规律[J]. 吉林大学学报(地球科学版), 2013, 43(2): 573-581. Mohammed A, Yang Yuesuo, Du Xinqiang, et al. Environmental Risk of EDC:Estrone and Its Sulphate Conjugate's Sorption from Mediator Solution in Soils of Nasarawa State of Nigeria[J]. Journal of Jilin University (Earth Science Edition), 2013, 43(2): 573-581. |
| [9] |
Yoon Y, Westerhof P, Snyder S A, et al. HPLC-Fluorescence Detection and Adsorption of Bisphenol A, 17β-Estradiol, and 17α-Ethynyl Estradiol on Powdered Activated Carbon[J]. Water Research, 2003, 37(14): 3530-3537. DOI:10.1016/S0043-1354(03)00239-2 |
| [10] |
Shi Y, Peng D D, Shi C H, et al. Selective Determination of Trace 17β-Estradiol in Dairy and Meat Samples by Molecularly Imprinted Solid-Phase Extraction and HPLC[J]. Food Chemistry, 2011, 126(4): 1916-1925. DOI:10.1016/j.foodchem.2010.12.020 |
| [11] |
Wang Q L, Zhang A Z, Pan X, et al. Simultaneous Determination of Sex Hormones in Egg Products by ZnCl2 Depositing Lipid, Solid-Phase Extraction and Ultra Performance Liquid Chromatography/Electrospray Ionization Tandem Mass Spectrometry[J]. Analytica Chimica Acta, 2010, 678(1): 108-116. DOI:10.1016/j.aca.2010.08.014 |
| [12] |
Xu C L, Chu X G, Peng C F, et al. Development of a Faster Determination of 10 Anabolic Steroids Residues in Animal Muscle Tissues by Liquid Chromatography Tandem Mass Spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 2006, 41(2): 616-621. DOI:10.1016/j.jpba.2005.11.033 |
| [13] |
Choi M H, Kim K R, Chung B C. Determination of Estrone and 17β-Estradiol in Human Hair by Gas Chromatography-Mass Spectrometry[J]. Analyst, 2000, 125(4): 711-714. DOI:10.1039/a909107f |
| [14] |
Tsakalof A K, Gkagtzis D C, Koukoulis G N, et al. Development of GC-MS/MS Method with Programmable Temperature Vaporization Large Volume Injection for Monitoring of 17β-Estradiol and 2-Methoxyestradiol in Plasma[J]. Analytica Chimica Acta, 2012, 709: 73-80. DOI:10.1016/j.aca.2011.09.043 |
| [15] |
Draisci R, Volpe G, Compagnone D, et al. Development of an Electrochemical ELISA for the Screening of 17β-Estradiol and Application to Bovine Serum[J]. Analyst, 2000, 125(8): 1419-1423. DOI:10.1039/b003176n |
| [16] |
Xin T B, Wang X, Jin H, et al. Development of Magnetic Particle-Based Chemiluminescence Enzyme Immunoassay for the Detection of 17β-Estradiol in Environmental Water[J]. Applied Biochemistry and Biotechnology, 2009, 158(3): 582-594. DOI:10.1007/s12010-008-8356-3 |
| [17] |
Gao Z X, Liu N, Cao Q L, et al. Immunochip for the Detection of Five Kinds of Chemicals:Atrazine, Nonylphenol, 17-Beta Estradiol, Paraverine and Chloramphenicol[J]. Biosensors and Bioelectronics, 2009, 24(5): 1445-1450. DOI:10.1016/j.bios.2008.08.037 |
| [18] |
Hu L T, Cheng Q, Chen D C, et al. Liquid-Phase Exfoliated Graphene as Highly-Sensitive Sensor for Simultaneous Determination of Endocrine Disruptors:Diethylstilbestrol and Estradiol[J]. Journal of Hazardous Materials, 2015, 283: 157-163. DOI:10.1016/j.jhazmat.2014.08.067 |
| [19] |
Song J C, Yang J, Hu X M. Electrochemical Determination of Estradiol Using a Poly(l-Serine) Film-Modified Electrode[J]. Journal of Applied Electrochemistry, 2008, 38(6): 833-836. DOI:10.1007/s10800-008-9520-8 |
| [20] |
Janegitz B C, Santos F A, Faria R C, et al. Electrochemical Determination of Estradiol Using a Thin Film Containing Reduced Graphene Oxide and Dihexadecylphosphate[J]. Materials Science and Engineering C, 2014, 37: 14-19. DOI:10.1016/j.msec.2013.12.026 |
| [21] |
Ellington A D, Szostak J W. In Vitro Selection of RNA Molecules that Bind Specific Ligands[J]. Nature, 346: 818-822. DOI:10.1038/346818a0 |
| [22] |
Song S P, Wang L H, Li J, et al. Aptamer-Based Biosensors[J]. TrAC Trends in Analytical Chemistry, 2008, 27(2): 108-117. DOI:10.1016/j.trac.2007.12.004 |
| [23] |
Li J J, You J, Dai Y, et al. Gadolinium Oxide Nanoparticles and Aptamer-Functionalized Silver Nanoclusters-Based Multimodal Molecular Imaging Nanoprobe for Optical/Magnetic Resonance Cancer Cell Imaging[J]. Analytical Chemistry, 2014, 86(22): 11306-11311. DOI:10.1021/ac503026d |
| [24] |
Roushani M, Shahdostfard F. A Highly Selective and Sensitive Cocaine Aptasensor Based on Covalent Attachment of the Aptamer-Functionalized AuNPs onto Nanocomposite as the Support Platform[J]. Analytica Chimica Acta, 2015, 853(1): 214-221. |
| [25] |
Liu F, Ha H D, Han D J, et al. Photoluminescent Graphene Oxide Microarray for Multiplex Heavy Metal Ion Analysis[J]. Small, 2013, 9(20): 3410-3414. DOI:10.1002/smll.v9.20 |
| [26] |
Piao Y X, Liu F, Seo T S. A Novel Molecular Beacon Bearing a Graphite Nanoparticle as a Nanoquencher for in Situ mRNA Detection in Cancer Cells[J]. ACS Applied Materials Interfaces, 2012, 4(12): 6785-6789. DOI:10.1021/am301976r |
| [27] |
Piao Y X, Liu F, Seo T S. Highly Conductive Graphite Nanoparticle Based Enzyme Biosensor for Electrochemical Glucose Detection[J]. Sensors and Actuators B Chemical, 2014, 194: 454-459. DOI:10.1016/j.snb.2013.12.045 |
| [28] |
Sapsford K E, Berti L, Medintz I L. Materials for Fluorescence Resonance Energy Transfer Analysis:Beyond Traditional Donor-Acceptor Combinations[J]. Angewandte Chemie International Edition, 2006, 45(28): 4562-4589. DOI:10.1002/(ISSN)1521-3773 |
| [29] |
Lee E H, Lim H J, Lee S D, et al. Highly Sensitive Detection of Bisphenol A by Nano Aptamer Assaywith Truncated Aptamer[J]. ACS Applied Materials Interfaces, 2017, 9(17): 14889-14898. DOI:10.1021/acsami.7b02377 |
| [30] |
Shrivastava A, Gupta V B. Methods for the Determination of Limit of Detection and Limit of Quantitation of the Analytical Methods[J]. Drug Discovery and Therapeutics, 2011, 2(1): 21-25. |
| [31] |
Stafiej A, Pyrzynska K, Regan F. Determination of Anti-Inflammatory Drugs and Estrogens in Water by HPLC with UV Detection[J]. Journal of Separation Science, 2015, 30(7): 985-991. |
| [32] |
Salci B, Biryol I. Voltammetric Investigation of β-Estradiol[J]. Journal of Pharmaceutical Biomedical Analysis, 2002, 28(3): 753-759. |
| [33] |
孙思明, 周焕英, 房彦军, 等. 雌二醇的免疫胶体金试纸法检测[J]. 中国公共卫生, 2007, 23(1): 126-127. Sun Siming, Zhou Huanying, Fang Yanjun, et al. Detection of Estradiol by Immune Colloidal-Gold Strips Method[J]. Chinese Journal of Public Health, 2007, 23(1): 126-127. DOI:10.3321/j.issn:1001-0580.2007.01.070 |


