2. 地下水资源与环境教育部重点实验室(吉林大学), 长春 130021;
3. 逢甲大学理学院环境工程与环境科学学系, 台湾 台中 407
2. Key Laboratory of Groundwater Resources and Environment(Jilin University), Ministry of Education, Changchun 130021, China;
3. Department of Environment Engineering and Science, Feng Chia University, Taizhong 407, Taiwan, China
0 引言
镉是自然环境中的一种重金属元素,主要存在于硫镉矿、锌矿当中[1]。镉地下水污染主要来源于冶金、采矿、机械和电镀工业等部门生产和废水排放时的非人为性和人为性泄漏[1-3]。镉属于高毒性重金属元素,排在联合国环境规划署曾经提出的12种具有全球性意义的危险化学物质中的首位[2, 4]。镉不是人体的必需元素,它通过食物链直接或间接地进入人体内而累积,最终引起镉中毒[3]。目前,在污水处理和污染地下水处理中, 镉的处理方法主要有物理处理技术、化学处理技术和生物处理技术等[2, 5];但是,这些方法有一定的局限性,如体系复杂、成本高昂、同时对环境可能存在二次污染等。
电容去离子化(CDI)是一种常用的水处理方法[6],多用于污水处理、海水淡化等[7]。它利用大比表面积的导电材料制备电极,通电形成电场[8],在正极表面吸附溶液中的阴离子、在负极表面吸附溶液中的阳离子,从而使流过电极间的溶液淡化[6, 9-10]。CDI技术有别于一般耗能、高压的传统去离子之薄膜分离、电透析等程序[11-12],其能量利用率高、污染小、对低浓度的废水有很好的处理效果、易操作、系统亦具可逆性[13]、无二次污染物的问题[14-15]。因此,结合CDI对低浓度污染物去除的有效性、无二次污染和系统的可逆性,本文将CDI用于地下水中原位去除重金属镉,探讨镉初始质量浓度、体系供电电压和地下水中常见阳离子种类对CDI吸附镉的影响,以期为CDI原位修复地下水中的镉污染提供一定的理论基础和应用依据。
1 实验材料和方法 1.1 实验材料聚偏二氟乙烯(PVDF),涂料级,山东西亚化学工业有限公司;N-甲基吡啶烷酮(NMP),分析纯,天津光复化学试剂有限公司;活性炭(z70724505,卡尔冈炭素);镍泡沫板,0.3 mm×100.0 mm×100.0 mm,昆山嘉亿盛电子有限公司;氯化镉(CdCl2·2.5H2O),分析纯,国药集团化学试剂有限公司;无水氯化钠(NaCl),分析纯,国药集团化学试剂有限公司;氯化钙(CaCl2),分析纯,国药集团化学试剂有限公司;氯化镁(MgCl2·6H2O),分析纯,西陇科学股份有限公司。
1.2 实验装置BZF-30型真空干燥箱,达到真空度133 Pa,上海博迅;PL203型电子分析天平,精密度0.001 g,梅特勒-托利多国际贸易(上海)有限公司;RXN-305D型电源供应器(5 A, 30 V),深圳兆信电子仪器设备有限公司;DE-100 g型粉碎机,细度30~300目,浙江红景天工贸有限公司;BT100TJ型蠕动泵,保定兰格恒流泵有限公司;HQ40d型精密pH计,美国哈希股份有限公司;DDS-307A型精密电导率仪,测量范围0~100 mS/cm,上海雷磁仪器有限公司;PerkinElmer AAnlyst400型原子吸收光谱仪,美国铂金埃尔默股份有限公司;CDI反应槽(自制)。
1.3 电极的制备实验需制备活性炭质量分数为78.25%的电极。首先分别将活性炭、镍泡沫板置于去离子水中,放入120 ℃的烘箱中90 min,反复操作多次,去除活性炭、镍泡沫板表面的杂质; 然后将NMP加热到一定温度后,逐量加入PVDF,搅拌至PVDF完全溶解;再加入活性炭搅拌均匀,制备成电极材料混浆,将混浆均匀涂在镍泡沫板上;之后将刮好的电极板压实,依次将成形的电极放于55 ℃烘箱干燥12 h、55 ℃真空干燥箱真空干燥24 h;最终制成实验所用电容电极。
1.4 CDI反应槽的组装将制备成形的电极放入去离子水中浸泡24 h,以去除制备过程中残留在电极表面的杂质。将制备好的电极2个一组,两电极之间放置聚四氟乙烯绝缘网,组成电极对;再将电极对组合后放入CDI反应槽内。反应槽内共有6对反应电极。反应槽结构如图 1所示。
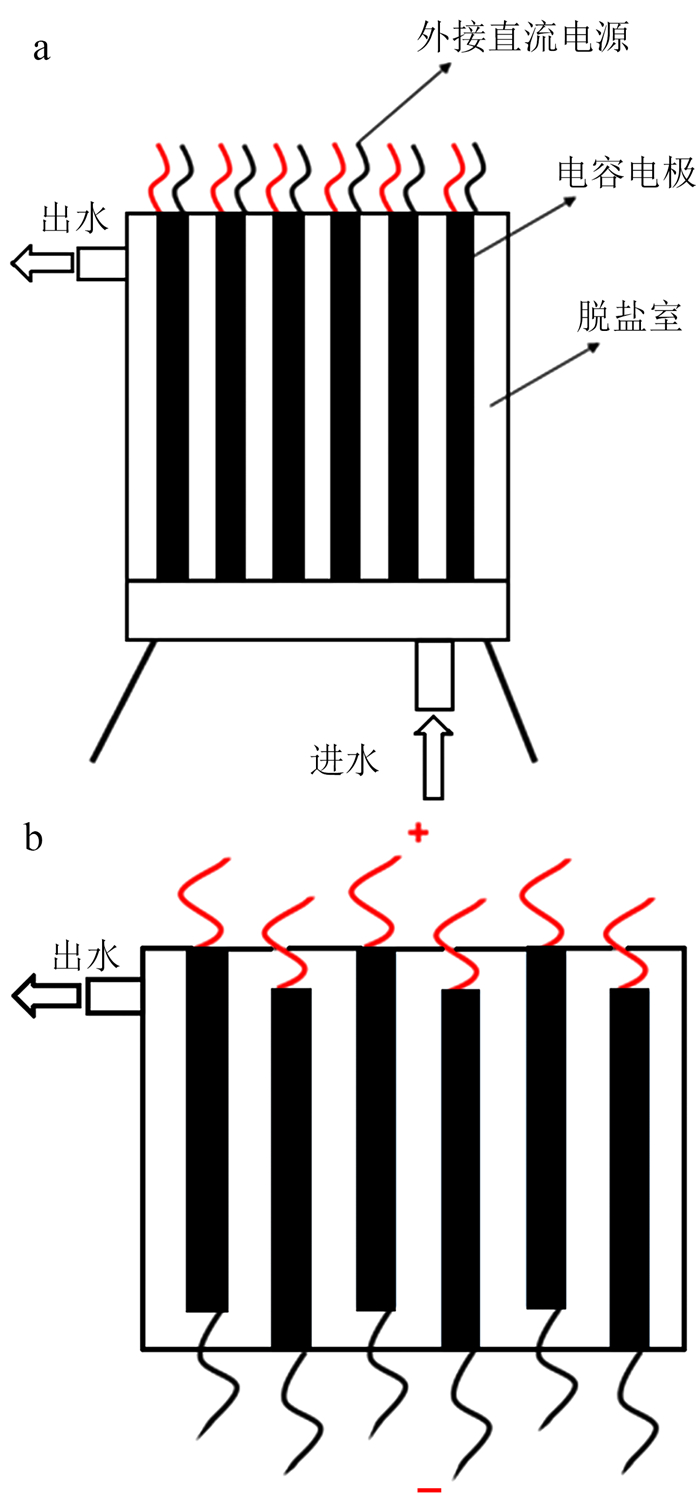
|
| a.主视图;b.俯视图。 图 1 CDI反应槽结构示意图 Fig. 1 Schematic diagram of CDI reactor structure |
|
|
首先配制1 000 mg/L的CdCl2母液,将CdCl2母液分别稀释至10、25、50、100、200 mg/L,以作为测定不同初始质量浓度时镉吸附量的吸附溶液。分别将吸附溶液放入CDI反应槽内,连接电源,供电电压设为2.5 V。在设定的时间点取样,测定CdCl2溶液的电导率;另取少量CdCl2溶液过0.45 mm滤膜,测定原子吸收光谱[4, 16-17]。
然后再配制1 000 mg/L的CdCl2母液,稀释至25 mg/L,以作为测定不同初始电压时镉吸附量的吸附溶液。将CdCl2溶液放入CDI反应槽内,连接电源,吸附时供电电压(E)分别设为1.6、2.0、2.5 V。
最后配制3个浓度为0.22 mmol/L的CdCl2溶液,向3个溶液中分别添加0.44 mmol/L的NaCl、0.22 mmol/L的CaCl2和MgCl2[18],测定3种溶液的初始电导率。依次将3种溶液置于CDI反应槽内,考虑到其他阳离子添加后可能发生的电水解。供电电压设为2.0 V。
对镉分别做吸附动力学和吸附等温线拟合。计算电极吸附量的公式为
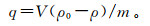 (1)
(1) 式中:q为电极的吸附量,mg/g;V为加入CdCl2溶液的体积,L;ρ0为CdCl2的初始质量浓度,mg/L;ρ为某时刻CdCl2的质量浓度,mg/L;m为电极中活性炭的质量,g。
镉的去除率(η)是指某一时刻溶液中被吸附的CdCl2质量浓度占溶液中CdCl2初始质量浓度的百分比。某时刻体系中镉去除率η的计算公式为
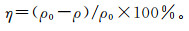 (2)
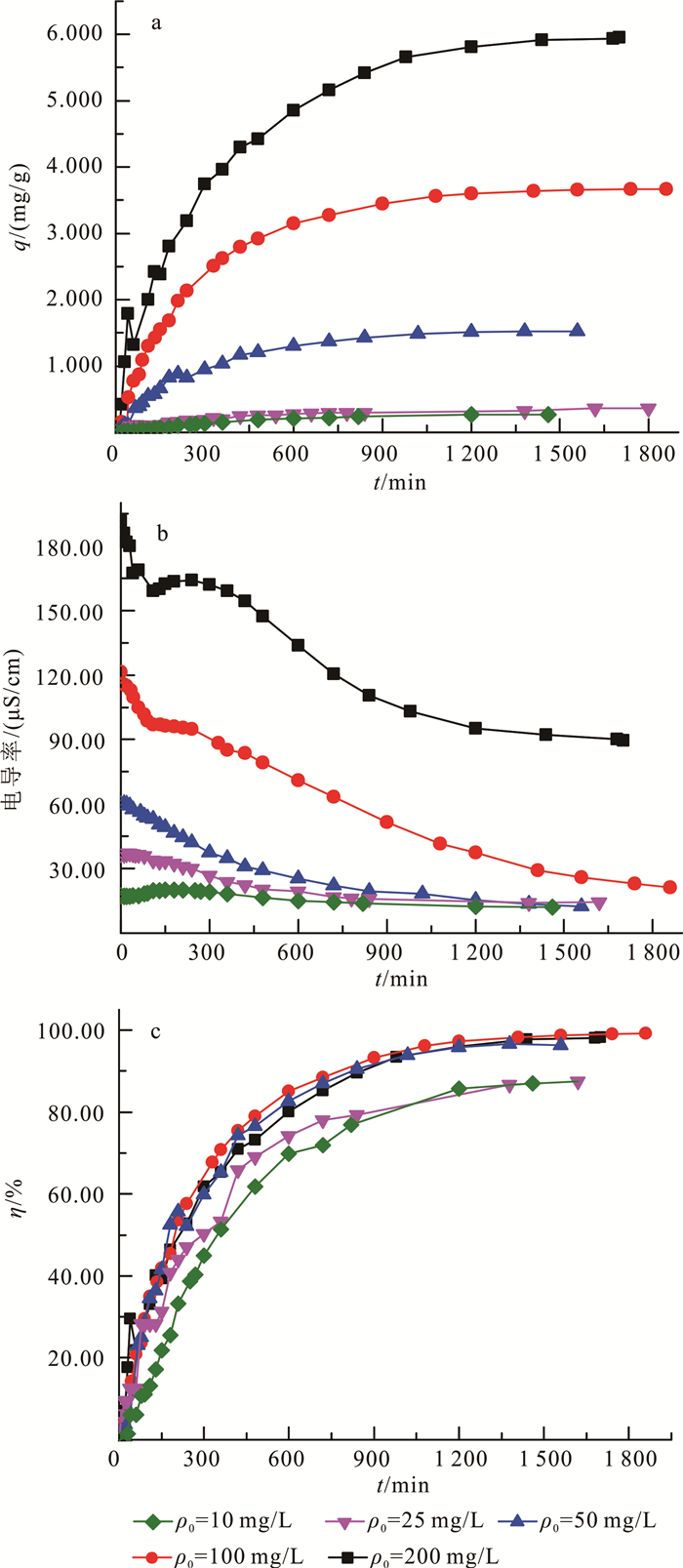
(2) 图 2a为CdCl2溶液不同初始质量浓度时单位电极镉的吸附量,由图 2a可以看出:吸附达到平衡时,CdCl2溶液初始质量浓度为10、25、50、100和200 mg/L体系电极的最终吸附量分别为0.268、0.368、1.550、3.680和5.951 mg/g,说明随溶液初始质量浓度的升高,电极的最终吸附量也逐渐升高。由图 2b(不同初始质量浓度时电导率变化图)可知,随着CdCl2溶液初始质量浓度的升高,溶液的初始电导率也增大;同时,在吸附的初始阶段溶液中镉的质量浓度越高,电导率也越大,在这个阶段镉的吸附速率也越快。随着吸附的进行,溶液中镉的质量浓度和电导率逐渐减小,镉的吸附速率也逐渐降低。这主要是因为:溶液的电导率与溶液中镉的质量浓度正相关,随着溶液中镉质量浓度的减小,溶液的电导率也减小;溶液的电导率在电容电极充电过程中对CDI吸附镉有着关键作用,较高的电导率可以促进CdCl2溶液中的Cl-和Cd2+分别向正负两极移动,增加离子在溶液中的传递效率,从而加快对镉的吸附速率,同时提升了电容电极的最终吸附量。此外,从图 2c(不同初始质量浓度时镉去除率图)可以看出,CdCl2溶液初始质量浓度为10、25、50、100、200 mg/L时,镉的最终去除率分别为87.02%、87.50%、98.38%、99.18%和98.12%;说明在一定质量浓度范围内,镉的最终去除率随初始质量浓度的增加而增加,当溶液初始质量浓度达到200 mg/L时,镉的最终去除率不再增加。
|
| 图 2 不同CdCl2溶液初始质量浓度时单位电极镉的吸附量(a)、溶液的电导率(b)和镉的去除率(c)变化 Fig. 2 Change of adsorption capacity per capacitor electrode of cadmium(a), conductivity of solution(b) and removal rate of cadmium (c) on different CdCl2 initial concentration |
|
|
图 3a为不同初始电压时镉的去除率图,从图 3a可以看出,在180~750 min之间:供电电压为2.5 V的体系,去除率出现了明显的快速上升趋势;而供电电压为1.6和2.0 V的体系随时间的延长,去除率一直处于几乎相同的平稳上升的趋势。说明当供电电压足够高时,电压会提高体系初始阶段的吸附速率。另外,从图 3b可以看出,在180~750 min之间:供电电压为2.5 V的体系,电导率出现了明显快速下降的趋势;而供电电压为1.6和2.0 V时的电导率一直处于平稳下降的趋势。溶液电导率与溶液质量浓度正相关,电导率在初始阶段的快速下降间接证明了当体系电压足够高时可以促进CDI吸附镉。这主要是因为:电压是CDI吸附镉的作用力,电压越高形成的电场强度越高;对于低质量浓度的CdCl2溶液,当体系电压足够高时,较高的电压会加速溶液中的阴阳离子向正负电极移动,提高体系初始阶段的吸附速率。此外,从图 3c可以看出,当电压分别为1.6、2.0、2.5 V,吸附达到平衡时,电极的最终吸附量相近,分别为0.357、0.361和0.368 mg/g,说明CDI吸附低质量浓度CdCl2时,电压不会对体系的最终吸附量产生影响。
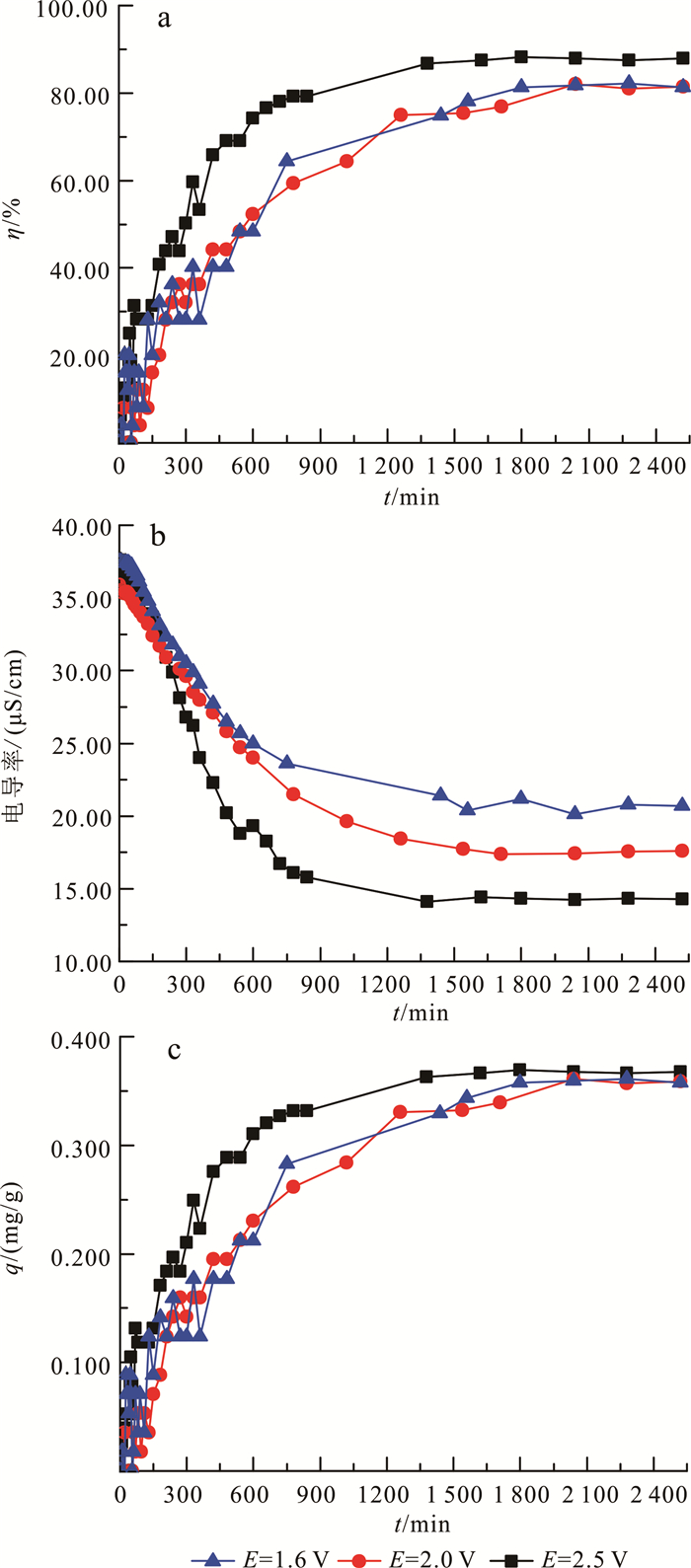
|
| 图 3 不同电压时镉的去除率(a)、溶液的电导率(b)和单位电极镉的吸附量(c)变化 Fig. 3 Change of removal rate of cadmium(a), conductivity of solution (b) and adsorption capacity per electrode of cadmium (c) on different voltage |
|
|
对CDI吸附镉做准二级吸附动力学拟合[5, 19]。准二级吸附动力学方程为
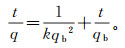 (4)
(4) 式中:t为时间,min;k为准二级吸附速率常数,g/(mg·min);qb为准二级动力学方程中的平衡吸附量,mg/g。
分别对数据进行线性拟合(图 4),由斜率和截距求出k和qb,得到R2(R为相关系数)的值(表 1)。
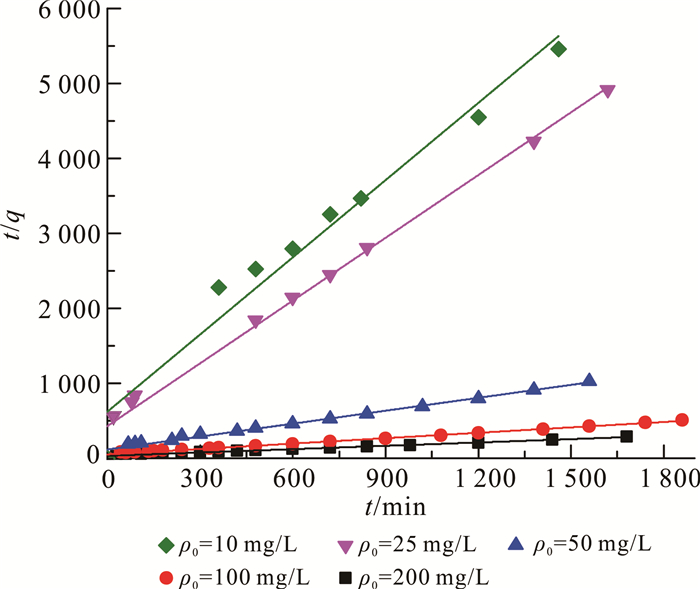
|
| 图 4 不同CdCl2溶液初始质量浓度时的准二级吸附动力学 Fig. 4 Quasi-secondary sorption kinetics on different CdCl2 initial concentration |
|
|
| ρ0/(mg/L) | 准二级 | qe/(mg/g) | ||
| R2 | k/(g/(mg·min)) | qb/(mg/g) | ||
| 10 | 0.953 | 1.900 | 0.29 | 0.268 |
| 25 | 0.988 | 1.820 | 0.36 | 0.368 |
| 50 | 0.989 | 0.298 | 1.72 | 1.550 |
| 100 | 0.990 | 0.111 | 4.17 | 3.680 |
| 200 | 0.984 | 0.069 | 6.71 | 5.951 |
| 注:qe为电容电极平衡时实际吸附量。 | ||||
从表 1中可以看出,质量浓度为25、50、100、200 mg/L时,R2均大于0.980,且在10 mg/L时也达到0.953;说明CDI吸附镉符合二级吸附动力学模型,因此在CDI对镉的去除中,控制速率的主要是吸附作用而不是扩散作用[20]。
图 5为CDI去除镉的吸附等温曲线。结果用Langmuir模型拟合。Langmuir单层吸附等温式[5]为
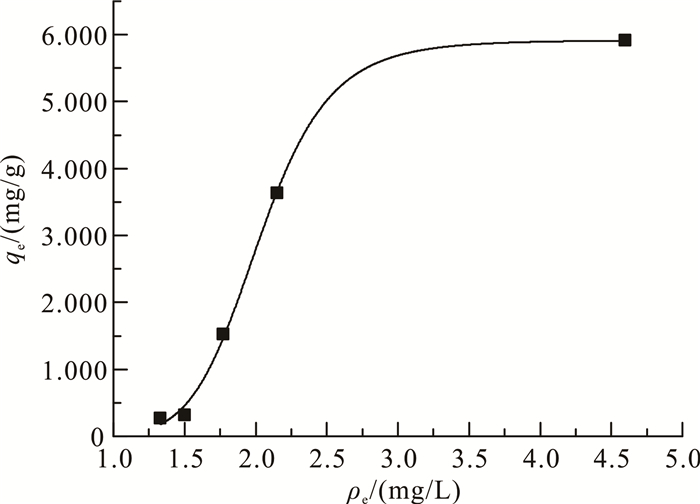
|
| 图 5 CDI去除镉的吸附等温线 Fig. 5 Adsorption isotherm of capacitive deionization for removing cadmium |
|
|
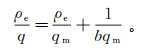 (5)
(5) 式中:qm为固体表面单层的饱和吸附量,mg/g;ρe为吸附平衡时CdCl2质量浓度,mg/L;b为等温方程的参数,L/mg。
以ρe为横坐标、qe为纵坐标进行非线性拟合,可以得出Langmuir吸附等温线的R2值为0.997,说明CDI吸附镉符合该吸附等温线,可以得出CDI对镉的吸附是发生在电极表面的单分子层吸附。
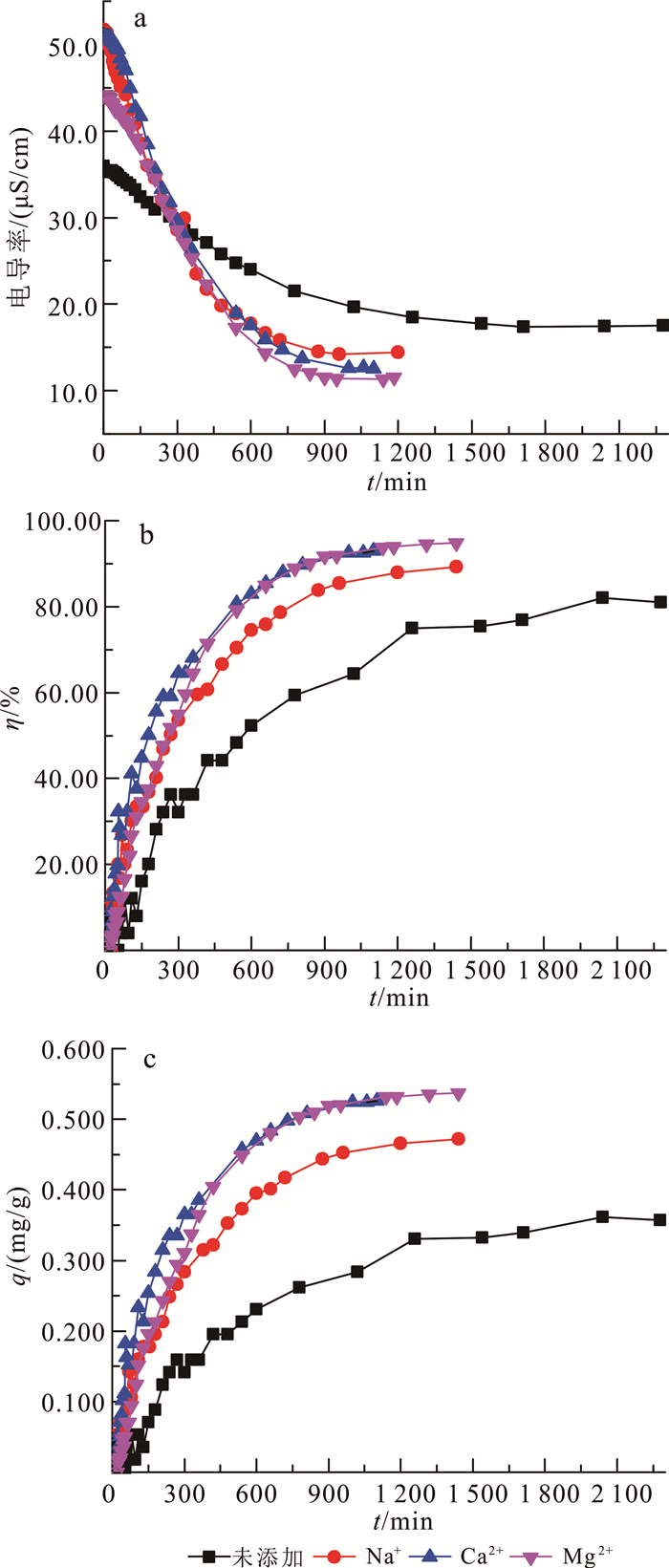
2.4 地下水中阳离子种类对CDI的影响从图 6a可以看出:添加了Na+、Ca2+、Mg2+的体系初始电导率分别为51.60、50.80和44.10 μS/cm,明显高于未添加阳离子体系的电导率(35.90 μS/cm);同时,在吸附初始阶段,添加了阳离子的体系电导率的下降速率要明显高于未添加阳离子的体系。从图 6b可以看出:添加了Na+、Ca2+、Mg2+的体系,在吸附初始阶段,镉的去除率上升趋势均快于未添加阳离子的体系;3个体系中镉的最终去除率分别为87.90%、92.88%和94.87%,均高于未添加阳离子体系的去除率(81.97%)。从图 6c可以看出,添加了Na+、Ca2+、Mg2+体系的电极的最终吸附量分别为0.472、0.526和0.537 mg/g,也同样高于未添加阳离子体系的最终吸附量(0.361 mg/g)。结果表明,添加了阳离子的体系,电极的吸附速率、最终吸附量和镉的最终去除率都有显著的提高,说明阳离子的添加促进了CDI对镉的吸附。结合图 6a和6b还可以看出,当4个体系溶液中镉的去除率达到50.00%时,未添加阳离子溶液和添加Na+、Ca2+、Mg2+溶液的电导率分别为24.40、32.00、38.7和31.70 μS/cm,与溶液初始电导率相比,分别降低了11.50、19.60、12.10和12.40 μS/cm,添加了阳离子的体系中电导率的下降均高于未添加阳离子的体系,说明电导率的变化由体系中2种复合离子共同决定,而溶液电导率同质量浓度正相关。因此,电容电极会同时吸附体系中的Cd2+和地下水中的其他阳离子。
|
| 图 6 添加不同阳离子时溶液电导率(a)、镉的去除率(b)和单位电极镉的吸附量(c)变化 Fig. 6 Change of conductivity of solution(a), removal rate of cadmium (b) and adsorption capacity per electrode of cadmium(c) on different cation |
|
|
1) CDI可以有效地去除地下水中的镉,且镉的去除过程符合准二级吸附动力学模型。吸附等温曲线符合Langmuir模型,CDI对镉的吸附为单分子层吸附,镉被吸附在活性炭孔隙表面。
2) CDI对镉的最终吸附量随CdCl2溶液质量浓度的升高而增加;在低质量浓度时,较高的供电电压会提高初始阶段的吸附速率,但对于电极的最终吸附量无显著影响。
3) 地下水中主要阳离子的存在会提高吸附溶液的电导率,在相同CdCl2溶液初始质量浓度和体系供电电压时,地下水中阳离子的存在促进CDI对镉的吸附,提高电容电极的吸附速率、最终吸附量和镉的最终去除率。
| [1] |
胡曦尹, 冯扬, 李岩. 镉中毒与金属硫蛋白表达的研究进展[J]. 职业与健康, 2017, 33(21): 3022-3025. Hu Xiyin, Feng Yang, Li Yan. Advancements in Cadmium Intoxication and Metallothionein Expression[J]. Occupation and Health, 2017, 33(21): 3022-3025. |
| [2] |
代群威, 王可, 王岩, 等. 灭活面包酵母菌对水溶液中镉离子的吸附特性[J]. 河北大学学报(自然科学版), 2017, 37(5): 523-530. Dai Qunwei, Wang Ke, Wang Yan, et al. Biosorption of Cadmium Ions from Solution by Nonliving Saccharomyces Cerevisiae[J]. Journal of Hebei University (Natural Science Edition), 2017, 37(5): 523-530. DOI:10.3969/j.issn.1000-1565.2017.05.012 |
| [3] |
钟志文. 蒸发浓缩前期预处理火焰原子吸收分光光度法测定地下水中镉的探讨[J]. 广东化工, 2014, 41(8): 140-141. Zhong Zhiwen. The Pretreatment for the Determination of Cadmium in Water by Flame Atomic Absorption Spectrophotometry of Evaporation[J]. Guangdong Chemical Industry, 2014, 41(8): 140-141. DOI:10.3969/j.issn.1007-1865.2014.08.071 |
| [4] |
周长松, 邹胜章, 李录娟, 等. 岩溶区典型石灰土Cd形态指示意义及风险评价:以桂林毛村为例[J]. 吉林大学学报(地球科学版), 2016, 46(2): 552-562. Zhou Changsong, Zou Shengzhang, Li Lujuan, et al. Implications of Cadmium Forms and Risk Assessment of Calcareous Soil in Karst Area:A Case Study of Maocun in Guilin, China[J]. Journal of JiLin University (Earth Science Edition), 2016, 46(2): 552-562. |
| [5] |
李佳, 霍丽娟, 钱天伟. 硫化亚铁纳米粒子吸附地下水中的镉[J]. 环境工程学报, 2016, 10(3): 1264-1270. Li Jia, Huo Lijuan, Qian Tianwei. Sorption of Cadmium in Groundwater by FeS Nanoparticles[J]. Chinese Journal of Environmental Engineering, 2016, 10(3): 1264-1270. |
| [6] |
Suss M E, Porada S, Sun X, et al. Water Desalination via Capacitive Deionization:What Is It and What Can We Expect from It?[J]. Energy & Environmental Science, 2015, 8(8): 2296-2319. |
| [7] |
Mossad M, Zhang W, Zou L. Using Capacitive Deionisation for Inland Brackish Groundwater Desalination in a Remote Location[J]. Desalination, 2013, 308(2): 154-160. |
| [8] |
尹广军, 陈福明. 电容去离子研究进展[J]. 水处理技术, 2003, 29(2): 63-66. Yin Guangjun, Chen Fuming. Research Progress of Capacitor Deionization[J]. Technology of Water Treatment, 2003, 29(2): 63-66. DOI:10.3969/j.issn.1000-3770.2003.02.001 |
| [9] |
Suss M E, Baumann T F, Bourcier W L, et al. CapacitiveDesalination with Flow-Through Electrodes[J]. Energy & Environmental Science, 2012, 5(11): 9511-9519. |
| [10] |
Hemmatifar A, Stadermann M, Santiago J G. Two-Dimensional Porous Electrode Model for Capacitive Deionization[J]. The Journal of Physical Chemistry C, 2015, 119(44): 24681-24694. DOI:10.1021/acs.jpcc.5b05847 |
| [11] |
刘红, 王刚, 王六平, 等. 电容去离子脱盐技术:离子交换膜复合活性炭电极的性能[J]. 化工学报, 2012, 63(5): 1512-1516. Liu Hong, Wang Gang, Wang Liuping, et al. Capacitive Deionization (CDI) Technology for Desalination of Sea Water:Properties of Carbon Electrode Materials Made of Activated Carbon and Ion-Exchange Membranes[J]. CIESC Journal, 2012, 63(5): 1512-1516. DOI:10.3969/j.issn.0438-1157.2012.05.027 |
| [12] |
Bieshuvel P M, Hamelers H V M, Suss M E. Theory of Water Desalination by Porous Electrodes with Immobile Chemical Charge[J]. Colloids and Interface Science Communications, 2015, 9: 1-5. DOI:10.1016/j.colcom.2015.12.001 |
| [13] |
李琛, 张莉, 王凯, 等. 双电层超级电容器的矩阵式模型研究[J]. 电子元件与材料, 2011, 30(4): 41-44. Li Chen, Zhang Li, Wang Kai, et al. Study on the Matrix Model for the Double Layer Super-Capacitor[J]. Electronic Components and Materials, 2011, 30(4): 41-44. DOI:10.3969/j.issn.1001-2028.2011.04.011 |
| [14] |
Jeon S I, Park H R, Yeo J G, et al. Desalination via a New Membrane Capacitive Deionization Process Utilizing Flow-Electrodes[J]. Energy & Environmental Science, 2013, 6(5): 1471-1475. |
| [15] |
Bouhadana Y, Avraham E, Noked M, et al. Capacitive Deionization of NaCl Solutions at Non-Steady-State Conditions:Inversion Functionality of the Carbon Electrodes[J]. The Journal of Physical Chemistry C, 2011, 115(33): 16567-16573. DOI:10.1021/jp2047486 |
| [16] |
王璇, 邱键俊, 徐思飞. 原子吸收测定镉标准曲线相关系数的不确定度分析[J]. 山东化工, 2016, 45(1): 62-63. Wang Xuan, Qiu Jianjun, Xu Sifei. Determination of Uncertainty of Correlation Coefficient of Cadmium Standard Curve by Atomic Absorption Spectrometry[J]. Shandong Chemical Industry, 2016, 45(1): 62-63. DOI:10.3969/j.issn.1008-021X.2016.01.020 |
| [17] |
高心岗, 吴得福, 李洪杰, 等. 氢化物发生-原子荧光法测定地下水中的镉[J]. 化学分析计量, 2016, 25(6): 30-33. Gao Xingang, Wu Defu, Li Hongjie, et al. Determination of Cadmium in Groundwater by Hydride Generation-Atomic Fluorescence Spectro-metry[J]. Chemical Analysis and Meterage, 2016, 25(6): 30-33. DOI:10.3969/j.issn.1008-6145.2016.06.007 |
| [18] |
张波涛, 董德明, 杨帆, 等. 溶液离子强度对自然水体生物膜吸附Pb2+和Cd2+的影响[J]. 吉林大学学报(地球科学版), 2004, 34(4): 566-570. Zhang Botao, Dong Deming, Yang Fan, et al. Effect of Ionic Strength in Solution on Pb2+ and Cd2+ Adsorption to Surface Coatings[J]. Journal of Jilin University (Earth Science Edition), 2004, 34(4): 566-570. |
| [19] |
孔岩, 韩志勇, 庄媛, 等. 磁性高分子复合水凝胶的制备及其对水中铜离子的吸附性能[J]. 环境科学学报, 2018, 38(3): 1001-1009. Kong Yan, Han Zhiyong, Zhuang Yuan, et al. Preparation of Magnetic Polymer Hydrogel and Their Application for Removal Cu(Ⅱ) from Water[J]. Acta Scientiae Circumstantiae, 2018, 38(3): 1001-1009. |
| [20] |
Ho Y S, McKay G. Pseudo-Second Order Model for Sorption Processes[J]. Process Biochemistry, 1999, 34(5): 451-465. DOI:10.1016/S0032-9592(98)00112-5 |


