2. 地下水资源与环境教育部重点实验室(吉林大学), 长春 130021;
3. 水利部松辽水利委员会水文局, 长春 130021
2. Key Laboratory of Groundwater Resources and Environment(Jilin University), Ministry of Education, Changchun 130021, China;
3. Bureau of Hydrology Songliao River Water Resources Commission, Changchun 130021, China
0 引言
六价铬(Cr(Ⅵ))是地下水中常见的污染物之一,主要来源于电镀、印染和冶炼等工业过程产生的废弃物及污水[1-2]的排放和下渗。Cr(Ⅵ)溶解度高、在地下水中极易迁移且具有潜在致癌风险。目前最常用的Cr(Ⅵ)处理方式是利用纳米铁(nZVI)、硫化亚铁和蔗糖等无机或有机的还原剂将Cr(Ⅵ)转化为Cr(Ⅲ)后,形成共沉淀从而去除[3-7]。
nZVI是最常用的修复药剂之一,可处理的污染物范围广泛,但其在具有高还原性、低成本和有磁性优点的同时存在活性pH值范围较窄、表面易钝化致使反应活性降低等问题[8],因此目前的研究选择金属掺杂、高分子聚合物包覆和将nZVI负载在一些载体上这3种方法对nZVI进行改性[9]。
近年的研究[9]表明“硫化”将是nZVI改性的一种有效手段。硫化纳米铁(S-nZVI)是一种新型还原材料,其制备方法有两种:一种是Kim等[10]使用的一步合成法,另一种是Rajajayavel等[9]使用的两步合成法。两种方法的产物具有相同的化学组成,但前者是混合材料,后者有明显的壳核结构且能保留磁性;两种硫化均减少了nZVI遇水析氢产生的电子流失[9, 11-12]。Kim等[10]进行了S-nZVI、nZVI和FeS处理三氯乙烯(TCE)的对比实验,首先证实了S-nZVI具有比nZVI和FeS更高的TCE去除率和去除速率。之后,Su等[13]、Li等[14-15]和Cao等[16]分别得出S-nZVI相比于nZVI可以更好地去除水中的镉、四溴双酚A(TBBPA)、六溴环十二烷(HBCD)和抗生素氟苯尼考(FF)。Rajajayavel等[9]、Fan等[12]和Han等[11]在证实了处理TCE效果的同时推断出,反应过程中nZVI的电子更多地转移至TCE而不是水,即减少了nZVI的析氢作用。Han等[11]还表示,硫化可以抑制氢气的重组,使反应过程中产生更多的质子(H·)并参与反应。此外,Li等[14]还观察到硫化产生的表面FeS具有更好的电子传导能力。研究还表明,在处理不同的污染物时反应中最佳的硫铁摩尔比(n(S)/n(Fe))是不同的,例如:在Su等[13]去除Cd实验中的最佳n(S)/n(Fe)为0.28;Li等[14]的实验中反应效率随n(S)/n(Fe)增加(0.12~0.51)而升高,并未得出最佳n(S)/n(Fe);Han等[11]利用S-nZVI去除TCE时最佳n(S)/n(Fe)为0.025;Cao等[16]在处理抗生素氟苯尼考时得出的最佳n(S)/n(Fe)为0.14。因此n(S)/n(Fe)是研究S-nZVI去除Cr(Ⅵ)过程中的重要参数。
本文以地下水中的Cr(Ⅵ)为研究对象,研究了不同n(S)/n(Fe)的S-nZVI对Cr(Ⅵ)的处理效果,与nZVI进行对比,得到反应的最佳n(S)/n(Fe);之后,考察了初始pH值、试剂投加量和水化学成分对S-nZVI和nZVI去除Cr(Ⅵ)的影响。
1 实验材料与方法 1.1 试剂实验用七水合硫酸亚铁、硼氢化钠、九水合硫化钠、碳酸氢钠、硝酸钠、硫酸钠、氯化钠、氯化镁、氯化钙、氯化钾、重铬酸钾、盐酸、氢氧化钠、丙酮和二苯基碳酰二肼均为分析纯,购于国药集团化学试剂有限公司。使用蒸馏水进行溶液配制及材料制备,材料制备前将蒸馏水曝氮气,时间为30 min。
1.2 nZVI和S-nZVI的制备nZVI的制备:将过量的硼氢化钠(NaBH4)溶液通入0.14 mol/L的FeSO4溶液中制备nZVI[17],反应式为
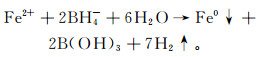 (1)
(1) 所得的悬浮液用除氧蒸馏水洗涤3遍后,用磁铁分离并置于真空干燥箱中60 ℃烘干。
S-nZVI的制备[9]:在制得nZVI的悬浮液后,用除氧蒸馏水洗涤3遍,在40 kHz的功率下超声10 min;然后,用蠕动泵将按理论n(S)/n(Fe)分别为0.07,0.14,0.21,0.28,0.35和0.56计算所得到的不同浓度(0.024 5,0.049 0,0.073 5,0.098 0,0.122 5,0.196 0 mol/L)的Na2S溶液通入nZVI的悬浮液中,并搅拌1 h;之后用除氧蒸馏水洗涤,用磁铁分离并置于真空干燥箱中60 ℃烘干。
以上所有制备过程均在氮气保护下进行。
1.3 测试及分析方法实验中Cr(Ⅵ)使用二苯基碳酰二肼分光光度法测定(GB 7467-87),测试仪器为Thermo Scientific SPECTRONIC 200分光光度计,波长为540 nm。氧化还原电位(ORP)和酸碱度(pH)使用哈希DR900便携式多参数设备进行测定。
使用具有Cu Kα辐射的X射线衍射(XRD,Bruker D8 Advance)分析两种材料的矿物学特征。使用单色Al Kα辐射的Thermo ESCALAB-250 X射线光电子能谱仪(XPS)检测S-nZVI和nZVI的表面元素组成。对样品表面的主要元素所在区域进行分析,包括:C 1s,O 1s,Fe 2p和S 2p。透射电子显微镜(TEM,Tecnai G2 F20 S-TWIN)与能量色散X射线分析仪(EDX)耦合用于研究纳米颗粒的结构。在TEM-EDX测试前,需将样品分散在无水乙醇中并超声处理。
1.4 实验方法各个实验设置的变量参数如下:最佳n(S)/n(Fe)实验设置了7个n(S)/n(Fe)值(0,0.07,0.14,0.21,0.28,0.35,0.56)和3个S-nZVI投加量(0.5,1.0,1.5 g/L);S-nZVI投加量影响实验设置了4个S-nZVI投加量(0.5,1.0,1.5,2.0 g/L);初始pH值影响实验设置了5个pH值(3,5,7,9,11),利用0.1 mol/L的HCl和0.1 mol/L的NaOH调节pH值;地下水化学成分影响实验设置了8个常见离子(K+、Na+、Ca2+、Mg2+、SO42-、NO3-、Cl- 和HCO3-),离子浓度均为10 mmol/L。
以上实验均设置nZVI的对比实验。实验均在反应瓶中进行,溶液体积为50 mL,Cr(Ⅵ)质量浓度为50 mg/L。模拟地下水环境(温度17 ℃、避光),将装有Cr(Ⅵ)和还原剂的反应瓶置于恒温水浴摇床中连续反应3 h,转速为185 r/min,反应过程中每隔一段时间用注射器吸取1 mL样品过0.22 μm微孔滤膜后,装入离心管测定,总共取样8次。实验设3组平行实验,计算平均值及标准差。
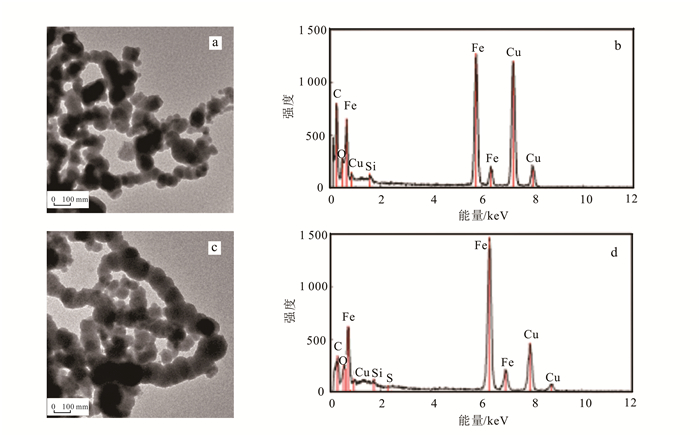
2 实验结果与讨论 2.1 S-nZVI及nZVI的表征使用TEM-EDX对S-nZVI及nZVI的结构进行表征并对比,结果如图 1所示。TEM图(图 1a,c)显示,由于磁力和静电引力的作用,S-nZVI和nZVI均是由球形连接成的链状结构,但S-nZVI的球形直径在100 nm左右,比nZVI稍大且更均匀。EDX图谱(图 1b,d)中,S-nZVI除了有与nZVI相同的Fe和O峰的存在,还有S峰,证明nZVI被成功硫化。以上均与Rajajayavel等[9]的研究结果相同;由于与Su等[13]使用的硫化方法不同,因此并没有出现其TEM结果中的片状结构。
|
| a.nZVI,TEM图;b.nZVI,EDX谱图;c. S-nZVI,TEM图;d.S-nZVI.EDX谱图。 图 1 nZVI和S-nZVI的TEM图和EDX谱图 Figure 1 TEM images and EDX spectra of nZVI(a, b) and S-nZVI(c, d) |
|
|
在XRD图谱(图 2)中:nZVI在44.6°和65.2°有2个对应α-Fe0的明显特征峰,说明制备的nZVI具有很好的结晶度和纯度;而S-nZVI仅在44.6°处有一个很弱的峰,这说明nZVI在硫化后,表面产生的铁硫化物将nZVI的表面大量覆盖,但图中并未显示任何有关硫铁化合物的峰,说明产生的硫铁化合物是高分散、非晶型的。

|
| 图 2 nZVI和S-nZVI的XRD图 Figure 2 XRD patterns of nZVI and S-nZVI |
|
|
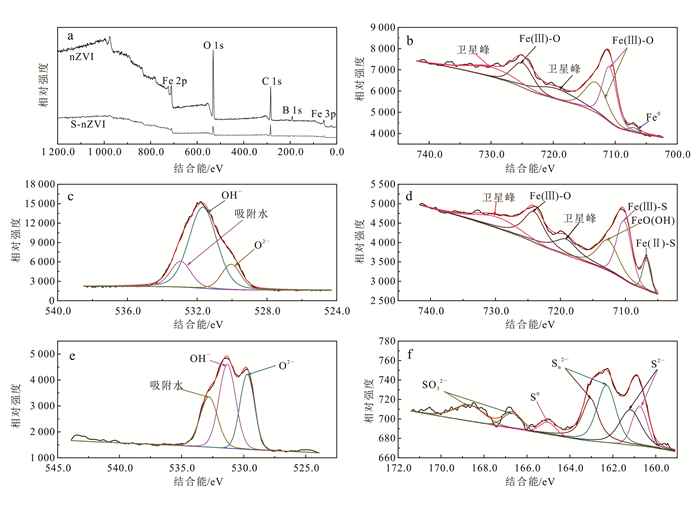
利用XPS对nZVI硫化前后表面的化学组成进行分析,结果如图 3所示。所有数据分析前均已使用284.8 eV的C 1s峰进行校正。
|
| a. nZVI和S-nZVI的XPS全谱扫描; b. nZVI的Fe 2p区域窄谱扫描;c. nZVI的O 1s区域窄谱扫描;d. S-nZVI的Fe 2p区域窄谱扫描;e. S-nZVI的O 1s区域窄谱扫描;f. S-nZVI的S 2p区域窄谱扫描。 图 3 nZVI与S-nZVI的XPS扫描图 Figure 3 XPS scan of nZVI and S-nZVI |
|
|
图 3b显示出nZVI Fe 2p区域中分析得到的6个峰:707.0 eV处的Fe0峰, 710.9 eV、713.1 eV和724.9 eV所代表的Fe(Ⅲ)-O,以及719.6 eV和729.8 eV的卫星峰[18-19]。图 3c所显示的O在530.1 eV和531.7 eV的峰分别代表了Fe的氧化物和羟基氧化物[20-22]。这符合nZVI的典型组成结构,即由Fe0核与氧化铁壳组成[23-24]。
对S-nZVI的S 2p区域进行拟合得到7个峰(图 3f),其中:(161.0±0.2) eV和(162.7±0.4) eV处的4个峰分别由2个双峰组成,分别代表硫化物及多硫化物;165.0 eV处出现的峰对应S0;而166.7 eV和168.7 eV对应SO32-[18-19, 25]。图 3d中:在706.7 eV和710.2 eV处分别出现了代表Fe(Ⅱ)-S和Fe(Ⅲ)-S的峰[25];在712.7 eV和719.1 eV处出现了代表Fe(Ⅲ)-O和FeOOH的峰。这与图 3e中O分峰结果中得到的O形态一致。SO32-、Fe(Ⅲ)-O和FeOOH的存在说明材料制备的过程有一定程度的氧化。S-nZVI表面主要为硫化亚铁和多硫化物,还有少部分的单质硫和亚硫酸盐。
2.2 n(S)/n(Fe)及S-nZVI投加量对S-nZVI还原Cr(Ⅵ)的影响由图 4可知,在3种S-nZVI投加量(0.5,1.0,1.5 g/L)条件下,n(S)/n(Fe)对Cr(Ⅵ)的去除表现出相近的规律,即:当n(S)/n(Fe)为0.00~0.07、0.28~0.56时,S-nZVI对Cr(Ⅵ)的去除率(ρ/ρ0,ρ为反应过程中Cr(Ⅵ)质量浓度,ρ0为Cr(Ⅵ)初始质量浓度)多低于nZVI(即n(S)/n(Fe)为0.00);当n(S)/n(Fe)为0.14~0.21时,S-nZVI对Cr(Ⅵ)的去除率高于nZVI。在3种投加量条件下,去除Cr(Ⅵ)的最佳n(S)/n(Fe)均为0.14。在此最佳n(S)/n(Fe)条件下,1.5 g/L的S-nZVI在3 h内对50 mg/L Cr(Ⅵ)的去除率为86.5%,nZVI对Cr(Ⅵ)的去除率为71.0%。实验结果表明,过高与过低的n(S)/n(Fe)均不能提高Cr(Ⅵ)的去除率。这是由于当n(S)/n(Fe)为0~0.07时,S2-与nZVI反应消耗了nZVI的电子;当n(S)/n(Fe)为0.14~0.21时,硫化层厚度可以抑制nZVI与污染物反应过程中的副反应,如nZVI遇水析氢[26-27]反应式为
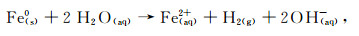 (2)
(2)

|
| a.ρ(S-nZVI)= 0.5 g/L;b. ρ(S-nZVI)= 1.0 g/L;c. ρ(S-nZVI)= 1.5 g/L。 图 4 3种S-nZVI投加量、不同n(S)/n(Fe)条件下Cr(Ⅵ)的去除率 Figure 4 Removal of Cr(Ⅵ) by S-nZVI under the condition of different n(S)/n(Fe) with three particles dosages |
|
|
减少了电子向副反应的流失,将更多的电子用于还原Cr(Ⅵ);当n(S)/n(Fe)>0.28时,表面硫化程度过高,形成过厚的硫化层,从而阻碍了Fe0与Cr(Ⅵ)之间的电子传递[10],使得去除率大幅度降低。后续实验中选用n(S)/n(Fe)为0.14的S-nZVI进行实验。
如图 5所示:随着S-nZVI和nZVI投加量的增加,S-nZVI和nZVI对Cr(Ⅵ)的去除率增加;当投加量达到2.0 g/L时,S-nZVI对Cr(Ⅵ)的去除率为98%,显著高于同等投加量下nZVI的82%。较高的试剂投加量可以为Cr(Ⅵ)提供更多的活性位点,因此在反应的初始阶段,其反应速率更快;但当材料表面被逐渐氧化或被产物覆盖后,反应速率开始逐渐变缓。之后的实验中,选取2.0 g/L作为试剂投加量。
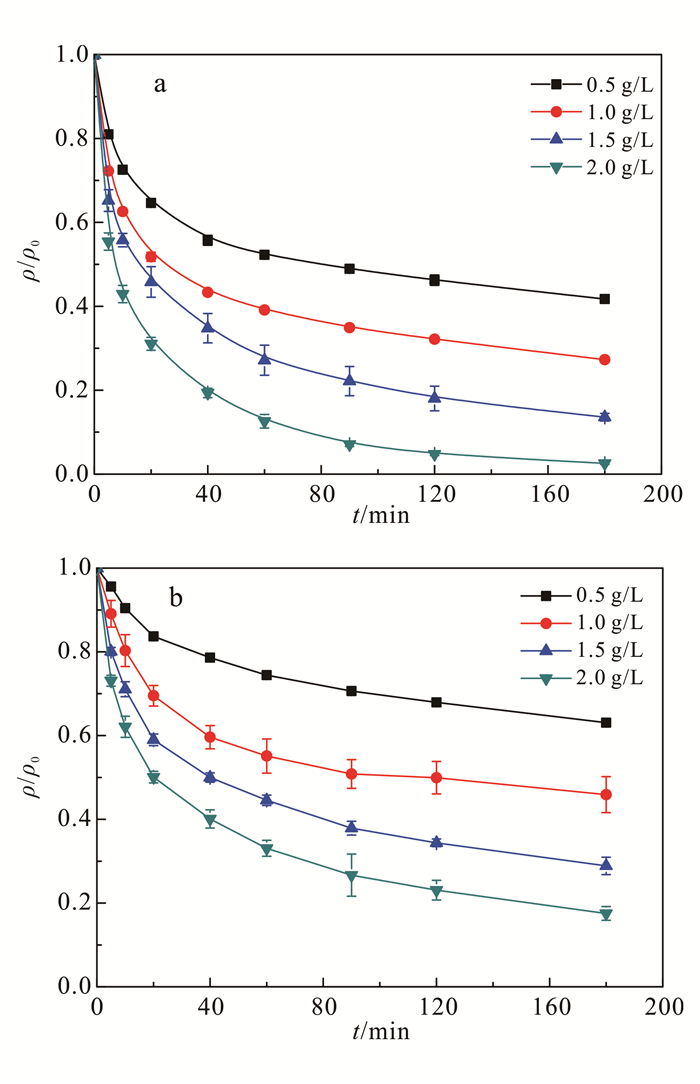
|
| 图 5 4种投加量条件下,S-nZVI (a)和nZVI (b)对Cr(Ⅵ)的去除率 Figure 5 Removal of Cr(Ⅵ) by S-nZVI (a) and nZVI (b) under the condition of four particles dosages |
|
|
如图 6所示,随着pH值由3升高至11,S-nZVI及nZVI对Cr(Ⅵ)的去除均呈现降低趋势,S-nZVI去除率由100%降低至79%,nZVI由100%降低至73%。当pH=3时,S-nZVI和nZVI对Cr(Ⅵ)的去除率达到100%所需时间分别为10、20 min,S-nZVI的反应速率显著高于nZVI。在pH=5、7、9和11时,S-nZVI对Cr(Ⅵ)的去除率比nZVI对Cr(Ⅵ)分别高了15%、9%、7%和6%;值得强调的是,在pH=5时,S-nZVI仍能去除100%的Cr(Ⅵ),而nZVI只能去除85%的Cr(Ⅵ)。
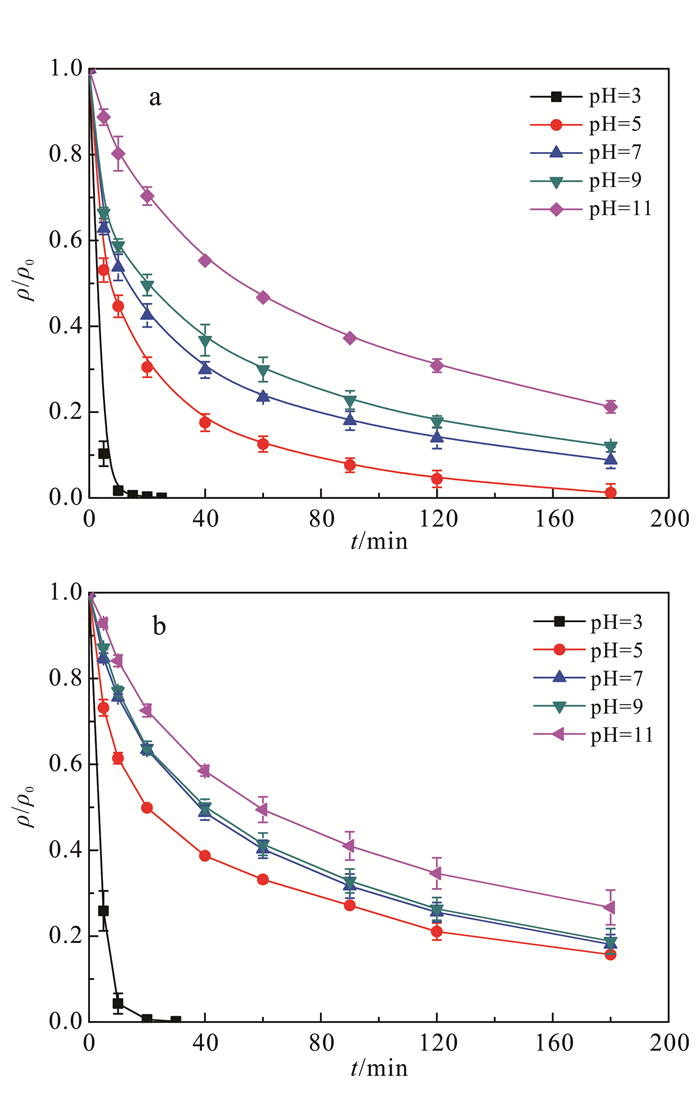
|
| 图 6 不同初始pH值条件下S-nZVI (a)和nZVI (b)对Cr(Ⅵ)的去除率 Figure 6 Removal of Cr(Ⅵ) by S-nZVI (a) and nZVI (b) under the condition of different initial pH |
|
|
在反应过程中S-nZVI优于nZVI的原因可以分2种情况分析:1)在酸性条件下,S-nZVI和nZVI还原Cr(Ⅵ)的过程是消耗H+的过程,但S-nZVI可以提供更多的H·,从而促进反应的进行[9, 11-12, 28];表面的S2-可以作为Fe(Ⅱ)—Fe(Ⅲ)循环的通道,将Fe(Ⅱ)氧化产生的Fe(Ⅲ)重新还原为Fe(Ⅱ),加速电子传递和Cr(Ⅵ)的还原[25, 29];H+会对材料表面产生腐蚀,释放更多的Fe(Ⅱ)、S2-和反应位点。2)碱性环境时,氢氧根离子会消耗铁离子并沉淀在材料表面阻碍反应的进行,但正如Kantar等[29]在使用FeS2还原Cr(Ⅵ)的文章中提到的,此时Fe(Ⅱ)已经失去了还原能力,而S22-仍能参与进反应中,同时提供其还原能力,因此仍能保留比nZVI更好的去除效果。
2.4 水化学成分对S-nZVI去除Cr(Ⅵ)的影响天然地下水中常见的离子包括K+、Na+、Ca2+、Mg2+、SO42-、NO3-、Cl- 和HCO3-,研究其对S-nZVI处理Cr(Ⅵ)的影响对于材料应用于地下水污染的修复具有重要实际意义。各种阴阳离子的影响见图 7。
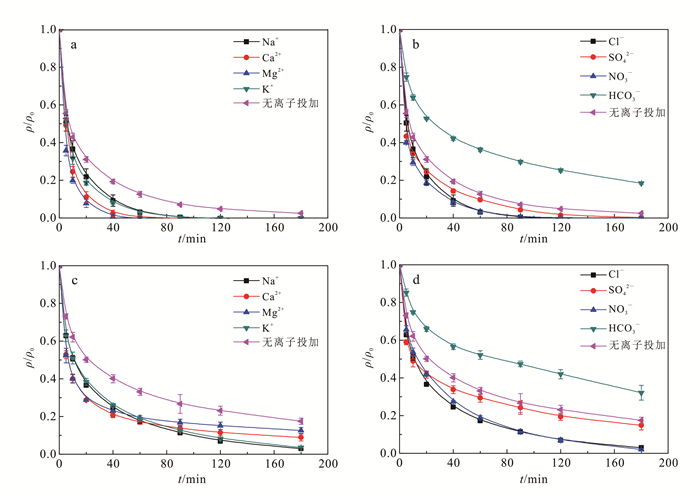
|
| 图 7 地下水中常见离子对S-nZVI (a,b)和nZVI (c,d)去除Cr(Ⅵ)的影响 Figure 7 Effect of common groundwater ions on removal of Cr(Ⅵ) by S-nZVI (a, b)and nZVI (c, d) |
|
|
对比图 7a、c,4种阳离子均促进了S-nZVI和nZVI对Cr(Ⅵ)的去除,并提高了反应速率。对S-nZVI的影响顺序为Mg2+ > Ca2+ > K+ > Na+ > 无离子投加;投加Mg2+和Ca2+后Cr(Ⅵ)可以在60 min内基本被去除,明显快于Na+、K+的120 min,在无离子投加的反应中,180 min仍有2%的Cr(Ⅵ)残留;投加Mg2+、Ca2+、K+、Na+后的反应速率分别是无离子投加的2.20、1.45、1.22、1.13倍。对比nZVI体系,虽然4种阳离子均促进了Cr(Ⅵ)去除,但其最终去除率及还原速率均不及S-nZVI体系。
对比图 7b、d及表 1可知:Cl-、NO3-和SO42-均促进了S-nZVI和nZVI对Cr(Ⅵ)的去除,并提高了还原速率;且对S-nZVI的促进效率明显高于nZVI,S-nZVI对Cr(Ⅵ)的去除率始终比nZVI高;HCO3-明显抑制了体系反应的进行,但对nZVI体系的抑制作用强于S-nZVI体系。这是因为:1)Cl-、NO3-和SO42-有去钝化的作用,促进材料的表面腐蚀,使S-nZVI体系释放S2-参与反应[25, 30]。2)加入HCO3-后,Cr(Ⅵ)溶液初始pH值由5.1值升至8.0,体系由酸性环境转换为碱性;当铁离子还原Cr(Ⅵ)使pH值进一步升高时,HCO3-会转化为CO32-并与铁离子产生FeCO3沉淀后聚集在材料表面[27, 31-32],占据反应位点,从而降低去除率。
| % | |||||
| 无离子投加 | Cl- | NO3- | SO42- | HCO3- | |
| S-nZVI | 98 | 100(2 h) | 100(2 h) | 100 | 82 |
| nZVI | 82 | 97 | 98 | 85 | 68 |
1) 两步合成法制备的S-nZVI具有明显的壳核结构,其Fe0核外层包覆着非晶的硫化亚铁和多硫化物,增强了nZVI的还原能力。
2) 在S-nZVI投加量为0.5~1.5 g/L时,去除Cr(Ⅵ)效果最佳的n(S)/n(Fe)为0.14,此时的硫化层厚度可以抑制nZVI与污染物反应过程中的副反应,减少电子的流失,将更多的电子用于还原Cr(Ⅵ)。随着S-nZVI投加量的增加,Cr(Ⅵ)的去除率升高。当投加量为2.0 g/L时,S-nZVI对Cr(Ⅵ)的去除率达到98%,相同投加量下nZVI的去除率为82%。
3) 当pH值由3升高到11时,S-nZVI对Cr(Ⅵ)的去除率逐渐降低,但在相同pH值条件下,S-nZVI对Cr(Ⅵ)的去除率和去除速率始终高于nZVI。当pH=5时,S-nZVI对Cr(Ⅵ)的去除率仍能达到100%,而nZVI只能去除85%的Cr(Ⅵ)。因此S-nZVI相对于nZVI可以在更大的pH范围内应用。
4) K+、Na+、Ca2+、Mg2+、SO42-、NO3-和Cl-均促进了S-nZVI对Cr(Ⅵ)的去除,其对S-nZVI体系的促进效率高于nZVI体系;HCO3-溶液pH值的升高会抑制Cr(Ⅵ)的去除,其对nZVI体系的抑制作用高于S-nZVI体系。
| [1] |
Aber S, Amanighadim A R, Mirzajani V. Removal of Cr(Ⅵ) from Polluted Solutions by Electrocoagulation:Modeling of Experimental Results Using Artificial Neural Network[J]. Journal of Hazardous Materials, 2009, 171(1): 484-490. |
| [2] |
董军, 徐暖, 刘同喆, 等. 乳化植物油强化土著微生物修复中高浓度Cr(Ⅵ)污染地下水[J]. 吉林大学学报(地球科学版), 2018, 48(1): 234-240. Dong Jun, Xu Nuan, Liu Tongzhe, et al. Indigenous Microbial Remediation of Middle-High Concentration Cr(Ⅵ) Contaminated Groundwater Enhanced by Emulsified Vegetable Oil[J]. Journal of Jilin University (Earth Science Edition), 2018, 48(1): 234-240. |
| [3] |
Gheju M. Hexavalent Chromium Reduction with Zero-Valent Iron (ZVI) in Aquatic Systems[J]. Water, Air, & Soil Pollution, 2011, 222(1): 103-148. |
| [4] |
Li Y, Wang W, Zhou L, et al. Remediation of Hexavalent Chromium Spiked Soil by Using Synthesized Iron Sulfide Particles[J]. Chemosphere, 2017, 169(Sup. C): 131-138. |
| [5] |
Liu X, Dong H, Yang X, et al. Effects of Citrate on Hexavalent Chromium Reduction by Structural Fe(Ⅱ) in Nontronite[J]. Journal of Hazardous Materials, 2018, 343(Sup. C): 245-254. |
| [6] |
Hug S J, Laubscher H-U, James B R. Iron(Ⅲ) Catalyzed Photochemical Reduction of Chromium(Ⅵ) by Oxalate and Citrate in Aqueous Solutions[J]. Environmental Science & Technology, 1997, 31(1): 160-170. |
| [7] |
Tzou Y M, Wang S L, Wang M K. Fluorescent Light Induced Cr(Ⅵ) Reduction by Citrate in the Presence of TiO2 and Ferric Ions[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2005, 253(1): 15-22. |
| [8] |
宋世琨, 苏益明, 代朝猛, 等. 纳米硫化铁在环境保护中的应用研究进展[J]. 化工进展, 2016, 35(1): 248-254. Song Shikun, Su Yiming, Dai Chaomeng, et al. Recent Advances in the Application of Iron Sulfide Nanoparticles in Environment[J]. Chemical Industry and Engineering Progress, 2016, 35(1): 248-254. |
| [9] |
Rajajayavel S R C, Ghoshal S. Enhanced Reductive Dechlorination of Trichloroethylene by Sulfidated Nanoscale Zerovalent Iron[J]. Water Research, 2015, 78: 144-153. DOI:10.1016/j.watres.2015.04.009 |
| [10] |
Kim E J, Kim J H, Aazd A M, et al. Facile Synthesis and Characterization of Fe/FeS Nanoparticles for Environmental Applications[J]. ACS Applied Materials & Interfaces, 2011, 3(5): 1457-1462. |
| [11] |
Han Y, Yan W. Reductive Dechlorination of Trichlo-roethene by Zero-Valent Iron Nanoparticles:Reactivity Enhancement Through Sulfidation Treatment[J]. Environmental Science & Technology, 2016, 50(23): 12992-13001. |
| [12] |
Fan D, O'Brien Johnson G, Tratnyek P G, et al. Sulfidation of Nano Zerovalent Iron (nZVI) for Improved Selectivity During In-Situ Chemical Reduction (ISCR)[J]. Environmental Science & Technology, 2016, 50(17): 9558-9565. |
| [13] |
Su Y, Adeleye A S, Keller A A, et al. Magnetic Sulfide-Modified Nanoscale Zerovalent Iron (S-nZVI) for Dissolved Metal Ion Removal[J]. Water Research, 2015, 74: 47-57. DOI:10.1016/j.watres.2015.02.004 |
| [14] |
Li D, Mao Z, Zhong Y, et al. Reductive Transfor-mation of Tetrabromobisphenol A by Sulfidated Nano Zerovalent Iron[J]. Water Research, 2016, 103: 1-9. DOI:10.1016/j.watres.2016.07.003 |
| [15] |
Li D, Zhu X, Zhong Y, et al. Abiotic Transformation of Hexabromocyclododecane by Sulfidated Nanoscale Zerovalent Iron:Kinetics, Mechanism and Influencing Factors[J]. Water Research, 2017, 121: 140-149. DOI:10.1016/j.watres.2017.05.019 |
| [16] |
Cao Z, Liu X, Xu J, et al. Removal of Antibiotic Florfenicol by Sulfide-Modified Nanoscale Zero-Valent Iron[J]. Environmental Science & Technology, 2017, 51(19): 11269-11277. |
| [17] |
Crane R A, Scott T. The Removal of Uranium onto Carbon-Supported Nanoscale Zero-Valent Iron Particles[J]. Journal of Nanoparticle Research, 2014, 16(12): 2813. DOI:10.1007/s11051-014-2813-4 |
| [18] |
Gong Y, Gai L, Tang J, et al. Reduction of Cr(Ⅵ) in Simulated Groundwater by FeS-Coated Iron Magnetic Nanoparticles[J]. Science of the Total Environment, 2017, 595: 743-751. DOI:10.1016/j.scitotenv.2017.03.282 |
| [19] |
Li Y, Liang J, He X, et al. Kinetics and Mechanisms of Amorphous FeS2 Induced Cr(Ⅵ) Reduction[J]. Journal of Hazardous Materials, 2016, 320(Sup. C): 216-225. |
| [20] |
Zhu F, Li L, Ren W, et al. Effect of pH, Tem-perature, Humic Acid and Coexisting Anions on Reduction of Cr(Ⅵ) in the Soil Leachate by nZVI/Ni Bimetal Material[J]. Environmental Pollution, 2017, 227: 444-450. DOI:10.1016/j.envpol.2017.04.074 |
| [21] |
Lv X, Xu J, Jiang G, et al. Highly Active Nanoscale Zero-Valent Iron (nZVI)-Fe3O4 Nanocomposites for the Removal of Chromium(Ⅵ) from Aqueous Solutions[J]. Journal of Colloid and Interface Science, 2012, 369(1): 460-469. DOI:10.1016/j.jcis.2011.11.049 |
| [22] |
Fu R, Yang Y, Xu Z, et al. The Removal of Chro-mium (Ⅵ) and Lead(Ⅱ) from Groundwater Using Sepiolite-Supported Nanoscale Zero-Valent Iron (S-NZVI)[J]. Chemosphere, 2015, 138: 726-734. DOI:10.1016/j.chemosphere.2015.07.051 |
| [23] |
Grieger K D, Fjordb GE A, Hartmann N B, et al. Environmental Benefits and Risks of Zero-Valent Iron Nanoparticles (nZVI) for in Situ Remediation:Risk Mitigation or Trade-off[J]. Journal of Contaminant Hydrology, 2010, 118(3): 165-183. |
| [24] |
Li X Q, Zhang W X. Sequestration of Metal Cations with Zerovalent Iron Nanoparticles:A Study with High Resolution X-Ray Photoelectron Spectroscopy (HR-XPS)[J]. The Journal of Physical Chemistry C, 2007, 111(19): 6939-6946. DOI:10.1021/jp0702189 |
| [25] |
Murphy R, Strongin D R. Surface Reactivity of Pyrite and Related Sulfides[J]. Surface Science Reports, 2009, 64(1): 1-45. DOI:10.1016/j.surfrep.2008.09.002 |
| [26] |
Gong Y, Tang J, Zhao D. Application of Iron Sulfide Particles for Groundwater and Soil Remediation:A Review[J]. Water Research, 2016, 89(Sup. C): 309-320. |
| [27] |
Yu R F, Chi F H, Cheng W P, et al. Application of pH, ORP, and DO Monitoring to Evaluate Chromium(Ⅵ) Removal from Wastewater by the Nanoscale Zero-Valent Iron (nZVI) Process[J]. Chemical Engineering Journal, 2014, 255: 568-576. DOI:10.1016/j.cej.2014.06.002 |
| [28] |
Breysse M, Furimsky E, Kasztelan S, et al. Hyd-rogen Activation by Transition Metal Sulfides[J]. Catalysis Reviews, 2002, 44(4): 651-735. DOI:10.1081/CR-120015483 |
| [29] |
Kantar C, Ari C, Keskin S, et al. Cr(Ⅵ) Removal from Aqueous Systems Using Pyrite as the Reducing Agent:Batch, Spectroscopic and Column Experiments[J]. Journal of Contaminant Hydrology, 2015, 174: 28-38. DOI:10.1016/j.jconhyd.2015.01.001 |
| [30] |
Zhang R, Sun H, Yin J. Arsenic and Chromate Re-moval from Water by Iron Chips:Effects of Anions[J]. Frontiers of Environmental Science & Engineering in China, 2008, 2(2): 203-208. |
| [31] |
Heuer J K, Stubbins J F. An XPS Characterization of FeCO3 Films from CO2 Corrosion[J]. Corrosion Science, 1999, 41(7): 1231-1243. DOI:10.1016/S0010-938X(98)00180-2 |
| [32] |
Lv X, Hu Y, Tang J, et al. Effects of Co-Existing Ions and Natural Organic Matter on Removal of Chromium (Ⅵ) from Aqueous Solution by Nanoscale Zero Valent Iron (nZVI)-Fe3O4 Nanocomposites[J]. Chemical Engineering Journal, 2013, 218: 55-64. DOI:10.1016/j.cej.2012.12.026 |


