扩展功能
文章信息
- 张爽, 李颖, 张彦春, 马红梅, 王园园, 张赫
- Zhang Shuang, Li Ying, Zhang Yanchun, Ma Hongmei, Wang Yuanyuan, Zhang He
- 2015-2017年北京市顺义区腹泻病例副溶血弧菌流行特征与分子分型特征分析
- Epidemiological and molecular characteristics of Vibrio Parahaemolyticus in Shunyi district of Beijing, 2015-2017
- 疾病监测, 2018, 33(5): 381-386
- Disease Surveillance, 2018, 33(5): 381-386
- 10.3784/j.issn.1003-9961.2018.05.008
-
文章历史
- 收稿日期:2018-02-07
副溶血弧菌(Vibrio parahaemolyticus)又称致病性嗜盐菌,主要分布在海水、鱼贝类等海产品以及高盐腌制食品中,沿海地区发病较多[1]。副溶血弧菌是重要的食源性病原菌之一,感染后常引起以腹泻、腹痛为主要症状的急性胃肠炎。副溶血弧菌被首次检出是在1950年日本的一次严重暴发性食物中毒事件中,该事件共导致272人患病,并有20人死亡[2]。近年来,由副溶血弧菌感染引发的腹泻暴发屡见不鲜[3-4],且由于海产品在内陆地区的广泛流通和食用,使副溶血弧菌的感染不再局限于沿海。为填补顺义区副溶血弧菌系统研究的空白,笔者通过分析2015-2017年间北京市顺义区副溶血弧菌的流行特征和分子分型特征,以了解该地区副溶血弧菌的分布和进化情况,为进一步的防控工作提供数据参考。
1 材料与方法 1.1 标本来源北京市顺义医院和顺义区空港医院为该区腹泻病例监测的2家哨点医院。收集哨点医院2015年1月至2017年12月间,每日腹泻3次及以上,并伴有粪便性状改变的病例粪便标本,尽快送至疾病预防控制中心(CDC)进行下一步实验。同时收集病例的流行病学和临床资料。
1.2 主要试剂及仪器3%氯化钠碱性蛋白胨水、TCBS琼脂、3%氯化钠胰蛋白胨大豆琼脂(TSA)购自北京陆桥公司;科玛嘉弧菌显色琼脂平板购自法国CHROMagar公司;VITEK 2 compact全自动细菌鉴定/药敏系统、革兰阴性细菌鉴定卡(GN卡)购自法国梅里埃公司;副溶血弧菌诊断血清为日本生研所生产;副溶血弧菌tlh/tdh/trh三重实时荧光聚合酶链反应(PCR)检测试剂盒(货号:A2983)购自北京卓诚惠生公司;Tris-HCl、EDTA、SDS、TBE、蛋白酶K购自美国索莱宝公司;内切酶SfiⅠ、XbaⅠ为美国NEB公司产品;沙门标准菌株(H9812)为北京市CDC 2013年提供;脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)CHEF Mapper、凝胶成像仪为美国伯乐公司产品;所有试剂均在有效期内使用。
1.3 分离培养鉴定和血清学分型粪便标本接种于3%氯化钠碱性蛋白胨水37 ℃、24 h增菌。增菌液分别转种TCBS琼脂平板和弧菌显色琼脂平板,37 ℃培养24 h。对比观察后,挑取疑似副溶血弧菌的单克隆菌落接种于TSA 37 ℃纯培养。纯培养物使用GN卡在VITEK 2上做系统生化鉴定。鉴定为副溶血弧菌的分离株使用副溶血弧菌诊断血清确定血清型。
1.4 分离株毒力基因的检测煮沸法提取分离株核酸,使用tlh/tdh/trh三重实时荧光PCR检测试剂盒检测副溶血弧菌中的不耐热溶血素(thermolabile hemolysin,TLH)、耐热溶血素(thermostable direct hemolysin,TDH)和TDH相关溶血素(TDH-related hemolysin,TRH)的编码基因,操作步骤和结果判读按试剂说明书进行。
1.5 PFGE分子分型将所得的副溶血弧菌分离株使用内切酶Sfi Ⅰ进行酶切,并以沙门标准菌株H9812使用XbaⅠ酶切后的片段作为分子质量参考标准,设置电泳条件:片段大小78~396 kb;电泳时间18~19 h;脉冲时间10~35 s。电泳后使用Gelred染色呈像。将所得条带上传国家致病菌识别网,并进行比对分析。
1.6 统计学分析使用SPSS 16.0软件进行统计学分析,组间计数资料的比较应用χ2检验,P < 0.05为差异有统计学意义。
2 结果 2.1 副溶血弧菌血清学分型及毒力基因检测3年间,共收集腹泻病例标本1 106份,检出副溶血弧菌阳性标本96份,阳性检出率为8.68%。其中2017年有2份标本中各检出2株不同血清型的副溶血弧菌分离株,共得到98株副溶血弧菌菌株。
菌株共分为9个血清型,其中最多的是O3:K6型,占73.47%(72 /98),其次为O4:K8和O4:KUT型,占9.18%(9/98),O1:KUT和O3:KUT型仅检出2株(2.04%,2/98);O2:K3、O3:K5、O10:KUT和O11:KUT型仅检出1株(1.02%,1/98),见表 1。
| 血清型 | 各血清型 | tlh+ 菌株数 |
tdh+ 菌株数 |
trh+ 菌株数 |
|
| 菌株数 | 构成比(%) | ||||
| O3:K6 | 72 | 73.47 | 72 | 72 | 0 |
| O4:K8 | 9 | 9.18 | 9 | 9 | 0 |
| O4:KUT | 9 | 9.18 | 9 | 9 | 0 |
| O1:KUT | 2 | 2.04 | 2 | 2 | 0 |
| O3:KUT | 2 | 2.04 | 2 | 2 | 0 |
| O2:K3 | 1 | 1.02 | 1 | 1 | 0 |
| O3:K5 | 1 | 1.02 | 1 | 1 | 0 |
| O10:KUT | 1 | 1.02 | 1 | 1 | 0 |
| O11:KUT | 1 | 1.02 | 1 | 0 | 0 |
经荧光定量PCR检测,98株副溶血弧菌分离株均为tlh+;仅有1株2016年分离株(O11:KUT)tdh-,其余tdh+;全部菌株trh-。
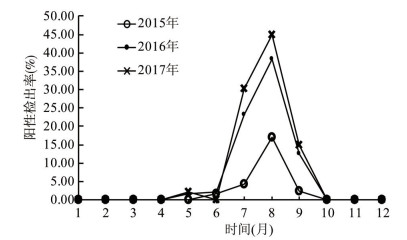
2.2 时间分布如图 1所示,每年10月至次年4月均未检出副溶血弧菌;2015年首例副溶血弧菌检出在6月,2016、2017年均在5月;每年阳性检出率最高的月份均为8月,3年中2017年8月阳性检出率最高,为45.00%(27/60)。
|
| 图 1 副溶血弧菌阳性检出率的时间分布 Figure 1 Time distribution of positive detection rates of V. parahaemolyticus |
| |
1 106例腹泻病例中,男性657例、女性449例,其中副溶血弧菌阳性病例男性55例、女性41例,性别比1.34:1。男女性阳性检出率分别为8.37%(55/657)和9.13%(41/449),经χ2检验,差异无统计学意义(χ2=0.19,P=0.66)。
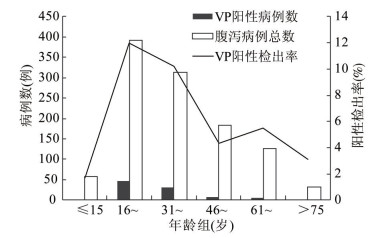
2.3.2 年龄分布总腹泻病例年龄分布在10月龄至96岁间,副溶血弧菌阳性病例年龄分布在15~84岁间。每15岁分为1个年龄组,75岁以上为1组,将病例分为6组。阳性检出率最高的为16~30岁(11.99%,47/392),其次为31~45岁(10.22%,32/313)。各组的阳性检出率分布见图 2。
|
| 图 2 副溶血弧菌阳性检出率的年龄分布 Figure 2 Age specific distribution of positive detection rates of V. parahaemolyticus |
| |
副溶血弧菌阳性检出率前3位的职业为其他职业(18.31%,13/71)、商业服务(13.70%,10/73)和工人(11.84%,27/228)。其他职业分类按阳性检出率从高到低排列,分别为家务及待业、干部职员、农民、不详、学生和离退人员。餐饮食品业、儿童和医务人员中未检出副溶血弧菌。
2.4 可疑感染食品分布副溶血弧菌阳性检出率前3位的可疑感染食品为水产类及其制品(18.75%,12/64)、蛋及其制品(14.29%,2/14)和肉及其制品(13.56%,24/177)。其中,肉及其制品感染病例数占副溶血弧菌阳性病例总数比例最高,为25.00%(24/ 96)。各类食品感染病例占副溶血弧菌阳性病例总数的分布见图 3。

|
| 图 3 副溶血性弧菌可疑感染食品分布 Figure 3 Distribution of suspected V. parahaemolyticus contaminated foods |
| |
据临床资料,副溶血弧菌阳性病例的全身症状主要有发热、脱水、口渴、乏力、体重下降等,其中所占比例最高的是脱水(33.33%,32/ 96),其次是发热(31.25%,30/96)和乏力(30.21%,29/ 96)。消化系统症状除腹泻外,主要有腹痛、恶心、呕吐和里急后重等。其中前3位的是腹痛(83.33%,80/ 96)、恶心(72.92%,70/96)和呕吐(38.54%,37/96)。粪便性状按构成比排列:水样便(69.79%,67/96)、稀便(26.04%,25/96)、血便(2.08%,2/96)、黏液便(1.04%,1/96)和其他(1.04%,1/96)。
2.6 PFGE结果98株副溶血弧菌菌株共得到91条指纹图谱,有7株O3:K6型菌株降解。将常引起腹泻暴发的O3:K6型菌株(65株)的PFGE图谱作聚类图,见图 4。

|
| 图 4 O3:K6型副溶血弧菌脉冲场凝胶电泳聚类图 Figure 4 PFGE fingerprints clustering diagram of V. parahaemolyticus O3:K6 注:流水编号为syk的菌株采集自空港医院,syq的菌株采集自顺义医院。 |
| |
如图 4所示:为方便描述,笔者将各分支按进化距离的远近进行了命名。大部分O3:K6型菌株聚集成簇,相似度较高。它们可被分为A、B两个分支,其中A分支只有1株,B2分支只有2株,这3株菌株均为2016年8月初左右采集自空港医院,且与其余菌株的相似度较低。结合流行病学资料得知,这3例病例均在家中进餐后发病,没有共同就餐者,可疑感染食品各不相同,分别为水产类及其制品、肉及其制品和其他食品,且食品均购自当地。将相似度较高的菌株划分为6个小组,其中组内同时含有采集自两家哨点医院的菌株的小组有:B1-1组,采样时间在2017年7、8月;B1-2a-1组,采样时间在2016及2017年7、8月;B1-2a-2组,采样时间在2016及2017年8月;B1-2a-3组,所含菌株数目最多,采样时间分布在2015年8、9月,2016年7、8月和2017年5月、7-9月,组内的部分菌株存在每2株或3株的采样时间和地点十分接近;B1-2b-2组,采样时间为2015及2017年8月、2016年5、8月。B1-2b-1组菌株全部采自空港医院,采样时间2015及2016年的6、7月。2017年8月24日采的BJSY2017VP038株比其他相似菌株图谱中多了一条十分明显酶切条带。据流行病学资料,该病例为家中独自进餐后发病,可疑感染食品为蔬菜类及其制品,且食品购自当地。
3 讨论副溶血弧菌为革兰阴性嗜盐杆菌,是引起全球食源性疾病的主要致病菌之一。顺义区作为内陆地区,2013-2015年的细菌学检测结果显示,副溶血弧菌已成为导致腹泻的第3位主要病原菌[5],北京市其他区(县)和全国其他地区的监测结果与之类似[6-10]。
溶血素是副溶血弧菌致病的主要因素,包括TLH、TDH和TRH,它们分别由tlh、tdh和trh基因编码。其中tlh基因具有种特异性,tdh和trh是副溶血弧菌P的毒力基因,与致病相关。本研究中的98株副溶血弧菌分离株均为tlh+,进一步证实了其均为副溶血弧菌;1株O11:KUT型分离株tdh- trh-,说明该菌株可能不致病,或由脂多糖等其他致病因素致病;其余菌株tdh+ trh-,证明它们可能因表达TDH而致病。
与以往研究结果相同[11],本研究结果显示副溶血弧菌的阳性检出时间呈现明显的季节性,夏季检出率高。3年的检出高峰均在8月,10月至次年4月未检出。这可能与夏季海鲜的流通和食用都较为频繁,加之生食的蔬果也可能被副溶血弧菌交叉污染等因素相关。
据报道副溶血弧菌在男性病例中的阳性检出率较高[12],也有报道男女病例的副溶血弧菌阳性检出率无差异[11],本研究结果与后者一致。16~45岁的青壮年副溶血弧菌阳性检出率较高,职业以其他职业、商业服务和工人较高。造成该结果的原因可能是:该年龄段和职业人群在外就餐机会较多,夏季常见的烧烤等烹饪方式对食物加热可能不充分,或直接生食的食品被副溶血弧菌污染。
以往认为,副溶血弧菌感染主要源自高盐的水产制品[1],本研究结果表明,阳性检出率最高的是水产类及其制品。但其阳性数并没有超过肉及其制品和蔬菜及其制品。这可能是因为其他食品与高盐的水产品间的交叉污染也可能会造成副溶血弧菌感染[13]。
感染副溶血弧菌可能会引起急性胃肠炎,临床症状主要表现为腹痛、腹泻、呕吐和发热[14]。本研究中副溶血弧菌阳性病例的全身症状以脱水、发热和乏力为主,消化道症状以腹痛、恶心和呕吐为主,粪便性状以水样便为主,偶见血便。据报道,副溶血弧菌感染后病例可能会出现血便症状[15]。造成各项临床症状不同的原因可能与感染的副溶血弧菌型别不同以及个人的免疫力水平不同有关。
根据菌体O和荚膜K抗原的不同,副溶血弧菌可被分为13个热稳定O抗原群(O1~O13),71种热不稳定K抗原群(K1~K71),除此之外仍存在许多不能被血清分型的菌株。本研究中的98株副溶血弧菌菌株,共分为9个血清型,其中最多的是O3:K6型,其次为O4:K8和O4:KUT型,该结果与以往报道类似[16]。据报道,O3:K6型副溶血弧菌曾在全球多地引起过腹泻的暴发[17-18]。因此,本研究进一步做了O3:K6型的PFGE聚类分析。
PFGE被称为细菌分子分型的金标准[19]。通过聚类分析,A分支和B2分支的3株菌株与其余菌株的相似度较低。结合流行病学资料,这3株菌株为外源性输入的可能性较小,推测可能是这些致病副溶血弧菌菌株传染性较弱,并非本地的主要流行株。有报道称,副溶血弧菌的血清型和PFGE图谱的聚类结果没有相关性[16],这可能是个别菌株相似度较低的原因。相似度较高的6个小组中的大部分菌株的采样时间和地点不一致,为散发病例。B1-2a-3组的菌株的数量较大,可能为副溶血弧菌在本地区的优势型别,该组内的部分菌株存在每2株或3株的采样时间和地点十分接近,结合流行病学资料分析可能为聚集性发病。65株O3:K6型菌株中的大部分聚集成簇,相似度较高。BJSY2017VP038株比其他相似菌株图谱中多了一条十分明显的酶切条带,可能是该菌株的基因组发生了变异。
据报道,世界范围内引起腹泻暴发的O3:K6型菌株均为tdh+ trh-,且具有一致的基因特征[20]。顺义区全部O3:K6型菌株均为tdh+ trh-,其是否与引起腹泻暴发的菌株一致,仍需进一步鉴定。
作者贡献:
张爽 ORCID:0000-0002-5372-1907
张爽:大部分实验工作和文章撰写
李颖:实验工作和论文指导
张彦春、王园园、张赫:实验工作
马红梅:实验经费支持和论文指导
| [1] |
McLaughlin JB, DePaola A, Bopp CA, et al. Outbreak of Vibrio parahaemolyticus gastroenteritis associated with Alaskan oysters[J]. N Engl J Med, 2005, 353(14): 1463-1470. DOI:10.1056/NEJMoa051594 |
| [2] |
Joseph SW, Colwell RR, Kaper JB. Vibrio parahaemolyticus and related halophilic Vibrios[J]. CRC Crit Rev Microbiol, 1982, 10(1): 77-124. DOI:10.3109/10408418209113506 |
| [3] |
杨小蓉, 李薇薇, 赵晋, 等. 2009年四川省副溶血性弧菌血清型、致病力及分子分型研究[J]. 预防医学情报杂志, 2013, 29(1): 25-29. Yang XR, Li WW, Zhao J, et al. The serotype, virulence genes and molecular type of Vibrio parahaemolyticus in Sichuan Province in 2009[J]. J Prev Med Inf, 2013, 29(1): 25-29. |
| [4] |
Gonzalez-Escalona N, Jolley KA, Reed E, et al. Defining a core genome multilocus sequence typing scheme for the global epidemiology of Vibrio parahaemolyticus[J]. J Clin Microbiol, 2017, 55(6): 1682-1697. DOI:10.1128/JCM.00227-17 |
| [5] |
朱美娟, 李颖, 王彦波. 2013-2015年北京市顺义区947份感染性腹泻病原菌监测结果分析[J]. 现代预防医学, 2017, 44(4): 734-737, 754. Zhu MJ, Li Y, Wang YB. Analysis on the 947 pathogens in infectious diarrhea in Shunyi district in Beijing from 2013 to 2015[J]. Mod Prev Med, 2017, 44(4): 734-737, 754. |
| [6] |
杨艳娜, 李洪军, 李秋虹. 2011-2015年通州区感染性腹泻监测病例细菌性病原谱分析[J]. 疾病监测, 2017, 32(6): 477-480. Yang YN, Li HJ, Li QH. Bacterial diarrhea pathogen spectrum in Tongzhou district, Beijing, 2011-2015[J]. Dis Surveill, 2017, 32(6): 477-480. DOI:10.3784/j.issn.1003-9961.2017.06.009 |
| [7] |
卢丽彬, 闫雪, 赵明星, 等. 2014-2016年北京市怀柔区食源性疾病主动监测结果[J]. 职业与健康, 2017, 33(18): 2494-2496, 2501. Lu LB, Yan X, Zhao MX, et al. Active monitoring results of food-borne diseases in Huairou District of Beijing from 2014-2016[J]. Occup Health, 2017, 33(18): 2494-2496, 2501. DOI:10.13329/j.cnki.zyyjk.2017.0747 |
| [8] |
于兆阳, 张薇薇. 北京市密云地区腹泻病原菌耐药性分析[J]. 中国卫生检验杂志, 2017, 27(5): 751-753. Yu ZY, Zhang WW. Analysis of the drug resistance of diarrhea pathogens in Miyun, Beijing[J]. Chin J Health Lab Technol, 2017, 27(5): 751-753. |
| [9] |
姚利利, 何平, 沈先标, 等. 2014-2016年上海市宝山区食品中微生物污染监测结果分析[J]. 现代预防医学, 2017, 44(10): 1776-1779. Yao LL, He P, Shen XB, et al. Analysis on the monitoring results of food microbial contamination in Baoshan district of Shanghai from 2014 to 2016[J]. Mod Prev Med, 2017, 44(10): 1776-1779. |
| [10] |
Li YH, Xie X, Shi XL, et al. Vibrio parahaemolyticus, southern coastal region of China, 2007-2012[J]. Emerg Infect Dis, 2014, 20(4): 685-688. DOI:10.3201/eid2004.130744 |
| [11] |
武庆锐, 杨军勇, 董晓根, 等. 2013年北京市丰台区腹泻病人和水产品中副溶血性弧菌带菌状况调查[J]. 实用预防医学, 2017, 24(3): 304-308. Wu QR, Yang JY, Dong XG, et al. Infection status of Vibrio parahaemolyticus in diarrhea patients and aquatic products in Fengtai District, Beijing, 2013[J]. Pract Prev Med, 2017, 24(3): 304-308. DOI:10.3969/j.issn.1006-3110.2017.03.013 |
| [12] |
封会茹, 曲梅, 耿荣, 等. 2010-2012年北京市丰台区感染性腹泻病原菌分布及耐药性分析[J]. 疾病监测, 2013, 28(2): 96-100. Feng HR, Qu M, Geng R, et al. Distribution and drug resistance of enteric pathogenic bacteria in Fengtai, Beijing, 2010-2012[J]. Dis Surveill, 2013, 28(2): 96-100. DOI:10.3784/j.issn.1003-9961.2013.2.004 |
| [13] |
Liu YH, Tam YH, Yuan J, et al. A foodborne outbreak of gastroenteritis caused by Vibrio parahaemolyticus and norovirus through non-seafood vehicle[J]. PLoS One, 2015, 10(9): e0137848. DOI:10.1371/journal.pone.0137848 |
| [14] |
Li H, Tang R, Lou Y, et al. A comprehensive epidemiological research for clinical Vibrio parahaemolyticus in Shanghai[J]. Front Microbiol, 2017, 8: 1043. DOI:10.3389/fmicb.2017.01043 |
| [15] |
赵虹, 王维黎, 马景红, 等. 1起副溶血弧菌引起食物中毒的报告[J]. 预防医学情报杂志, 2003, 19(2): 177. Zhao H, Wang WL, Ma JH, et al. A report of food poisoning caused by Vibrio parahaemolyticus[J]. J Prev Med Inf, 2003, 19(2): 177. DOI:10.3969/j.issn.1006-4028.2003.02.046 |
| [16] |
Wang HL, Tang XY, Su YC, et al. Characterization of clinical Vibrio parahaemolyticus strains in Zhoushan, China, from 2013 to 2014[J]. PLoS One, 2017, 12(7): e0180335. DOI:10.1371/journal.pone.0180335 |
| [17] |
Guerrero A, Lizárraga-Partida ML, Gómez Gil Rodríguez B, et al. Genetic analysis of Vibrio parahaemolyticus O3:K6 strains that have been isolated in Mexico since 1998[J]. PLoS One, 2017, 12(1): e0169722. DOI:10.1371/journal.pone.0169722 |
| [18] |
Velazquez-Roman J, León-Sicairos N, de Jesus Hernández-Díaz L, et al. Pandemic Vibrio parahaemolyticus O3:K6 on the American continent[J]. Front Cell Infect Microbiol, 2014, 3: 110. DOI:10.3389/fcimb.2013.00110 |
| [19] |
Kam KM, Luey CKY, Parsons MB, et al. Evaluation and validation of a PulseNet standardized pulsed-field gel electrophoresis protocol for subtyping Vibrio parahaemolyticus:an international multicenter collaborative study[J]. J Clin Microbiol, 2008, 46(8): 2766-2773. DOI:10.1128/JCM.00424-08 |
| [20] |
Matsumoto C, Okuda J, Ishibashi M, et al. Pandemic spread of an O3:K6 clone of Vibrio parahaemolyticus and emergence of related strains evidenced by arbitrarily primed PCR and toxRS sequence analyses[J]. J Clin Microbiol, 2000, 38(2): 578-585. |
 2018, Vol. 33
2018, Vol. 33


