扩展功能
文章信息
- 张颖华, 陈秀华, 刘芸, 童锐, 王小光
- Zhang Yinghua, Chen Xiuhua, Liu Yun, Tong Rui, Wang Xiaoguang
- 2014-2017年上海市闵行区副溶血弧菌的耐药性分析及预测
- Analysis and prediction of antibiotic resistance of Vibrio parahaemolyticus isolates in Minhang district of Shanghai, 2014-2017
- 疾病监测, 2018, 33(5): 376-380
- Disease Surveillance, 2018, 33(5): 376-380
- 10.3784/j.issn.1003-9961.2018.05.007
-
文章历史
- 收稿日期:2018-02-12
副溶血弧菌(Vibrio parahaemolyticus),又称致病性嗜盐菌,常存在于海水鱼虾贝类海产品中,是一种典型的食源性致病菌,在沿海地区其常引起食源性疾病暴发[1-5]。临床上常用头孢类和喹诺酮类抗生素治疗因副溶血弧菌引起的腹泻,了解其耐药谱对腹泻病治疗有重要参考作用。不同地区和来源的副溶血弧菌的耐药谱不同,国内外文献报道其对临床常用抗生素的敏感率多>90%[6-8],但缺乏耐药趋势分析。目前,抗生素耐药严重,可推测虽同为敏感菌株,但这些敏感性可能会逐年下降。因此,我们收集2014-2017年上海市闵行区腹泻病监测点的分离到的副溶血弧菌,分析其耐药谱,并预测敏感菌株可能出现耐药的时间,为其耐药监测和评估提供参考。
1 材料与方法 1.1 腹泻患者来源2014-2017年上海市闵行区腹泻病监测点(复旦大学附属第五人民医院、七宝社区卫生服务中心)急性腹泻患者,按10:1比例抽取,各年份腹泻病例数分别为3 375、3 933、4 441和4 118例。留取患者粪便标本,放入卡里管内,于24 h内送往闵行区疾病预防控制中心微生物实验室进行副溶血弧菌的分离培养鉴定。
1.2 副溶血弧菌的分离培养鉴定根据感染性腹泻病诊断标准WS 271-2007,将腹泻患者的肛拭标本接种于氯化钠结晶紫增菌液,(35±2)℃培养6~ 8 h。取1接种环增菌液,划线接种于硫代硫酸盐柠檬酸盐胆盐蔗糖(TCBS)琼脂平板,(35±2)℃培养18~24 h,挑取可疑菌落进行生化鉴定,鉴定为副溶血弧菌者进行药敏实验。
1.3 药敏实验采用CLSI 2014推荐的纸片扩散法[9]对分离培养的1 376株菌进行药敏实验。药敏纸片包括头孢噻肟(CTX,30 μg)、头孢呋辛(CXM,30 μg)、头孢西丁(FOX,30 μg)、环丙沙星(CIP,5 μg)、诺氟沙星(NOR,10 μg)、左氧氟沙星(LEV,5 μg)、四环素(TE)、庆大霉素(CN,10 μg)、萘啶酸(NA,30 μg)、氯霉素(C,30 μg)、复方新诺明(SXT,1.25、23.75 μg)(英国Oxoid公司)。将菌在血平板上的纯培养物制成0.5麦氏比浊浓度菌悬液,均匀涂抹至水解酪蛋白胨(MH)琼脂平板,(35±2)℃培养16~18 h,游标卡尺测量抑菌圈直径,根据CLSI doucument M45标准判断敏感(S)、中介(I)和耐药(R)[9]。质控菌株为大肠埃希菌(Escherichia coli) ATCC25922。
1.4 统计学分析利用SPSS 20.0软件进行分析,副溶血弧菌对头孢噻肟、头孢呋辛的敏感率的年份差异采用χ2检验分析,抑菌圈直径以均值±标准差(x±s)表示,单因素方差分析比较各年份抑菌圈直径,利用Excel软件制作折线图,分析不同年份抗生素敏感株的敏感性下降趋势并进行耐药预测。P<0.05为差异有统计学意义。
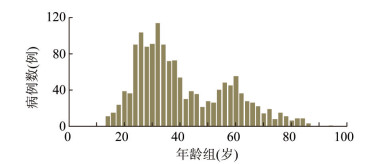
2 结果 2.1 基本信息1 376例腹泻患者中,男性657例,女性719例。年龄13~93岁,集中于20~60岁年龄组(图 1)。2014-2017年副溶血弧菌数及构成比分别为61(4.43%)、287(20.86%)、736(53.49%)、292 (21.22%)。
|
| 图 1 1 376例副溶血弧菌感染所致腹泻患者年龄分布 Figure 1 Age distribution of 1 376 diarrhea patients infected with V. parahaemolyticus |
| |
1 376株副溶血弧菌对头孢类抗生素CTX、CXM、FOX耐药率分别为1.89%、19.40%和1.60%,中度耐药率分别为8.94%、39.24%和11.55%,敏感率分别为89.17%、41.35%和86.85%,而对其他抗生素的敏感率均> 94.00%,见表 1。
| 抗生素 | 敏感 | 中介 | 耐药 | |||||
| 菌株数 | 率(%) | 菌株数 | 率(%) | 菌株数 | 率(%) | |||
| 头孢噻肟 | 1 227 | 89.17 | 123 | 8.94 | 26 | 1.89 | ||
| 头孢呋辛 | 569 | 41.35 | 540 | 39.24 | 267 | 19.40 | ||
| 头孢西丁 | 1 195 | 86.85 | 159 | 11.55 | 22 | 1.60 | ||
| 环丙沙星 | 1 306 | 94.91 | 56 | 4.07 | 14 | 1.01 | ||
| 诺氟沙星 | 1 362 | 98.98 | 10 | 0.70 | 4 | 0.29 | ||
| 左氧氟沙星 | 1 367 | 99.35 | 5 | 0.36 | 4 | 0.29 | ||
| 萘啶酸 | 1 345 | 97.75 | 21 | 1.53 | 10 | 0.73 | ||
| 四环素 | 1 359 | 98.76 | 2 | 0.10 | 15 | 1.09 | ||
| 庆大霉素 | 1 348 | 97.96 | 14 | 1.01 | 14 | 1.02 | ||
| 氯霉素 | 1 364 | 99.13 | 3 | 0.22 | 9 | 0.65 | ||
| 复方新诺明 | 1 351 | 98.18 | 5 | 0.36 | 20 | 1.45 | ||
对抗生素敏感的菌株中,不同年份抗生素敏感性差异有统计学意义。菌株对CTX、CXM、LEV、NA的抑菌圈直径逐年减小(表 2)。因2014年对CXM敏感株仅1株,故CXM数据可能有偏倚。
| 抗生素 | 2014年 | 2015年 | 2016年 | 2017年 | 合计 | F值 | P值 | |||||||
| 菌株数 | 抑菌圈直径 (mm) |
菌株数 | 抑菌圈直径 (mm) |
菌株数 | 抑菌圈直径 (mm) |
菌株数 | 抑菌圈直径 (mm) |
|||||||
| 头孢噻肟 | 58 | 31.22±2.82 | 270 | 31.06±2.59 | 670 | 29.74±2.25 | 229 | 28.64±2.48 | 1 227 | 51.660 | < 0.01 | |||
| 头孢呋辛 | 1 | 27.26±0.00 | 201 | 20.12±2.01 | 250 | 18.86±1.43 | 117 | 18.94±1.18 | 569 | 33.211 | < 0.01 | |||
| 头孢西丁 | 51 | 20.64±2.79 | 270 | 23.19±3.75 | 621 | 20.75±2.57 | 254 | 19.52±1.57 | 1 196 | 84.687 | < 0.01 | |||
| 环丙沙星 | 61 | 26.98±3.06 | 275 | 26.10±2.42 | 680 | 24.96±2.27 | 290 | 25.82±1.89 | 1 306 | 30.606 | < 0.01 | |||
| 诺氟沙星 | 60 | 26.26±2.95 | 282 | 26.63±2.81 | 732 | 24.94±2.47 | 288 | 25.22±1.96 | 1 362 | 34.390 | < 0.01 | |||
| 左氧氟沙星 | 61 | 25.80±3.11 | 287 | 25.82±2.75 | 731 | 24.24±2.44 | 288 | 24.64±1.84 | 1 367 | 33.453 | < 0.01 | |||
| 萘啶酸 | 61 | 26.88±2.27 | 279 | 26.71±2.65 | 713 | 24.52±2.35 | 292 | 24.00±1.52 | 1 345 | 159.588 | < 0.01 | |||
| 四环素 | 61 | 26.58±1.55 | 280 | 26.13±2.75 | 728 | 24.43±2.16 | 290 | 24.35±1.67 | 1 359 | 59.144 | < 0.01 | |||
| 庆大霉素 | 61 | 19.48±2.03 | 266 | 18.14±2.45 | 732 | 18.97±1.63 | 289 | 19.51±1.37 | 1 348 | 29.175 | < 0.01 | |||
| 氯霉素 | 61 | 31.91±2.36 | 283 | 31.22±2.91 | 728 | 28.08±2.88 | 292 | 29.54±1.86 | 1 364 | 118.417 | < 0.01 | |||
| 复方新诺明 | 60 | 24.66±2.21 | 281 | 25.00±2.55 | 726 | 21.68±2.05 | 284 | 22.76±2.00 | 1 351 | 176.770 | < 0.01 | |||
| 注:抑菌圈直径以均值±标准差(x±s)表示 | ||||||||||||||
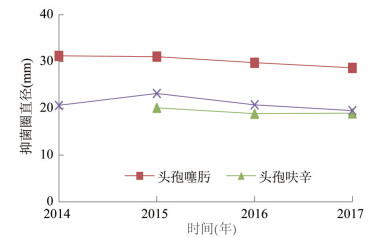
由图 2可以看出,CTX抑菌圈直径随年份变化有逐年下降趋势,直线方程为y = -0.906x + 32.43,R2 = 0.928 5。CXM和FOX抑菌圈直径也呈下降趋势,但不明显。CTX的斜率较CXM和FOX大,下降速度更快。
|
| 图 2 头孢类抗生素抑菌圈直径变化趋势 Figure 2 Inhibition zone diameters of cephalosporins by year |
| |
由图 3可以看出,喹诺酮类抗生素抑菌圈直径整体呈逐年下降趋势,LEV、NA的下降趋势变化比较明显。NA线性方程分别为y = -1.083x + 28.24,R2 = 0.892,下降速度快于LEV、CIP和NOR。

|
| 图 3 喹诺酮类抗生素抑菌圈直径变化趋势 Figure 3 Inhibition zone diameters of quinoloncs by year |
| |
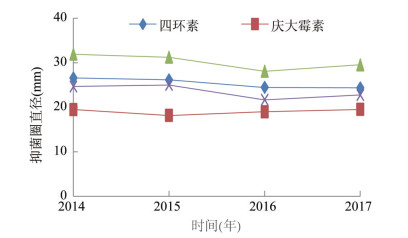
由图 4可以看出,TE、CN、C、SXT抑菌圈直径变化趋势不明显,且CN抑菌圈直径有随年份增长趋势,即抑菌圈直径越来越大。
|
| 图 4 其他类抗生素抑菌圈直径变化趋势 Figure 4 Inhibition zone diameters of other antibiotics by year |
| |
对线性回归趋势线相关性较好的2种抗生素CTX、NA进行耐药预测,对于CTX来说,推算副溶血弧菌自2014年起第8年(2022年)开始出现中度耐药,第11年(2025年)开始耐药。同理对NA来说,推算其分别在2023年出现中度耐药,2027年出现耐药,见表 3。
| 抗生素 | 回归方程 | x1 | x2 | 中度耐药年份 | 耐药年份 |
| 头孢噻肟 | y=-0.906x+32.43,R2=0.928 5 | 8 | 11 | 2022 | 2025 |
| 萘啶酸 | y=-1.083x+28.24,R2=0.892 | 9 | 13 | 2023 | 2027 |
副溶血弧菌是全球范围内引起食源性疾病的一种重要致病菌。食用被其污染的水产品可引起急性肠胃炎,常伴有腹泻、头痛、呕吐、恶心等症状。抗生素是治疗的有效药物。抗生素耐药日益严重,了解并掌握副溶血弧菌的耐药谱、耐药趋势及敏感菌株可能出现耐药的时间十分重要。
本研究的1 376株副溶血弧菌主要来源于20~ 60岁年龄组人群,尤常见于20~40岁年龄组,可能与青壮年更喜食海产品有关,海产品处置不当被误食也可导致腹泻。本研究中 < 13岁年龄组未分离出菌株,主要因本研究腹泻病监测点患者主要为二、三级医院的成年人腹泻病例,< 13岁儿童主要选择儿科医院就诊,目前儿科医院不属于监测点,故暂无 < 13岁年龄组病例及菌株数。本研究数据显示,2014-2017年副溶血弧菌菌株数差异较大,具体原因待进一步调查,可能与当年副溶血弧菌引起食源性疾病的次数有关。
本研究发现,副溶血弧菌对头孢类抗生素的耐药率比较高,CTX的敏感率由2014年的95.08%下降至2017的78.42%,CXM的敏感率由2015年的70.03%下降至2017的40.07%,CTX的耐药率(1.89%,26 / 1 376)稍高于马来西亚数据(1.49%,1/67),但中度耐药率(8.94%,123/1 376)远低于马来西亚(31.34%,21/67)[6],远高于我国南部11个省(直辖市)0.00%的耐药率[10]。
有研究表明,副溶血弧菌对氨苄西林(AMP)、链霉素(STR)、头孢唑林(CZ)、卡那霉素(KAN)等高度耐药,我国南部11个省(直辖市)海产品中分离的98株副溶血弧菌对AMP、STR、CZ和KAN的耐药率分别为79.59%、68.37%、39.80%和39.80%[10],我国北部6省从水产品中分离的145株副溶血弧菌对AMP、STR、CZ和KAN的耐药率为86.2%、49.6%、43.5%和22.1%[11]。本研究未监测该4种抗生素的耐药性,因此,应扩大抗生素耐药的监测种类,以便更全面了解和掌握副溶血弧菌对抗生素的耐药情况。来源不同(水体、零售水产品、腹泻患者)的副溶血弧菌耐药谱不尽相同[12-15],故加强水产养殖场、市场零售水产品副溶血弧菌的耐药性监测同样重要,可为其风险评估提供更全面的资料。
研究发现,副溶血弧菌除对头孢类抗生素耐药率比较高外,对CIP、LEV、C、CN、NA、SXT均高度敏感,与国内外其他研究基本一致,敏感率多> 90%[8, 10-11],但相对于浙江省舟山地区100%的敏感率已有下降趋势[16]。副溶血弧菌对部分抗生素的耐药率较低是该菌生存环境决定还是其本身固有某种分子机制导致值得深入探讨。
抗生素抑菌圈直径是判断耐药的依据,低于临界值为耐药,高于临界值判断为敏感。同为敏感株,抗生素对其抑菌圈直径变化范围足够大,仅判为耐药和敏感易掩盖副溶血弧菌敏感性变化趋势,特别是对敏感株而言,可误认为其对抗生素的敏感性一直处于较高水平。本研究对抗生素敏感的副溶血弧菌抑菌圈直径随年份变化的分析结果表明,CTX、CXM、FOX、LEV、NA、C、TE和SXT的抑菌圈直径有逐年下降趋势,特别是CTX、NA下降趋势比较明显,若不采取有效措施,并在其他影响因素不变的情况下,预计未来几年内耐药株可能将大量增加。与其他抗生素不同,CN抑菌圈直径呈微上升趋势,农业部自2015年开始禁用NOR、CN等抗生素,或许可以佐证停用抗生素或规范使用抗生素可减少耐药发生。本研究局限性在于仅有4年数据,增加将来2~3年的数据和菌株数进一步分析更有说服力,通过趋势分析可更早推算菌株出现耐药的时间,以便及早采取干预措施,控制耐药株或超级耐药株的发生。
目前,相关专业人员已意识到农业抗生素滥用造成耐药的严重性,中华人民共和国农业部已颁发《全国遏制动物源细菌耐药行动计划(2017 - 2020)》[农医发(2017)22号],提出遏制细菌耐药的行动目标及6个重点任务,包括农业抗生素使用的监管及促生长用抗菌药物的逐步退出行动,动物源性细菌耐药监测体系的健全等。
针对抗生素耐药问题需要多部门协同合作,应扩大临床分离株的抗生素耐药监测种类;加强水体和零售食品分离株的耐药监测;增加环境中抗生素抗性基因的检测;考虑完善抗生素耐药监测评估体系,以便动态了解和全面掌握病原菌的耐药情况;积极研发治疗抗生素耐药菌的生物制剂等。通过多部门、多学科的共同努力来遏制细菌耐药的发生发展。
作者贡献:
张颖华 ORCID:0000-0002-5937-7174
张颖华:药敏实验、数据整理分析、文章撰写
陈秀华、刘芸、童锐:数据录入、药敏实验
王小光:协调
| [1] |
Martinez-Urtaza J, Powell A, Jansa J, et al. Epidemiological investigation of a foodborne outbreak in Spain associated with U.S.West Coast genotypes of Vibrio parahaemolyticus[J]. Springerplus, 2016, 5: 87. DOI:10.1186/s40064-016-1728-1 |
| [2] |
Haendiges J, Jones J, Myers RA, et al. A nonautochthonous U.S.Strain of Vibrio parahaemolyticus isolated from chesapeake bay oysters caused the outbreak in maryland in 2010[J]. Appl Environ Microbiol, 2016, 82(11): 3208-3216. DOI:10.1128/AEM.00096-16 |
| [3] |
Gonzalez-Escalona N, Gavilan RG, Toro M, et al. Outbreak of Vibrio parahaemolyticus sequence type 120, Peru, 2009[J]. Emerg Infect Dis, 2016, 22(7): 1235-1237. DOI:10.3201/eid2207.151896 |
| [4] |
Chonsin K, Matsuda S, Theethakaew C, et al. Genetic diversity of Vibrio parahaemolyticus strains isolated from farmed Pacific white shrimp and ambient pond water affected by acute hepatopancreatic necrosis disease outbreak in Thailand[J]. FEMS Microbiol Lett, 2016, 363(2): fnv222. DOI:10.1093/femsle/fnv222 |
| [5] |
Liu YH, Tam YH, Yuan J, et al. A foodborne outbreak of gastroenteritis caused by Vibrio parahaemolyticus and norovirus through non-seafood vehicle[J]. PLoS One, 2015, 10(9): e0137848. DOI:10.1371/journal.pone.0137848 |
| [6] |
Tan CW, Malcolm TTH, Kuan CH, et al. Prevalence and antimicrobial susceptibility of Vibrio parahaemolyticus isolated from short mackerels(Rastrelliger brachysoma) in Malaysia[J]. Front Microbiol, 2017, 8: 1087. DOI:10.3389/fmicb.2017.01087 |
| [7] |
Kang CH, Shin Y, Kim W, et al. Prevalence and antimicrobial susceptibility of Vibrio parahaemolyticus isolated from oysters in Korea[J]. Environ Sci Pollut Res, 2016, 23(1): 918-926. DOI:10.1007/s11356-015-5650-9 |
| [8] |
Letchumanan V, Yin WF, Lee LH, et al. Prevalence and antimicrobial susceptibility of Vibrio parahaemolyticus isolated from retail shrimps in Malaysia[J]. Front Microbiol, 2015, 6: 33. DOI:10.3389/fmicb.2015.00033 |
| [9] |
Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing: 25th informational supplement//CLSI Document M100-S25[S]. Wayne, PA: Clinical and Laboratory Standards Institute, 2015.
|
| [10] |
Yang Y, Xie JF, Li H, et al. Prevalence, antibiotic susceptibility and diversity of Vibrio parahaemolyticus isolates in seafood from South China[J]. Front Microbiol, 2017, 8: 2566. DOI:10.3389/fmicb.2017.02566 |
| [11] |
Xu XK, Cheng JH, Wu QP, et al. Prevalence, characterization, and antibiotic susceptibility of Vibrio parahaemolyticus isolated from retail aquatic products in North China[J]. BMC Microbiol, 2016, 16: 32. DOI:10.1186/s12866-016-0650-6 |
| [12] |
Ottaviani D, Leoni F, Talevi G, et al. Extensive investigation of antimicrobial resistance in Vibrio parahaemolyticus from shellfish and clinical sources, Italy[J]. Int J Antimicrob Agents, 2013, 42(2): 191-193. DOI:10.1016/j.ijantimicag.2013.05.003 |
| [13] |
Pazhani GP, Bhowmik SK, Ghosh S, et al. Trends in the epidemiology of pandemic and non-pandemic strains of Vibrio parahaemolyticus isolated from diarrheal patients in Kolkata, India[J]. PLoS Negl Trop Dis, 2014, 8(5): e2815. DOI:10.1371/journal.pntd.0002815 |
| [14] |
Obaidat MM, Salman AEB, Roess AA. Virulence and antibiotic resistance of Vibrio parahaemolyticus isolates from seafood from three developing countries and of worldwide environmental, seafood, and clinical isolates from 2000 to 2017[J]. J Food Prot, 2017, 80(12): 2060-2067. DOI:10.4315/0362-028X.JFP-17-156 |
| [15] |
Hu QX, Chen LM. Virulence and antibiotic and heavy metalresistance of vibrio parahaemolyticus isolated from crustaceans and shellfish in Shanghai, China[J]. J Food Prot, 2016, 79(8): 1371-1377. DOI:10.4315/0362-028X.JFP-16-031 |
| [16] |
Wang HL, Tang XY, Su YC, et al. Characterization of clinical Vibrio parahaemolyticus strains in Zhoushan, China, from 2013 to 2014[J]. PLoS One, 2017, 12(7): e0180335. DOI:10.1371/journal.pone.0180335 |
 2018, Vol. 33
2018, Vol. 33


