扩展功能
文章信息
- 杨卫红, 冯云, 章域震, 潘虹, 张云智, 韩茜, 周济华, 袁庆虹, 张海林
- Yang Weihong, Feng Yun, Zhang Yuzhen, Pan Hong, Zhang Yunzhi, Han Xi, Zhou Jihua, Yuan Qinghong, Zhang Hailin
- 2012-2015年云南省狂犬病病毒糖蛋白基因进化特征分析
- Phylogenetic analysis on glycoprotein genome of rabies viruses in Yunnan, 2012-2015
- 疾病监测, 2018, 33(4): 300-305
- Disease Surveillance, 2018, 33(4): 300-305
- 10.3784/j.issn.1003-9961.2018.04.010
-
文章历史
- 收稿日期:2017-10-26
狂犬病是由狂犬病病毒(Rabies virus,RABV)引起的一种人兽共患病,犬是当前人类狂犬病的主要传染源[1-3]。20世纪80年代,狂犬病在我国大范围流行,90年代得到控制。我国新一轮狂犬病大流行起始于21世纪初,近10多年来,大多数省份都有流行,近几年疫情有下降趋势[4-6]。云南省新一轮狂犬病流行始于2000年,2016年仍有13州市35县(区、市)发生狂犬病48例,仍属狂犬病高发地区[6-7]。Tao等[8-9]和Guo等[10]对我国RABV核蛋白(nucleoprotein,N)或糖蛋白(glycoprotein,G)基因全序列的系统进化分析表明,我国的RABV可分为6个进化群(China-Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ和Ⅵ),各省(直辖市、自治区)的进化群分布有所不同,传播来源亦较为复杂。Zhang等[7]对云南省2006-2012年RABV N基因序列的进化分析表明,云南省存在4个进化群RABV的流行,即YN-A、YN-B、YN-C和YN-D,并分别属于China - Ⅰ、Ⅵ、Ⅱ、Ⅲ,具有基因多样性[7, 11-13]。虽然云南省RABV G基因序列的分析在2008-2011年间见诸一些报道[14-17],但未发现使用G基因做过上述中国进化群的分析。本研究对2012-2015年云南省RABV样本进行G基因序列测定和系统进化分析,以期阐明云南省RABV流行株的G基因进化特征及当前流行株的主要进化群。
1 材料与方法 1.1 标本在云南省狂犬病流行地区采集狂犬、可疑犬脑组织标本,狂犬病患者唾液和尸检脑组织标本。所有标本置于2 ml冻存管中,4 ℃冷藏箱运送到云南省地方病防治所病毒实验室检测。所有脑组织标本用直接免疫荧光试验(direct immunofluorescence assay,DFA)进行RABV抗原检测[18],阳性标本贮存于-80 ℃冰箱,备用。
1.2 RABV核酸检测采用反转录聚合酶链式反应(reverse transcription - polymerase chain reaction,RT-PCR)法。使用TRIzol试剂(Invitrogen Carlsbad,CA,USA)提取病毒RNA。用Ready - To - Go You - Prime First-strand Beads试剂(GE Healthcare,USA)反转录合成cDNA。常规PCR法检测RABV核酸,1%琼脂糖凝胶检测扩增产物。引物及扩增条件见文献[18]。阳性者进行G基因序列测定。
1.3 G基因序列测定选择RABV核酸检测阳性样本,用RABV G基因特异性引物扩增其序列[16],PCR产物经QIAquick PCR Purification Kit试剂(QIAGEN)纯化,由生工生物工程(上海)股份有限公司完成测序。
1.4 序列分析使用DNA Star软件中的Seqmen对获得的核苷酸序列进行编辑;用MEGA 5.0软件邻接法(neighbor-joining,NJ)进行系统进化树分析。本研究引用来自GenBank中18株RABV G基因序列,其中8株China-Ⅰ(云南2006和2007年2株、四川4株、湖南1株、贵州1株)、1株China-Ⅱ(广西)、1株China-Ⅲ(河南)、1株China-Ⅳ(内蒙古)、1株China-Ⅴ(重庆)和1株China-Ⅵ(云南2006年),缅甸、越南和老挝各1株(类似China-Ⅵ),斯里兰卡和美国各1株,见表 1。
| 病毒株名称 | GenBank接受号 | 进化群 | 年份 | 地区或国家 | 参考文献 |
| SCR1002 | JX005928 | China-Ⅰ | 2009 | 四川省 | 未出版 |
| SCR0965 | JX005925 | China-Ⅰ | 2009 | 四川省 | 未出版 |
| SCR0968 | JX005926 | China-Ⅰ | 2009 | 四川省 | 未出版 |
| SichuanBZ1 | GU591791 | China-Ⅰ | 2009 | 四川省 | [8] |
| GuizhouQx2 | EU267750 | China-Ⅰ | 2004 | 贵州省 | [19] |
| HNDB11 | EU008924 | China-Ⅰ | 2005 | 湖南省 | [20] |
| YunnanMd06 | EU253477 | China-Ⅰ | 2006 | 云南省楚雄州 | [14] |
| YunnanQJ07 | EU275240 | China-Ⅰ | 2007 | 云南省曲靖市 | [14] |
| GXSL | GQ472558 | China-Ⅱ | 2005 | 广西壮族自治区 | [21] |
| MRV | DQ875050 | China-Ⅲ | 2004 | 河南省 | [10] |
| NeiMeng927A | EU284095 | China-Ⅳ | 2007 | 内蒙古自治区 | [22] |
| CQ92 | DQ849072 | China-V | 1992 | 重庆市 | [23] |
| YunnanTC06 | EU275242 | China-Ⅵ | 2006 | 云南省保山市 | [14] |
| 9913BIR | EU086129 | 东南亚 | 1999 | 缅甸 | [24] |
| 01017VNM | EU086160 | 东南亚 | 2001 | 越南 | [24] |
| Lao4 | AB981664 | 东南亚 | 2011 | 老挝 | [25] |
| G6309 | AB817101 | 东南亚 | 2009 | 斯里兰卡 | [26] |
| G0960 | KF484538 | 美洲 | 1986 | 美国 | [27] |
2012-2015年在云南省各地采获的标本经DFA和RT-PCR检测,RABV核酸阳性者经G基因序列扩增和测序,共获得35株云南RABV的G基因核苷酸序列,其中来自犬脑组织28株、牛脑组织1株、患者唾液和尸检脑组织6株。35株RABV的地区分布为楚雄州14株,普洱市5株,曲靖市2株,德宏州4株,大理州3株,保山市2株,怒江州1株,西双版纳州1株,昆明市3株,见图 1;年度分布为2012年12株,2013年6株,2014年9株,2015年8株。所有本次测定的G基因核苷酸序列均已提交GenBank。

|
| 图 1 2012-2015年云南省狂犬病病例和2006-2015年狂犬病病毒G基因序列的地区分布 Figure 1 Distributions of rabies cases during 2012-2015 and G gene sequence of rabies virus isolates during 2006-2015 in Yunnan 注:▲:2012-2015年采集的35份狂犬病病毒样本;△:2008- 2011年采集的8份狂犬病病毒样本;●:2006-2007年采集的3份狂犬病病毒样本 |
| |
共使用云南省46株RABV(2012- 2015年35株,2008 - 2011年8株,张文东等[14] 2006-2007年Md06、Tc06和Qj07株)的G基因核苷酸序列(病毒株的地区分布见图 1)与来自GenBank的18株RABV国内外参考株G基因核苷酸序列构建系统进化树。图 2显示,除Tc06株(EU275242)外,所有云南株均处于China - Ⅰ进化群分支中。China-Ⅰ包含了本次调查期间所有州(市)的病毒株,并与来自相邻省份的8株China-Ⅰ同在一个进化支中,亲缘关系最为接近。2006年保山市腾冲县的Tc06株则属China - Ⅵ进化群,并与缅甸(EU086129)、老挝(AB981664)和越南(EU086160)的东南亚进化群病毒株同在一个分支,进化关系最近,见图 2。
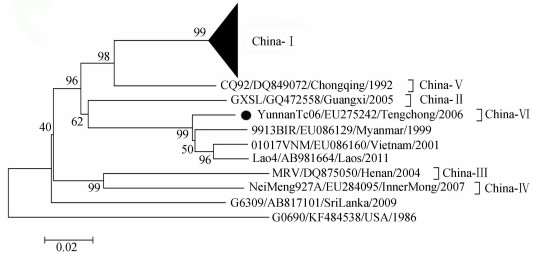
|
| 图 2 2012-2015年云南省35株狂犬病病毒G基因序列进化树 Figure 2 Phylogenetic tree based on G genes of 35 rabies virus strains isolated in Yunnan during 2012-2015 注:●:2006-2007年狂犬病毒云南株 |
| |
为进一步阐明云南省China-Ⅰ进化群病毒株间的进化关系及其与相邻省份流行株间的进化关系,仅使用China-Ⅰ病毒株G基因构建系统进化树,进化分析病毒株共51株,包括云南省45株China-Ⅰ(2012-2015年35株和2006-2011年10株)和邻省6株China-Ⅰ。图 3显示,虽然2008-2015年云南省China-Ⅰ病毒株均位于进化关系较近的大分支中,但不同年份或不同地区流行株间仍存在一定差异,并可分为多个进化亚支。如2012-2015年楚雄州各县病毒株(元谋JX276394,姚安KP072043、KT861558、KT861567,牟定KP072042、KP202407,楚雄市KP072049,双柏KT861574,南华KP072047)亲缘性较近并与四川省2009年流行株(JX005928、JX005925和JX005926)和贵州省2010年JQ040574株的进化关系最为接近;2015年滇西北大理州和怒江州流行株(洱源KT861581,剑川KT861555、云龙KX096986和兰坪KX096990)的亲缘性较近;2012- 2015年滇南和滇西南普洱市(景东KT861578和澜沧JX276398)和西双版纳州(勐腊KP072038、勐海JX276399)及保山市(隆阳KT861560和KT861565)的流行株同在一个亚支,进化关系较近。此外,云南2006年Md06株(EU253477)和2007年Qj07株(EU275240)与2009年四川株(GU591791)、2005年湖南株(EU008924)和2004年贵州株(EU267750)则同为相对独立的一个进化亚支,与其他云南株进化关系稍远,见图 3。

|
| 图 3 2012-2015年云南省35株China-Ⅰ进化群狂犬病病毒G基因序列进化树 Figure 3 Phylogenetic tree based on G genes of 35 clade China-Ⅰ rabies virus strains isolateed in Yunnan during 2012-2015 注:▲:2012-2015年狂犬病病毒云南株;△:2008-2011年狂犬病病毒云南株;●:2006-2007年狂犬病病毒云南株 |
| |
云南省北部和东部与狂犬病高发的四川、贵州和广西省份相邻,西部和南部与狂犬病地方性流行区的缅甸、老挝和越南相连,云南省狂犬病流行受到周边地区疫情的影响[7, 11-13]。云南省本轮狂犬病疫情首先发生于滇南文山州广南县(2000年),随后在该州和相邻红河州传播扩散,之后,滇东曲靖市和滇东北昭通市相继发生流行,2008年以来在云南省上述地区以及中部、西部和南部广大地区流行不断[7],迄今,所有州(市)及其大多数县(区、市)均发生过人间狂犬病(云南省辖16个州、市和129个县、区、市)。不同地区RABV流行株存在一定差异并具有地域特征,因此,阐明各地RABV的分子生物学特征对了解该病毒进化和传播来源不仅具有理论价值亦具重要公共卫生意义。以往N基因序列进化分析表明,2006-2012年云南省52株RABV可分为China-Ⅰ、Ⅵ、Ⅱ和Ⅲ共4个进化群[7],为来自周边省份和国家的多个传播来源[7, 11-13]。本次云南省2006-2015年46株RABV的G基因进化分析表明,45株为China-Ⅰ,1株为China-Ⅵ,其中本次测定的35株(2012-2015年)和此前测定的8株(2008- 2011年)均为China-Ⅰ进化群;而引用的3株(2006和2007年)中,2株为China-Ⅰ,1株为China-Ⅵ。与此前N基因进化群分析结果相比[7],本次2006- 2011年11株RABV G基因分群结果与此前这11株病毒的N基因分群结果一致,其中10株两种分析方法均为China-Ⅰ,另1株两种分析方法均为China-Ⅵ。由此认为,无论采用N基因或G基因的进化分析,均可获得RABV流行株相同的进化分群结果。
China - Ⅰ进化群为我国南北地区近10多年RABV流行株的主要进化群。本次G基因进化分析表明,云南省China-Ⅰ流行株首先于2006年被发现,随后每年及云南省大多数狂犬病流行区均能检测到该进化群病毒。鉴于China-Ⅰ为相邻省份乃至我国广大地区的优势进化群[4, 8-10],根据本研究并结合Zhang等[7]的RABV N基因研究结果综合分析认为,该进化群病毒株于2004-2008年间通过犬类流动由当时狂犬病高发的广西、贵州和四川省将该病毒传入滇东南和滇东北地区[5],并逐步向滇中和滇西地区扩散,如近几年楚雄、大理、保山、临沧、德宏和怒江州(市)的狂犬病疫情及其当地犬和狂犬病病例中检测到的病原体均为China-Ⅰ病毒株足以说明此特征。本研究还表明,China-Ⅰ流行株不仅广泛分布于云南省各州(市)狂犬病流行区并贯穿于整个调查期间,且已发展成为主导云南省狂犬病流行的RABV主要流行株。此外,针对China-Ⅰ的进化分析还发现,云南省不同时期和不同地域的RABV流行株存在明显差异,如2006和2007年流行株与2008-2015年流行株存在明显差异,前者可能来自贵州,后者可能来自四川等相邻省份;而2008-2015年间流行株又可分为多个进化亚支,且滇中地区流行株与滇西南流行株也有不同,由此认为,云南省China-Ⅰ流行株亦具有多个传播来源,在不同路径的传播扩散中与宿主共进化并形成了一定的时间和地域特征。
此前,RABV N基因进化分析曾在云南省发现8株China-Ⅱ(YN-C,2008-2010年)和9株China-Ⅵ(YN-B,2008-2010年)病毒株,在多个州(市)标本中检测到这两个进化群病毒[7]。由于当时未获得病毒株的G基因序列,以致本次缺乏G基因进化群分析。本研究未从2012 - 2015年标本中检测到China-Ⅱ、China-Ⅲ和China-Ⅵ病毒株,表明云南省近几年未再出现进化群病毒株的流行。综合分析认为,本轮狂犬病疫情早期,境内外不同传播来源的RABV经犬类流动将各进化群病毒株传入云南省并在各地传播扩散,其中China-Ⅰ具有较高的传播速率并成为该地区优势进化群,此可能与该进化群病毒对当地家犬具有较好的宿主适应性有关;而来自邻省的China-Ⅱ和来自相邻东南亚国家的China- Ⅵ等进化群病毒株的流行强度则不断减弱,经短暂几年的流行便被China-Ⅰ替换,表明它们在云南的地区和时间分布较为局限。China-Ⅱ和China-Ⅵ流行株的传播为何不断减弱和消失,并被China-Ⅰ完全替换的机制尚需进一步研究。
作者贡献:
杨卫红 ORCID:0000-0003-2348-7504
杨卫红:标本采集和实验室检测及论文撰写
冯云:标本采集和检测及序列测定与进化分析
章域震、潘虹、张云智、韩茜、周济华、袁庆虹:标本采集和/或实验室检测
张海林:论文设计和数据分析及论文修改
| [1] |
Burgos-Cáceres S. Canine rabies:a looming threat to public health[J]. Animals, 2011, 1(4): 326-342. DOI:10.3390/ani1040326 |
| [2] |
龚震宇, 龚训良. 2015年全球犬传播的人类狂犬病流行现况[J]. 疾病监测, 2016, 31(3): 263-264. Gong ZY, Gong XL. The epidemic situation of human rabies was transmitted by canine in worldwide in 2015[J]. Dis Surveil, 2016, 31(3): 263-264. DOI:10.3784/j.issn.1003-9961.2016.03.019 |
| [3] |
Thiptara A, Atwill ER, Kongkaew W, et al. Epidemiologic trends of rabies in domestic animals in southern Thailand, 1994-2008[J]. Am J Trop Med Hyg, 2011, 85(1): 138-145. DOI:10.4269/ajtmh.2011.10-0535 |
| [4] |
Yao HW, Yang Y, Liu K, et al. The spatiotemporal expansion of human rabies and its probable explanation in mainland China, 2004-2013[J]. PLoS Negl Trop Dis, 2015, 9(2): e0003502. DOI:10.1371/journal.pntd.0003502 |
| [5] |
宋淼, 陶晓燕, 李晓龙, 等. 1996-2007年和2008-2014年中国狂犬病分布特点对比分析[J]. 中华实验和临床病毒学杂志, 2015, 29(4): 300-302. Song M, Tao XY, Li XL, et al. Distribution characteristics analysis of rabies in China between years of 1996-2007 and 2008-2014[J]. Chin J Exp Clin Virol, 2015, 29(4): 300-302. DOI:10.3760/cma.j.issn.1003-9279.2015.04.004 |
| [6] |
刘淑清, 陶晓燕, 于鹏程, 等. 中国2015年狂犬病流行特征分析[J]. 中华实验和临床病毒学杂志, 2016, 30(6): 537-540. Liu SQ, Tao XY, Yu PC, et al. Epidemiological features and analysis on human rabies in 2015, China[J]. Chin J Exp Clin Virol, 2016, 30(6): 537-540. DOI:10.3760/cma.j.issn.1003-9279.2016.06.009 |
| [7] |
Zhang HL, Zhang YZ, Yang WH, et al. Molecular epidemiology of reemergent rabies in Yunnan province Southwestern China[J]. Emerg Infect Dis, 2014, 20(9): 1433-1442. DOI:10.3201/eid2009.130440 |
| [8] |
Tao XY, Tang Q, Rayner S, et al. Molecular phylodynamic analysis indicates lineage displacement occurred in Chinese rabies epidemics between 1949 to 2010[J]. PLoS Negl Trop Dis, 2013, 7(7): e2294. DOI:10.1371/journal.pntd.0002294 |
| [9] |
Tao XY, Tang Q, Li H, et al. Molecular epidemiology of rabies in southern People's Republic of China[J]. Emerg Infect Dis, 2009, 15(8): 1192-1198. DOI:10.3201/eid1508.081551 |
| [10] |
Guo ZY, Tao XY, Yin CP, et al. National borders effectively halt the spread of rabies:the current rabies epidemic in China is dislocated from cases in neighboring countries[J]. PLoS Negl Trop Dis, 2013, 7(1): e2039. DOI:10.1371/journal.pntd.0002039 |
| [11] |
张海林, 唐青, 陶晓燕, 等. 云南省保山市人间狂犬病调查及病毒分子生物学特征分析[J]. 中华流行病学杂志, 2008, 29(9): 899-904. Zhang HL, Tang Q, Tao XY, et al. Survey on human rabies cases and its viral molecular biological features in Baoshan city, Yunnan province[J]. Chin J Epidemiol, 2008, 29(9): 899-904. DOI:10.3321/j.issn:0254-6450.2008.09.012 |
| [12] |
Zhang J, Zhang HL, Tao XY, et al. The full-length genome analysis of a street rabies virus strain isolated in Yunnan province of China[J]. Virol Sin, 2012, 27(3): 204-213. DOI:10.1007/s12250-012-3251-z |
| [13] |
Zhang YZ, Vrancken B, Feng Y, et al. Cross-border spread, lineage displacement and evolutionary rate estimation of rabies virus in Yunnan province, China[J]. Virol J, 2017, 14: 102. DOI:10.1186/s12985-017-0769-6 |
| [14] |
张文东, 赵焕云, 吕粤, 等. 云南省2006-2010年狂犬病病毒N和G基因分子结构特征分析[J]. 中国人兽共患病学报, 2011, 27(10): 871-876. Zhang WD, Zhao HY, Lyu Y, et al. Molecular characteristics of N and G genes of rabies virus from Yunnan province during 2006 to 2010[J]. Chin J Zoon, 2011, 27(10): 871-876. DOI:10.3969/j.issn.1002-2694.2011.10.004 |
| [15] |
何健, 丁继超, 陶晓燕, 等. 云南省狂犬病病毒糖蛋白全编码区序列特征研究[J]. 国际病毒学杂志, 2015, 22(6): 367-371. He J, Ding JC, Tao XY, et al. Molecular characteristics on the entire coding region of glycoprotein of rabies virus isolates in Yunnan province, China[J]. Int J Virol, 2015, 22(6): 367-371. DOI:10.3760/cma.j.issn.1673-4092.2015.06.002 |
| [16] |
潘虹, 冯云, 杨卫红, 等. 云南省2014年狂犬病病毒G基因序列测定与分析[J]. 中国病毒病杂志, 2016, 6(4): 279-283. Pan H, Feng Y, Yang WH, et al. Sequencing analysis of the glycoprotein genome of rabies viruses isolated from Yunnan province of China in 2014[J]. Chin J Viral Dis, 2016, 6(4): 279-283. DOI:10.16505/j.2095-0136.2016.04.008 |
| [17] |
丁继超, 章域震, 李浩, 等. 云南省狂犬病病人和犬类感染狂犬病病毒及M基因序列分析[J]. 中国人兽共患病学报, 2016, 32(6): 518-524. Ding JC, Zhang YZ, Li H, et al. Survey on rabies viruses in rabies patients and dog population from endemic sites of Yunnan province, China and the viral M gene sequence analysis[J]. Chin J Zoon, 2016, 32(6): 518-524. DOI:10.3969/j.issn.1002-2694.2016.06.003 |
| [18] |
卫生部疾病预防控制局. 狂犬病防治手册[M]. 2版. 北京: 人民卫生出版社, 2010: 29-40. Bureau of Disease Control and Prevention, Health Department of the People's Republic of China. Handbook of prevention and control for Rabies[M]. 2nd ed. Beijing: People's Health Press, 2010: 29-40. |
| [19] |
Zhang YZ, Xiong CL, Lin XD, et al. Genetic diversity of Chinese rabies viruses:evidence for the presence of two distinct clades in China[J]. Infect, Genet Evolut, 2009, 9(1): 87-96. DOI:10.1016/j.meegid.2008.10.014 |
| [20] |
刘浩, 江禹, 王莉莉, 等. 湖南湘西地区外观健康犬携带狂犬病病毒的调查研究[J]. 中国动物检疫, 2007, 24(9): 17-19. Liu H, Jiang Y, Wang LL, et al. Investigation on rabies virus carried by dogs with healthy appearance in Xiangxi district Hunan province[J]. Chin J Anim Health Inspect, 2007, 24(9): 17-19. DOI:10.3969/j.issn.1005-944X.2007.09.014 |
| [21] |
Liu Q, Xiong Y, Luo TR, et al. Molecular epidemiology of rabies in Guangxi, south of China[J]. J Clin Virol, 2007, 39(4): 295-303. DOI:10.1016/j.jcv.2007.04.021 |
| [22] |
Shao XQ, Yan XJ, Luo GL, et al. Genetic evidence for domestic raccoon dog rabies caused by Arctic-like rabies virus in Inner Mongolia, China[J]. Epidemiol Infect, 2011, 139(4): 629-635. DOI:10.1017/S0950268810001263 |
| [23] |
Meng SL, Yan JX, Xu GL, et al. A molecular epidemiological study targeting the glycoprotein gene of rabies virus isolates from China[J]. Virus Res, 2007, 124(1/2): 125-138. DOI:10.1016/j.virusres.2006.10.011 |
| [24] |
Bourhy H, Reynes JM, Dunham EJ, et al. The origin and phylogeography of dog rabies virus[J]. J Gen Virol, 2008, 89(Pt 11): 2673-2681. DOI:10.1099/vir.0.2008/003913-0 |
| [25] |
Ahmed K, Phommachanh P, Vorachith P, et al. Molecular epidemiology of rabies viruses circulating in two rabies endemic provinces of Laos, 2011-2012:regional diversity in southeast Asia[J]. PLoS Negl Trop Dis, 2015, 9(3): e0003645. DOI:10.1371/journal.pntd.0003645 |
| [26] |
Matsumoto T, Ahmed K, Karunanayake D, et al. Molecular epidemiology of human rabies viruses in Sri Lanka[J]. Infect Genet Evolut, 2013, 18: 160-167. DOI:10.1016/j.meegid.2013.05.018 |
| [27] |
Kuzmina NA, Lemey P, Kuzmin IV, et al. The phylogeography and spatiotemporal spread of south-central skunk rabies virus[J]. PLoS One, 2013, 8(12): e82348. DOI:10.1371/journal.pone.0082348 |
 2018, Vol. 33
2018, Vol. 33


