扩展功能
文章信息
- 徐帅, 侯雪新, 孙丽娜, 张景山, 吉兴照, 唐璐, 韦超, 李和桥, 王雪冰, 李振军
- Xu Shuai, Hou Xuexin, Sun Lina, Zhang Jingshan, Ji Xingzhao, Tang Lu, Wei Chao, Li Heqiao, Wang Xuebing, Li Zhenjun
- 鼻疽诺卡菌菌体蛋白的免疫蛋白质组学研究
- Immunoproteomics research of cellular protein of Nocardia farcinica
- 疾病监测, 2018, 33(4): 294-299
- Disease Surveillance, 2018, 33(4): 294-299
- 10.3784/j.issn.1003-9961.2018.04.009
-
文章历史
- 收稿日期:2017-12-26
诺卡菌(Nocardia)至少包括50个种,其中约50%对人或动物有致病性[1]。诺卡菌病的临床症状和微生物学特征随诺卡菌种的不同而变化[2]。其临床表现包括肺部感染、皮肤感染和散播性感染,常见于免疫缺陷患者,但任何宿主均有可能患病[3-4]。其中以鼻疽诺卡菌(Nocardia farcinica)致病性最强,在临床样品中分离率最高,较其他菌更易侵袭正常宿主[5-9]。其主要引起肺部感染和散播性感染[10-12],几乎可影响到身体的每个器官,如皮肤、肺,甚至入侵至脑,引起脑脓肿[5]。鼻疽诺卡菌引起的脑脓肿病例有限,但有上升趋势。Kumar等[13]通过文献检索回顾1966-2011年报道的诺卡菌病病例个案报告,其中因鼻疽诺卡菌引发41例脑脓肿病例。近年来,又新增4例[14-17]。
诺卡菌病的诊断主要依靠传统的分离培养和核酸检测[18],通常需较长时间而耽误治疗。同时,诺卡菌病的临床症状通常并不特异,一些症状与结核病相似,很难被鉴别。若诺卡菌感染患者诊断不及时,很难得到及时、针对性的治疗,导致感染慢性化和合并各种并发症,使疾病负担重、预后差[19]。因此,筛选诺卡菌中保守性较强、具有抗原性的蛋白作为诊断靶标有重要意义。本研究采用免疫蛋白质组学方法鉴别鼻疽诺卡菌菌体蛋白中具有抗原活性的蛋白,为筛选诺卡菌病诊断靶标奠定基础。
1 材料与方法 1.1 材料 1.1.1 实验动物和菌株2月龄健康雄性新西兰大白兔购于北京维通利华实验动物技术有限公司;鼻疽诺卡菌标准菌株IFM 10152购于德国微生物菌种保藏中心。
1.1.2 主要试剂脑心浸液肉汤(BHI)液体培养基,购于OXOID公司。IPG干胶条(ReadyStripTM IPG Strip,17 cm,pH值4~7)、IPG缓冲液(pH值4~7)和矿物油购于Bio-Rad;尿素、3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(CHAPS)、二硫苏糖醇(DTT)、溴酚蓝、十二烷基硫酸钠(SDS)、甘油、碘乙酰胺、低熔点琼脂糖、考马斯亮蓝G250、硫酸铵、三氯乙酸(TCA)等购于Sigma公司。2D定量试剂盒(2D Quant Kit)、2D去除杂质试剂盒(2D Clean-Up Kit)和杂交纸(blotting paper)购于Amersham公司。核酸酶、聚偏二氟乙烯膜(PVDF)膜购于Millipor公司。
1.2 方法 1.2.1 鼻疽诺卡菌多抗血清制备将鼻疽诺卡菌单菌落接种于BHI液体培养基中,180 r/min,37 ℃,培养24 h。按1:100比例转接于BHI中,培养至对数生长期。5 411 × g离心10 min,去上清液。以0.1%甲醛溶液,置于37 ℃温箱,20 h灭活后,进行无活菌检测。离心,去上清液,PBS洗涤3次。用PBS调整菌液A值为0.8,菌液浓度约为108 /ml。健康雄性新西兰大白兔免疫前先于一侧耳缘取2 ml静脉血,2 862 × g离心,取血清作为阴性对照。另一侧耳静脉注射1 ml预先制备的菌液,加强免疫2次,间隔时间为2周。对照组注射同等体积的PBS。第3次免疫后14 d,心脏取血,2 862×g离心10 min,取血清,置-80 ℃保存备用。
1.2.2 菌体蛋白样品的制备将鼻疽诺卡菌单菌落接种于BHI培养基中,180 r/min,37 ℃,过夜培养24 h。将摇过夜的菌液以1: 100转接于99 ml BHI培养基,37 ℃,培养至对数期。4 ℃,5 411× g离心10 min,收集菌体。用预冷的低盐磷酸缓冲盐溶液(PBS)(68 mmol/L NaCl、3 mmol/L KCl、9 mmol/L Na2HPO4和1.5 mmol/L KH2PO4)洗3次后去除上清液。超声液(50 mmol/L Tris-HCl、10 mmol/L MgCl2、1 mmol/L苯甲基磺酰氟(PMSF)、1 mmol/L乙二醇双(2-氨基乙基醚)四乙酸(EGTA)和0.1%叠氮化钠,pH值7.4)重悬菌体,冷浴超声3次,每次5 min,脉冲3.5 s,停3 s,40%振幅。加入2.5 U/ml核酸酶,混匀后,室温作用15 min,转移至1.5 ml离心管中。40 000×g离心30 min,取上清液。加入10% TCA,冰浴3 h,13 000×g离心40 min。用预冷的丙酮洗3次。用裂解液(7 mol/L尿素、2 mol/L硫脲、4%CHAPS和1% DTT)重悬菌体蛋白。利用2D去除杂质试剂盒进行纯化后,使用2D蛋白定量试剂盒测浓度,以800 μg分装,置于-80 ℃保存备用。
1.2.3 双向电泳按照BIO-RAD操作手册进行,800 μg蛋白样品与水化液(8 mol / L尿素、4% CHAPS、60 mmol / L DTT和0.001%溴酚蓝)和1% IPG缓冲液(pH值4~7)混合,总体系为300 μl。室温放置30~60 min,15 ℃,40 000×g离心1 h,取上清液。将蛋白样品缓慢加入聚焦盘,放下17 cm IPG胶条,使蛋白样品液均匀分布在胶条下,不要产生气泡。滴加1 ml矿物油,使之均匀覆盖在胶条上,室温吸涨2 h,30 V、10 h。第1向等点聚焦按照BIO- RAD操作手册进行,程序设置为300 V 1 h、600 V 1 h、1 000 V 1 h、8 000 V 1 h、8 000 V 10 h。聚焦结束后,进行第2向聚丙烯酰胺凝胶电泳(SDS-PAGE)。将胶条放入平衡液Ⅰ(6 mol/L尿素、2% SDS、1.5 mol/L Tris-HCl pH值8.8、30%甘油、1% DTT和0.001%溴酚蓝)中,置于摇床上晃动15 min。在平衡液Ⅱ(6 mol/L尿素、2% SDS、1.5 mol/L Tris-HCl pH值8.8、30%甘油、2.5%碘乙酰胺和0.001%溴酚蓝)中平衡15 min,操作同上。平衡后的胶条使用12.5%的SDS-PAGE胶进行电泳,20 mA电泳20~40 min,然后以60 mA至电泳结束,约4 h。图像采用PowerLook 2100XL扫描仪(UMAX公司)进行扫描采集。
1.2.4 免疫杂交采用半干转印法转移至PVDF膜上,丽春红染色10 min,水洗脱色并迅速用针头在膜上刺孔以定位蛋白,扫描后进行免疫印迹(Western Blot,WB)。PVDF膜浸没在200 ml封闭液(TBS、0.05 %吐温-20、5%脱脂奶粉)中,置于摇床缓慢摇动约1 h,然后放于4 ℃冰箱,封闭过夜,与封闭液稀释的抗鼻疽诺卡菌兔血清(1:500)室温孵育2 h,TBST洗3次,每次10 min;荧光标记的羊抗兔IgG二抗(1:10 000)避光室温孵育1 h,TBST洗3次,第1次和第2次均为30 min,第3次10 min,最后用TBS洗膜5 min,以去除吐温-20。采用Odyssey扫描仪(LICOR公司)进行扫描保存。每个样品重复3次,对3次均为阳性的蛋白点进行鉴定,取本底血清作为阴性对照,以剔去非特异性杂交点。
1.2.5 胶内酶切和质谱鉴定将考马斯蓝染色胶与WB显色膜进行比对,确定胶上免疫反应蛋白点。从考马斯蓝染色胶上切取相应蛋白点进行脱色后,使10 mmol/L DTT和55 mmol/L碘乙酰胺先后对胶块进行还原和烷基化。冷冻干燥约1 h后,加入40 g/ml的胰蛋白酶2 μ(l胰蛋白酶溶于pH值8.0,25 mmol/L NH4HCO3),待胶块完全涨大后,置于4 ℃冰箱30 min,加入10 μl 25 mmol/L NH4HCO3,37 ℃水浴16 h。离心后,将反应液吸出。向胶块加入10 μl的5%TCA,37 ℃放置1 h。将液体吸入干净的离心管中。向胶块加入10 μl的2.5% TCA-50%乙腈溶液,37 ℃放置1 h。将液体吸入到上述的离心管中,进行真空干燥。使用4700 MALDI TOF / TOF Proteomics Analyzer(美国ABI公司)进行质谱鉴定,同时在鼻疽诺卡菌IFM 10152基因组本地运行数据库中进行Mascot在线检索。Mascot可支持几乎所有常用的质谱输出数据,可实现从质谱数据到蛋白质的鉴定。鉴定的蛋白序列使用在线软件Web Gene Ontology(http://wego.genomics.org.cn/)[20]进行蛋白功能预测;使用在线软件pSORTb(version 3.0.3,www.psort.org/psortb/index.html)[21]进行蛋白定位预测。
2 结果 2.1 菌体蛋白谱首先以pH值3~10的IPG胶条进行2D电泳分析,经考马斯蓝染色、扫描和分析发现,鼻疽诺卡菌菌株的菌体蛋白大多分布在pH值4~7范围内,故采用pH值4~7的胶条进行蛋白2D电泳分析,共检测到约蛋白点480个(图 1)。

|
| 图 1 鼻疽诺卡菌菌体蛋白2D电泳考马斯蓝染色 Figure 1 Identification of immunogenic proteins of N. farcinica by two-dimensional gel 注:1:假想的热休克蛋白;2:假想的磷酸丝氨酸转氨酶;3:假想的硫代硫酸硫基转移酶;5:假想的环化酶;6:假想的电子转移黄素蛋白β亚基;4、7、8:假想蛋白 |
| |
取菌体蛋白进行并行双向电泳,一块胶进行考马斯蓝染色,用于图谱分析和蛋白点的鉴定,另一块胶的蛋白转移至PVDF膜上,与抗鼻疽诺卡菌兔血清进行WB。经显色后,杂交膜上共发现9个杂交点,共有8个点可与考马斯蓝染色胶上蛋白点匹配(图 2)。
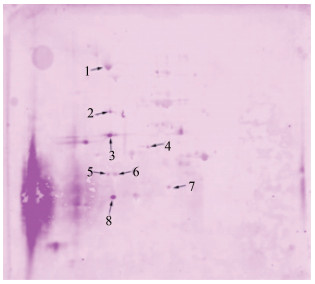
|
| 图 2 鼻疽诺卡菌菌体蛋白与抗鼻疽诺卡菌兔多抗杂交 Figure 2 Identification of immunogenic proteins of N. farcinica by Western Blot 注:1:假想的热休克蛋白;2:假想的磷酸丝氨酸转氨酶;3:假想的硫代硫酸硫基转移酶;5:假想的环化酶;6:假想的电子转移黄素蛋白β亚基;4、7、8:假想蛋白 |
| |
切取蛋白点进行酶切和质谱鉴定,其中8个蛋白鉴定成功(表 1)。经蛋白定位预测,8个蛋白全部位于细胞质。
| 蛋白序号 a | 蛋白描述 b | 蛋白ID号 | 编码基因 | 功能分类 d | 蛋白定位 e | 相对分子质量 f | 等电点 | 分数 g | 序列覆盖率(%) |
| 1 | 假想热休克蛋白 | BAD60261.1 | NFA_54090 | 核苷结合, 细胞代谢加工 | 细胞质 | 65 720 | 4.75 | 964 | 24 |
| 2 | 假想的磷酸丝氨酸转氨酶 | BAD55500.1 | NFA_6550 | 转移酶活性, 细胞代谢加工 | 细胞质 | 40 144 | 4.9 | 286 | 25 |
| 3 | 假想的硫代硫酸硫基转移酶 | BAD56698.1 | NFA_5940 | 转移酶活性 | 细胞质 | 31 053 | 4.74 | 280 | 22 |
| 4 | 假想蛋白 c | BAD59128.1 | NFA_17740 | 生化过程调控,细胞壁合成蛋白 | 细胞质 | 30 363 | 5.04 | 577 | 40 |
| 5 | 假想的环化酶 | BAD56620.1 | NFA_18520 | 转移酶/裂解酶活性 | 细胞质 | 26 929 | 4.68 | 343 | 41 |
| 6 | 假想的电子转移黄素蛋白 β亚基 | BAD60261.1 | NFA_42790 | 电子载体活性 | 细胞质 | 27 466 | 4.76 | 207 | 22 |
| 7 | 假想蛋白 | BAD55411.1 | NFA_5660 | 水解酶活性 | 细胞质 | 23 136 | 5.31 | 267 | 32 |
| 8 | 假想蛋白 | BAD56067.1 | NFA_12220 | 水解酶活性/离子结合 | 细胞质 | 22 230 | 4.71 | 110 | 15 |
| 注:a蛋白序号与2D电泳和WB图一致( | |||||||||
免疫蛋白质组学是将蛋白质组学技术与传统WB手段相结合的交叉学科,将高通量、高分辨率的分离生物体全部蛋白与抗原抗体在体外特异性结合的优势相结合[22],为筛选免疫原性蛋白提供技术手段,有助于疾病诊断标志物和疫苗学的发展。
诺卡菌在环境中普遍存在,在世界范围内均有发现,尤其在热带、亚热带气候地区常有发生。因医务人员缺乏对诺卡菌的认识和研究,临床医生在肺部感染疾病诊断时很少考虑诺卡菌病感染,常被误诊为结核分枝杆菌(Mycobacterium tuberculosis)感染,而诺卡菌普遍对传统抗结核药耐药[23]。因误诊、漏诊造成感染诺卡菌的免疫缺陷患者病死率较高[24]。血清学诊断是诺卡菌引起感染一种快速简便的方法。因此,本研究采用免疫蛋白质组学技术,鉴定鼻疽诺卡菌免疫原性蛋白,为临床诊断提供实验基础。
通过Web Gene Ontology(WEGO)注释分析,对8个鉴定的蛋白进行蛋白功能预测。生物信息学分析结果表明,这些蛋白具有多样的生物学功能,包括核苷酸结合蛋白、细胞代谢加工、电子载体蛋白和离子络合。几种酶活性包括转移酶、裂解酶和水解酶活性。蛋白点1为假定的热休克蛋白,经BLAST检索发现,该蛋白具有DnaK功能,参与细菌毒力、解毒和宿主防御[25]。许多胞内菌利用囊膜向宿主细胞传递毒力因子,如毒素、黏附素和免疫调节物等[26]。结核分枝杆菌和牛分枝杆菌的囊膜皆存在DnaK [27],其可能在病原体感染中起重要致病作用,但缺乏特异性,难以作为检测抗原。蛋白点2、3和5具有转移酶活性。转移酶包括磷酸丝氨酸转氨酶、硫代硫酸硫基转移酶和咪唑甘油、磷酸合成酶环化酶亚基(HisF)。磷酸丝氨酸转氨酶参与丝氨酸的生物合成,该酶的下调可能影响包皮垢分枝杆菌(M. smegamatis)的渗透性和细菌的存活[28]。硫代硫酸硫基转移酶由供体底物先转移硫烷硫原子到酶活性中心,之后再转移到嗜硫受体。该酶的主要功能是向受体底物氰化物转移硫烷硫原子[29]。咪唑甘油三磷酸合成酶属于谷氨酰胺转移酶家族,由2个亚基组成,即HisH和HisF,HisH具有谷氨酰胺酶活性,而HisF催化环化酶反应,合成咪唑甘油三磷酸合成酶。HisF构象的改变影响底物结合、催化作用和/或HisF和HisH间信号的传递[30]。氨基酸序列分析表明,蛋白点2、蛋白点3和蛋白点5与结核分枝杆菌的磷酸丝氨酸转氨酶、硫代硫酸硫基转移酶和环化酶的相似度很高,分别为71.86%、83.45%和80.47%,作为临床诊断候选蛋白意义不大。蛋白点4和6分别为细胞壁合成蛋白和离子载体蛋白。有研究报道,胆固醇在结核分枝杆菌感染和隐性感染过程中的起重要作用[31]。当胆固醇作为唯一碳源时,结核分枝杆菌的细胞壁合成蛋白和离子载体蛋白过度表达,可能有利于休眠状态的结核分枝杆菌克服不利的细胞内环境[32]。在以往研究中没有报道蛋白点4具有抗原性,同时其在诺卡菌中具有保守性,可作为判定病原菌感染的标志性蛋白的候选抗原进一步研究。蛋白点7和8均为折叠类金属水解酶,具有水解酶活性。将蛋白序列在BLAST中进行检索发现,2个蛋白仅在诺卡菌属和红球菌属(Rhodococcus spp.)中具有保守性,在其他菌属中未发现相似性高的蛋白,因此,折叠金属水解酶为诺卡菌的特异蛋白,可能作为标志性蛋白用于特异诊断试剂的研究。
本研究因菌体蛋白数量繁杂,可能高丰度蛋白遮蔽一些低丰度蛋白,使WB膜上检测到的阳性点在考马斯蓝染色胶图上无法肉眼识别匹配的蛋白点,导致具有良好免疫原性的抗原被漏检。可采用抗体亲和层析方法去除高丰度蛋白[33]。
本研究成功建立了免疫蛋白质组学技术平台。在鼻疽诺卡菌菌体蛋白中发现8种蛋白可与抗鼻疽诺卡菌兔血清发生杂交,具有抗原活性,但这些蛋白是否具有良好的免疫原性和特异性,需进一步研究证实。同时本研究采用健康兔免疫血清进行抗原筛选,而感染鼻疽诺卡菌的患病人群除正常宿主,还有相当一部分免疫缺陷病患者,故采用抗原进行检测时,临床血清样品的来源应包含非免疫缺陷和免疫缺陷患者,用以验证其灵敏度。
作者贡献:
徐帅 ORCID:0000-0002-8686-0268
徐帅:实验设计、实验操作、论文撰写
侯雪新、孙丽娜、张景山:文章审核
吉兴照、唐璐、韦超:文献检索
李和桥、王雪冰:论文修改完善
李振军:定题并给出指导性意见
| [1] |
Brown-Elliott BA, Brown JM, Conville PS, et al. Clinical and laboratory features of the Nocardia spp.based on current molecular taxonomy[J]. Clin Microbiol Rev, 2006, 19(2): 259-282. DOI:10.1128/CMR.19.2.259-282.2006 |
| [2] |
Tan CK, Lai CC, Lin SH, et al. Clinical and microbiological characteristics of Nocardiosis including those caused by emerging Nocardia species in Taiwan, 1998-2008[J]. Clin Microbiol Infect, 2010, 16(7): 966-972. DOI:10.1111/j.1469-0691.2009.02950.x |
| [3] |
McGuinness SL, Whiting SE, Baird R, et al. Nocardiosis in the tropical northern territory of Australia, 1997-2014[J]. Open Forum Infect Dis, 2016, 3(4): ofw208. DOI:10.1093/ofid/ofw208 |
| [4] |
McNeil MM, Brown JM. The medically important aerobic actinomycetes:epidemiology and microbiology[J]. Clin Microbiol Rev, 1994, 7(3): 357-417. DOI:10.1128/CMR.7.3.357 |
| [5] |
Wang HL, Seo YH, LaSala PR, et al. Nocardiosis in 132 patients with cancer:microbiological and clinical analyses[J]. Am J Clin Pathol, 2014, 142(4): 513-523. DOI:10.1309/AJCPW84AFTUWMHYU |
| [6] |
Wauters G, Avesani V, Charlier J, et al. Distribution of Nocardia species in clinical samples and their routine rapid identification in the laboratory[J]. J Clin Microbiol, 2005, 43(6): 2624-2628. DOI:10.1128/JCM.43.6.2624-2628.2005 |
| [7] |
Poonwan N, Mekha N, Yazawa K, et al. Characterization of clinical isolates of pathogenic Nocardia strains and related actinomycetes in Thailand from 1996 to 2003[J]. Mycopathologia, 2005, 159(3): 361-368. DOI:10.1007/s11046-005-1045-7 |
| [8] |
Scharfen JJR, Morávková M, Buncek M, et al. Nocardia farcinica as the causative agent of a brain abscess in a patient with interstitial lung disease[J]. Epidemiol Mikrobiol Imunol, 2010, 59(1): 13-20. |
| [9] |
Rafiei N, Peri AM, Righi E, et al. Central nervous system nocardiosis in Queensland:a report of 20 cases and review of the literature[J]. Medicine(Baltimore), 2016, 95(46): e5255. DOI:10.1097/MD.0000000000005255 |
| [10] |
Lewis KE, Ebden P, Wooster SL, et al. Multi-system Infection with Nocardia farcinica-therapy with linezolid and minocycline[J]. J Infect, 2003, 46(3): 199-202. DOI:10.1053/jinf.2002.1122 |
| [11] |
Quinn MP, Courtney AE, McCarron MO, et al. Breathless and dizzy!-disseminated Nocardia farcinica complicating renal transplantation[J]. Nephrol Dial Transplant, 2007, 22(11): 3338-3340. DOI:10.1093/ndt/gfm464 |
| [12] |
Torres OH, Domingo P, Pericas R, et al. Infection caused by Nocardia farcinica:case report and review[J]. Eur J Clin Microbiol Infect Dis, 2000, 19(3): 205-212. DOI:10.1007/s100960050460 |
| [13] |
Kumar VA, Augustine D, Panikar D, et al. Nocardia farcinica brain abscess:epidemiology, pathophysiology, and literature review[J]. Surg Infect(Larchmt), 2014, 15(5): 640-646. DOI:10.1089/sur.2012.205 |
| [14] |
Tamarit M, Poveda P, Barón M, et al. Four cases of nocardial brain abscess[J]. Surg Neurol Int, 2012, 3: 88. DOI:10.4103/2152-7806.99927 |
| [15] |
Chow FC, Marson A, Liu C. Successful medical management of a Nocardia farcinica multiloculated pontine abscess[J]. BMJ Case Rep, 2013. DOI:10.1136/bcr-2013-201308 |
| [16] |
Chaudhari DM, Renjen PN, Sardana R, et al. Nocardia farcinica brain abscess in an immunocompetent old patient:a case report and review of literature[J]. Ann Indian Acad Neurol, 2017, 20(4): 399-402. DOI:10.4103/aian.AIAN_263_17 |
| [17] |
Kim SY, Lee KL, Lee DM, et al. Nocardia brain abscess in an immunocompetent patient[J]. Infect Chemother, 2014, 46(1): 45-49. DOI:10.3947/ic.2014.46.1.45 |
| [18] |
Couble A, Rodriguez-Nava V, de Montclos MP, et al. Direct detection of Nocardia spp.in clinical samples by a rapid molecular method[J]. J Clin Microbiol, 2005, 43(4): 1921-1924. DOI:10.1128/JCM.43.4.1921-1924.2005 |
| [19] |
Angeles RM, Lasala RP, Fanning CV. Disseminated subcutaneous nocardiosis caused by Nocardia farcinica diagnosed by FNA biopsy and 16S ribosomal gene sequencing[J]. Diagn Cytopathol, 2008, 36(4): 266-269. DOI:10.1002/dc.20804 |
| [20] |
Wang ZQ, Liu RD, Sun GG, et al. Proteomic analysis of Trichinella spiralis adult worm excretory-secretory proteins recognized by sera of patients with early trichinellosis[J]. Front Microbiol, 2017, 8: 986. DOI:10.3389/fmicb.2017.00986 |
| [21] |
孙强正, 罗霞, 叶长芸, 等. 猪链球菌分泌蛋白的免疫蛋白质组学研究[J]. 中华流行病学杂志, 2008, 29(3): 267-271. Sun QZ, Lu X, Ye CY, et al. Immunoprotemic assay of secretive proteins from Streptococcus suis type 2 strain SC84[J]. Chin J Epidemiol, 2008, 29(3): 267-271. DOI:10.3321/j.issn:0254-6450.2008.03.014 |
| [22] |
王越, 杨再峰, 马安, 等. 应用免疫蛋白质组学方法鉴定日本血吸虫虫卵诊断抗原[J]. 中国人兽共患病学报, 2011, 27(10): 861-865, 881. Wang Y, Yang ZF, Ma A, et al. Identification of diagnostic antigens from Schistosoma japonicum eggs with immunoproteomic approach[J]. Chin J Zoon, 2011, 27(10): 861-865, 881. DOI:10.3969/j.issn.1002-2694.2011.10.002 |
| [23] |
Tellez I, Franco-Paredes C. A woman with chronic subcutaneous swelling of the right foot associated with sinus tracts discharging yellow grains[J]. PLoS Negl Trop Dis, 2010, 4(9): e772. DOI:10.1371/journal.pntd.0000772 |
| [24] |
King AS, Castro JG, Dow GC. Nocardia farcinica lung abscess presenting in the context of advanced HIV infection:Spontaneous resolution in response to highly active antiretroviral therapy alone[J]. Can J Infect Dis Med Microbiol, 2009, 20(3): e103-106. |
| [25] |
Schertzer JW, Whiteley M. Bacterial outer membrane vesicles in trafficking, communication and the host-pathogen interaction[J]. J Mol Microbiol Biotechnol, 2013, 23(1/2): 118-130. DOI:10.1159/000346770 |
| [26] |
Kuehn MJ, Kesty NC. Bacterial outer membrane vesicles and the host-pathogen interaction[J]. Genes Dev, 2005, 19(22): 2645-2655. DOI:10.1101/gad.1299905 |
| [27] |
Prados-Rosales R, Baena A, Martinez LR, et al. Mycobacteria release active membrane vesicles that modulate immune responses in a TLR2-dependent manner in mice[J]. J Clin Invest, 2011, 121(4): 1471-1483. DOI:10.1172/JCI44261 |
| [28] |
Keshari D, Singh KS, Sharma R, et al. MSMEG_5684 down-regulation in Mycobacterium smegmatis affects its permeability, survival under stress and persistence[J]. Tuberculosis, 2017, 103: 61-70. DOI:10.1016/j.tube.2017.01.004 |
| [29] |
Witholt SJ, Sankaranarayanan R, Garen CR, et al. Expression, purification, crystallization and preliminary X-ray analysis of Rv3117, a probable thiosulfate sulfurtransferase (CysA3) fromMycobacterium tuberculosis[J]. Acta Crystallogr Sect F Struct Biol Cryst Commun, 2008, 64(Pt 6): 541-544. DOI:10.1107/S1744309108014449 |
| [30] |
Liebold C, List F, Kalbitzer HR, et al. The interaction of ammonia and xenon with the imidazole glycerol phosphate synthase from Thermotoga maritima as detected by NMR spectroscopy[J]. Protein Sci, 2010, 19(9): 1774-1782. DOI:10.1002/pro.463 |
| [31] |
Pienaar E, Matern WM, Linderman JJ, et al. Multiscale model of Mycobacterium tuberculosis infection maps metabolite and gene perturbations to granuloma sterilization predictions[J]. Infect Immun, 2016, 84(5): 1650-1669. DOI:10.1128/IAI.01438-15 |
| [32] |
Garcia-Morales L, Leon-Solis L, Monroy-Muñoz IE, et al. Comparative proteomic profiles reveal characteristic Mycobacterium tuberculosis proteins induced by cholesterol during dormancy conditions[J]. Microbiology, 2017, 163(8): 1237-1247. DOI:10.1099/mic.0.000512 |
| [33] |
应天翼, 廖翔, 冯尔玲, 等. 福氏志贺杆菌2a 2457T免疫蛋白质组学方法的建立[J]. 世界华人消化杂志, 2005, 13(11): 1272-1274. Ying TY, Liao X, Feng EL, et al. Application of immunoproteomics methods in research on Shigella flexneri 2a 2457T[J]. World Chin J Digestol, 2005, 13(11): 1272-1274. DOI:10.3969/j.issn.1009-3079.2005.11.004 |
 2018, Vol. 33
2018, Vol. 33


