扩展功能
文章信息
- 金速速, 陈占国, 余坚, 白伟伟, 陈碎朋, 谢振迪, 李向阳
- Jin Susu, Chen Zhanguo, Yu Jian, Bai Weiwei, Chen Suipeng, Xie Zhendi, Li Xiangyang
- 高敏乙型肝炎病毒脱氧核糖核酸定量检测在低病毒载量患者治疗监测中的应用
- Application of highly sensitive HBV DNA quantitative detection in treatment monitoring of hepatitis B patients with low viral load
- 疾病监测, 2018, 33(1): 67-71
- Disease Surveillance, 2018, 33(1): 67-71
- 10.3784/j.issn.1003-9961.2018.01.016
-
文章历史
- 收稿日期:2017-09-08
乙型肝炎(乙肝)病毒脱氧核糖核酸(HBV DNA)定量检测是反映乙肝患者HBV复制活跃程度及传染性最直接的指标[1],同时也是指导抗病毒药物治疗、疗效监测及预后判断的重要指标之一。目前,实时荧光定量PCR(FQ-PCR)是检测HBV DNA常用的技术之一,而最低检测限为500~1 000 IU/ml的传统非高敏HBV DNA荧光定量检测方法已无法满足HBV的临床检测需求。《慢性乙型肝炎防治指南》(2015年更新版)[2]建议采用灵敏度和精确度更高的FQ-PCR方法定量检测HBV DNA。高敏HBV DNA检测有助于更好地了解低病毒载量的乙肝患者DNA复制情况和抗病毒治疗过程中的病毒清除速率,可发现隐匿性感染[3]。根据文献[4],本研究拟验证基于全自动核酸提纯及荧光PCR分析系统的HBV DNA定量检测性能,探讨该方法在低病毒载量的乙肝患者治疗监测中的临床应用价值。
1 材料与方法 1.1 研究对象2017年5—7月温州医科大学附属第二医院门诊、住院接受HBV DNA定量检测的乙肝患者共2 358例,其中男性1 474例,女性884例,年龄1~87岁,平均(39±14)岁。
1.2 仪器与试剂Anadas9850全自动核酸提纯及荧光PCR分析系统(厦门安普利生物工程有限公司);Cobas E602电化学发光全自动免疫分析系统(瑞士罗氏);Aptio全自动流水线(德国西门子);核酸提取试剂和HBV核酸定量检测试剂(厦门安普利生物工程有限公司);乙肝两对半定量试剂盒(瑞士罗氏);HBV DNA标准物质〔北京康彻斯坦生物技术有限公司S4,国制标物证书GBW(E)090138〕;丙氨酸氨基转移酶(ALT)(德国西门子)。
1.3 方法 1.3.1 标本采集和处理采集患者外周血标本2 ml置15 g/L EDTA-K2抗凝管中,用于HBV DNA定量检测,标本在1 h内被送至实验室进行处理,于3 500 r/min离心5 min(离心半径为16 cm),原始管于24 h内完成上机检测。
1.3.2 乙肝两对半定量和肝功能检测利用Cobas E602电化学发光全自动免疫分析系统进行乙肝两对半定量检测,方法学为电化学发光。利用Aptio全自动流水线检测肝功能指标(如ALT),方法学为速率法。
1.3.3 高敏HBV DNA定量检测利用Anadas9850全自动核酸提纯及荧光PCR分析系统内完成核酸提取和荧光定量PCR检测。标本核酸提取方法为磁珠法,采用FQ-PCR扩增检测。所有操作严格按照实验室标准操作程序(SOP)进行。核酸自动提取结束后,仪器自动移入荧光PCR分析仪模块封膜,并进入FQ-PCR检测。扩增条件:38 ℃ 5 min,95 ℃ 5 min;95 ℃ 15 s,58 ℃ 50 s,45个循环,荧光采集信号设为58 ℃。FQ-PCR检测后进行数据分析,查看标准曲线及检测结果。
1.3.4 高敏HBV DNA定量检测的性能评估HBV DNA定量检测的性能评估与HBV DNA临床标本检测均利用Anadas9850全自动核酸提纯及荧光PCR分析系统完成。(1)线性范围:取1份高浓度定量值约为108 IU/ml的临床标本,用小牛血清进行梯度稀释,获得浓度为50、5.0×102、5.0×103、5.0×104、5.0×105、5.0×106、5.0×107和5.0×108 IU/ml的样本。每个样本重复测定3次,并对测定值和理论值的对数值进行回归分析,r>0.98为符合要求。(2)批内精密度和批间精密度:批内精密度试验采用低值、中值和高值临床样本各1份,每个样本分别重复检测20次,计算均值、标准差和变异系数(coefficient variation,CV)值。批间精密度采用低值、中值和高值临床混合样本,分5次试验,每次4个复孔,累计20次进行统计。批内精密度和批间精密度均以CV值≤5.00%为合格。(3)最低检测限和定量检测限:使用小牛血清稀释HBV DNA标准物质(S4,104 IU/ml),稀释浓度至厂家试剂盒说明书的最低检测限浓度,即20 IU/ml。重复检测20次统计检出率,要求总检出率>95%。同时使用小牛血清稀释上述国家标准物质至50 IU/ml的定量检测限,重复检测25次,要求至少80%的检测结果CV值<7.50%。(4)防污染能力:取浓度>107 IU/ml的样本4份和阴性血清4份,按照(阴-阳-阴-阳-阳-阴-阳-阴)的顺序交叉放置,采用全自动核酸提纯及荧光PCR分析系统Anadas9850检测,重复检测12次,要求阴性血清检测结果为阴性。
1.4 质量控制HBV DNA定量检测在临床基因扩增实验室进行,严格按照SOP操作。HBV DNA定量检测试剂带内标,每批试验要求内标得到扩增,内标扩增曲线的循环次数(Ct值)<35,每批试验的标准曲线r>0.98,且HBV DNA的临界、低值和高值质控符合实验室质控规则。
1.5 统计学分析采用SPSS 22.0软件进行统计分析,年龄采用均值±标准差表示。血清HBV DNA取对数值后用均数±标准差表示,线性范围验证对检验值和预测值进行线性回归分析。计数资料采用例数和构成比表示,构成比的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果 2.1 高敏HBV DNA定量检测方法的性能评价 2.1.1 线性范围验证结果高值为108 IU/ml的临床标本,不同稀释浓度的内标得到扩增,且Ct值<35(图 1A);FQ-PCR扩增曲线呈典型的“S”形曲线且间隔均匀(图 1B);不同浓度进行线性回归,回归方程为y= 1.006 9x -0.023 4,相关系数r =0.999 7(图 1C)。
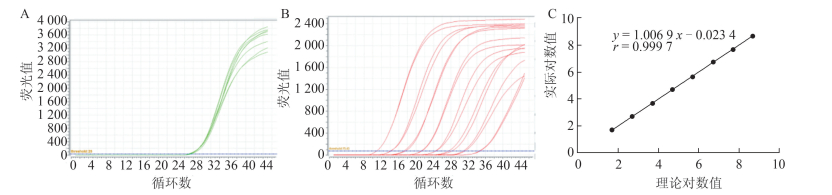
|
| 图 1 线性范围验证和回归曲线 Figure 1 Linear range verification and regression curve 注:A.内标扩增曲线;B.不同浓度标本的扩增曲线(50~5.0×108 IU/ml);C.线性回归曲线 |
| |
批内精密度的低值、中值和高值分别为(2.07±0.09)、(3.36 ± 0.10)和(7.36 ± 0.11),CV值分别为4.30%、2.98%和1.49%;批间精密度的低值、中值和高值分别为(2.11±0.07)、(3.14±0.07)和(7.21±0.12),CV值分别为3.27%、2.11%和1.66%,均<5.00%。
2.1.3 最低检测限、定量检测限和防污染能力检测结果重复检测20次浓度为20 IU/ml的样本,检出率为100%,提示该方法的最低检测限为20 IU/ml;重复检测25次浓度为50 IU/ml的样本,检出率为100%,CV值为5.40%(<7.50%),提示最低定量检测限为50 IU/ml;防污染试验结果显示,阳性孔的定量值为阳性,阴性孔仍为阴性,检测系统未出现污染情况,扩增曲线见图 2。
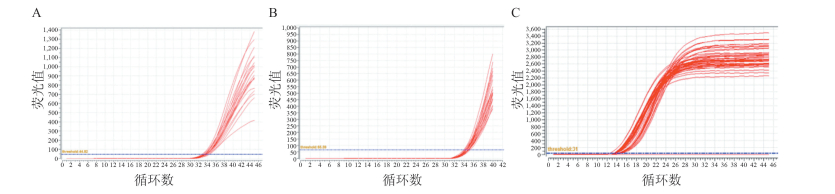
|
| 图 2 最低检测限、定量检测限和防污染能力检测的FQ⁃PCR扩增曲线 Figure 2 FQ-PCR amplification curve of limit of detection, limit of quantitative detection and anti⁃pollution capability 注:A.最低检测限; B.定量检测限; C.防污染能力检测 |
| |
2 358例HBV感染者中,以HBV DNA低载量乙肝患者(<500 IU/ml)较多,占总病例数的46.40%,见表 1。
| 乙肝病毒脱氧核糖核酸(IU/ml) | 病例数 | 构成比(%) |
| <500 | 1 095 | 46.40 |
| 500~ | 338 | 14.40 |
| 2 000 ~ | 467 | 19.80 |
| ≥100 000 | 458 | 19.40 |
| 合计 | 2 358 | 100.00 |
对1 095例HBV DNA低载量乙肝患者(<500 IU/ml)进行分组,进一步研究其肝功能的损害情况。HBV DNA载量<30 IU / ml的727例,HBV DNA载量为30~500 IU/ml的368例。按照HBeAg阴、阳性进行分组,HBeAg阳性组和阴性组中HBV DNA载量为30~500 IU/ml的患者ALT异常比例均高于HBV DNA载量<30 IU/ml的患者,差异均有统计学意义(χ2=6.378、12.296,P=0.012、0.001),见表 2。
| 乙肝病毒脱氧核糖核酸(IU/ml) | 总病例数 | HBeAg阳性 | HBeAg阴性 | |||||||||
| ALT<50U/L | ALT>50U/L | ALT<50 U/L | ALT>50U/L | |||||||||
| 例数 | 构成比(%) | 例数 | 构成比(%) | 例数 | 构成比(%) | 例数 | 构成比(%) | |||||
| <30 | 727 | 168 | 93.30 | 12 | 6.70 | 505 | 92.30 | 42 | 7.70 | |||
| 30~500 | 368 | 83 | 83.80 | 16 | 16.20 | 227 | 84.40 | 42 | 15.60 | |||
对1 095例HBV DNA低载量乙肝患者的两对半血清学模式进行分组,大致分为模式Ⅰ(HBsAg、HBeAg和HBcAb阳性,“大三阳”)、模式Ⅱ(HBsAg、HBeAb和HBcAb阳性,“小三阳”)、模式Ⅲ(HBsAg和HBcAb阳性)和其他模式(除模式Ⅰ、Ⅱ、Ⅲ和Ⅳ)。HBV DNA载量<30 IU/ml和30~500 IU/ml患者之间的血清学模式分布差异无统计学意义(χ2=4.990,P=0.179),各模式病例数和构成比见表 3。
| 乙肝病毒脱氧核糖核酸(IU/ml) | 总病例数 | 乙肝患者两对半血清学检出模式 | ||||||||||
| 模式Ⅰ | 模式Ⅱ | 模式Ⅲ | 其他模式 | |||||||||
| 例数 | 构成比(%) | 例数 | 构成比(%) | 例数 | 构成比(%) | 例数 | 构成比(%) | |||||
| <30 | 727 | 145 | 19.90 | 412 | 56.70 | 84 | 11.60 | 86 | 11.80 | |||
| 30~500 | 368 | 80 | 21.70 | 223 | 60.60 | 34 | 9.20 | 31 | 8.50 | |||
HBV DNA定量检测用于判断慢性HBV感染的病毒复制水平,可用于抗病毒治疗适应证的选择及疗效的判断[2]。国内传统HBV DNA的FQ-PCR定量检测试剂绝大部分采用煮沸裂解法提取核酸,操作费时、需要样本量大、易形成气溶胶造成实验室污染等问题[5]。传统HBV DNA定量检测体系中往往不加入内标,不能有效地监控HBV提取和扩增,且最低检测限为500~1 000 IU/ml,无法满足临床检测需求[6]。本研究利用全自动核酸提纯及荧光PCR分析系统进行FQ-PCR方法验证,可实现提取和扩增的全程自动化操作。在提取试剂中加入内标,可与样本同时进行提取和扩增,实现全程监控实验进程,有效地避免了假阴性结果,且利用磁珠法提取可增加反应体积,对扩增体系进行优化,具有检测通量大、检测效率高等优点。而另一种国产试剂也采用自动化核酸提取平台磁珠法提取标本的DNA,各项性能均与本分析系统相近[6],但价格比较昂贵。
基于全自动核酸提纯及荧光PCR分析系统,对高敏HBV DNA定量检测方法进行线性范围、精密度、最低检测限、最低定量检测限和防污染能力等性能验证,结果显示,该检测方法的线性范围为50~5.0×108 IU/ml,线性关系良好(r=0.999 7)。批内和批间精密度高,CV值均<5.00%,且最低定量检测限为50 IU/ml,最低检测限达20 IU/ml,可满足临床对低拷贝标本的定量要求。在最低检测限方面,通过重复检测20 IU/ml的标本20次,检出率达100%,与国际上公认的金标准COBAS Amplicor检测试剂的检测下限一致[7]。
对2 358例乙肝患者的HBV DNA载量的构成比进行分析发现,低载量乙肝患者(<500 IU/ml)最多。对其进一步分组,HBeAg阳性和阴性组HBV DNA载量为30~500 IU/ml的患者ALT异常比例均高于HBV DNA载量<30 IU/ml的患者,而ALT是反映肝功能异常的敏感指标[8]。本研究选择ALT与低载量HBV DNA进行比较,说明在传统检测方法检测下限的乙肝患者也可能存在肝功能损害的情况。HBV DNA载量较低时往往难以检出,不能反映HBV DNA的真实水平[9],而高灵敏度检测试剂有助于判断启动治疗时机、预测治疗效果和停药时机。
传统观念认为,HBsAg(+)、HBeAg(+)和HBcAb(+)提示HBV病毒复制活跃、传染性强,而HBsAg、HBeAg转阴,HBsAb、HBcAb出现是机体清除HBV的标志[10],且血清HBsAg定量检测对预测疾病进展、抗病毒疗效和预后具有一定参考意义[11-13]。本研究结果显示,不同HBV DNA载量间血清标志物分布无差别,血清标志物各种模式均显示有低拷贝的病毒复制,说明血清学标志物并不能及时、动态地反应病毒的复制程度和传染的危险性。而荧光定量PCR检测HBV DNA可以弥补乙肝血清学标志物检测存在的不足[14]。因此,HBV DNA在诊断、治疗监测及预后判断中的应用效果优于HBV血清学标志物。
传统的HBV核酸定量检测试剂盒已不能满足临床检测需求,基于全自动核酸提纯及荧光PCR分析系统对高敏HBV DNA定量检测具有操作简便、快速等优点,可提高工作效率,减少实验室污染,完全适用于各级具备临床基因扩增实验室的医院推广使用,在乙肝患者的诊断、抗病毒治疗及预后判断过程中具有重要意义,特别适于低病毒载量乙肝患者的治疗监测,可及时判断隐匿性和外显性HBV的复制活跃程度、传染性和药物疗效。
作者贡献:
金速速 ORCID:0000-0001-8496-893X
金速速:数据处理、论文撰写和文献查阅
余坚、白伟伟、陈碎朋、谢振迪:数据收集和样本检测
李向阳、陈占国:工作指导及内容修订
| [1] |
Tu T, Budzinska MA, Shackel NA, et al. HBV DNA integration: molecular mechanisms and clinical implications[J]. Viruses, 2017, 9(4): 75. DOI:10.3390/v9040075 |
| [2] |
王贵强, 王福生, 成军, 等. 慢性乙型肝炎防治指南(2015年更新版)[J]. 临床肝胆病杂志, 2015, 31(12): 1941-1960. Wang GQ, Wang FS, Cheng J, et al. The guideline of prevention and treatment for chronic hepatitis B: a 2015 update[J]. J Clin Hepa, 2015, 31(12): 1941-1960. DOI:10.3969/j.issn.1001-5256.2015.12.002 |
| [3] |
李敏伟. HBV-DNA及HBsAg定量对低病毒载量慢性乙型肝炎的临床意义[D]. 杭州: 浙江大学, 2014. Li MW. Serum HBV DNA and hepatitis B surface antigen levels help predict diseases progression in patients with low hepatitis B virus loads[D]. Hangzhou: Zhejiang University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10335-1015538026.htm |
| [4] |
刘维薇, 关明. 2013版《医学实验室质量和能力认可准则在基因扩增检验领域的应用说明》改版解读[J]. 中华临床实验室管理电子杂志, 2013, 1(1): 36-40. Liu WW, Guan M. Interpretation of the guidance on the application of accreditation criteria for the medical laboratory quality and competence in the field of gene amplification testing (version 2013)[J]. Chin J Clin Lab Manag, 2013, 1(1): 36-40. DOI:10.3877/cma.j.issn.2095-5820.2013.01.008 |
| [5] |
查瑶, 王小灵, 朱诗艳, 等. 煮沸裂解法与磁珠法在HBV DNA荧光定量检测中的核酸提取效果[J]. 浙江预防医学, 2015, 27(12): 1292-1293, 1296. Zha Y, Wang XL, Zhu SY, et al. The extraction effect of nucleic acid in HBV DNA fluorescence detection by boiling cracking method and magnetic bead method[J]. Zhejiang J Prev Med, 2015, 27(12): 1292-1293, 1296. DOI:10.19485/j.cnki.issn1007-0931.2015.12.035.j.cnki.issn1007-0931.2015.12.035 |
| [6] |
沈弢, 龙璐, 邓中平, 等. 新型国产乙型肝炎病毒核酸定量检测试剂的质量评价[J]. 中华检验医学杂志, 2013, 36(3): 280-285. Shen T, Long L, Deng ZP, et al. Evaluation of novel domestic hrpstitis B viral DNA quantitative fluorescence diagnostic kit[J]. Chin J Lab Med, 2013, 36(3): 280-285. DOI:10.3760/cma.j.issn.1009-9158.2013.03.022.issn.1009-9158.2013.03.022 |
| [7] |
Han MS, Park Y, Nah H, et al. Comparison of the QIAGEN artus HBV QS-RGQ assay with the roche COBAS /COBAS TaqMan HBV assay for quantifying viral DNA in sera of chronic hepatitis B patients[J]. Ann Lab Med, 2017, 37(3): 248-253. DOI:10.3343/alm.2017.37.3.248 |
| [8] |
Fourati S, Pawlotsky JM. Recent advances in understanding and diagnosing hepatitis B virus infection[J]. F1000 Res, 2016, 5: 2243. DOI:10.12688/f1000research.8983.1 |
| [9] |
蒋素贞, 鲁凤民, 庄辉. 慢性乙型肝炎病毒DNA定量检测的临床意义[J]. 中华检验医学杂志, 2012, 35(2): 117-121. Jiang SZ, Lu FM, Zhuang H. The clinical significance of quantitative detection of HBV DNA in the chronic infected patients[J]. Chin J Lab Med, 2012, 35(2): 117-121. DOI:10.3760/cma.j.issn.1009-9158.2012.02.004 |
| [10] |
Lin CL, Kao JH. New perspectives of biomarkers for the management of chronic hepatitis B[J]. Clin Mol Hepatol, 2016, 22(4): 423-431. DOI:10.3350/cmh.2016.0069 |
| [11] |
World Health Organization. Guidelines for the prevention, care and treatment of persons with chronic hepatitis B infection[J]. Geneva: WHO, 2015. |
| [12] |
Lampertico P, Maini M, Papatheodoridis G. Optimal management of hepatitis B virus infection -EASL Special Conference[J]. J Hepatol, 2015, 63(5): 1238-1253. DOI:10.1016/j.jhep.2015.06.026 |
| [13] |
Liaw YF, Kao JH, Piratvisuth T, et al. Asian-Pacific consensus statement on the management of chronic hepatitis B: a 2012 update[J]. Hepatol Int, 2012, 6(3): 531-561. DOI:10.1007/s12072-012-9365-4 |
| [14] |
刘志勇, 王娜, 刘浩, 等. 乙型肝炎血清学标志物定量检测与HBV DNA定量检测结果的相关性分析[J]. 国际检验医学杂志, 2014, 35(2): 233-235. Liu ZY, Wang N, Liu H, et al. Association of hepatitis B serological marker detection and quantitative detection of HBV DNA[J]. Int J Lab Med, 2014, 35(2): 233-235. DOI:10.3969/j.issn.1673-4130.2014.02.049 |
 2018, Vol. 33
2018, Vol. 33


