扩展功能
文章信息
- 马月, 高利萍, 肖康, 王晶, 董小平, 石琦
- Ma Yue, Gao Liping, Xiao Kang, Wang Jing, Dong Xiaoping, Shi Qi
- 核转录因子-κB(p65)在羊瘙痒因子139A感染小鼠脑组织中变化的研究
- Alteration of NF-κB(p65) in brain tissue of scrapie-139A infected mice
- 疾病监测, 2018, 33(1): 32-36
- Disease Surveillance, 2018, 33(1): 32-36
- 10.3784/j.issn.1003-9961.2018.01.008
-
文章历史
- 收稿日期:2017-10-18
朊病毒病(prion diseases)又称可传播性海绵状脑病(TSEs),是一类可感染人类及动物中枢神经系统的神经退行性疾病,包括散发型及遗传型克-雅病(creutzfeldt-Jakob disease, CJD)、吉斯特曼综合征(gerstmann-Sträussler-Scheinker syndrome,GSS)、致命性家族型失眠症、库鲁病及变异型克-雅病(variant CJD,vCJD),还包括牛的海绵状脑病(bovinc spongiform enccphalopathy,BSE)及羊的瘙痒症等[1-2]。该病潜伏期长,致死率100%。目前认为,朊病毒病的致病因子为正常构象的朊蛋白(PrPC)发生错误折叠,形成了具有致病性的异常朊蛋白(PrPSc)。朊病毒病的病理特征主要表现为神经元丢失,空泡样变性,胶质细胞增生以及淀粉样斑块沉积[1]。然而,朊病毒病中神经退行性变的调控机制仍不十分明确。
NF-κB作为重要的转录调控因子,在中枢神经系统中发挥着重要功能。不仅参与生理功能的调节,同时与中枢神经系统的神经退行性变息息相关[3-7]。NF-κB家族成员包括:NF-κB1,NF-κB2,RelA(p65),RelB以及c-Rel[3]。NF-κB以二聚体形式发挥作用,在静息状态下,NF-κB与IκB结合存在于胞浆中,当NF-κB经典信号通路被激活时,IκB发生磷酸化、泛素化,从而被进一步降解,NF-κB二聚体被释聚,核定位信号暴露[8]。随后,NF-κB二聚体入核结合到目的基因的κB位点,调节目的基因的转录[9]。有研究表明,NF-κB的激活可保护神经元对抗Aβ肽段所诱导的凋亡[10]。在帕金森(PD)患者中,黑质区域多巴胺神经元中p65入核比例明显增高[11],表明NF-κB活性增强在一定程度上具有保护神经元的作用。在朊病毒病中,NF-κB的潜在功能尚不十分清楚。本研究选取羊瘙痒因子毒株139A感染小鼠模型为研究对象,通过检测NF-κB(p65)在羊瘙痒因子感染小鼠脑组织中的含量变化及分布情况,初步探究NF-κB在朊病毒病发病过程中的作用及机制。
1 材料与方法 1.1 实验材料实验小鼠购自北京维通利华实验动物技术有限公司;小鼠Scrapie-139A毒株为中国疾病预防控制中心病毒病预防控制所朊病毒病室保存;p65兔源多克隆抗体购自美国Santa Cruz公司;β-actin鼠源单克隆抗体购自中国华兴博奥公司;NeuN鼠源单克隆抗兔购自美国Millipore公司;GFAP鼠源单克隆抗兔购自美国CST公司;辣根过氧化物酶标记的羊抗兔及羊抗鼠二抗购自美国Jackson实验室,用于蛋白免疫印迹检测;Alexa Fluor 488标记的羊抗兔,Alexa Fluor 568标记的羊抗鼠荧光二抗购自美国Thermo公司;ECL Kit购自美国PerkinElmer公司;免疫组织化学使用的辣根过氧化物酶标记的羊抗兔二抗、DAB购自中国博士德公司。
1.2 脑组织匀浆的制备取正常小鼠及感染139A毒株的小鼠脑组织,按照100 mg/ml比例加入裂解液(100 mmol/L NaCl,10 mmol/L EDTA,0.5% Nonidet P-40,0.5% sodiam deoxycholate,10 mmol/L Tris-HCl,pH7.5),匀浆器研磨制成10%(m/v)匀浆液,2 000 r/min离心30 min,取上清。
1.3 蛋白免疫印迹检测取脑组织匀浆10 μl,加入5 × Loading buffer 2.5 μl,100 ℃水浴10 min,8% SDS-PAGE电泳,半干式电转至NC膜,室温下,用TBS配制5%的脱脂乳封闭NC膜2 h,随后分别包被一抗p65兔源多克隆抗体(1:1 000)及β-actin(1:5 000),4 ℃孵育过夜。利用含有0.1%吐温20的TBST洗膜3次,每次10 min,随后包被相应的羊抗兔二抗(1:5 000),室温孵育1 h,TBST洗膜3次后进行ECL显影,X胶片曝光观察。
1.4 石蜡切片制备取正常小鼠及139A感染终末期小鼠脑组织,10%甲醛浸泡过夜,自来水冲洗3 h,放入75%乙醇4 ℃过夜。次日依次放入85%乙醇(1 h),95%乙醇(1 h),100%乙醇Ⅰ(1 h),100%乙醇Ⅱ(2 h),二甲苯Ⅰ(1 h),二甲苯Ⅱ(0.5 h),浸蜡Ⅰ(2 h),浸蜡Ⅱ(3 h),石蜡包埋。制成5 μm石蜡切片备用。
1.5 免疫组织化学取正常小鼠及139A感染终末期小鼠脑组织切片,脱蜡至水,将其浸于0.01 mol/L枸橼酸钠缓冲液中,放入微波炉,中高火抗原修复30 min。复温后,利用3%双氧水进行内源阻断10 min,5% BSA室温封闭15 min,p65兔源多克隆抗体(1:50)一抗包被,4 ℃过夜。次日,PBS洗片5次,每次10 min,随后,37 ℃包被羊抗兔二抗1 h,最后进行DAB复染,封片观察。
1.6 免疫组织荧光取正常小鼠及139A感染终末期小鼠脑组织切片,脱蜡至水,将其浸于枸橼酸钠缓冲液中,放入微波炉,中高火抗原修复30 min。复温后,0.3% Triton-X100室温通透30 min,随后,正常山羊血清封闭20 min,一抗包被(p65/NeuN,p65/GFAP),4 ℃过夜。次日,37 ℃复温15 min,PBS洗片5次,每次10 min,随后,37 ℃包被二抗1 h,DAPI复染30 min,封片观察。
1.7 数据处理及统计分析每组实验重复3次以上,利用Image J软件对蛋白质免疫印迹法(western blot,WB)结果进行灰度分析,利用Image-Pro Plus 6.0对免疫组织化学结果进行灰度分析,利用GraphPad Prism 6.0软件统计分析并制图,数据以均数±标准差(x±s)表示,t检验分析组间差异。
2 结果 2.1 p65在羊瘙痒因子感染小鼠脑组织中含量的检测为探究NF-κB(p65)在139A感染小鼠脑组织中的变化规律,首先利用WB对139A感染终末期小鼠及正常对照小鼠脑组织中p65含量进行检测,对p65及β-actin条带灰度值作比对,并进行统计分析。由图 1可知,在139A感染小鼠脑组织中,p65含量明显低于正常对照组(Ctrl:7.99 ± 1.86;139A:2.51 ± 1.27,P<0.05)。
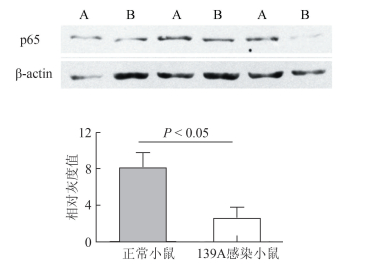
|
| 图 1 p65在羊瘙痒因子139A感染小鼠脑组织中含量的蛋白质免疫印迹法检测 Figure 1 WB detection of expression of p65 in brains of scrapie-139A infected mice 注:A为正常小鼠组;B为139A感染小鼠组 |
| |
为进一步验证以上结果,利用免疫组织化学对139A感染终末期小鼠及正常对照小鼠大脑皮层中p65含量进行检测,对p65信号强度进行统计分析。由图 2可知,在139A感染小鼠的大脑皮层中,p65含量明显低于正常对照组(Ctrl:38.71 ± 6.02;139A:17.05±5.01,P<0.01),进一步验证了利用WB所检测的结果。
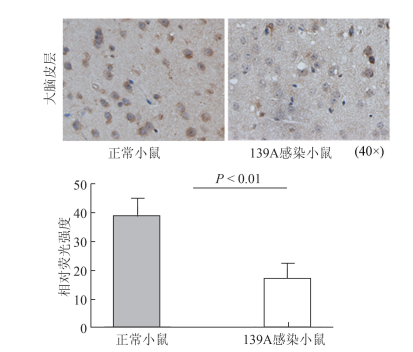
|
| 图 2 p65在139A羊瘙痒因子感染小鼠脑组织中含量的免疫组织化学检测 Figure 2 HIC detection of expression of p65 in brains of scrapie-139A infected mice |
| |
p65的活化有利于提高神经元对外界损伤的抵抗作用,而p65的活化又与多种蛋白相关。为探究139A感染不同时间的小鼠脑组织中p65及相关蛋白的含量变化,利用WB对正常小鼠脑组织及139A感染不同时间的小鼠脑组织进行检测,对其灰度值进行统计分析。由图 3可知,139A感染不同时间的小鼠脑组织中p65含量呈先升高后下降的趋势,但仅有139A感染终末期样本差异有统计学意义(Ctrl:8.81±0.44;139A:6.21±0.41,P<0.05)。
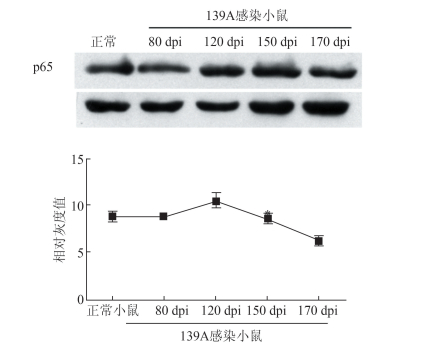
|
| 图 3 p65蛋白在139A感染小鼠不同时间点的变化 Figure 3 Dynamic analysis of p65 expression in brains of scrapie-139A infected mice |
| |
神经元中p65的激活有利于其存活,而胶质细胞中p65的激活多表现为对神经元的损伤作用。为检测p65在中枢神经系统中不同细胞的表达情况,利用免疫荧光方法检测p65在正常小鼠及139A感染终末期小鼠大脑皮层中的分布情况。由图 4可知,在正常小鼠及139A感染小鼠脑组织中,p65阳性信号均与神经元细胞标记物NeuN存在共定位,而与星形胶质细胞几乎无共定位现象。提示p65在中枢神经系统中主要分布于神经元细胞。
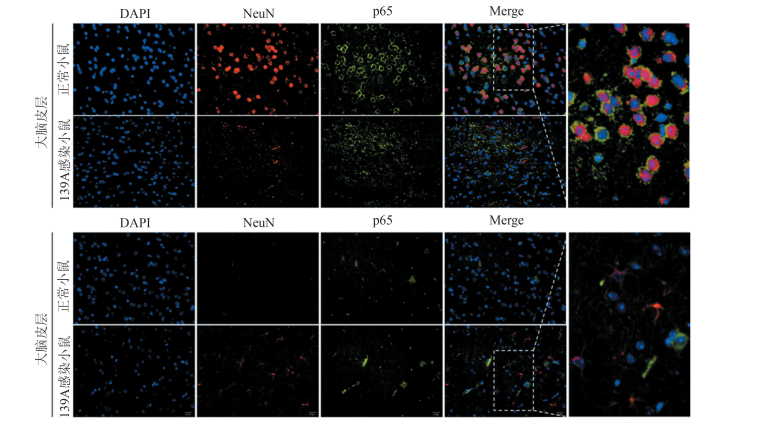
|
| 图 4 p65在中枢神经系统中的定位情况(40×) Figure 4 Location of p65 in central nervous system |
| |
本研究中,通过WB及免疫组织化学的方法对139A感染小鼠脑组织样本中p65含量进行检测。在139A感染小鼠终末期脑组织中,p65含量明显低于正常对照组。同时,小鼠脑组织切片的免疫组织荧光结果表明,无论是正常小鼠还是139A感染终末期小鼠中,p65均主要分布于NeuN阳性细胞,而不是GFAP阳性细胞。由于神经元丢失是朊病毒病典型的病理特征之一[1],以上结果提示在139A感染终末期小鼠脑组织中,p65含量的减少可能源于神经元中p65含量的减少以及神经元的丢失。神经元细胞中的p65有利于神经元的存活及抵抗有害刺激所致的神经元损伤[3],故神经元中p65含量的减少会阻碍神经元的存活,可能在一定程度上加速了朊病毒病的疾病进程。大量研究表明,胶质细胞中存在NF-κB的激活,同时可诱导毒素的产生[12-13],本实验室近期研究结果也发现,在139A感染小鼠脑组织中的小胶质细胞中存在NF-κB的激活。然而朊病毒病感染终末期,神经元中NF-κB的下调似乎起主导作用。针对神经元与小胶质细胞中NF-κB的动力学研究需要进一步的研究。
本研究中,WB检测139A感染小鼠不同时间点的动态分析结果显示p65含量早期增高,后逐渐下降,终末期时含量明显低于正常对照组。在疾病早期,神经元受到不良刺激后可能产生保护性应激反应导致p65表达增高,而随着疾病的发生发展应激反应逐渐消失,神经元细胞中p65表达逐渐下降,同时伴随着神经元细胞死亡,从而导致139A感染小鼠脑组织中p65总量逐渐下降。而Akt与IκBα含量并无明显变化,可能与其分布及转录调控机制有关,有待进一步的研究验证。
在其他神经退行性疾病中,同样有NF-κB信号通路发生异常的报道,尤其是阿尔兹海默病。Aβ肽段作用于培养的细胞可诱导NF-κB的激活[14-15],在阿尔兹海默病的动物模型中,特定的脑区可见到NF-κB表达的增高,一定程度上反映了阿尔兹海默病的炎症反应[16-17]。然而,在本研究中,NF-κB在139A感染小鼠模型中含量明显降低。同样,其他细胞水平的研究也得到了相似的结果[18]。NF-κB在阿尔兹海默病和朊病毒病中所表现出的变化不同,其原因尚不明确。与阿尔兹海默病相比,朊病毒病的临床期较短,因此,推测在朊病毒病中,NF-κB的下调可能与神经元快速丢失相关。
作者贡献:
马月 ORCID:0000-0002-1031-5175
马月:实验操作,结果整理与数据分析,论文撰写
高利萍、肖康、王晶:部分问题分析解决
董小平、石琦:负责整体设计及论文的修改
| [1] |
Walker LC, Jucker M. Neurodegenerative diseases: expanding the prion concept[J]. Ann Rev Neurosci, 2015, 38(1): 87-103. DOI:10.1146/annurev-neuro-071714-033828 |
| [2] |
Collinge J. Prion diseases of humans and animals: their causes and molecular basis[J]. Ann Rev Neurosci, 2001, 24(1): 519-550. DOI:10.1146/annurev.neuro.24.1.519 |
| [3] |
Meffert MK, Baltimore D. Physiological functions for brain NF-κB[J]. Trends Neurosci, 2005, 28(1): 37-43. DOI:10.1016/j.tins.2004.11.002 |
| [4] |
Blank T, Prinz M. NF-kappaB signaling regulates myelination in the CNS[J]. Front Mol Neurosci, 2014, 7: 47. DOI:10.3389/fnmol.2014.00047 |
| [5] |
Haenold R, Weih F, Herrmann KH, et al. NF-κB controls axonal regeneration and degeneration through cell-specific balance of RelA and p50 in the adult CNS[J]. J Cell Sci, 2014, 127(14): 3052-3065. DOI:10.1242/jcs.140731 |
| [6] |
Lian H, Yang L, Cole A, et al. NF-κB-activated astroglial release of complement C3 compromises neuronal morphology and function associated with Alzheimer′s disease[J]. Neuron, 2015, 85(1): 101-115. DOI:10.1016/j.neuron.2014.11.018 |
| [7] |
Hsiao HY, Chen YC, Chen HM, et al. A critical role of astrocytemediated nuclear factor-kappaB -dependent inflammation in Huntington′s disease[J]. Human Mol Genet, 2013, 22(9): 1826-1842. DOI:10.1093/hmg/ddt036 |
| [8] |
Napetschnig J, Wu H. Molecular basis of NF -κB signaling[J]. Ann Rev Biophys, 2013, 42: 443-468. DOI:10.1146/annurevbiophys-083012-130338 |
| [9] |
Bonizzi G, Karin M. The two NF -κB activation pathways and their role in innate and adaptive immunity[J]. Trends Immunol, 2004, 25(6): 280-288. DOI:10.1016/j.it.2004.03.008 |
| [10] |
Barger SW, Horster D, Furukawa K, et al. Tumor necrosis factors alpha and beta protect neurons against amyloid beta-peptide toxicity: evidence for involvement of a kappa B -binding factor and attenuation of peroxide and Ca2+ accumulation[J]. Proc Natl Acad Sci USA, 1995, 92(20): 9328-9332. DOI:10.1073/pnas.92.20.9328 |
| [11] |
Hunot S, Brugg B, Ricard D, et al. Nuclear translocation of NFkappaB is increased in dopaminergic neurons of patients with parkinson disease[J]. Proc Natl Acad Sci USA, 1997, 94(14): 7531-7536. DOI:10.1073/pnas.94.14.7531 |
| [12] |
Cunningham C. Microglia and neurodegeneration: the role of systemic inflammation[J]. Glia, 2013, 61(1): 71-90. DOI:10.1002/glia.22350 |
| [13] |
Colombo E, Farina C. Astrocytes: key regulators of neuroinflammation[J]. Trends Immunol, 2016, 37(9): 608-620. DOI:10.1016/j.it.2016.06.006 |
| [14] |
Barger SW, Mattson MP. Induction of neuroprotective kappa Bdependent transcription by secreted forms of the Alzheimer′s beta-amyloid precursor[J]. Brain Res Mol Brain Res, 1996, 40(1): 116-126. DOI:10.1016/0169-328X(96)00036-8 |
| [15] |
Guo Q, Robinson N, Mattson MP. Secreted β-amyloid precursor protein counteracts the proapoptotic action of mutant presenilin-1 by activation of NF-κB and stabilization of calcium homeostasis[J]. J Biol Chem, 1998, 273(20): 12341-12351. DOI:10.1074/jbc.273.20.12341 |
| [16] |
Zhang LD, Ma L, Zhang L, et al. Hyperbaric oxygen and ginkgo biloba extract ameliorate cognitive and memory impairment via nuclear factor Kappa -B pathway in rat model of Alzheimer′s disease[J]. Chin Med J, 2015, 128(22): 3088-3093. DOI:10.4103/0366-6999.169105 |
| [17] |
Chen CH, Zhou WH, Liu SC, et al. Increased NF-κB signalling up-regulates BACE1 expression and its therapeutic potential in Alzheimer′s disease[J]. Int J Neuropsychopharmacol, 2012, 15(1): 77-90. DOI:10.1017/S1461145711000149 |
| [18] |
Bourteele S, Oesterle K, Weinzierl AO, et al. Alteration of NF-κB activity leads to mitochondrial apoptosis after infection with pathological prion protein[J]. Cell Microbiol, 2007, 9(9): 2202-2217. DOI:10.1111/j.1462-5822.2007.00950.x |
 2018, Vol. 33
2018, Vol. 33


