扩展功能
文章信息
- 车洁, 赵晓菲, 卢金星, 李娟, 陈霞
- CHE Jie, ZHAO Xiao-fei, LU Jin-xing, LI Juan, CHEN Xia
- MGB探针标记-实时荧光PCR方法检测细菌int1基因和ISCR1元件方法的建立
- Establishment of a duplex MGB real-time PCR assay for int1 gene and ISCR1 element detections
- 疾病监测, 2017, 32(10/11): 878-882
- Disease Surveillance, 2017, 32(10/11): 878-882
- 10.3784/j.issn.1003-9961.2017.10/11.022
-
文章历史
- 收稿日期:2017-07-19
随着抗菌药物在临床和动物中的广泛使用,造成了多耐药、泛耐药细菌不断出现,给抗感染治疗带来了新的挑战。快速、灵敏、简便的多重耐药细菌检测方法为研究细菌多重耐药程度,分析多种类耐药基因流行特点提供了技术手段。ISCR1相关的复合型Ⅰ型整合子是由ISCR1元件、其下游携带的基因盒及位于其上游的普通Ⅰ型整合子组成的一类复杂的整合子,其所携带的耐药基因种类广、数量多,且可造成耐药基因盒在不同种属细菌中传播[1-2]。构成该复合整合子的基础骨架是int1基因和ISCR1元件,是与细菌多药耐药表型十分相关的基因元件,在很多种类的细菌中均有检出[3-5]。以往通过分别检测这2种基因元件的携带情况对多药耐药细菌的表型进行初步地预测。
目前尚未有研究建立ISCR1相关的复合型Ⅰ型整合子快速、简便的检测方法,因此本研究建立了可同时检测int1基因和ISCR1元件的实时荧光定量聚合酶链式反应(real-time quantitative PCR,qPCR)方法,用于对该复合型整合子的检测,并评价了该实时荧光PCR方法的灵敏度、特异性和稳定性。
1 材料与方法 1.1 材料 1.1.1 实验菌株同时携带有int1基因和ISCR1元件的肠埃希菌属细菌16株、不动杆菌属细菌2株、假单胞菌属细菌2株;只携带有int1基因的肠杆菌属细菌12株、不动杆菌属2株、假单胞菌属细菌2株、沙门菌属细菌2株、志贺菌属细菌2株;只携带有ISCR1元件的不动杆菌属细菌19株;2种基因元件均不含有的肠杆菌属细菌16株、不动杆菌属细菌2株、假单胞菌属细菌2株、志贺菌属细菌2株。所有菌株属,int1基因和ISCR1元件携带情况均通过前期普通PCR试验进行验证确认,并由中国疾病预防控制中心(CDC)传染病预防控制所细菌耐药室保存。
1.1.2 荧光引物及探针根据GenBank上公布的int1基因和ISCR1元件序列,使用Oligo 6.0软件,根据实时荧光定量PCR方法特点,按照每种基因的预期扩增长度不超过250 bp,上、下游引物及探针长度均各不超过25 bp,探针Tm值在68~70 ℃,完成引物和探针设计,经与GenBank进行blast比对确定后,交由上海基康生物科技有限公司进行合成。使用的引物和探针见表 1。
| 扩增基因 | 引物/探针名称 | 碱基序列(5′~3′) | Tm值(℃) | 扩增片段长度(bp) |
| int1 | int1-F | GGC AAC YTT GGG CAG CA | 60.3 | 148 |
| int1-R | CTG AAG CCA GGG CAG ATC C | 59.3 | ||
| int1-P | HEX-TTC GGT CTC CAC GCA TCG TCA GG-MGB | 69.2 | ||
| ISCR1 | ISCR1-F | TAA CCG AAG CAC CAT GTA ATT GA | 58.2 | 128 |
| ISCR1-R | CCT CAG CCA TCG CAT CG | 58.4 | ||
| ISCR1-P | FAM-TCG TCT TCG CCC TCT TCC AGT GTC A-MGB | 68.8 |
使用LightCycler® 480 Ⅱ(瑞士Roche Doagnostics公司)仪器进行实时荧光定量PCR操作,使用LabCycler Standard Plus PCR仪(德国Senso公司)进行普通PCR操作。使用NanoDrop ND-1000分光光度计(美国Thermo Fisher公司)进行DNA浓度的测定。使用QIAquick® Gel Extraction Kit(德国Qiagen公司)进行目的基因切胶纯化。使用pEASY®-T5 Zero Cloning Kit (北京全式金生物技术有限公司)进行目标基因片段转化。使用TIANGEN®TIANamp Bacteria DNA Kit和TIANprep Mini Plasmid Kit Ⅱ(均购于天根科技生化北京有限公司)进行菌株DNA的提取和质粒的提取。使用Probe qPCR Mix进行real-time PCR操作和Premix Taq (TaKaRa Taq® Version 2.0 plus dye)进行普通PCR操作,均购于宝生物工程(大连)有限公司。
1.2 方法 1.2.1 DNA的提取按照说明书进行菌株基因组DNA的提取,-20 ℃保存。
1.2.2 实时荧光定量PCR反应体系和条件按照LightCycler® 480 Ⅱ荧光定量PCR仪及Probe qPCR Mix规定的操作流程及推荐体系,将本研究的反应体系定位总体积为20 μl,含有2×Premix Taq 10 μl,两对10 μmol/L的引物各0.3 μl,2种耐药基因元件检测MGB探针各0.3 μl,DNA模板1 μl,其他加入去离子水补充至20 μl。扩增条件为预变性95 ℃ 120 s,接着为95 ℃ 5 s,56 ℃ 20 s用于产物延伸及荧光信号的收集,共进行40个循环。反应完成后将baseline扣除,记录反应过程中对应的超过阈值的荧光信号所经历的循环数,即Ct值。每次进行反应时,均需要同时进行去离子水阴性对照,单独含有int1基因和ISCR1元件的阳性对照,同时含有int1基因和ISCR1元件的阳性对照以及一个靶定为16S rDNA的内参对照作为每次荧光PCR反应的质控对照。
1.2.3 标准质粒的制备和标准曲线的建立分别以int1-F/int1-R和ISCR1-F/ISCR1-R为引物,目的产物片段经过切胶纯化回收后连接T载体,并转化到感受态细胞中,筛选阳性克隆,用PCR验证并测序最终确认后,进行质粒提取。
1.2.4 质粒拷贝数的计算测定2个标准重组质粒DNA浓度,其中int1基因重组质粒浓度为263.1 ng/μl,ISCR1元件重组质粒浓度为183.6 ng/μl,按照下列公式根据质粒的分子质量将质粒样品浓度换算成拷贝数浓度。int1基因重组质粒拷贝数为5.89×1010拷贝/μl,ISCR1元件重组质粒拷贝数为4.13×1010拷贝/μl。
1.2.5 标准曲线的建立将重组质粒稀释为100拷贝/μl~108拷贝/μl共9个浓度梯度,每个梯度进行3次重复的实时荧光定量PCR检测。
1.2.6 实时荧光定量PCR方法特异性的检测将所有实验菌株按照上述real-time PCR条件和体系进行扩增。
1.2.7 实时荧光定量PCR方法的稳定性评价分别使用int1基因携带、ISCR1元件携带的标准质粒拷贝质粒进行本方法的稳定性评价试验。在同一次实时荧光定量PCR试验中,对108拷贝/μl~102拷贝/μl的标准质粒进行检测,每个质粒样本进行3个重复。相同的试验操作共进行3次。获得批内和批间重复稳定性试验评价结果。
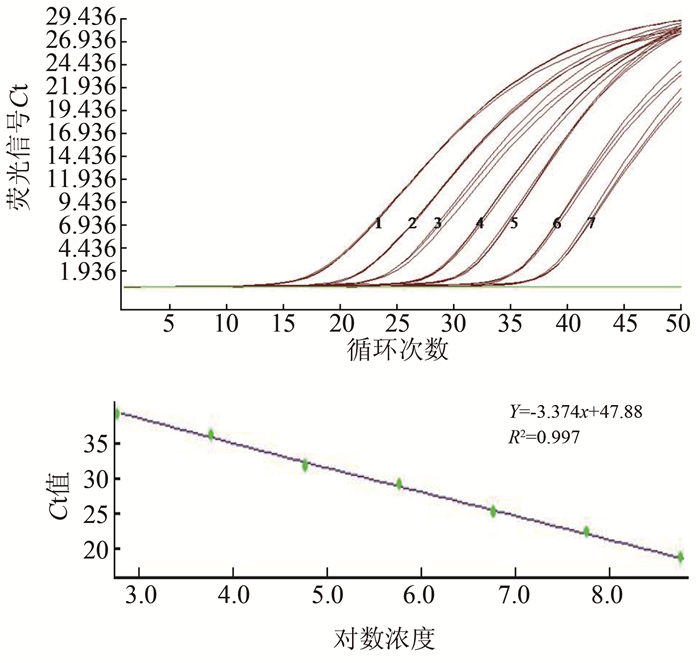
2 结果 2.1 含int1基因和ISCR1元件的质粒标准品的灵敏度检测当int1和ISCR1构建质粒的浓度分别在5.89×101拷贝/μl~5.89×108拷贝/μl和4.13×101拷贝/μl~4.13×108拷贝/μl时,所有携带2种基因元件的实验菌株的3个平行都出现了高于检测阈值的扩增荧光信号;所有只单独携带int1基因或者ISCR1元件的实验菌株的3个平行都出现了相应的高于检测阈值的扩增荧光信号。而当构建质粒的浓度梯度为100拷贝/μl时,所有携带2种基因元件实验菌株均未出现扩增荧光信号,所有不携带int1基因或者ISCR1元件的实验菌株也均未出现扩增荧光信号。由每个反应体系加入模板量为1 μl可知,本研究建立的同时检测int1基因和ISCR1元件的二重实时荧光PCR方法,对int1和ISCR1构建质粒标准品的检测下限分别为5.89×101拷贝/μl反应体系和4.13×101拷贝/μl反应体系。int1基因重组质粒在质粒浓度为5.89×102拷贝/μl~5.89×108拷贝/μl的区间内,对数值与反应Ct值之间成良好的线性关系,见图 1,扩增效率为0.99。ISCR1元件重组质粒在质粒浓度为4.13×102拷贝/μl~4.13×108拷贝/μl的区间内,对数值与反应Ct值之间成良好的线性关系,见图 2,扩增效率为1.04。
|
| 图 1 int1基因重组质粒标准品荧光信号图及对数值-Ct对应标准曲线 Figure 1 Fluorescent graph and standard curve of int1 gene carrying recombinant plasmid amplified by MGB qPCR assay 注:1~7分别表示5.89×108拷贝/μl~5.89×102拷贝/μl重组质粒标准品对应扩增曲线 |
| |

|
| 图 2 ISCR1基因重组质粒标准品荧光信号图及对数值-Ct对应标准曲线 Figure 2 Fluorescent graph and standard curve of ISCR1 gene carrying recombinant plasmid amplified by MGB qPCR assay 注:1~7分别表示4.13×108拷贝/μl~4.13×102拷贝/μl重组质粒标准品对应扩增曲线 |
| |
对2种基因元件均不含的实验菌株进行试验扩增,未见出现特异性扩增曲线。对单独含有int1基因或者ISCR1元件的实验菌株进行实验扩增,未发现出现非特异性扩增。在2种基因元件都存在的实验菌株的扩增中,亦不存在由于2套引物/探针相互影响而造成干扰的扩增现象。
2.3 实时荧光定量PCR方法的稳定性评价分别使用int1基因携带、ISCR1元件携带的标准质粒拷贝质粒进行本方法的稳定性评价。int1基因标准质粒qPCR批内变异系数在0.21%~1.26%,批间变异系数在0.27%~1.46%;ISCR1元件标准质粒qPCR批内变异系数在0.14%~1.01%,批间变异系数在0.11%~1.73%,见表 2。
| 重组质粒浓度梯度 | 基因类型 | 批内重复(Ct) | CV(%) | 批间重复(Ct) | CV(%) | ||||
| 重复1 | 重复2 | 重复3 | 批次1 | 批次2 | 批次3 | ||||
| 108 | int1 | 18.37 | 18.38 | 18.21 | 0.49 | 18.36 | 18.28 | 18.37 | 0.27 |
| ISCR1 | 18.25 | 17.96 | 18.12 | 0.83 | 17.92 | 17.94 | 17.96 | 0.11 | |
| 107 | int1 | 21.92 | 22.02 | 21.85 | 0.36 | 22.02 | 22.13 | 21.54 | 1.46 |
| ISCR1 | 21.53 | 21.95 | 21.85 | 1.01 | 21.91 | 21.87 | 22.16 | 0.73 | |
| 106 | int1 | 24.99 | 24.47 | 24.45 | 1.26 | 23.54 | 23.75 | 23.59 | 0.47 |
| ISCR1 | 25.05 | 25.20 | 25.13 | 0.32 | 25.14 | 25.18 | 25.11 | 0.16 | |
| 105 | int1 | 28.65 | 28.53 | 28.58 | 0.21 | 29.24 | 29.11 | 28.65 | 1.07 |
| ISCR1 | 27.67 | 27.69 | 27.75 | 0.14 | 27.77 | 27.72 | 27.67 | 0.18 | |
| 104 | int1 | 31.43 | 31.06 | 31.52 | 0.80 | 31.06 | 30.63 | 30.62 | 0.81 |
| ISCR1 | 31.09 | 31.16 | 31.05 | 0.19 | 31.05 | 30.99 | 30.85 | 0.32 | |
| 103 | int1 | 35.44 | 35.74 | 35.70 | 0.45 | 35.74 | 35.13 | 35.86 | 1.10 |
| ISCR1 | 35.63 | 35.91 | 36.03 | 0.56 | 35.99 | 36.03 | 36.35 | 0.55 | |
| 102 | int1 | 38.58 | 38.28 | 38.50 | 0.39 | 38.58 | 38.93 | 37.86 | 1.43 |
| ISCR1 | 38.17 | 38.14 | 38.36 | 0.31 | 38.36 | 38.21 | 39.43 | 1.73 | |
| 注:CV:coefficient of variation,变异系数 | |||||||||
ISCR1是最近十几年发现和逐渐被认识的一种和多种基因捕获和传播有密切关系的元件[6-7]。Ⅰ型整合子是一种已经被广泛认识和发现的与耐药基因传播有关的基因结构,其结构存在可以通过检测上游存在的Ⅰ型整合酶完成[8-9]。Ⅰ型整合酶和ISCR1构成的复合型Ⅰ型整合子结构,可造成更广泛意义的耐药基因在人间和自然界的散播。已有国内、外研究显示,在人间、动物种群中、自然环境中存在大量携带有复合型Ⅰ型整合子的多药耐药细菌、泛耐药菌甚至全耐药菌[3-5, 10-15],这些细菌的流行给院内感染控制和社区公共卫生防控带来了巨大的潜在威胁,监测和检测十分必要。
目前使用探针标记技术qPCR进行病原菌检测、耐药基因筛查已经越来越多见[15-18]。孟双等[19]利用TaqMan探针技术对克罗诺杆菌进行检测,特异性和灵敏度均可满足日常检测需求。龚林等[20]针对氨基糖苷类耐药基因armA建立qPCR方法达到了4.07×101拷贝/μl的检测灵敏度。Chen等[21]应用MGB探针标记技术对新型耐药基因mcr-1进行检测,qCPR的灵敏度为1.0×101拷贝/μl。本研究利用MGB探针标记技术,将int1基因和ISCR1元件的检测融合到一个实时荧光反应体系中,新建一套双元件二重实时荧光PCR检测方案,可在40 min内于一个反应管里同时对int1基因和ISCR1元件2种多药耐药相关基因进行检测,检测灵敏度均在101拷贝/μl数量级,与以往文献实验结果相似。在满足特异性和稳定性的要求下,将相较传统的PCR检测方法,节约了时间,减少了由于开盖造成的PCR产物污染,避免了扩增试验下游凝胶电泳成像方法观察结果的耗时和由此产生的环境污染,非常适合大批量多重耐药细菌的初步筛选工作,但该方法尚未经过大规模分离菌株的验证及基层实验室的推广试用,其实际应用的评价效率还需基层、临床实践进行进一步验证和全面的评价。
作者贡献:
车洁 ORCID: 0000-0003-0473-7942
车洁:建立方法、文章撰写
赵晓菲:单盲法验证
李娟、卢金星:思路、技术指导
陈霞:实验室指导、文章校验
| [1] |
Li J, Lan RT, Xiong YW, et al. Sequential isolation in a patient of Raoultella planticola and Escherichia coli bearing a novel ISCR1 element carrying blaNDM-1[J]. PLoS One, 2014, 9(3): e89893. DOI:10.1371/journal.pone.0089893 |
| [2] |
Casella T, Rodríguez MM, Takahashi JT, et al. Detection of blaCTX-M-type genes in complex class 1 integrons carried by Enterobacteriaceae isolated from retail chicken meat in Brazil[J]. Int J Food Microbiol, 2015, 197: 88-91. DOI:10.1016/j.ijfoodmicro.2014.12.001 |
| [3] |
Toleman MA, Walsh TR. ISCR elements are key players in IncA/C plasmid evolution[J]. Antimicrob Agents Chemother, 2012, 54(8): 3534. |
| [4] |
Chen X, Li GX, Zhang H, et al. Characterization of class 1 integron gene cassettes among clinical bacteria isolated from one large hospital in northern China[J]. Biomed Environ Sci, 2013, 26(12): 1003-1007. |
| [5] |
Chen X, Yuan M, Li GX, et al. Dissemination of int1 gene and ISCR1 and their relations with multi-drug resistance in clinical isolates[J]. Chinese Journal of Zoonoses, 2013, 29(7): 646-652. (in Chinese) 陈霞, 袁敏, 李桂喜, 等. 基因捕获元件int1和ISCR1在临床菌株中的分布及与细菌耐药性的关系研究[J]. 中国人兽共患病学报, 2013, 29(7): 646-652. |
| [6] |
Toleman MA, Bennett PM, Walsh TR. ISCR elements:novel gene-capturing systems of the 21st century[J]. Microbiol Mol Biol Rev, 2006, 70(2): 296-316. DOI:10.1128/MMBR.00048-05 |
| [7] |
Wang FP, Wu KH, Sun JJ, et al. Novel ISCR1-linked resistance genes found inmultidrug-resistant Gram-negative bacteria in southern China[J]. Int J Antimicrob Agents, 2012, 40(5): 404-408. DOI:10.1016/j.ijantimicag.2012.06.016 |
| [8] |
Wu KH, Wang FP, Sun JJ, et al. Class 1 integron gene cassettes inmultidrug-resistant Gram-negative bacteria in southern China[J]. Int J Antimicrob Agents, 2012, 40(3): 264-267. DOI:10.1016/j.ijantimicag.2012.05.017 |
| [9] |
Ibrahim ME, Maqzoub MA, Bilal NE, et al. Distribution of class Ⅰ integrons and their effect on the prevalence of multi-drug resistant Escherichia coli clinical isolates from Sudan[J]. Saudi Med J, 2013, 34(3): 240-247. |
| [10] |
Xia RR, Guo XH, Zhang YZ, et al. qurVC-like gene located in a novel complex class 1 integron harboring the ISCR1 element in an Aeromonas punctata strain from an aquatic environment in Shandong province, China[J]. Antimicrob Agents Chemother, 2010, 54(8): 3471-3474. DOI:10.1128/AAC.01668-09 |
| [11] |
Wang FP, Chen Q, Wu KH, et al. Study on the mechanism of drug resistance and the genotype of Escherichia coli clinical isolastes[J]. Chinese Journal of Laboratory Diagnosis, 2011, 15(2): 293-297. (in Chinese) 王凤平, 陈清, 吴奎海, 等. 临床分离大肠埃希菌耐药机制和基因分型研究[J]. 中国实验诊断学, 2011, 15(2): 293-297. |
| [12] |
Shahid M. Citrobacter spp. simultaneously harboring blaCTX-M, blaTEM, blaSHV, blaampC, and insertion sequences IS 26 and orf513:an evolutionary phenomenon of recent concern for antibiotic resistance[J]. J Clin Microbiol, 2012, 48(5): 1833-1838. |
| [13] |
Chen X, Li GX, Yu HL, et al. Distribution of ISCR1 in clinical strains and its relationship with blaPER-1 gene[J]. Disease Surveillance, 2013, 28(3): 178-183. (in Chinese) 陈霞, 李桂喜, 禹惠兰, 等. 插入序列共同区在多种临床菌株间的分布及其与超广谱β-内酰胺酶基因blaPER-1的关系研究[J]. 疾病监测, 2013, 28(3): 178-183. DOI:10.3784/j.issn.1003-9961.2013.3.004 |
| [14] |
Chen XL, Huang ZJ. Genetic mechanisms of aquatic bacterial resistance[J]. Chinese Journal of Antibiotics, 2013, 38(8): 573-578. (in Chinese) 陈旭凌, 黄志坚. 水生细菌耐药性的遗传机制[J]. 中国抗生素杂志, 2013, 38(8): 573-578. |
| [15] |
Zhu SR, Jin DZ, Zhang Z, et al. Duplex fluorescence quantitative PCR for detection of Legionella by using MGB fluorescence probe[J]. Chinese Journal of Zoonoses, 2009, 25(2): 174-178. (in Chinese) 朱水荣, 金大智, 张政, 等. TaqMan-MGB双重探针PCR技术检测军团菌[J]. 中国人兽共患病学报, 2009, 25(2): 174-178. |
| [16] |
Gao ZQ, Xing J, Feng YF, et al. Development of a TaqMan MGB-probe based real-time fluorescence quantitative PCR assay for rapid detection of Brucella[J]. Chinese Journal of Zoonoses, 2011, 27(11): 995-100. (in Chinese) 高正琴, 邢进, 冯育芳, 等. TaqMan MGB探针实时荧光定量PCR快速检测布鲁氏菌[J]. 中国人兽共患病学报, 2011, 27(11): 995-100. DOI:10.3969/j.issn.1002-2694.2011.11.011 |
| [17] |
Shi KC, Li FM, Zhang BX, et al. Establishment of TaqMan-MGB real-time PCR for detection of blaNDM-1 gene of superbug[J]. Chinese Journal of Preventive Veterinary Medicine, 2015, 37(12): 952-956. (in Chinese) 施开创, 李凤梅, 张步娴, 等. 超级细菌blaNDM-1基因TaqMan-MGB荧光定量PCR检测方法的建立[J]. 中国预防兽医学报, 2015, 37(12): 952-956. DOI:10.3969/j.issn.1008-0589.2015.12.13 |
| [18] |
Xian HP, Sun YJ, Liu C, et al. Employment of TaqMan MGB fluorescent probe real-time PCR in detecting current resistant mutation of H. pylori A2142GA2143G in Beijing area[J]. Chinese Journal of Clinical Laboratory Science, 2016, 34(6): 401-406. (in Chinese) 线海鹏, 孙宇晶, 刘畅, 等. 用TaqMan-MGB荧光探针法检测北京地区幽门螺旋杆菌A2142G/A2143G耐药突变[J]. 临床检验杂志, 2016, 34(6): 401-406. |
| [19] |
Meng S, Li J, Bai XM, et al. Study of real time TaqMan PCR for detection of Enterobacter sakazakii[J]. Disease Surveillance, 2011, 26(9): 746-748, 752. (in Chinese) 孟双, 李娟, 白雪梅, 等. 阪崎肠杆菌实时荧光TaqMan PCR检测方法的研究[J]. 疾病监测, 2011, 26(9): 746-748, 752. |
| [20] |
Gong L, Yuan M, Chen X, et al. Establishment of real-time PCR assay to detect resistance gene armA[J]. Disease Surveillance, 2014, 29(11): 901-904. (in Chinese) 龚林, 袁敏, 陈霞, 等. 氨基糖苷类药物耐药基因armA实时荧光定量聚合酶链反应检测方法的建立[J]. 疾病监测, 2014, 29(11): 901-904. DOI:10.3784/j.issn.1003-9961.2014.11.015 |
| [21] |
Chen X, Zhao XF, Che J, et al. Detection and dissemination of the colistin resistance gene, mcr-1, from isolates and fecal samples in China[J]. J Med Microbiol, 2017, 66(2): 119-125. DOI:10.1099/jmm.0.000425 |
 2017, Vol. 32
2017, Vol. 32


