扩展功能
文章信息
- 亚红祥, 沈姝, 苏正元, 邓菲, 张云智
- YA Hong-xiang, SHEN Shu, SU Zheng-yuan, DENG Fei, ZHANG Yun-zhi
- 云南省西北地区家畜体表蜱类形态学与分子生物学鉴定
- Morphological and molecular identification of tick species from body surface of domestic animals in northwestern Yunnan
- 疾病监测, 2017, 32(7): 609-614
- Disease Surveillance, 2017, 32(7): 609-614
- 10.3784/j.issn.1003-9961.2017.07.019
-
文章历史
- 收稿日期:2016-12-14
2. 中国科学院武汉病毒研究所, 湖北 武汉 430071
2. Wuhan Institute of Virology, China Academy of Science, Wuhan 430071, Hubei, China
蜱是一种寄生于动物体表的常见的吸血寄生虫,隶属节肢动物门(Arthropoda),蛛形纲(Arachnida),蜱螨亚纲(Acari),寄螨总目(Parasitiformes),蜱目(Ixodida)。目前世界上已发现硬蜱科(Ixodidae)12属713种,软蜱科(Argasidae)4属185种,纳蜱科(Nuttalliellidae)1属1种,共计3科17属899种[1]。中国发现蜱类2科(硬蜱科和软蜱科)10属119种[2]。蜱可携带细菌、病毒、立克次体、寄生虫等病原体叮咬人或动物,引发多种人兽共患疾病[3]。自2006年安徽省首次发现人粒细胞无形体病以来,我国各地报道了许多“蜱叮人”事件,涌现出大量蜱传病例,并发现了新布尼亚病毒、新内罗病毒、劳氏立克次体等新的蜱传病原体与疾病[4-8]。蜱已是我国近年来重要的新发传染病的主要传播媒介之一。云南省为我国西南边陲高原省份,素有“动植物王国”之称,已发现蜱类47种居我国首位[9-10],存在莱姆病、Q热、森林脑炎、巴贝西虫病等多种蜱传疾病[11],但对其媒介蜱的相关调查较少[12]。云南省西北地区山多,地形复杂,动植物丰富,自然条件优越,较适宜宿主动物及媒介昆虫的生存与繁殖。为了更好地认识媒介蜱,为蜱的防治和蜱传播疾病的研究提供依据,笔者在云南省西北地区进行了蜱类及蜱携带病原体的调查。
1 材料与方法 1.1 样本来源2015年4月在云南省怒江州和迪庆州家养动物体表分别采集蜱1 227只和37只,8月在云南省德宏州瑞丽市家养动物体表采集蜱11只,置液氮保存。
1.2 形态学鉴定参考文献[13]分类检索表中的描述,在体视显微镜(SMZ-45T3,重光仪器有限公司)下直接观察进行蜱形态学鉴定。
1.3 PCR检测以生理盐水作为研磨液将经形态学鉴定后的蜱种分别进行研磨,每份样品取60 μl研磨悬液,采用Qiagen公司的组织DNA提取试剂盒,按说明书操作提取总DNA。应用文献[14-15]中的引物及条件对样品的16S rRNA和ITS2基因分别进行聚合酶链反应(PCR)扩增,目的基因片段分别为460 bp和920~1 850 bp,引物由武汉擎科生物科技有限公司合成。PCR反应总体积为50 μl,应用北京全式金生物技术有限公司2×EasyTaq PCR SuperMix试剂盒在Biometra TProfessional PCR仪中进行PCR扩增,以无菌水作为阴性对照,无阳性对照。PCR扩增时取2 μl被检样本DNA为模板,6 μl PCR产物用1.5%琼脂糖凝胶检测,DL5000 DNA Marker来自于大连宝生物公司。
1.4 DNA序列测定及分析PCR阳性产物送武汉擎科生物科技有限公司进行序列测定。利用SeqMan软件拼接序列后,通过Internet网进入美国国家生物技术信息中心(www.ncbi.nlm.nih.gov)利用“BLAST”工具进行比较得到相关的已知序列信息。然后,采用DNAstar中的MegAlign软件对序列进行同源性比较,并运用Mega 6.06软件Neighbor-joining法(Kimura 2-parameter model)自展1 000次构建系统进化树。
2 结果 2.1 形态学鉴定通过观察蜱假头基、基突、须肢、眼、盾板、缘垛、气门板、足、肛沟等形态学特征,见表 1。将1 275只成蜱鉴定为1科(硬蜱科)3属(扇头蜱属Rhipicephalus、硬蜱属Ixodes、血蜱属Haemaphysalis)4种,见图 1。其中微小扇头蜱(R. microplus)1 263只(占99.1%),卵形硬蜱(I. ovatus)7只(占0.6%),锐跗硬蜱(I. acutitarsus)4只(占0.3%),未知血蜱(Haemaphysalis sp.)1只(占0.1%)。
| 特征 | 微小扇头蜱 R. microplus |
卵形硬蜱 I. ovatus |
锐跗硬蜱 I. acutitarsus |
未知血蜱 Haemaphysalis sp. |
||||||
| 雄 | 雌 | 雄 | 雌 | 雄 | 雌 | 雌 | ||||
| 体形 | 椭圆形 | 椭圆形 | 卵圆形 | 卵圆形 | 卵圆形 | 卵圆形 | 逗点形 | |||
| 假头基 | 六角形 | 六角形 | 近五边形 | 近五边形 | 五边形 | 五边形 | 矩形,宽短 | |||
| 基突 | 短 | 很短 | 付缺 | 短小 | 付缺 | 付缺 | 很短 | |||
| 须肢 | 粗短 | 很粗短 | 长约宽的2倍 | 长约宽的3倍 | 较粗,长约宽的2倍 | 较窄长,长约宽的4倍 | 外侧突出, 呈角状 | |||
| 眼 | 小,扁平 | 小,卵圆形 | 无 | 无 | 无 | 无 | 无 | |||
| 盾板 | 较窄,两侧留下窄长的体缘 | 五边形,长大于宽 | 长卵圆形,侧缘弧度较小 | 亚圆形 | 卵圆形 | 心形 | 心形 | |||
| 缘垛 | 无 | 无 | 无 | 无 | 无 | 无 | 有 | |||
| 缘沟 | 无 | 无 | 明显,缘褶窄小 | 两侧明显 | 明显 | 深,缘褶肥大,后缘窄 | 不明显 | |||
| 气门板 | 长圆形,稍短 | 长圆形 | 卵圆形 | 近圆形 | 卵圆形 | 近圆形 | 近圆形 | |||
| 足 | 中等大小,按次序渐粗, | 中等大小 | 中等大小 | 中等大小 | 稍长 | 稍长 | 中等大小 | |||
| 垫 | 短 | 短 | 与爪等长 | 长 | 短 | 短 | 未观察 | |||
| 肛沟 | 无 | 无 | 肛前沟 | 肛前沟 | 肛前沟 | 肛前沟 | 肛后沟 | |||
| 尾突 | 明显,呈三角形 | 无 | 无 | 无 | 无 | 无 | 无 | |||

|
| 图 1 云南省西北地区的2种蜱 Figure 1 Four species of ticks in northwestern Yunnan 注:微小扇头蜱(雌):a1.背面,a2.腹面;卵形硬蜱(雌,肢体不完整):b1.背面,b2.腹面;锐跗硬蜱(雄):c1.背面,c2.腹面;未知血蜱(雌,肢体不完整):d1.背面,d2.腹面 |
| |
寄生于耕牛体表的蜱种有微小扇头蜱(1 253只,占98.3%)、卵形硬蜱(7只,占0.6%)、锐跗硬蜱(4只,占0.3%)。寄生于家犬体表的蜱种有微小扇头蜱(10只,占0.8%)、未知血蜱(1只,占0.1%),见表 2。
| 宿主动物 | 微小扇头蜱 R. microplus |
卵形硬蜱 I. ovatus |
锐跗硬蜱 I. acutitarsus |
未知血蜱 Haemaphysalis sp. |
总计 | |||||||||
| 只数 | 百分比(%) | 只数 | 百分比(%) | 只数 | 百分比(%) | 只数 | 百分比(%) | 只数 | 百分比(%) | |||||
| 耕牛 | 1 253 | 98.3 | 7 | 0.6 | 4 | 0.3 | 0 | 0.0 | 1 264 | 99.1 | ||||
| 家犬 | 10 | 0.8 | 0 | 0.0 | 0 | 0.0 | 1 | 0.1 | 11 | 0.9 | ||||
| 合计 | 1 263 | 99.1 | 7 | 0.6 | 4 | 0.3 | 1 | 0.1 | 1 275 | 100.0 | ||||
对经形态学鉴定的微小扇头蜱(P6和P8)、卵形硬蜱(P2、P3、P5和P9)、锐跗硬蜱(P1和P7) 及未知血蜱(P4) 分别进行基因16S rDNA和ITS2片段扩增,结果样品P1~P9均检测出预期目的片段(见图 2),检出率100.0%。

|
| 图 2 PCR检测蜱基因16S rDNA和ITS2片段结果 Figure 2 Results of PCR detection for tick 16S rDNA and ITS2 segments 注:P1、P7:I. acutitarsus;P2、P3、P5、P9:I. ovatus;P4:Haemaphysalis sp.;P6、P8:R. microplus;N:negative control;M:DL5000 DNA Marker |
| |
应用MegAlign软件将所获得的样本序列与GenBank中已知参考序列进行核苷酸相似性比较分析。16S rDNA序列分析显示:样品P6和P8的相似性100.0%,P6与印度微小扇头蜱(EU918188) 的相似性最高为99.8%,与中国云南省微小扇头蜱(JX051062) 的相似性99.4%;P2、P3、P5和P9的相似性100.0%,P2与美国卵形硬蜱(U95900) 的相似性最高为93.8%,与美国锐跗硬蜱(U95877) 的相似性为87.6%;P1和P7的相似性100.0%,P1与日本锐跗硬蜱(AB105167) 的相似性最高为95.9%,与美国锐跗硬蜱(U95877) 的相似性为94.2%,与P2的相似性为87.0%;P4与澳大利亚parva血蜱(JX573136) 的相似性为90.5%,与中国云南省长角血蜱(JX051064) 的相似性为88.7%;P1、P2、P4和P6之间的差异性为13.0%~27.1%。
ITS2序列分析显示:样品P6和P8的相似性100.0%,P6与来自老挝(KC503276)、柬埔寨(KC503272)、中国贵州省(JQ737125)、中国云南省(KC203364) 的微小扇头蜱的相似性均为99.9%;P2、P3、P5和P9的相似性100.0%,P2与日本卵形硬蜱(D88857) 的相似性最高为96.1%;P1与日本锐跗硬蜱(AB605168) 的相似性最高为95.3%,与P2的相似性为57.5%;P4与罗马尼亚Haemaphysalis parva血蜱(FN296282) 的相似性最高为91.0%;P1、P2、P4和P6之间的差异性在42.5%~62.2%。
2.5 系统进化树分析根据蜱16S rDNA基因部分核苷酸序列进行系统进化树分析,结果显示P6与印度微小扇头蜱(EU918188) 在同一分支上,与中国云南省微小扇头蜱(JX051062) 不在同一分支上,表明P6与印度微小扇头蜱的亲缘关系较近,而与云南省微小扇头蜱的亲缘关系稍远;P2与美国卵形硬蜱(U95900) 在同一分支上,亲缘关系较近;P1与日本锐跗硬蜱(AB105167) 在同一分支上,亲缘关系较近;P4与澳大利亚parva血蜱(JX573136) 同属一支,亲缘关系较近,见图 3。
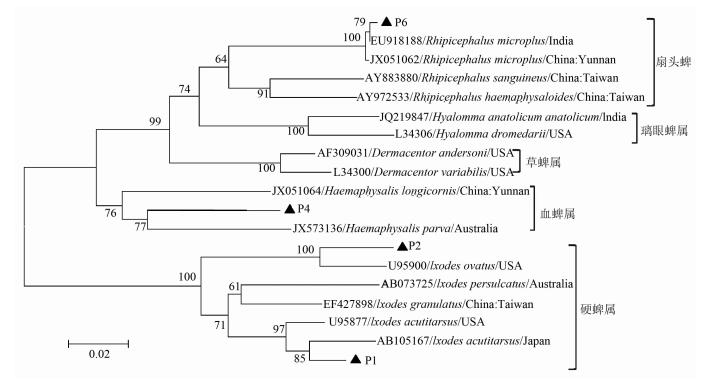
|
| 图 3 根据蜱16S rDNA基因部分序列构建系统进化树 Figure 3 Phylogenetic tree of partial segments of tick 16S rDNA gene |
| |
据蜱ITS2基因部分核苷酸序列进行系统进化树分析,结果显示P6与来自柬埔寨(KC503272)、老挝(KC503276)、中国贵州省(JQ737125)、中国云南省(KC203364) 的微小扇头蜱在同一分支上,亲缘关系较近;P2与日本卵形硬蜱(U95900) 在同一分支上,亲缘关系较近;P1与日本锐跗硬蜱(AB605168) 在同一分支上,亲缘关系较近;P4与罗马尼亚parva血蜱在同一分支,亲缘关系较近,见图 4。
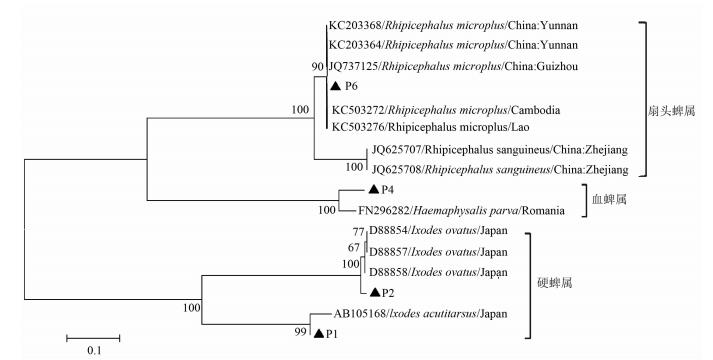
|
| 图 4 根据蜱ITS2基因部分序列构建系统进化树 Figure 4 Phylogenetic tree of partial segments of tick ITS 2 gene |
| |
蜱类的系统分类主要依靠传统的形态特征分类法,其优点是比较直观、操作简便、对环境条件要求低、鉴定成本低等,从而被长期广泛采用,但对鉴定人员的专业知识、工作经验等方面要求高。另外,形态学方法对一些外形相似蜱、肢体不完整蜱、亲缘种蜱等一些特殊蜱样较难以鉴定。随着分子生物学的发展,可通过检测蜱DNA分子对蜱类进行分子分类学研究[14-17]。目前主要采用检测线粒体16S rDNA、核糖体转录间隔ITS2等基因[18-21],并将分子检测数据与形态学特征数据相结合,使蜱分类鉴定更加客观可靠。云南省蜱种类丰富,然而蜱类系统分类研究较少,系统发育学研究更滞后。
本次调查在云南省西北地区家养动物体表共捕获蜱1 275只,经形态学鉴定为1科3属4种:微小扇头蜱、卵形硬蜱、锐跗硬蜱和未知血蜱。蜱16S rDNA和ITS2基因核苷酸序列进化树分析显示,经形态学鉴定的微小扇头蜱、卵形硬蜱、锐跗硬蜱和未知血蜱分别与一些已知相对应的蜱种类聚,表明分子生物学鉴定与形态学结果完全一致。其中微小扇头蜱占99.1%,提示微小扇头蜱为该地区家畜体表蜱优势种群。寄生于耕牛体表的有微小扇头蜱、卵形硬蜱和锐跗硬蜱,家犬体表的有微小扇头蜱和未知血蜱,其中98.3%的微小扇头蜱采自耕牛体表。
基因16S rDNA进化速率较慢,结构保守,适合于研究属间、不同蜱种间的系统关系[15-16]。ITS2受外界环境的影响小,种内变异小,种间进化快、变异大,是种类鉴定和系统进化分析的重要标记[19-21]。本次通过对蜱基因16S rDNA和ITS2序列分析,结果显示两基因序列分析属间分类结果完全一致,而种内分析结果似乎存在一定分歧。目前蜱分类主要依靠形态学特征,分子检测工作较滞后,现有蜱种基因序列信息较少。本次序列分析时所选取的参照序列无法针对同一蜱的16S rDNA和ITS2序列同时获取进行分析,因此同一蜱的两基因序列种内分析结果似乎存在一些差异。检测到的4种蜱ITS2序列之间的差异性(42.5%~62.2%)明显大于16S rDNA序列(13.0%~27.1%),表明ITS2种属间变异大于16S rDNA。本次检测的微小扇头蜱与来自印度、柬埔寨、老挝、中国贵州省、云南省的微小扇头蜱的亲缘关系较近,卵形硬蜱与来自日本、美国的卵形硬蜱的亲缘关系较近,锐跗硬蜱与来自日本的锐跗硬蜱的亲缘关系较近。未知血蜱与罗马尼亚和澳大利亚parva血蜱的亲缘关系相对较近,序列相似性在91.0%~90.5%,而与中国云南省长角血蜱(JX051064) 的相似性仅88.7%,结合形态学鉴定结果,提示本次检测到的未知血蜱为一血蜱新种。
作者贡献:
亚红祥 ORCID:0000-0002-9917-9420
亚红祥:形态学分类、实验室检测、结果分析、论文撰写
沈姝:参与形态学分类、分子鉴定指导
苏正元:参与形态学分类和实验室检测
邓菲:指导
张云智:样品的收集和指导
| [1] |
Barker SC, Murrell A. Systematics and evolution of ticks with a list of valid genus and species names[J]. Parasitology, 2004, 129(Suppl): S15-36. |
| [2] |
Yang XJ, Chen Z, Liu JZ, et al. The valid genus and species names of ticks (Acari: Ixodida: Argasidae, Ixodidae) in China[J]. Journal of Hebei Normal University: Natural Science Edition, 2008, 32(4): 529-533. (in Chinese) 杨晓军, 陈泽, 刘敬泽, 等. 中国蜱类的有效属和有效种[J]. 河北师范大学学报:自然科学版, 2008, 32(4): 529-533. |
| [3] |
Pfäffle M, Littwin N, Muders SV, et al. The ecology of tick-borne diseases[J]. Int J Parasitol, 2013, 43(12/13): 1059-1077. |
| [4] |
Zhang LJ, Liu Y, Ni DX, et al. Nosocomial transmission of human granulocytic anaplasmosis in China[J]. JAMA, 2008, 300(19): 2263-2270. DOI:10.1001/jama.2008.626 |
| [5] |
Yu XJ, Liang MF, Zhang SY, et al. Fever with thrombocytopenia associated with a novel bunyavirus in China[J]. N Engl J Med, 2011, 364(16): 1523-1532. DOI:10.1056/NEJMoa1010095 |
| [6] |
Jia N, Zheng YC, Ma L, et al. Human infections with Rickettsia raoultii, China[J]. Emerg Infect Dis, 2014, 20(5): 866-868. DOI:10.3201/eid2005.130995 |
| [7] |
Xia H, Hu C, Zhang DK, et al. Metagenomic profile of the viral communities in Rhipicephalus spp. ticks from Yunnan, China[J]. PLoS One, 2015, 10(3): e0121609. DOI:10.1371/journal.pone.0121609 |
| [8] |
Shi M, Lin XD, Tian JH, et al. Redefining the invertebrate RNA virosphere[J]. Nature, 2016, 540(7634): 539-543. DOI:10.1038/nature20167 |
| [9] |
Chen Z, Yang XJ, Yang XH, et al. Geographical distribution and fauna of Chinese ticks[J]. Sichuan Journal of Zoology, 2008, 27(5): 820-823. (in Chinese) 陈泽, 杨晓军, 杨晓红, 等. 中国蜱类地理分布及区系分析[J]. 四川动物, 2008, 27(5): 820-823. |
| [10] |
Ya HX, Shen S, Su ZY, et al. Tick species and genetic variants analysis of tick gene in Hengduan Mountains, West Yunnan province, China[J]. Chinese Journal of Zoonoses, 2016, 32(10): 865-870. (in Chinese) 亚红祥, 沈姝, 苏正元, 等. 滇西横断山区家畜体表蜱类调查及鉴定[J]. 中国人兽共患病学报, 2016, 32(10): 865-870. |
| [11] |
Wu XB, Na RH, Wei SS, et al. Distribution of tick-borne diseases in China[J]. Parasit Vectors, 2013, 6(1): 119. DOI:10.1186/1756-3305-6-119 |
| [12] |
Gong ZD, Zi DY, Feng XG, et al. Composition and distribution of tick species in Hengduan mountains, West of Yunnan province[J]. Chinese Journal of Pest Control, 2001, 17(1): 31-33. (in Chinese) 龚正达, 自登云, 冯锡光, 等. 云南西部横断山区蜱类的组成及其分布[J]. 医学动物防制, 2001, 17(1): 31-33. |
| [13] |
Deng GP, Jiang ZJ. Economic insect fauna of China (Fasc 39)[M]. Beijing: Science Press, 1991. (in Chinese) 邓国藩, 姜在阶. 中国经济昆虫志(第三十九册)[M]. 北京: 科学出版社, 1991. |
| [14] |
Simon C, Frati F, Beckenbach A, et al. Evolution, weighting, and phylogenetic utility of mitochondrial gene sequences and a compilation of conserved polymerase chain reaction primers[J]. Ann Entomol Soc Am, 1994, 87(6): 651-701. DOI:10.1093/aesa/87.6.651 |
| [15] |
Mangold AJ, Bargues MD, Mas-Coma S. Mitochondrial 16S rDNA sequences and phylogenetic relationships of species of Rhipicephalus and other tick genera among Metastriata (Acari: Ixodidae)[J]. Parasitol Res, 1998, 84(6): 478-484. DOI:10.1007/s004360050433 |
| [16] |
Norris DE, Klompen JSH, Black WC. Comparison of the mitochondrial 12S and 16S Ribosomal DNA genes in resolving phylogenetic relationships among hard ticks (Acari: Ixodidae)[J]. Ann Entomol Soc Am, 1999, 92(1): 117-129. DOI:10.1093/aesa/92.1.117 |
| [17] |
Murrell A, Campbell NJH, Barker SC. A total-evidence phylogeny of ticks provides insights into the evolution of life cycles and biogeography[J]. Mol Phylogenet Evol, 2001, 21(2): 244-258. DOI:10.1006/mpev.2001.1018 |
| [18] |
Casati S, Bernasconi MV, Gern L, et al. Assessment of intraspecific mtDNA variability of European Ixodes ricinus sensu stricto (Acari: Ixodidae)[J]. Infect Genet Evol, 2008, 8(2): 152-158. DOI:10.1016/j.meegid.2007.11.007 |
| [19] |
Chitimia L, Lin RQ, Cosoroaba I, et al. Molecular characterization of hard and soft ticks from Romania by sequences of the internal transcribed spacers of ribosomal DNA[J]. Parasitol Res, 2009, 105(4): 907-911. DOI:10.1007/s00436-009-1474-1 |
| [20] |
Qin XC, Tian JH, Wang JB, et al. Identification of Haemaphysalis longicomis and Rhipicephalus microplus[J]. Chinese Journal of Epidemiology, 2011, 32(6): 608-612. (in Chinese) 覃新程, 田俊华, 王剑波, 等. 长角血蜱和微小扇头蜱的形态与分子生物学鉴定[J]. 中华流行病学杂志, 2011, 32(6): 608-612. |
| [21] |
Song S, Shao RF, Atwell R, et al. Phylogenetic and phylogeographic relationships in Ixodes holocyclus and Ixodescornuatus (Acari: Ixodidae) inferred from COX1 and ITS2 sequences[J]. Int J Parasitol, 2011, 41(8): 871-880. DOI:10.1016/j.ijpara.2011.03.008 |
 2017, Vol. 32
2017, Vol. 32


