扩展功能
文章信息
- 赵红庆, 徐萍, 周声安, 胡守奎
- ZHAO Hong-qing, XU Ping, ZHOU Sheng-an, HU Shou-kui
- 耐甲氧西林金黄色葡萄球菌不同来源株耐药性及流行特征分析
- Analysis of epidemiological characteristics and drug resistance of methicillin-resistant Staphylococcus aureus strains with different sources
- 疾病监测, 2017, 32(7): 603-608
- Disease Surveillance, 2017, 32(7): 603-608
- 10.3784/j.issn.1003-9961.2017.07.018
2. 合肥市51中学, 安徽 合肥 230061;
3. 日照市莒县人民医院, 山东 日照 276500;
4. 北京大学首钢医院, 北京 100144
2. No.51 Middle School of Hefei, Hefei 230061, Anhui, China;
3. Juxian County People's Hospital, Rizhao 276500, Shandong, China;
4. Peking University Shougang Hospital, Beijing 100144, China
随着抗菌药物的广泛使用,耐药性细菌的出现成为全球不容忽视的严重问题,耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)是目前世界范围内人医和兽医临床上的常见病原菌[1-3]。自1961年英国首次发现MRSA之后,便以惊人的速度在世界各地蔓延。近年来,MRSA的临床分离率呈明显上升趋势,并且对各种常用抗生素耐药,给临床治疗带来了严峻挑战,因此受到了全球广泛关注和重视[4-6]。Devriese等[7]报道在患乳腺炎的奶牛奶汁中检出MRSA以后,许多不同种动物如犬、猫、马、羊、猪、牛及家禽中均检出MRSA。有证据表明农场中家畜和人携带的MRSA存在交叉传播,且养殖猪、牛等的农场中MRSA的分离率高于养鸡场[8-9]。本研究对安徽省MRSA在动物食品、动物临床及人医临床中的分布和流行情况进行分析,对其耐药情况进行研究,旨在为控制MRSA的感染和临床用药提供理论支持。
1 材料与方法 1.1 菌株来源质控菌株为金黄色葡萄球菌ATCC29213和粪肠球菌ATCC29212,购自中国食品药品检定研究院。食源、动物源和人源菌株于2012年3-12月期间,分别采集于安徽省淮北、合肥和马鞍山地区的农贸市场、屠宰场,奶牛场及三甲医院。每个市选取10家农贸市场,每个农贸市场采集15份标本。
1.2 仪器和试剂聚合酶链反应(polymerase chain reaction,PCR)仪器购自美国BIO-RAD公司;VITEK-32微生物分析仪及配套比浊仪购自法国生物梅里埃公司;DYY-10C型电泳仪购自北京六一仪器厂;CHEF-MAPPER脉冲场电泳仪及Universal Hood Ⅱ凝胶成像仪购自美国BIO-RAD公司。GPI鉴定卡和GPS药敏卡由法国生物梅里埃公司生产;头孢西丁纸片(FOX 30 μg)购自Oxoid公司;PCR引物由上海生物工程公司合成;Taq DNA聚合酶、dNTP、上样缓冲液及DNA Marker DL2000购于大连宝生物公司;琼脂糖购自上海东海制药厂;MH琼脂购自杭州天和微生物试剂厂。
1.3 方法 1.3.1 样品的采集、菌株的分离培养及鉴定动物性食品标本的采集:分别采集淮北、合肥和马鞍山地区农贸市场的家畜及家禽肉类25 g。盛放于无菌试管或容器中,具体分离培养参照GB 4789.10-2010进行。动物临床标本的采集:采集合肥市某屠宰场刚宰杀的猪鼻腔拭子60份,快速放入装有2 ml 7.5% NaCl肉汤的5 ml试管中,封口摇匀,做好标记。标本接种于羊血琼脂平板上,35 ℃孵育培养18~24 h。人医临床标本的采集:采用常规方法采集门诊和住院患者的标本,主要是其炎性组织液或带血的脓性分泌物。标本接种于羊血琼脂平板上,35 ℃孵育培养18~24 h。
1.3.2 MRSA菌株的筛选所有MRSA菌株按细菌鉴定程序,采用法国生物梅里埃公司的VITEK-32全自动微生物分析系统的GPI卡进行鉴定,鉴定为金黄色葡萄球菌,同时进行补充试验,包括革兰染色、触酶试验、血浆凝固酶试验,所有MRSA菌株均为阳性。应用临床实验室标准化委员会(CLSI)推荐的头孢西丁纸片扩散法进行筛选。抑菌圈≤19 mm为耐药,≥20 mm为敏感。抑菌圈内有任何小菌落生长都应判断为MRSA。
1.3.3 MRSA的确认用PCR方法检测mecA基因进行确认。引物序列和扩增条件参照文献[10]进行。引物由上海生物工程公司合成。模板的提取采用煮沸方法,PCR反应体系25 μl,其中Taq酶0.2 μl、10×Buffer缓冲液2.5 μl、dNTP 1 μl、上游引物1 μl、下游引物1 μl、模板1 μl,无菌双蒸馏水补足25 μl;热循环参数为:94 ℃预变性5 min,94 ℃ 30 s,48 ℃ 30 s,72 ℃ 45 s,循环30次,最后72 ℃延伸5 min;电泳并在紫外凝胶成像仪下观察及记录结果。
1.3.4 药物敏感试验采用VITEK-32微生物分析仪GPS109药敏板对82株MRSA进行检测,共检测MRSA对14种抗菌药物的耐药性。14种抗菌药物分别为万古霉素、利奈唑烷、利福平、喹努普汀/达福普汀、四环素、甲氧苄啶/磺胺异恶唑、头孢唑啉、左氧氟沙星、庆大霉素、氨苄西林、氯洁霉素、红霉素、苯唑西林和青霉素G。操作过程严格依照说明书进行。
1.3.5 脉冲场凝胶电泳(Pulsed-field gel eletrophoresis, PFGE)参照美国CDC的PulseNet实验手册[11]。从培养皿上刮取适量细菌,均匀悬浊于2 ml细胞悬浮液(cell suspension buffer, CSB)中,浊度仪调节其麦氏浊度值为4.0,取400 μl CSB 37 ℃孵育5 min后加入20 μl蛋白酶K混匀。将菌悬液与400 μl 1% Seakem Gold:1%SDS慢慢混匀后加入模具,避免产生气泡,室温下凝固10~15 min后制成胶块。将胶块移入装有5 ml细胞裂解液(cell lysis solution, CLB)中,54 ℃水浴摇床(转速约130 r/min)中孵育2 h。弃去CLB后加入50 ℃预热的纯水,于50 ℃水浴摇床中清洗2次。每次10 min,然后用TE清洗4次,重复以上步骤,每次15 min。切取2 mm宽的胶块放入150 μl Sma Ⅰ酶切缓冲液中37 ℃缓冲10~15 min。吸出缓冲液,加入酶切液,每个菌株用酶40 U,H9812使用Xba Ⅰ酶切。确保胶块在液面下,37 ℃至少孵育2 h。吸出酶切液,每管加入200 μl 0.5×TBE,将胶块黏在梳子齿上,室温静置5 min后,用100 ml 1%金胶琼脂糖(Seakem Gold Agarose, SKG)将胶条浸润,室温凝固30 min后电泳。电泳条件为0.5×TBE,电压6.0 V/cm,120 °夹角,脉冲切换时间为2~50 s,时间22 h。电泳结束后,将胶块放入1 μg /ml EB中,染色300 min,然后用纯水脱色60 min,读胶仪中观察拍照。
2 结果 2.1 样品的采集和不同来源MRSA的检出结果分别从安徽省淮北、合肥和马鞍山地区采集人医临床标本、动物源性食品标本、猪鼻腔拭子和养牛场奶牛乳液标本。经分离培养和鉴定,MRSA的检出结果见表 1。
| 样品类别 | 数量 | 耐甲氧西林金黄色 葡萄球菌菌株数 |
耐甲氧西林金黄色 葡萄球菌阳性率(%) |
| 人医临床标本 | 150 | 45 | 30.0 |
| 动物食品标本 | 450 | 14 | 3.1 |
| 动物临床标本 | 90 | 23 | 25.6 |
| 合计 | 690 | 82 | 11.9 |
经头孢西丁纸片扩散法筛选到82株MRSA,对其进行mecA基因检测,凝胶成像系统观察310 bp处出现荧光条带,82株MRSA均携带mecA基因。部分PCR结果扩增电泳见图 1。
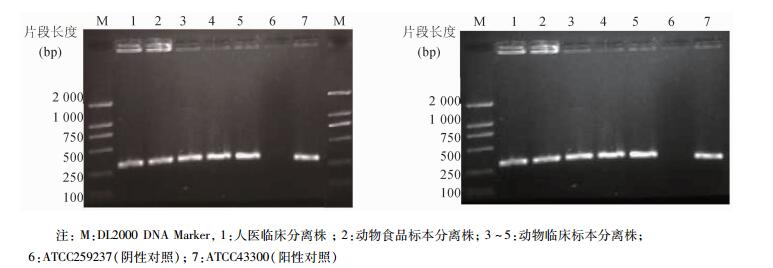
|
| 图 1 部分菌株mecA基因PCR扩增产物电泳结果 Figure 1 Electrophoretogram of mecA PCR products of some MRSA isolates |
| |
所有菌株对青霉素G、氨苄西林100%耐药,对红霉素、苯唑西林、头孢唑啉、克林霉素、庆大霉素及左氧氟沙星的耐药率较高,对甲氧苄啶/磺胺异恶唑、利福平、四环素的耐药率较低,对万古霉素、奎努普丁/达福普丁和利奈唑胺均100%敏感。82株菌株药敏实验结果见表 2。
| 抗生素 | 人源(n=45) | 动物源(n=23) | 动物食品源(n=14) | |||||
| 耐药株数 | 耐药率(%) | 耐药株数 | 耐药率(%) | 耐药株数 | 耐药率(%) | |||
| 青霉素 | 45 | 100 | 23 | 100 | 14 | 100 | ||
| 苯唑西林 | 45 | 100 | 23 | 100 | 14 | 100 | ||
| 氨苄西林 | 45 | 100 | 21 | 92 | 13 | 93 | ||
| 庆大霉素 | 35 | 78 | 18 | 77 | 10 | 75 | ||
| 红霉素 | 35 | 78 | 15 | 67 | 11 | 80 | ||
| 四环素 | 25 | 56 | 12 | 52 | 8 | 55 | ||
| 克林霉素 | 39 | 87 | 20 | 89 | 12 | 81 | ||
| 利福平 | 10 | 23 | 4 | 19 | 3 | 20 | ||
| 左氧沙星 | 40 | 89 | 19 | 83 | 12 | 81 | ||
| 甲氧嘧啶 | 30 | 66 | 14 | 60 | 9 | 67 | ||
| 头孢唑林 | 41 | 92 | 21 | 91 | 12 | 86 | ||
| 达福普丁 | 0 | 0 | 0 | 0 | 0 | 0 | ||
| 利奈唑胺 | 0 | 0 | 0 | 0 | 0 | 0 | ||
| 万古霉素 | 0 | 0 | 0 | 0 | 0 | 0 | ||
82株不同来源的MRSA经Sma Ⅰ酶切,PFGE电泳,所得图像经BioNumerics 5.0软件进行聚类分析,应用非加权平均法(UPGMA),聚类相似性系数采用基于条带比较的Dice。Dice=2×N/(N+M),N表示能匹配的条带个数,M表示所有的条带个数(2株菌带型上的条带数总和减去匹配的条带数)。结果见图 2,不同来源株MASA经PFGE分型可分为49个型别,不同来源MRSA的PFGE型别各不相同,同源性较低。

|
| 图 2 安徽省82株不同来源耐甲氧西林金黄色葡萄球菌PFGE-SmaⅠ酶切结果 Figure 2 PFGE patterns digested by SmaⅠ of 82 MRSA strains with different sources in Anhui |
| |
MRSA自1961年初次发现以来,随着时间的推移,其感染几乎遍及世界各地的各级医院和临床各注:M:DL2000 DNA Marker,1:人医临床分离株;2:动物食品标本分离株;3~5:动物临床标本分离株;6:ATCC259237(阴性对照);7:ATCC43300(阳性对照)科室,在我国也呈逐年增多趋势。由于抗生素的大量使用,MRSA耐药率逐年增高,耐药程度不断增大,多重耐药现象也日趋严重,MRSA感染的流行和暴发时有发生。MRSA与乙型肝炎、艾滋病共同被列为世界范围内最难解决的三大感染性顽疾[12],是临床医学非常关注的严重感染问题。因而加强MRSA的监测、耐药机制研究及分子流行病学研究变得尤为迫切,其结果有助于指导临床制定针对性的预防和控制措施。
MRSA的感染和耐药在人医临床和兽医临床均有报道[13-14],然而将人源、动物源与食源性MRSA综合在一起进行分析和研究,国内尚未见报道。本研究分别从安徽省淮北、合肥和马鞍山3个地区采集标本,3个地区分别处于安徽的皖北、皖中及皖南,地理位置覆盖安徽全境,有一定的区域代表性。本研究结果显示:动物性食品如鸡腿,猪肉等MRSA的携带率相对较低(3.1%),而人医临床(浓汁及伤口分泌物等)和动物标本(猪鼻腔拭子及奶牛场生奶)MRSA携带率较高,分别达到30.0%和25.6%。在我国,医院和社区获得性感染革兰阳性细菌耐药监测研究显示,2001年MRSA的分离率为37.4%[15-16],2002-2003年增加到41.0%[17]。2005年我国5家教学医院革兰阳性球菌耐药监测研究显示,MRSA分离率已达到51.3%,其中上海市的发生率高达78.4%[18]。本研究中安徽地区的MRSA的分离阳性率略低于全国平均水平。
本试验证明MRSA已经在与人类生活密切相关的动物身上出现。其中在奶牛乳房炎感染中,MRSA菌株的出现呈上升趋势,可能与近年来给动物(尤其是奶牛等经济价值较高的动物)滥用抗生素,导致金黄色葡萄球菌产生耐药相关。本研究发现合肥地区奶牛MASA携带率高达30%。MRSA在奶牛和动物身上的检出对食品卫生安全将是一个非常严峻的考验。
本研究显示,不同来源的MRSA菌株对万古霉素、达福普丁及利奈唑胺100%敏感,结果表明糖肽类抗生素如万古霉素仍可有效治疗MRSA感染;而对包括甲氧西林在内的所有β-内酰胺类抗生素都产生了耐药性,如青霉素和苯唑西林100%耐药;不同来源MRSA对头孢唑啉、红霉素、克林霉素、四环素、庆大霉素、左氧氟沙星、利福平、甲氧嘧啶和氨苄西林有不同程度的耐药,但不同来源MRSA间无差异。
PFGE是目前国内外流行病学研究广泛接受的分型方法之一,与其他方法相比,具有重复性好、分辨率高、分辨力强、结果稳定、易于标准化的优点,能在细菌基因组很庞大的情况下,尽可能反映较多的变异信息,被誉为细菌分子生物学分型技术的“金标准”[19]。PFGE方法主要被广泛应用于追踪监测细菌传染性疾病的暴发流行[20],还有助于识别散发病例的传染源。最近的研究证实,PFGE与公认的适合于MRSA的MLST结果相比符合率超过95%。PFGE同样能鉴别MRSA的稳定谱系,同样可以用于追踪这些谱系克隆洲际的长时期传播[21-22]。但是使用PFGE研究金黄色葡萄球菌的长期进化在总体上,特别是MRSA的适用性仍存在争议[23]。本研究将82株MRSA分为49个PFGE型别,不同来源MRSA的PFGE型别各不相同,同源性较低,显示不同来源MRSA的多克隆性。PFGE是一种较为有效的分型及同源性分析的科学方法,能够从基因水平上阐释菌株之间的同源性关系,将在食源性疾病的防控及食品污染控制等方面有良好的应用前景。
作者贡献:
赵红庆 ORCID:0000-0002-4423-0612
徐萍 ORCID:0000-0002-6788-7289
赵红庆:文章撰写,审阅、定稿
徐萍:数据收集,结果分析
周声安:实验研究
胡守奎:实验设计,文章修改
| [1] |
Pada SK, Ding Y, Ling ML, et al. Economic and clinical impact of nosocomial meticillin-resistant Staphylococcus aureus infections in Singapore: a matched case–control study[J]. J Hosp Infect, 2011, 78(1): 36-40. DOI:10.1016/j.jhin.2010.10.016 |
| [2] |
Dantes R, Mu Y, Belflower R, et al. National burden of invasive methicillin-resistant Staphylococcus aureus infections, United States, 2011[J]. JAMA Intern Med, 2013, 173(21): 1970-1978. |
| [3] |
Jean SS, Hsueh PR. High burden of antimicrobial resistance in Asia[J]. Int J Antimicrob Agents, 2011, 37(4): 291-295. DOI:10.1016/j.ijantimicag.2011.01.009 |
| [4] |
Iyer A, Kumosani T, Azhar E, et al. High incidence rate of methicillin-resistant Staphylococcus aureus (MRSA) among healthcare workers in Saudi Arabia[J]. J Infect Dev Ctries, 2014, 8(3): 372-378. |
| [5] |
McCarthy H, Rudkin JK, Black NS, et al. Methicillin resistance and the biofilm phenotype in Staphylococcus aureus[J]. Front Cell Infect Microbiol, 2015, 5: 1. |
| [6] |
Prabhu K, Rao SL, Rao V. Inducible clindamycin resistance in Staphylococcus aureus isolated from clinical samples[J]. J Lab Physicians, 2011, 3(1): 25-27. DOI:10.4103/0974-2727.78558 |
| [7] |
Devriese LA, van Damme LR, Fameree L, et al. Methicillin (cloxacillin)-resistant Staphylococcus aureus strains isolated from bovine mastitis cases[J]. Zentralbl Veterinarmed B, 1972, 19(7): 598-605. |
| [8] |
Osadebe LU, Hanson B, Smith TC, et al. Prevalence and characteristics of Staphylococcus aureus in Connecticut swine and swine farmers[J]. Zoonoses Public Health, 2013, 60(3): 234-243. DOI:10.1111/j.1863-2378.2012.01527.x |
| [9] |
Geenen PL, Graat EAM, Haenen A, et al. Prevalence of livestock-associated MRSA on Dutch broiler farms and in people living and/or working on these farms[J]. Epidemiol Infect, 2013, 141(5): 1099-1108. DOI:10.1017/S0950268812001616 |
| [10] |
Ziebuhr W, Krimmer V, Rachid S, et al. A novel mechanism of phase variation of virulence in Staphylococcus epidermidis: evidence for control of the polysaccharide intercellular adhesin synthesis by alternating insertion and excision of the insertion sequence element IS256[J]. Mol Microbiol, 1999, 32(2): 345-356. DOI:10.1046/j.1365-2958.1999.01353.x |
| [11] |
Tenover FC, Arbeit RD, Goering RV, et al. Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis: criteria for bacterial strain typing[J]. J Clin Microbiol, 1995, 33(9): 2233-2239. |
| [12] |
Xia PY. Research progress in mechanism and therapeutic drug of methicillin-resistant Staphylococcus aureus[J]. World Notes on Antibiotics, 1999, 20(4): 178-180, 188. (in Chinese) 夏培元. 耐甲氧西林金黄色葡萄球菌的耐药机制及其治疗药物的研究进展[J]. 国外医药抗生素分册, 1999, 20(4): 178-180, 188. |
| [13] |
Jang SJ, Han HL, Lee SH, et al. PFGE-based epidemiological study of an outbreak of candida tropicalis candiduria: The importance of medical waste as a reservoir of nosocomial infection[J]. Jpn J Infect Dis, 2005, 58(5): 263-267. |
| [14] |
Naas T, Fortineau N, Snanoudj R, et al. First nosocomial outbreak of vancomycin-resistant Enterococcus faecium expressing a VanD-like phenotype associated with a vanA genotype[J]. J Clin Microbiol, 2005, 43(8): 3642-3649. DOI:10.1128/JCM.43.8.3642-3649.2005 |
| [15] |
Ma Y, Chen HB, Li JY, et al. Study on Antimicrobial Resistance of Staphylococcus aureus Between Beijing and Hubei Regions During a Period of 1999-2000[J]. Chinese Journal of Clinical Pharmacology, 2002, 18(3): 185-187, 210. (in Chinese) 马越, 陈鸿波, 李景云, 等. 1999-2000年北京和湖北地区金黄色葡萄球菌耐药性分析[J]. 中国临床药理学杂志, 2002, 18(3): 185-187, 210. |
| [16] |
Li JT, Li Y, Wang J. Surveillance on gram-positive bacteria isolated from patients with hospital acquired infections or community acquired infections[J]. National Medical Journal of China, 2003, 83(5): 365-374. (in Chinese) 李家泰, 李耘, 王进. 中国医院和社区获得性感染革兰阳性球菌耐药性监测研究[J]. 中华医学杂志, 2003, 83(5): 365-374. |
| [17] |
Li JT, Qi HM, Li Y, et al. 2002-2003 Bacterial resistance surveillance on Gram-positive cocci isolated from hospital acquired infections and community acquired infections in China[J]. Chinese Journal of Laboratory Medicine, 2005, 28(3): 254-265. (in Chinese) 李家泰, 齐慧敏, 李耘, 等. 2002-2003年中国医院和社区获得性感染革兰阳性细菌耐药监测研究[J]. 中华检验医学杂志, 2005, 28(3): 254-265. |
| [18] |
Wang H, Sun HL, Chen MJ, et al. Antimicrobial resistance surveillance of gram-positive cocci isolated from 5 teaching hospitals in China in 2005[J]. Chinese Journal of Laboratory Medicine, 2006, 29(10): 873-877. (in Chinese) 王辉, 孙宏莉, 陈民钧, 等. 2005年我国五家教学医院革兰阳性球菌耐药监测研究[J]. 中华检验医学杂志, 2006, 29(10): 873-877. DOI:10.3760/j:issn:1009-9158.2006.10.005 |
| [19] |
Hunter SB, Vauterin P, Lambert-Fair MA, et al. Establishment of a universal size standard strain for use with the pulsenet standardized pulsed-field gel electrophoresis protocols: converting the national databases to the new size standard[J]. J Clin Microbiol, 2005, 43(3): 1045-1050. DOI:10.1128/JCM.43.3.1045-1050.2005 |
| [20] |
Hallin M, Deplano A, Denis O, et al. Validation of Pulsed-Field gel electrophoresis and spa typing for long-term, nationwide epidemiological surveillance studies of Staphylococcus aureus infections[J]. J Clin Microbiol, 2007, 45(1): 127-133. DOI:10.1128/JCM.01866-06 |
| [21] |
Fica A, Fernández J, Ebensperger DG, et al. Molecular epidemiology of a streptococcus pyogenes related nosocomial outbreak in a burn unit[J]. Rev Méd Chil, 2003, 131(2): 145-154. |
| [22] |
Faria NA, Carrico JA, Oliveira DC, et al. Analysis of typing methods for epidemiological surveillance of both methicillin-resistant and methicillin-susceptible Staphylococcus aureus strains[J]. J Clin Microbiol, 2008, 46(1): 136-144. DOI:10.1128/JCM.01684-07 |
| [23] |
Harmsen D, Claus H, Witte W, et al. Typing of methicillin-resistant Staphylococcus aureus in a university hospital setting by using novel software for spa repeat determination and database management[J]. J Clin Microbiol, 2003, 41(12): 5442-5448. DOI:10.1128/JCM.41.12.5442-5448.2003 |
 2017, Vol. 32
2017, Vol. 32


