扩展功能
文章信息
- 徐秋琼, 李柏生, 余泳红, 单桂花
- XU Qiu-qiong, LI Bai-sheng, YU Yong-hong, SHAN Gui-hua
- 广州市一起非O1/O139群霍乱弧菌食物中毒分离株的病原特征分析
- Etiological characteristics of Vibrio cholerae non-O1/O139 strains isolated from a food poisoning in Guangdong
- 疾病监测, 2017, 32(2): 149-152
- Disease Surveillance, 2017, 32(2): 149-152
- 10.3784/j.issn.1003-9961.2017.02.016
-
文章历史
- 收稿日期:2016-08-08
2. 广东省疾病预防控制中心, 广东 广州 511430
2. Guangdong Provincial Center for Disease Control and Prevention, Guangzhou 511430, Guangdong, China
根据菌体O抗原的不同,霍乱弧菌可分为206个血清群。其中,O1群和O139群可引起霍乱的暴发和流行,而非O1/O139血清群霍乱弧菌不致病或偶然引起轻度腹泻,也偶致肠道外感染,主要表现为散发。近年来,国内外也有非O1/O139群霍乱弧菌导致聚集性病例的相关报道。2014年12月,广州市某电池厂发生一起食物中毒事件,患者主要症状为腹泻、腹痛和呕吐等,根据流行病学调查、临床表现和实验室检测结果,参照《食物中毒诊断标准及技术处理原则》[1],证实为一起非O1/O139群霍乱弧菌食物中毒。中毒患者经过及时对症治疗后症状消失,均痊愈出院。为进一步了解该部分菌株的耐药表型和分子特征,本研究对5株病例分离株和1株环境分离株进行了相关毒力基因检测、药敏试验及脉冲场凝胶电泳 (pulsed field gel electrophoresis,PFGE) 分析同源性。
1 材料与方法 1.1 材料 1.1.1 菌株从10份患者粪便样本、5份环境涂抹样、3份熟食中检测出6株非O1/O139群霍乱弧菌 (5株分离自患者粪便样本,1株分离自环境涂抹样本),保存菌株并进一步做相关病原学分析。
1.1.2 实验试剂碱性蛋白胨水、TCBS培养基、四号培养基、盐胨水、血平板等试剂均购自广东环凯微生物有限公司;O1/O139群霍乱弧菌血清购自宁波天润生物药业有限公司;生物梅里埃革兰阴性菌GN生化鉴定卡、Oxoid药敏纸片购自广州市千江企业有限公司;核酸磁珠提取试剂、毒力基因引物和探针购自中山大学达安基因股份有限公司,NotⅠ酶 (美国Promega公司)、Seakem Gold琼脂糖 (美国Cambrex公司)、蛋白酶K (Merck公司) 由广东省疾病预防控制中心 (CDC) 提供,所有试剂均在有效期内使用。
1.1.3 实验仪器梅里埃VITEK 2 Compact全自动细菌鉴定仪;ABI7500荧光定量PCR仪;Smart32核酸提取仪;CHEF Mapper脉冲场凝胶电泳仪和Gel Doc EQ凝胶成像系统 (美国Bio-Rad公司);比浊仪 (美国Bio-Rad公司)。
1.2 方法 1.2.1 细菌分离鉴定参照GB 4789-2013相关标准[2]和《霍乱防治手册》第6版[3]对食物中毒中采集的样品进行致病菌检测,利用梅里埃VITEK 2 Compact全自动细菌鉴定仪对分离菌株做生化鉴定并进一步做血清凝集实验。由于供餐单位没有对48 h内食物留样,3份熟食为当天出炉加工食品,导致对致病菌活菌的检出有一定的影响,因此对现场采集的粪便样本、环境涂抹样、熟食样进行增菌培养后利用荧光定量聚合酶链反应 (PCR) 方法进行致病菌核酸检测,分别检测了沙门菌、志贺菌、副溶血性弧菌、霍乱弧菌和金黄色葡萄球菌。
1.2.2 药敏实验参照世界卫生组织 (WHO) 推荐的K-B纸片法进行,选用Oxoid公司药敏纸片,试验所选抗生素包括氨苄西林 (10 μg/片)、头孢克肟 (5 μg/片)、头孢拉定 (30 μg/片)、阿米卡星 (30 μg/片)、妥布霉素 (10 μg/片)、庆大霉素 (10 μg/片)、多粘菌素B (300 IU/片)、诺氟沙星 (10 μg/片)、环丙沙星 (5 μg/片)、复方新诺明 (23.75 μg/1.25 μg)、呋喃唑酮 (100 μg/片)、四环素 (30 μg/片)、吡哌酸 (30 μg/片)、红霉素 (15 μg/片)、氯霉素 (30 μg/片)。标准参考菌株为大肠埃希菌 (ATCC25922)。结果判定参照美国临床和实验室标准协会CLSI出版的《抗菌药物敏感性试验标准 (2014版M 100-S24)》[4]。
1.2.3 毒力基因检测利用磁珠提取法对菌株进行DNA提取后进一步检测霍乱肠毒素基因 (ctxA)、毒力协同调节菌毛基因 (tcpA)、毒力表达调控基因 (toxR)、溶血素基因 (hlyA) 和肠毒素基因 (ST)。引物和探针由中山大学达安基因股份有限公司合成,其序列及产物大小参照表 1。根据荧光定量PCR-Taman探针法试剂盒说明要求,配置总体积为20 μl的反应体系 (反应液Ⅰ 16.5 μl、反应液Ⅱ 1.5 μl、样品模板2 μl),检测反应条件:94 ℃,3 min,1个循环;93 ℃,15 s;55 ℃,25 s (收集荧光信号);72 ℃,30 s,40个循环。
| 目的基因 (bp) | 引物序列 (5′~3′) | 探针序列 (5′~3′) |
| ctxA(106) | F:TCG ATG ATC TTG GAG CAT TCC R:GAT GGT TAT GGA TTG GCA GGT T |
P:FAM-CGG TGC ATG ATG AAT CCA CGG-TAMRA |
| tcpA(92) | F:GCG CAG TAG CAC TTG CAG ATC R:AGC GGG AGC GAT AGA TTT GA |
P:FAM-AGC AGC GGC TGA GAC AGG CG-TAMRA |
| toxR(92) | F:TCG GGC GAT CAA TTG GTA AC R:TTT CGA CTC TGC GCA AAA TG |
P:FAM-CTT CGG AAC CGT TTT GAC GTA TT-TAMRA |
| hlyA(105) | F:TGG TGA AGC GGC GGA TAT R:GCT AAG CTC GGT AAT GCG TTG T |
P:FAM-TGC TGC TGA TTG GCA AGC CGA A-TAMRA |
| ST(109) | F:AAT CGC ATT TAG CCA AAC AGT AGA R:TGG GCA TTC TTC ATT TTC ACT TAG |
P:FAM-TGC AGC AAC CAC AAC AAA TTG AAA GCA-TAMRA |
参照美国CDC PulseNet霍乱弧菌的PFGE标准操作程序,采用NotⅠ内切酶对菌株进行酶切后利用CHEF Mapper脉冲场凝胶电泳仪进行电泳。电泳结束后采用Gel Doc EQ凝胶成像系统读取图像,获得图像最后通过BioNumerics 6.6软件进行同源性分析。
2 结果 2.1 细菌分离及鉴定从TCBS平板和四号平板挑选可疑菌落,接种于营养琼脂斜面进行生化试验及血清凝集试验,结果显示6株菌株经梅里埃VITEK 2 Compact全自动细菌鉴仪进行生化鉴定结果显示为霍乱弧菌。菌株氧化酶和动力均为阳性,O129(10 μg/片、150 μg/片) 敏感实验均为敏感。用霍乱弧菌O1/O139血清做血清凝集试验,6株菌株均不凝集,生理盐水对照均未发生自凝。将分纯菌株接种到5%绵羊血平板中进行溶血试验[5],37 ℃培养24 h后观察结果显示6株菌株均出现β溶血现象。利用荧光定量PCR方法对沙门菌、志贺菌、副溶血性弧菌、霍乱弧菌和金黄色葡萄球菌核酸筛查,结果显示18份样品中8份患者粪便样本、2份环境涂抹样、1份熟食均为霍乱弧菌核酸阳性,阳性率高达61.1%,6株菌株均来自11株霍乱弧菌核酸阳性样本。
2.2 耐药试验耐药谱分析显示6株菌株均对氨苄西林、头孢克肟、头孢拉定、阿米卡星、妥布霉素、多粘菌素B和庆大霉素7种抗生素耐药,对诺氟沙星、环丙沙星、复方新诺明、呋喃唑酮、四环素、吡哌酸、红霉素、氯霉素敏感。
2.3 毒力基因检测利用荧光定量PCR-Taman探针方法对6株菌株进行ctxA、tcpA、toxR、hlyA和ST检测,结果见表 2。
| 菌株编号 | 来源 | ctxA | tcpA | toxR | hlyA | ST |
| HL001 | 病例 | - | - | + | + | - |
| HL002 | 病例 | - | - | + | + | - |
| HL003 | 病例 | - | - | + | + | - |
| HL004 | 病例 | - | - | + | + | - |
| HL005 | 病例 | - | - | + | + | - |
| HL006 | 环境 | - | - | + | + | - |
对6株菌株经NotⅠ内切酶消化后,进行PFGE分离酶切片段,Gel Doc EQ凝胶成像系统读取图像,获得图像最后通过BioNumerics 6.6软件进行同源性分析,结果见图 1。6株菌株电泳条带比对后相似度100%同源。
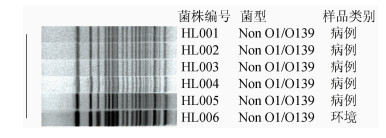
|
| 图 1 菌株PFGE图谱分析 Figure 1 PFGE analysis of strains |
| |
非O1/O139群霍乱弧菌是指除O1和O139群霍乱弧菌以外其他血清群的霍乱弧菌[6],广泛存在于环境中,尤其是水体和海产品中,是引起急性腹泻的主要病原菌之一,临床表现为轻症胃肠炎或严重腹泻[7]。有关报道提示,非O1/O139群霍乱弧菌的主要致病因子有外膜蛋白、肠毒素、蛋白酶、溶血素和转录调节因子等[8-9],由hly A基因编码的溶血素可以在细胞膜上形成孔隙而破坏靶细胞,在兔结肠结扎试验中,可引起血液和黏液的产物积聚[10]。toxR基因的活性主要影响霍乱CT毒素的表达,它的存在可以激活霍乱毒素的转录[11]。2014年12月广州地区某单位陆续有员工出现腹泻、腹痛、呕吐急性肠胃炎症状,经流行病现场个案调查和采样后,利用荧光定量PCR法和传统分离培养法进行致病菌筛查及分离,荧光定量PCR检测结果显示18份样品中8份患者粪便样本、2份环境涂抹样、1份熟食均为霍乱弧菌核酸阳性,阳性率高达61.1%。分离培养出6株非O1/O139群霍乱弧菌,其中5株来源于患者,1株来源于环境涂抹冷柜内壁,菌株接种于5%绵羊血平板中进行溶血试验出现β溶血环,提示菌株产生溶血素。对6株非O1/O139霍乱弧菌进行毒力基因检测,结果显示6株菌株均检出toxR和hly A基因,携带率为100.0%。未检出ctxA、tcpA和ST基因。6株菌株的PFGE结果显示电泳条带基本相同,提示病例株与环境株高度同源。菌株药敏试验结果显示对诺氟沙星、环丙沙星、复方新诺明、呋喃唑酮、四环素、吡哌酸、红霉素和氯霉素敏感。对氨苄西林、头孢克肟、头孢拉定、阿米卡星、妥布霉素、多粘菌素B和庆大霉素7种抗生素耐药,菌株出现多重耐药特性,因此临床上进行抗生素治疗时,应根据菌株抗生素敏感模式对患者进行用药,防止滥用抗生素而引起耐多药细菌的产生。
实验室检测结果提示,本次食物中毒是由产溶血素的非O1/O139霍乱弧菌引起的,根据菌株的药敏实验结果,患者治疗用药可首选呋喃唑酮、诺氟沙星和环丙沙星等敏感抗生素。由于患者粪便样和供餐制作场所均检出相同致病菌,提示供餐单位应加强对食品加工场所、制作工具及食品保鲜冷柜的彻底消毒和清洗,并做好48 h食物留样,防止类似事故发生。
作者贡献:
徐秋琼 ORCID:0000-0001-5132-6287
徐秋琼:主要负责细菌鉴定、毒力基因检测,实验结果分析及文章撰写
李柏生:主要负责指导实验开展及菌株脉冲场电泳同源性分析
余泳红、单桂花:主要负责细菌分离接种及相关生化试验
| [1] | National Technical Supervision Bureau. GB 14938-1994 General principles of diagnostic criteria and technical management of food poisoning[S]. Beijing:China Standard Press, 1994. (in Chinese) 国家技术监督局.GB 14938-1994食物中毒诊断标准及技术处理总则[S].北京:中国标准出版社, 1994. |
| [2] | National Food Safety Standards. GB 4789-2013 Food microbiology detection[S]. Beijing: China Standard Press, 2013. (in Chinese) 食品安全国家标准.GB 4789-2013食品微生物学检验[S].北京:中国标准出版社, 2013. |
| [3] | Xiao DL. Cholera prevention manual[M].6th ed. Beijing: People's Medical Publishing House, 2013 . (in Chinese) 肖东楼. 霍乱防治手册[M].6版. 北京: 人民卫生出版社, 2013 . |
| [4] | CLSI. M100-S24 Performance standards for antimicrobial susceptibility testing; twenty-fourth informational supplement[S]. Wayne, PA: CLSI, 2014. |
| [5] | Xu JY, Wang RY, Shi YZ, et al. Analysis of pathogenic factors about Vibriocholerae non-O1[J]. Chinese Journal of Health Laboratory Technology , 2004, 14 (4) : 452–453. (in Chinese) 徐景野, 王仁元, 石优章, 等. 非O1群霍乱弧菌致病因子检测与分析[J]. 中国卫生检验杂志 , 2004, 14 (4) : 452–453. |
| [6] | Shimada T, Arakawa E, Itoh K, et al. Extended serotyping scheme for Vibriocholerae[J]. Curr Microbiol , 1994, 28 (3) : 175–178. DOI:10.1007/BF01571061 |
| [7] | He XQ, Wang GL. Investigation of Vibriocholera infection in non O1group[J]. Shanghai Journal of Medical Laboratory Sciences , 1999, 14 (5) : 274. (in Chinese) 何小芹, 王国礼. 非O1群霍乱弧菌感染调查[J]. 上海医学检验杂志 , 1999, 14 (5) : 274. |
| [8] | Singh DV, Matte MH, Matte GR, et al. Molecular analysis of Vibriocholerae O1, O139, non-O1, and non-O139 strains: clonal relationships between clinical and environmental isolates[J]. Appl Environ Microbiol , 2001, 67 (2) : 910–921. DOI:10.1128/AEM.67.2.910-921.2001 |
| [9] | Iyer L, Vadivelu J, Puthucheary SD. Detection of virulence associated genes, haemolysin and protease amongst Vibriocholerae isolated in Malaysia[J]. Epidemiol Infect , 2000, 125 (1) : 27–34. DOI:10.1017/S0950268899004082 |
| [10] | Ichinose Y, Yamamoto K, Nakasone N, et al. Enterotoxicity of El Tor-like hemolysin of non-O1 Vibriocholerae[J]. Infect Immun , 1987, 55 (5) : 1090–1093. |
| [11] | Cariri FAMO, Costa APR, Melo CC, et al. Characterization of potentially virulent non-O1/non-O139 Vibriocholerae strains isolated from human patients[J]. Clin Microbiol Infect , 2010, 16 (1) : 62–67. DOI:10.1111/j.1469-0691.2009.02763.x |
 2017, Vol. 32
2017, Vol. 32


