扩展功能
文章信息
- 金轶, 焦劲松, 刘尊敬, 彭丹涛, 金超岭, 贾树红
- JIN Yi, JIAO Jin-Song, LIU Zun-Jing, PENG Dan-Tao, JIN Chao-Ling, JIA Shu-Hong
- 小脑共济失调为主要症状的多系统萎缩患者脑99mTc-SPECT影像学特征分析
- An analysis of brain 99mTc-SPECT features in patients with multiple system atrophy with predominant cerebellar ataxia
- 国际神经病学神经外科学杂志, 2020, 47(2): 162-166
- Journal of International Neurology and Neurosurgery, 2020, 47(2): 162-166
-
文章历史
收稿日期: 2020-01-16
修回日期: 2020-04-07
2. 中日友好医院核医学科, 北京 100029
多系统萎缩(multiple system atrophy, MSA)是一种病因尚不完全明确的神经系统变性病,目前一般将其分为以帕金森样症状为主的MSA-P型(MSA with predominant parkinsonism)及以小脑共济失调症状为主的MSA-C型(MSA with predominant cerebellar ataxia)。在临床工作中,MSA-C是小脑共济失调患者的主要病因之一,但该病无特殊诊断手段,其诊断主要依靠病史、临床症状及影像学检查等进行综合判断,因此有必要尽可能总结该疾病的特异性生理病理改变,提高诊断率。该病除众所周知的结构改变外,还能出现脑组织的代谢改变[1],对该病脑组织代谢水平变化规律的深入研究可为临床决策提供更多支持。
脑血流对脑组织的能量供应和代谢具有重要作用,局部脑血流量(regional cerebral blood flow, rCBF)测定可反映脑组织的代谢水平,单光子发射计算机断层成像(single photo emission computerized tomography, SPECT)可准确反映rCBF[2]。与正电子发射计算机断层显像(positron emission computed tomography, PET)相比,SPECT的实施难度小,费用低,在临床中应用简便。而基于体素的形态学分析技术(voxel-based morphometry, VBM)通过对影像数据在空间等方面进行标准化处理,可对各种影像学资料进行定量分析,大大提高了影像学分析的精确性。本研究以临床诊断的MSA-C患者的99mTc-SPECT图像进行VBM分析,总结其rCBF的改变特征,以提高对该病病理生理改变的认识,指导临床工作。
1 对象和方法 1.1 纳入及排除标准患者诊断符合2008年Gilman等[1]MSA诊断标准及2017年《多系统萎缩诊断标准中国专家共识》[3],可临床诊断为“很可能的MSA-C”。
纳入及排除标准:①30岁以上,散发起病,症状进行性加重,主要临床表现为小脑功能障碍(步态共济失调,伴小脑性构音障碍、肢体共济失调或小脑性眼动障碍);②至少有一种自主神经功能障碍的表现(尿失禁或体位性低血压);③患者无下列提示其他神经系统疾病的表现:静止性震颤、明显的周围神经病改变、痴呆、发病年龄大于75岁、共济失调或帕金森综合征家族史、符合多发性硬化的白质损害、非药源性的幻觉;④患者无明确脑血管病、颅内占位、硬膜下积液、颅脑手术史、颅脑外伤史等其他可能影响SPECT成像的情况;⑤无严重躯体疾病史或严重焦虑、抑郁等精神疾病史。
正常对照为在我科因“头晕”或“头昏”就诊的患者,其年龄和性别与MSA-C患者相匹配,并满足下列条件:①查体无明确神经系统阳性体征;②无明确脑血管病、颅内占位、硬膜下积液、颅脑手术史、颅脑外伤史等;③其颅脑MR检查脑白质病Fazekas评分小于等于1分,MRA及颈动脉超声无明显颅内外动脉狭窄(< 50%);④无提示痴呆、帕金森综合征等常见中枢神经系统退行性疾病的表现;⑤无严重躯体疾病史或严重焦虑、抑郁等精神疾病史。
1.2 一般资料纳入MSA-C患者12人,其中男性8人,女性4人,病程均小于5年。相匹配的对照组25人,其中男性14人,女性11人。所有参与者均签署知情同意书,本研究经过中日友好医院伦理委员会批准。
1.3 影像学检查所有对象均行99mTc-SPECT脑血流灌注显像检查,检查前受检者口服高氯酸钾,静息状态下封闭视听30 min,静脉注射显像剂锝[99mTc]双半胱乙酯(99mTc-ECD)30 mCi,20 min后进行图像采集,所用仪器型号为SIEMENS Symbia T2型双探头SPECT,每个探头每6度采集一桢,每桢采集时间25 s。采集矩阵128×128(每像素大小3.90 mm×3.90 mm,层厚3.9 mm)。SPECT数据采用有序子集最大拟然法(Ordered Subset Expectation Maximization, OSEM)方式重建及校正,获得脑部轴位,冠状位及矢状位图像。
1.4 SPECT影像处理及分析所获得的SPECT图像在SPM8(http://www.fil.ion.ucl.ac.uk/spm/)软件包中进行预处理,主要步骤:①前联合-后联合(anterior commissure-posterior commissure, AC-PC)手动校正;②空间标准化,所有图像进行头动校正,标准化投射至MNI(Montreal Neurological Institute)标准SPECT脑模板上;③强度标准化,总脑血流量以50 mL/(100 mL·min)进行标定;④平滑:为提高信噪比,标准化的图像经过6 mm的半高宽高斯核函数(FWHM Gaussian kernel)平滑处理。
处理完成后的图像在SPM8中应用双样本t检验来比较体素间的差异,所得结果以P < 0.01FDR校正,簇(cluster)水平为差异有显著性。应用xjView9(http://www.alivelearn.net/xjview/)软件包将前步骤中的统计结果进行可视化操作及将其位置在标准脑模版中标定,将其有差异脑区团块大小、峰值位置、峰值t值、峰值Z值、MNI相对位置、AAL分区[4]列表,并将其图像投射到标准脑模版上。
1.5 统计学处理统计学分析采用SPSS 19.0软件包。分类变量(性别)组间比较应用χ2检验;连续变量(年龄)以均数±标准差(x±s)表示,应用独立样本t检验进行两组间比较。P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料分析一般资料分析结果如表 1,见两组间年龄、性别均无有统计学意义的差异。
| 组别 | 例数(n) | 年龄(岁) | 性别(男/女) |
| MSA-C组 | 12 | 60.1±5.9 | 8/4 |
| 正常对照组 | 25 | 62.9±4.9 | 14/11 |
| t/χ2 | 1.532 | 0.383 | |
| P值 | 0.134 | 0.536 |
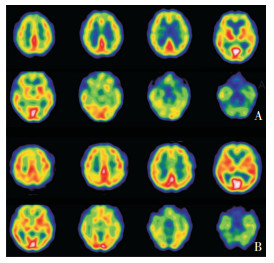
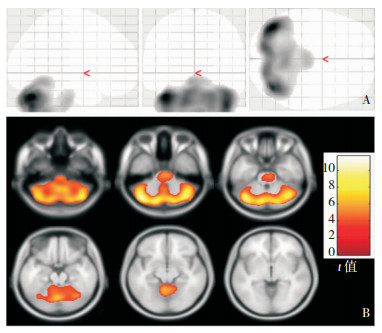
典型的MSA-C患者的脑SPECT图像如图 1所示,可见MSA-C患者有较明显的小脑rCBF下降,并可见大脑皮质的多发rCBF下降。MSA-C患者及正常对照的SPECT结果经上述分析处理,见rCBF明显下降(P < 0.01FDR校正,簇水平)的脑区主要为双侧小脑后叶、小脑蚓部及脑桥。在整个rCBF有差异脑区中,其3个rCBF最大差异位置(峰值位置)均在小脑后叶,AAL分区分别为91(左侧小脑后叶)、94(右侧小脑后叶)、93(左侧小脑后叶)区(图 2、表 2)。
|
| 图 1 两例典型的MSA-C患者脑SPECT图像 |
|
| 注:A:局部脑血流灌注差异有意义区域在透明脑模版上投影;B:该有意义区域在轴位脑模版上投影,可见局部脑血管灌注差异主要有意义区域为双侧小脑半球及脑桥 图 2 MSA-C与对照组脑SPECT图像分析在标准脑模版上的投影 |
| 脑区 | 团块体素数量 | PFDR校正簇 水平 |
峰值MNI坐标(mm/mm/mm) | 峰值位置 (t值) |
峰值位置 (Z值) |
峰值脑区 | AAL分区 | ||
| x | y | z | |||||||
| 双侧小脑后叶、 小脑蚓部、脑桥 |
15 890 | < 0.01 | -40 | -70 | -32 | 11.59 | 7.21 | 左侧小脑 | 91 |
| 40 | -70 | -42 | 10.19 | 6.76 | 右侧小脑 | 94 | |||
| -14 | -80 | -38 | 8.69 | 6.18 | 右侧小脑 | 93 | |||
MSA的病理特征为神经元丢失以及少突胶质细胞胞质内包涵体的形成,主要累及小脑、脑桥、下橄榄核、纹状体、黑质、交感和副交感神经核[5]。而MSA-C与MSA-P相比,其脑桥核团、下橄榄核及小脑Purkinje细胞(即小脑皮质)的受累较为明显,而小脑齿状核受累很少[6]。由此我们可以预想,在MSA患者的SPECT影像上,可发现上述有明确病理改变位置的rCBF降低。由上所述,我们的检查结果与基于病理结论的推测相符,有明显的小脑、脑桥位置的rCBF降低,且降低的区域主要为小脑皮质,避开了齿状核等小脑深部核团。既往有利用SPECT的研究与本研究结论大致相符,但其没有详细区分MSA-C及MSA-P两种不同的类型[7],故本研究更能说明MSA-C这一亚型的病理生理特征。本研究的此结论也与基于18F-FDG-PET[8-10]或其他VBM分析统计方式[11]所得出的结论相符合,均符合MSA-C的病理生理改变特征。曾有报道称MSA-C患者可能出现双侧小脑rCBF的差异[12],但本研究未做基于VBM或其他方式的统计学图像分析,后续可对该方面进行更深的研究。
单个患者的99mTc-SPECT图像上显示出有皮质rCBF的降低,但VBM分析未见在皮质区域有统计学意义上的rCBF改变。就对MSA的病理认识来说,MSA-C及MSA-P均可出现大脑皮质的受累[5-6],但并不是其主要特征。既往已有研究证实,MSA-P及MSA-C患者中均可能出现广泛的皮质萎缩[13-14]。而在功能影像方面,18F-FDG-PET显示在MSA上可出现大脑皮质的代谢降低[8, 15]。临床中也能观察到MSA患者出现不同程度的认知功能损害[16-17],以上均提示MSA-C可能出现不同程度的大脑皮质损害。对MSA-C患者为何出现皮质,尤其是额叶的结构及代谢受累这一点尚不完全明确。早期研究对此现象有两种解释,一是MSA的原发病理改变逐渐加重,累及到皮质。二是由于皮质与小脑、基底节的神经元存在广泛的联系,皮质神经元受到失传入的影响,出现代谢水平的降低[18]。进一步的研究表明,病程早期的MSA并不出现大脑皮质的受累[19],而MSA-C患者的18F-FDG-PET上出现的额叶代谢水平降低随着疾病的加重而加重,小脑的代谢水平降低无类似的表现。另外,相关性分析也表明,额叶代谢水平的降低与疾病的严重程度更为相关[9],这都说明在MSA-C患者中,皮质的受累更可能是由于疾病的原发进展所致[20]。
我们的研究并未发现MSA-C患者在基底节,尤其是壳核位置有明显rCBF下降,这一点在既往的基于18F-FDG-PET的研究也有不同的报道[8-9, 18]。就既往研究来看,壳核是否在MSA-C中有明显结构或功能受累这一点尚无定论[13-14, 18-19, 21]。但总的来说,壳核在MSA-C中的受累较MSA-P不明显,故MSA-C的患者本身即可能在壳核的代谢水平受到的影响较小,以致不能出现有统计学意义的差异。当然,受到本研究所应用的检查及分析技术的局限,即影像分辨率较低和对较微小结构的分析效力的影响,对壳核或较局限的皮质rCBF受损判断可能出现误差,这一点难以避免。
本研究基于99mTc-SPECT影像学检查,应用VBM分析手段对MSA-C患者的rCBF进行统计分析,得出的结论与目前我们根据病理、磁共振、18F-FDG-PET等其他手段所知的MSA-C特征基本相符,其结论有利于我们增加对该疾病的理解及提高该疾病的正确诊断率。本研究的不足之处在于,第一,本研究纳入的病例数相对较少,且缺乏随访资料,若能收集其随病情进展的其他资料,包括临床特征,共济失调评分,认知评估评价等,可进一步进行相关性分析,验证上述MSA的病理改变特征,有助于我们对此疾病的进一步理解。第二,本研究仅对MSA-C这一MSA的亚型进行了分析研究,若能纳入足够的MSA-P患者,预期可能得到更多有意义的结果。第三,本研究所应用的SPECT检查由于技术条件限制,分辨率较低,对精细结构,如壳核、橄榄核等较细微结构的显示程度有限,可能不能正确显示出其位置的血流灌注水平变化。
| [1] |
Gilman S, Wenning GK, Low P A, et al. Second consensus statement on the diagnosis of multiple system atrophy[J]. Neurology, 2008, 71(9): 670-676. DOI:10.1212/01.wnl.0000324625.00404.15 |
| [2] |
Hutton BF. The origins of SPECT and SPECT/CT[J]. Eur J Nucl Med Mol Imaging, 2014, 41(Suppl 1): S3-S16. |
| [3] |
唐北沙, 陈生弟, 中华医学会神经病学分会帕金森病及运动障碍学组, 等. 多系统萎缩诊断标准中国专家共识[J]. 中华老年医学杂志, 2017, 36(10): 1055-1060. DOI:10.3760/cma.j.issn.0254-9026.2017.10.001 |
| [4] |
Tzourio-Mazoyer N, Landeau B, Papathanassiou D, et al. Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI single-subject brain[J]. Neuroimage, 2002, 15(1): 273-289. DOI:10.1006/nimg.2001.0978 |
| [5] |
Wenning GK, Tison F, Ben Shlomo Y, et al. Multiple system atrophy:a review of 203 pathologically proven cases[J]. Mov Disord, 1997, 12(2): 133-147. |
| [6] |
Ozawa T, Paviour D, Quinn NP, et al. The spectrum of pathological involvement of the striatonigral and olivopontocerebellar systems in multiple system atrophy:clinicopathological correlations[J]. Brain, 2004, 127(Pt 12): 2657-2671. |
| [7] |
Cilia R, Marotta G, Benti R, et al. Brain SPECT imaging in multiple system atrophy[J]. J Neural Transm (Vienna), 2005, 112(12): 1635-1645. DOI:10.1007/s00702-005-0382-5 |
| [8] |
Gilman S. Functional imaging with positron emission tomography in multiple system atrophy[J]. J Neural Transm (Vienna), 2005, 112(12): 1647-1655. DOI:10.1007/s00702-005-0351-z |
| [9] |
Lee PH, An YS, Yong SW, et al. Cortical metabolic changes in the cerebellar variant of multiple system atrophy:a voxel-based FDG-PET study in 41 patients[J]. Neuroimage, 2008, 40(2): 796-801. DOI:10.1016/j.neuroimage.2007.11.055 |
| [10] |
Grimaldi S, Boucekine M, Witjas T, et al. Multiple System Atrophy:Phenotypic spectrum approach coupled with brain 18-FDG PET[J]. Parkinsonism Relat Disord, 2019, 67: 3-9. DOI:10.1016/j.parkreldis.2019.09.005 |
| [11] |
Kimura N, Kumamoto T, Masuda T, et al. Evaluation of regional cerebral blood flow in cerebellar variant of multiple system atrophy using FineSRT[J]. Clin Neurol Neurosurg, 2009, 111(10): 829-834. DOI:10.1016/j.clineuro.2009.08.014 |
| [12] |
Miyoshi F, Kanasaki Y, Shinohara Y, et al. Significance of combined use of MRI and perfusion SPECT for evaluation of multiple system atrophy, cerebellar type[J]. Acta Radiol, 2016, 57(6): 742-749. DOI:10.1177/0284185115598810 |
| [13] |
Brenneis C, Boesch SM, Egger KE, et al. Cortical atrophy in the cerebellar variant of multiple system atrophy:a voxel-based morphometry study[J]. Mov Disord, 2006, 21(2): 159-165. |
| [14] |
Brenneis C, Seppi K, Schocke MF, et al. Voxel-based morphometry detects cortical atrophy in the Parkinson variant of multiple system atrophy[J]. Mov Disord, 2003, 18(10): 1132-1138. DOI:10.1002/mds.10502 |
| [15] |
Kim HW, Oh M, Oh JS, et al. Striatofrontal Deafferentiation in MSA-P:Evaluation with[J]. PLoS One, 2017, 12(1): e0169928. DOI:10.1371/journal.pone.0169928 |
| [16] |
娄展, 范磊, 彭涛, 等. 多系统萎缩的认知功能障碍特点分析[J]. 国际神经病学神经外科学杂志, 2018, 45(1): 42-45. |
| [17] |
Takaya M, Atsumi M, Hirose T, et al. Cognitive impairment before changes appear on[J]. Psychogeriatrics, 2016, 16(3): 216-221. DOI:10.1111/psyg.12134 |
| [18] |
Gilman S, Koeppe RA, Junck L, et al. Patterns of cerebral glucose metabolism detected with positron emission tomography differ in multiple system atrophy and olivopontocerebellar atrophy[J]. Ann Neurol, 1994, 36(2): 166-175. DOI:10.1002/ana.410360208 |
| [19] |
Taniwaki T, Nakagawa M, Yamada T, et al. Cerebral metabolic changes in early multiple system atrophy:a PET study[J]. J Neurol Sci, 2002, 200(1-2): 79-84. DOI:10.1016/S0022-510X(02)00151-X |
| [20] |
Jellinger KA. Multiple System Atrophy:An Oligodendroglioneural Synucleinopathy[J]. J Alzheimers Dis, 2018, 62(3): 1141-1179. DOI:10.3233/JAD-170397 |
| [21] |
Minnerop M, Specht K, Ruhlmann J, et al. Voxel-based morphometry and voxel-based relaxometry in multiple system atrophy-a comparison between clinical subtypes and correlations with clinical parameters[J]. Neuroimage, 2007, 36(4): 1086-1095. DOI:10.1016/j.neuroimage.2007.04.028 |
 2020, Vol. 47
2020, Vol. 47




