扩展功能
文章信息
- 亢志强, 杜宝顺, 孙来广, 刘猛
- KANG Zhi-Qiang, DU Bao-Shun, SUN Lai-Guang, LIU Meng
- TCD大脑中动脉峰值流速在分级不良性颅内动脉瘤中的应用研究
- Application of peak flow velocity of the middle cerebral artery on transcranial Doppler in poor-grade intracranial aneurysm
- 国际神经病学神经外科学杂志, 2020, 47(1): 18-21
- Journal of International Neurology and Neurosurgery, 2020, 47(1): 18-21
-
文章历史
收稿日期: 2019-09-01
修回日期: 2020-01-11
脑血管痉挛(cerebral vasospasm,CVS)作为动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)后常见的严重并发症之一,是引起迟发性缺血性神经功能障碍甚至致残、致死影响临床预后的主要原因[1, 2],因此一直是神经科学领域的研究热点之一。目前,早期应用尼莫地平可以显著降低aSAH后严重神经功能障碍的发生率及致残、致死率已基本达成共识[3, 4]。Suarez等[5]研究表明,TCD在CVS诊断方面与MRA有较高的一致性;Nogueira等[6]提出TCD对脑血管狭窄及闭塞性疾病有极高的特异性,对其临床治疗及预后判断有重要指导意义。既往本课题组通过应用TCD对分级不良性颅内动脉瘤患者进行研究发现,基于大脑中动脉Vm实时调整尼莫地平用量可以显著改善患者预后[7];然而多数老年患者血管弹性退化,脉压增大,Vm可能难以准确反映CVS的严重程度,但是目前基于Vp的研究尚少见报道;因此本研究期望通过对大脑中动脉Vp进行研究,以期为分级不良性颅内动脉瘤患者的个体化治疗提供更多理论依据,进而改善其临床预后。
1 对象与方法 1.1 研究对象选自2015年8月至2018年10月在我院住院并确诊的分级不良性颅内动脉瘤患者。纳入标准:⑴年龄在18~75岁;⑵血管成像(CTA、MRA或DSA)确诊颅内动脉瘤;⑶能够完成不同时间窗TCD检查并配合治疗。排除标准:⑴罹患严重的心肝肺肾疾患;⑵有严重颅脑损伤及脑卒中病史;⑶合并其它颅内血管性疾病及肿瘤;⑷颞窗信号不佳。纳入患者56例,其中男25例,女31例,平均年龄(58.5±13.7)岁,随机分为Vm组(28例)和Vp组(28例),组内患者根据年龄是否≥60岁分为老年组(26例)和中年组(30例)。Hunt-Hess分级:Ⅲ级22例,Ⅳ级29例,Ⅴ级5例;瘤颈部位:颈内动脉12例,后交通动脉10例,大脑前动脉4例,前交通动脉11例,大脑中动脉13例,大脑后动脉1例,基底动脉3例,小脑前下动脉1例,小脑后下动脉1例;动脉瘤大小:最大径<5 mm 7例,≥5 mm~15 mm 40例,≥15 mm~25 mm 6例,≥25 mm 3例;早期手术(SAH 3 d内)45例,痉挛期手术(4~14 d)6例,延期手术(14 d后)5例。
1.2 数据采集采用德国DWL公司Multip X经颅多普勒血流分析仪,将2 MHz探头置于患者颞窗,探测双侧大脑中动脉血流动力学参数,频谱以最清晰、最大回流取样。常规TCD检测时间窗为SAH后1 d内、3~5 d、7~10 d、12~14 d,CVS诊断标准:大脑中动脉平均流速(Vm)≥120 cm/s,大脑中动脉峰值流速(Vp)≥140 cm/s。
1.3 药量调整结合患者临床表现和不同时间窗大脑中动脉血流动力学参数调整尼莫地平用量,具体调整标准如下:轻度CVS(Vm介于120~160 cm/s、Vp介于140~180 cm/s)在基础量上增加1~2 ml/h,中度CVS(Vm介于160~200 cm/s、Vp介于180~220 cm/s)增加2~3ml/h,重度CVS(Vm≥200cm/s、Vp≥220cm/s)增加4~5ml/h;期间严密关注患者生命体征,实时调整药物剂量,尽量避免药物性脑血管意外;其它治疗按破裂动脉瘤常规进行。
1.4 评价标准动脉瘤分级采用Hunt-Hess分级标准,Ⅲ~Ⅴ级为分级不良;基于GOS评分评价SAH 3个月后患者预后,GOS≥4分为预后良好。
1.5 统计学处理应用SPSS 16.0统计软件对研究资料进行统计学处理;计量资料以(x±s)表示,组间比较采用t检验;计数资料采用χ2检验;P<0.05为差异有统计学意义。
2 结果 2.1 一般资料2组(Vm组和Vp组,中年Vm组和Vp组,老年Vm组和Vp组)患者在性别、年龄、动脉瘤大小等方面的差异无统计学意义(均P>0.05)。
2.2 脑血流动力学参数TCD监测结果SAH后1 d内Vm、Vp分别为(48.3±13.6)cm/s、(75.8±20.6)cm/s,3~5 d时Vm、Vp分别为(80.1±21.9)cm/s、(122.7±27.3)cm/s,7~10 d时Vm、Vp分别为(134.9±32.5)cm/s、(172.8±40.6)cm/s,12~14 d时Vm、Vp分别为(114.7±26.1)cm/s、(149.5±30.9)cm/s;如图 1所示:大脑中动脉流速在aSAH后1 d内处于正常水平,3~5 d时流速明显增加,7~10 d时流速达到高峰,随后逐渐降低。
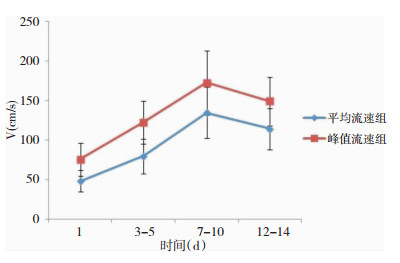
|
| 图 1 不同时间段脑血流动力学参数变化情况 |
通过电话随访形式了解2组患者预后(SAH 3个月后),采用卡方检验对2组患者预后进行统计学分析发现:Vm组和Vp组患者预后无明显差别,差异无统计学意义(P>0.05),如表 1所示;中年Vm组和Vp组患者预后无明显差别,差异无统计学意义(P>0.05),如表 2所示;老年Vp组患者预后明显优于Vm组,差异有统计学意义(P<0.05),如表 3所示。
作为分级不良性颅内动脉瘤患者的常见并发症之一,CVS是其预后不良的重要原因。许晖等[8]通过应用TCD对重型颅脑损伤患者进行连续监测,其证实CVS早于临床症状的出现;White等[9]提出TCD对CVS具有独特的诊断优势,其灵敏性和特异性分别为87.04%和86.32%,其中脑血流速度是反映CVS最直观的一项参数。近年来,随着“精准医学”的快速发展,TCD作为一种实时、便捷、无创的脑血流动力学参数监测手段被广泛应用临床[10],尤其是在SAH后CVS患者,且效果理想[11, 12]。
既往研究表明,CVS的发生有规律可循;aSAH患者通常在动脉瘤破裂1 d内脑血流速度基本正常,3~5 d时流速明显加快,于7~10 d达到高峰,随后逐渐下降[7, 13-15]。基于脑血流的多项研究表明,血流速度在一定范围内随血管痉挛程度的加重而增快[16, 17];虽然Eisenhut等[18]提出血管痉挛并非导致脑血流速度增高的唯一原因,但是Li等[19]通过研究发现脑血流速度是影响手术治疗颅内动脉瘤术后CVS发生的独立危险因素且影响预后。基于此,本课题组通过对56例分级不良性颅内动脉瘤患者的大脑中动脉Vm、Vp进行连续监测发现,aSAH患者Vm和Vp均符合上述规律,可以作为早期预测及诊断CVS的可靠指标。
虽然上述研究结论对CVS的防治具有一定指导价值,但是目前多项研究表明患者预后仍待提高。基于TCD和DSA对SAH患者进行研究,Dietrich等[20, 21]发现大脑中动脉是发生CVS最常见的血管,其可以作为监测CVS最可靠最有价值的血管。既往通过对分级不良性颅内动脉瘤患者大脑中动脉进行研究,本课题组发现基于Vm适时调整尼莫地平用量可以显著改善患者预后[7];本研究继续通过对56例分级不良性颅内动脉瘤患者预后进行组间差异性分析,发现Vm组和Vp组预后无明显差别,中年组亦无明显差别,而老年组中Vp患者预后明显优于Vm患者;既往研究表明,脉压增加是老年人心脑血管疾病发生的独立危险因素[22, 23];通过Logistic回归分析,郭森等[24]发现年龄、收缩压、脉压与脑卒中呈正相关,年龄越大、收缩压越高、脉压越大,发生脑卒中的风险越高,其中又以年龄>60岁的老年患者所占比例最高;基于此,推测本研究结果可能与老年患者血管弹性退化、脉压增大,平均流速难以准确反映老年患者的血管情况有关,提示平均流速可能无法准确反映老年患者CVS的严重程度,而大脑中动脉峰值流速在老年患者中的应用价值可能更大。
总之,本研究认为,TCD在分级不良性颅内动脉瘤患者的临床治疗中具有重要价值,特别针对CVS患者,其可以根据不同患者对各个参数的敏感性进行个体化指导治疗,进而改善其临床预后;然而,本研究中亦存在样本量偏小,相关操作及临床技能水平可能欠一致等因素的影响,未来这将是本课题组工作的重点;同时针对目前TCD不同参数在aSAH患者中的应用价值仍待挖掘,下一步本课题组将进一步增加病例数并应用多个参数指标对分级不良性颅内动脉瘤患者进行深入研究,以期为其个体化治疗提供更多理论依据,从而改善其临床预后。
| [1] |
Ilker Oz I, Bozay Oz E, Şerifoǧlu I, et al. Cerebellar infarction in childhood:delayed-onset complication of mild head trauma[J]. Iran J Child Neurol, 2016, 10(3): 82-85. |
| [2] |
范存刚, 孙澎, 张庆俊. 2012年AHA/ASA《动脉瘤性蛛网膜下腔出血的诊疗指南》解读[J]. 中华神经医学杂志, 2013, 12(6): 541-544. DOI:10.3760/cma.j.issn.1671-8925.2013.06.001 |
| [3] |
Romero CM, Morales D, Reccius A, et al. Milrinone as a rescue therapy for symptomatic refractory cerebral vasospasm in aneurysmal subarachnoid hemorrhage[J]. Neurocrit Care, 2009, 11(2): 165-171. DOI:10.1007/s12028-008-9048-0 |
| [4] |
张茂, 陈健龙, 彭浩, 等. 经颅多普勒检测破裂脑动脉瘤栓塞术后脑血管痉挛的临床应用[J]. 临床神经外科杂志, 2017, 14(3): 174-177. DOI:10.3969/j.issn.1672-7770.2017.03.004 |
| [5] |
Suarez JI, Martin RH, Calvillo E, et al. Effect of human albumin on TCD vasospasm, DCI, and cerebral infarction in subarachnoid hemorrhage:the ALISAH study[J]. Acta Neurochir Suppl, 2015, 120: 287-290. |
| [6] |
Nogueira RC, Saeed NP, Bor-Seng-Shu E, et al. The carotid artery as an alternative site for dynamic autoregulation measurement:an inter-observer reproducibility study[J]. Med Eng Phys, 2016, 38(7): 690-694. DOI:10.1016/j.medengphy.2016.03.007 |
| [7] |
杜宝顺, 亢志强, 孙来广. TCD在分级不良颅内动脉瘤中的应用研究[J]. 肿瘤基础与临床, 2016, 29(5): 447-449. DOI:10.3969/j.issn.1673-5412.2016.05.025 |
| [8] |
许晖, 董江涛, 王惠, 等. TCD在重型颅脑损伤患者救治中的临床应用研究[J]. 中华神经外科疾病研究杂志, 2018, 17(1): 76-77. |
| [9] |
White H, Venkatesh B. Applications of transcranial Doppler in the ICU:a review[J]. Intensive Care Med, 2006, 32(7): 981-994. DOI:10.1007/s00134-006-0173-y |
| [10] |
Reichman M, Gold R, Greenberg E, et al. Validation of a new reference standard for the diagnosis of vasospasm[J]. Acad Radiol, 2010, 17(9): 1083-1089. DOI:10.1016/j.acra.2010.04.025 |
| [11] |
顾志强, 李楠. 经颅多普勒监测蛛网膜下腔出血后脑血管痉挛的临床观察[J]. 中国实用神经疾病杂志, 2017, 20(13): 12-14. DOI:10.3969/j.issn.1673-5110.2017.13.004 |
| [12] |
Shahlaie K, Keachie K, Hutchins IM, et al. Risk factors for posttraumatic vasospasm[J]. J Neurosurg, 2011, 115(3): 602-611. DOI:10.3171/2011.5.JNS101667 |
| [13] |
惠品晶, 刘曼, 王中, 等. 动脉瘤性蛛网膜下腔出血后脑血管痉挛的脑血流动力学改变[J]. 中国脑血管病杂志(电子版), 2011, 5(6): 454-463. |
| [14] |
王青松, 李钢. 蛛网膜下腔出血后脑血管痉挛发病机制的研究新进展[J]. 中华神经医学杂志, 2013, 12(4): 422-425. |
| [15] |
陈华轩, 云德波, 邓学云, 等. 缺血修饰白蛋白评估动脉瘤性蛛网膜下腔出血患者迟发性脑缺血研究[J]. 国际神经病学神经外科学杂志, 2018, 45(6): 597-599. |
| [16] |
Ricarte IF, Funchal BF, Miranda Alves MA, et al. Symptomatic cerebral vasospasm and delayed cerebral ischemia following transsphenoidal resection of a craniopharyngioma[J]. J Stroke Cerebrovasc Dis, 2015, 24(9): e271-e273. DOI:10.1016/j.jstrokecerebrovasdis.2015.06.005 |
| [17] |
Kumar G, Shahripour RB, Harrigan MR. Vasospasm on transcranial Doppler is predictive of delayed cerebral ischemia in aneurysmal subarachnoid hemorrhage:a systematic review and meta-analysis[J]. J Neurosurg, 2016, 124(5): 1257-1264. DOI:10.3171/2015.4.JNS15428 |
| [18] |
Eisenhut M. The evidence for a role of vasospasm in the pathogenesis of cerebral malaria[J]. Malar J, 2015, 14: 405. DOI:10.1186/s12936-015-0928-4 |
| [19] |
Li G, Han K, Yang H, et al. Risk factors of intracranial hemorrhage after brain AVM interventional therapy and its effects on prognosis[J]. Int J Clin Exp Med, 2015, 8(7): 11014-11019. |
| [20] |
Dietrich HH, Dacey RG Jr. Molecular keys to the problems of cerebral vasospasm[J]. Neurosurgery, 2000, 46(3): 517-530. DOI:10.1097/00006123-200003000-00001 |
| [21] |
Matula C. Subarachnoid hemorrhage and cerebral vasospasm-facts and perspectives[J]. Wien Klin Wochenschr, 2000, 112(12): 519-522. |
| [22] |
Liu FD, Shen XL, Zhao R, et al. Pulse pressure as an independent predictor of stroke:a systematic review and a meta-analysis[J]. Clin Res Cardiol, 2016, 105(8): 677-686. DOI:10.1007/s00392-016-0972-2 |
| [23] |
Glasser SP, Halberg DL, Sands CD, et al. Is Pulse Pressure an Independent Risk Factor for Incident Stroke, REasons for Geographic And Racial Differences in Stroke[J]. Am J Hypertens, 2015, 28(8): 987-994. DOI:10.1093/ajh/hpu265 |
| [24] |
郭森, 肖凡凯, 杨帆, 等. 脑卒中与高血压关系的回顾性分析[J]. 中华高血压杂志, 2018, 26(3): 253-257. |
 2020, Vol. 47
2020, Vol. 47




