扩展功能
文章信息
- 顾佳炜, 刘畅, 李祥
- GU Jia-Wei, LIU Chang, LI Xiang
- 幕上高血压脑出血早期血肿扩大的相关因素和预后分析
- An analysis of the factors related to hematoma enlargement in the early stage of supratentorial hypertensive intracerebral hemorrhage and its prognosis
- 国际神经病学神经外科学杂志, 2019, 46(6): 622-627
- Journal of International Neurology and Neurosurgery, 2019, 46(6): 622-627
-
文章历史
收稿日期: 2019-11-02
修回日期: 2019-12-12
高血压脑出血(hypertensive intracerebral hemorrhage,HICH)因其高病死率、高致残率的特点,正逐渐成为危害当代国民健康的主要杀手之一。其中,幕上高血压脑出血占比达到80%,约有1/3的患者在发病24小时内出现血肿扩大(hematoma enlargement,HE),预示着患者更差的预后[1-3]。目前国内外还未确定HE完整的预测因素[4]。本研究通过对346例幕上高血压脑出血患者进行回顾性研究,探讨引起HE的相关影响因素,同时研究血肿扩大对患者预后的影响。
1 临床资料 1.1 一般资料收集徐州医科大学附属医院神经外科2015年01月至2019年05月诊断为幕上高血压脑出血并入院时行保守治疗的患者共1766人,其中符合第四届全国脑血管病会议制定的诊断标准且有完整临床数据的患者共346人。
1.2 分组标准患者均在发病后6小时内行头颅CT检查,并在发病后24小时内复查头颅CT。根据多田公式分别计算血肿量,两次头颅CT血肿量增加33%或者6 ml定义为血肿扩大,据此将所有患者分为血肿扩大组101人及血肿未扩大组245人。
1.3 排除标准① 脑动脉瘤、血管畸形等引起的脑出血。②继发于肿瘤或外伤的脑出血。③小脑、脑干出血。④单纯脑室出血。⑤一周内使用抗凝药物的患者。
1.4 观察指标通过对患者性别、年龄、血型、是否有糖尿病史、血肿部位、血肿形态、血肿量、入院时格拉斯哥昏迷评分、首次头颅CT距离发病时间、入院时红细胞分布宽度、血红蛋白、血小板、白细胞、中心粒细胞、淋巴细胞、谷丙转氨酶、谷草转氨酶、白蛋白、肌酐、血糖值、血清钙、血清镁、总胆固醇、甘油三酯、低密度脂蛋白、高密度脂蛋白、凝血功能、入院时血压等进行比较,探讨引起幕上高血压脑出血早期血肿扩大的相关影响因素。
2 统计学分析采用SPSS 22.0统计学软件处理,计量资料以均数±标准差(x ± s)表示,采用t检验,计数资料以百分率(%)表示,采用卡方检验,对影响血肿扩大的相关因素进行Logistic多因素回归分析,P<0.05为差异有统计学意义。
3 结果 3.1 单因素分析结果两组患者性别、血型、血肿形态、血肿量、首次CT距发病时间、入院时GCS、血糖、低密度脂蛋白之间差异具有统计学意义(P < 0.05),统计数据及结果见表 1。
| 因素 | 血肿扩大组(n=101) | 血肿无扩大组(n=245) | t/χ2 | P | |
| 性别(人) | 男 | 81 | 149 | 12.055 | 0.001 |
| 女 | 20 | 96 | |||
| 年龄(岁) | ≤40 | 6 | 9 | ||
| 40~60 | 35 | 96 | 1.299 | 0.522 | |
| >60 | 60 | 140 | |||
| 血型 | O型 | 43 | 76 | 4.231 | 0.04 |
| 非O型 | 58 | 169 | |||
| 糖尿病史 | 有 | 12 | 24 | 0.334 | 0.564 |
| 无 | 89 | 221 | |||
| 血肿部位 | 浅部(脑叶) | 19 | 46 | 0.000 | 0.994 |
| 深部(核壳、丘脑) | 82 | 199 | |||
| 血肿形态 | 规则 | 45 | 156 | 10.738 | 0.001 |
| 不规则 | 56 | 89 | |||
| 血肿量(ml) | 48.67±48.93 | 34.72±33.67 | 6.14 | 0.013 | |
| 入院GCS | 9.92±3.68 | 11.68±3.33 | 17.162 | 0.000 | |
| 首次CT距发病时间(h) | 2.58±1.70 | 3.00±1.62 | 6.769 | 0.009 | |
| RDW(%) | 12.86±0.75 | 12.83±0.91 | 1.887 | 0.170 | |
| HB(g/L) | 140.02±20.38 | 139.59±17.61 | 0.196 | 0.845 | |
| PLT(109/L) | 189.04±58.00 | 196.67±53.97 | 1.981 | 0.159 | |
| WBC(109/L) | 9.00±3.21 | 8.82±5.79 | 1.935 | 0.164 | |
| ANC(109/L) | 6.60±3.18 | 6.70±3.05 | 0.164 | 0.685 | |
| ALC(109/L) | 1.42±0.85 | 1.43±0.71 | 0.440 | 0.507 | |
| ALT(U/L) | 29.00±11.63 | 29.43±14.28 | 0.059 | 0.808 | |
| AST(U/L) | 29.67±14.39 | 29.67±16.71 | 0.296 | 0.586 | |
| ALB(g/L) | 42.08±4.86 | 41.87±4.46 | 0.312 | 0.576 | |
| CREA(umol/L) | 65.78±18.44 | 65.60±39.57 | 2.797 | 0.094 | |
| GLU(mmol/L) | 7.90±2.87 | 7.03±2.44 | 7.94 | 0.005 | |
| CA(mmol/L) | 2.26±0.17 | 2.28±0.16 | -1.169 | 0.269 | |
| Mg(mmol/L) | 0.84±0.11 | 0.88±0.39 | 2.310 | 0.129 | |
| CHOL(mmol/L) | 5.08±6.90 | 4.65±1.05 | 2.443 | 0.118 | |
| TG(mmol/L) | 1.27±0.83 | 1.43±1.08 | 1.128 | 0.288 | |
| LDL(mmol/L) | 2.32±0.82 | 2.66±0.92 | 10.397 | 0.001 | |
| HDL(mmol/L) | 1.46±0.61 | 1.44±0.48 | 0.051 | 0.821 | |
| PT(S) | 11.98±1.42 | 12.37±2.33 | 2.473 | 0.116 | |
| APTT(S) | 27.94±5.39 | 27.34±4.85 | 0.557 | 0.455 | |
| FIB(g/L) | 2.64±0.74 | 2.76±0.69 | 2.953 | 0.086 | |
| SBP(mmHg) | 175.35±28.59 | 170.61±26.02 | 1.895 | 0.169 | |
| DBP(mmHg) | 98.46±16.28 | 97.66±15.55 | 0.126 | 0.722 |
将相关影响因素纳入多因素Logistic回归方程,两组患者的性别、血型、血肿形态、首次CT距发病时间、入院时GCS、血糖、低密度脂蛋白之间差异具有统计学意义(P < 0.05),统计数据及结果见表 2。
| 因素 | B | 标准误 | Wald | df | P | OR | 95%可信区间 | |
| 下限 | 上限 | |||||||
| 性别 | 1.061 | 0.315 | 11.318 | 1 | 0.001 | 2.888 | 1.557 | 5.357 |
| 血型 | 0.547 | 0.274 | 3.985 | 1 | 0.046 | 1.727 | 1.010 | 2.954 |
| 血肿形态 | -0.680 | 0.278 | 5.982 | 1 | 0.014 | 0.506 | 0.294 | 0.874 |
| 血肿量 | 0.002 | 0.003 | 0.346 | 1 | 0.556 | 1.002 | 0.995 | 1.009 |
| 首次CT距发病时间 | -0.183 | 0.083 | 4.817 | 1 | 0.028 | 0.833 | 0.708 | 0.981 |
| 入院GCS | -0.129 | 0.039 | 10.831 | 1 | 0.001 | 0.879 | 0.813 | 0.949 |
| 血糖 | 0.104 | 0.049 | 4.540 | 1 | 0.033 | 1.110 | 1.008 | 1.221 |
| LDL | -0.320 | 0.155 | 4.262 | 1 | 0.039 | 0.726 | 0.536 | 0.984 |
随访两组患者发病后6个月的预后情况,进行格拉斯哥预后分级,血肿扩大组患者预后差于血肿未扩大组患者,统计数据及结果见表 3。
| 分组 | GOSⅠ级 | GOSⅡ级 | GOSⅢ级 | GOSⅣ级 | GOSⅤ级 | χ2 | P |
| 扩大组(人) | 7 | 22 | 35 | 26 | 11 | 13.706 | 0.008 |
| 未扩大组(人) | 3 | 32 | 102 | 70 | 38 |
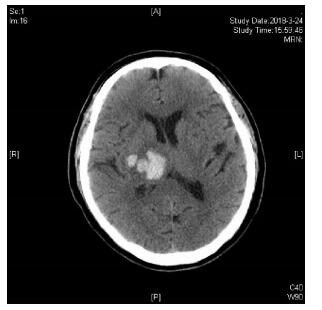
|
| 图 1 患者发病2小时后首次头颅CT检查。 |
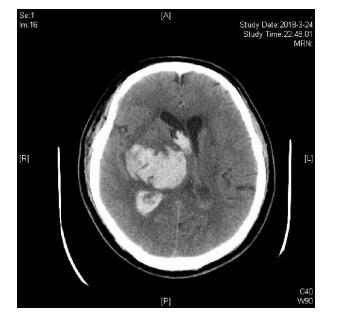
|
| 图 2 患者发病8.5小时后出现意识障碍加深,复查头颅CT。 |
高血压脑出血早期的病情恶化主要是血肿扩大所致,48小时后病情恶化主要是脑水肿所致,因此,早期预防血肿扩大是改善预后的关键[5]。本研究纳入了国内外相关研究中提及的与HE有关的因素共31项,根据单因素分析及进一步将多因素Logistic回归分析,排除混杂因素的影响,结果显示患者性别、血型、血肿形态、首次CT距发病时间、入院时GCS、血糖、低密度脂蛋白是幕上高血压脑出血患者早期血肿扩大的独立危险因素。
大多既往实验[6, 7]表明性别与血肿扩大无明显关系,但本研究显示,男性患者血肿扩大风险明显高于女性,这可能是由于两性不同的生活习惯,男性多有吸烟、饮酒及肥胖史,造成动脉粥样硬化,血管壁弹性差,更易发生破裂出血。但由于本研究总样本相对较少,需进一步增加样本做进一步研究。同时,上述既往研究多为国外进行的研究,由于东西方人种、生活习惯等差异,可能也是造成不同结果的原因。
根据本研究结果表明,O型血的患者出现血肿扩大的风险明显高于其他血型,Jenkins等[8]一项研究显示,血浆中存在一种叫血管性血友病因子(vWF)的凝血糖蛋白,主要参与了人体的凝血过程。与非O型血相比,O型血内的vWF水平要低25%左右,这增加了O型血患者的出血风险。但目前也有另一种观点[9],血型在凝血过程中不仅仅是通过vWF来发挥作用的,而是与内皮细胞-白细胞、血小板、纤维蛋白原以及红细胞相互作用,这可能意味着,虽然非O型血患者的vWF水平更高,但只表示其处于较低的早期血肿扩大风险,在整个活动性的出血过程中,内皮细胞破裂导致的出血可能由于其他因子无法激活启动止血,造成进一步的血肿扩大。但目前该观点尚停留在理论阶段,还需得到进一步的临床实验与大样本病例分析结果的支持。He等[10]一项关于210名患者的研究表明,O型血预测血肿扩大的敏感性为54.5%,特异性为72.9%,阳性预测值为41.6%,阴性预测值为81.9%。虽然无法直接通过改变血型改善预后,但作为一种廉价、快速的实验室指标,我们可以凭借其高敏感性,明确具有更高HE风险的患者,对其病情变化保持更高的关注度,展开更为积极的治疗。
根据Fujii等[11]对419例患者的回顾性分析研究,不规则形状血肿的患者比圆形血肿的患者有更高的血肿生长风险, 与本研究结论一致。Barras等[12]关于90名患者的研究也表明不规则血肿预示着更高风险的血肿扩大,主要是由于不规则的血肿往往预示着活动性,多灶性的出血。但该研究同时指出,大出血量与不规则血肿往往具有协同性,共同预测脑血肿的生长,但本研究并未发现血肿量对其影响。
由于出血是一个动态的过程,出血时间可能超过24小时,据Ovesen等[13, 14]两项相关的研究显示,在患者发病后的8小时以内,早期血肿扩大是一个动态的持续过程。张亚等[15]研究发现,3小时以内,患者血肿扩大发生率高达50%,而3~6小时的血肿扩大率为34.87%,出血甚至可持续到24小时。本研究显示血肿扩大组患者平均首次CT时间为2.58±1.70 h,未扩大组为3.00±1.62 h,差异与上述研究结果相符。首次CT时间虽然不是血肿扩大的预防因素,但可做为预测因素,对于首次CT时间较短的患者,需密切观察患者神志变化情况,动态复查头颅CT。患者的GCS主要是反应了患者发病后的神经功能损伤程度,葛小金等[16]一项关于138例高血压脑出血患者的研究显示,患者入院时昏迷程度越高,神经功能损伤越严重,早期发生血肿扩大的几率也越大,故可通过对患者入院GCS的评估预测HE的风险。
目前对于高血糖是HE的危险因素还是仅为脑出血后应激反应的结果尚且存在争议[17],一项国外研究[18]表明,高血糖下的人脑微血管内皮细胞与正常血糖下相比具有更高的还原型氧化酶Ⅱ(NADPH)氧化酶活性与表达,通过激活不同的信号转导途径,增加自由基的产生,加速了血脑屏障的破坏,进一步损害了出血部位周围血管的完整性,导致了新发或原发部位持续性的出血。Zhang等[19]一项包含138例患者的回顾性研究显示,患者入院血糖水平和HE有关,与本研究结果一致。目前低密度脂蛋白对于HE的影响机制尚不明确,根据Rodriguez-Luna[20]的研究,这种关系可能是由于LDL对于血管完整性的保护作用,LDL水平的降低会造成血管内侧平滑肌细胞的坏死,从而降低血管壁破裂的抵抗力。国内一项包含360名患者的研究[21]表明,当LDL<2.49 mmol/L是血肿扩大的独立危险因素,本研究血肿扩大组LDL为2.32±0.82 mmol/L,血肿未扩大组LDL为2.66±0.92 mmol/L,结果与上述研究一致。
总之,SICH患者早期血肿扩大是多种因素共同作用的结果。发生HE的患者预后更差。对于血型为O型,性别为男性,入院CT距发病时间短,血肿形态不规则,入院GCS低的患者,血糖高,LDL低的患者,应更密切的观察患者病情变化,采取更及时的治疗,改善患者的预后。
| [1] |
Mao J, Jiang W, Liu G, et al. Serum calcium levels at admission is associated with the outcomes in patients with hypertensive intracerebral hemorrhage[J]. Br J Neurosurg, 2019, 33(2): 145-148. DOI:10.1080/02688697.2019.1571162 |
| [2] |
Hemphill JC 3rd, Greenberg SM, Anderson CS, et al. Guidelines for the management of spontaneous intracerebral hemorrhage:a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke, 2015, 46(7): 2032-2060. DOI:10.1161/STR.0000000000000069 |
| [3] |
Chang GY, Davis SM, Broderick J, et al. Hematoma growth is a determinant of mortality and poor outcome after intracerebral hemorrhage[J]. Neurology, 2007, 68(6): 471-472. |
| [4] |
Chan S, Conell C, Veerina KT, et al. Prediction of intracerebral haemorrhage expansion with clinical, laboratory, pharmacologic, and noncontrast radiographic variables[J]. Int J Stroke, 2015, 10(7): 1057-1061. DOI:10.1111/ijs.12507 |
| [5] |
Yang LJ, Cui JL, Wu TM, et al. Sequential therapy for non-thalamus supratentorial hypertensive intracerebral hemorrhages[J]. Eur Rev Med Pharmacol Sci, 2014, 18(23): 3653-3658. |
| [6] |
Boulouis G, Morotti A, Brouwers HB, et al. Association Between Hypodensities Detected by Computed Tomography and Hematoma Expansion in Patients With Intracerebral Hemorrhage[J]. JAMA Neurol, 2016, 73(8): 961-968. DOI:10.1001/jamaneurol.2016.1218 |
| [7] |
Rodriguez-Luna D, Coscojuela P, Rubiera M, et al. Ultraearly hematoma growth in active intracerebral hemorrhage[J]. Neurology, 2016, 87(4): 357-364. DOI:10.1212/WNL.0000000000002897 |
| [8] |
Jenkins P, O'Donnell JC. ABO blood group determines plasma von Willebrand factor levels:a biologic function after all[J]. Transfusion (Malden), 2006, 46(10): 1836-1844. DOI:10.1111/j.1537-2995.2006.00975.x |
| [9] |
Roh D, Martin A, Sun CH, et al. ABO Blood Type and Hematoma Expansion After Intracerebral Hemorrhage:An Exploratory Analysis[J]. Neurocrit Care, 2019, 31(1): 66-71. DOI:10.1007/s12028-018-0655-0 |
| [10] |
He Q, Zhou Y, Wang F, et al. Blood Type O Predicts Hematoma Expansion in Patients with Intracerebral Hemorrhage[J]. J Stroke Cerebrovasc Dis, 2019, 28(8): 2311-2317. DOI:10.1016/j.jstrokecerebrovasdis.2019.05.022 |
| [11] |
Fujii Y, Takeuchi S, Sasaki O, et al. Multivariate Analysis of Predictors of Hematoma Enlargement in Spontaneous Intracerebral Hemorrhage[J]. Stroke, 1998, 29(6): 1160-1166. DOI:10.1161/01.STR.29.6.1160 |
| [12] |
Barras CD, Tress BM, Christensen S, et al. Density and Shape as CT Predictors of Intracerebral Hemorrhage Growth[J]. Stroke, 2009, 40(4): 1325-1331. DOI:10.1161/STROKEAHA.108.536888 |
| [13] |
Ovesen C, Havsteen I, Rosenbaum S, et al. Prediction and Observation of Post-Admission Hematoma Expansion in Patients with Intracerebral Hemorrhage[J]. Front Neurol, 2014, 5(5): 186. |
| [14] |
Ovesen C, Christensen AF, Krieger DW, et al. Time Course of Early Postadmission Hema toma Expansion in Spontaneous Intracerebral Hemorrhage[J]. Stroke, 2014, 45(4): 994-999. DOI:10.1161/STROKEAHA.113.003608 |
| [15] |
张亚, 王玉, 林亚楠, 等. 脑出血早期血肿扩大的危险因素分析[J]. 中华老年心脑血管病杂志, 2016(6期): 567-570. |
| [16] |
葛小金, 于挺敏.脑出血早期血肿扩大危险因素的临床研究[J].中风与神经疾病杂志, 2018, v.35;No.233(01): 45-48. http://www.cnki.com.cn/Article/CJFDTotal-ZFSJ201801011.htm
|
| [17] |
Qureshi AI, Palesch YY, Martin R, et al. Association of Serum Glucose Concentrations During Acute Hospitalization with Hematoma Expansion, Perihematomal Edema, and Three Month Outcome Among Patients with Intracerebral Hemorrhage[J]. Neurocrit Care, 2011, 15(3): 428-435. DOI:10.1007/s12028-011-9541-8 |
| [18] |
Allen CL, Bayraktutan U. Antioxidants attenuate hyperglycaemia-mediated brain endothelial cell dysfunction and bloodbrain barrier hyperpermeability[J]. Diabetes, Obes Metab, 2009, 11(5): 480-490. DOI:10.1111/j.1463-1326.2008.00987.x |
| [19] |
Zhang F, Zhang S, Tao C, et al. Association between serum glucose level and spot sign in intracerebral hemorrhage[J]. Medicine (Baltimore), 2019, 98(11): e14748. DOI:10.1097/MD.0000000000014748 |
| [20] |
Rodriguez-Luna D, Rubiera M, Ribo M, et al. Serum low-density lipoprotein cholesterol level predicts hematoma growth and clinical outcome after acute intracerebral hemorrhage[J]. Stroke, 2011, 42(9): 2447-2452. DOI:10.1161/STROKEAHA.110.609461 |
| [21] |
刘首峰, 徐小林. 血清低密度脂蛋白与脑出血血肿扩大的相关性研究[J]. 中国现代医学杂志, 2013(16): 90-92. |
 2019, Vol. 46
2019, Vol. 46



