扩展功能
文章信息
- 杨倩, 胡盼盼, 方娟, 汪凯
- YANG Qian, HU Pan-Pan, FANG Juan, WANG Kai
- 帕金森病患者双眼竞争的研究
- A study of binocular rivalry in patients with Parkinson's disease
- 国际神经病学神经外科学杂志, 2019, 46(6): 601-604
- Journal of International Neurology and Neurosurgery, 2019, 46(6): 601-604
-
文章历史
收稿日期: 2019-09-21
修回日期: 2019-11-28
2. 安徽医科大学第一附属医院神经内科, 安徽省合肥市 230022;
3. 安徽医科大学第一附属医院急诊内科, 安徽省合肥市 230032
2. Department of Neurology, the First Affiliated Hospital of Anhui Medical University, Hefei 230022, China
双眼竞争是指当两种不同的图像同时呈现给两眼时,两种图像动态交替出现,而不是两种图像的简单叠加[1, 2],是一个典型的双稳态视觉感知的例子,现已是研究视觉意识机制的非常有效的工具。帕金森病(Parkinson’s Disease, PD),又称震颤麻痹(paralysis agitans),是一组与额叶-基底节环路病变密切相关的神经系统变性疾病。在观察双稳态图像时,研究发现大脑额叶区域到视觉皮质的自上而下的连接发生了调节[3]。故我们推测PD患者感知双稳态图像可能存在异常,本研究采用双眼竞争范式,探讨PD患者的双眼竞争交替速率及其可能的神经机制。
1 对象与方法 1.1 研究对象 1.1.1 帕金森病组(PD组)选取在安徽医科大学第一附属医院就诊的临床确诊的原发性PD患者32例(诊断符合中华医学会神经病学分会帕金森病及运动障碍学组制定的中国PD的诊断标准[4]),其中男21例,女11例;均为右利手;改良Hoehn-Yahr分级在1~3级;病程在0.5~12年,平均病程(3.03±2.70)年。排除标准:①其他神经或精神系统疾病病史,如偏头痛、精神分裂症等;②严重躯体疾病病史;③酗酒或药物滥用史;④简易精神状态量表(Mini-Mental State Examination, MMSE)评分 < 24分;⑤视力、听力或语言理解表达能力障碍,存在色弱、色盲、斜视和(或)复视。所有入组的PD患者均存在一段时间的正规服药史,且所用药物均为多巴胺能药物,而未服用任何抗胆碱能药物。PD患者平均左旋多巴等效剂量[5]为(407.81±198.43)mg/d。
1.1.2 健康对照组(HC组)性别、年龄、教育年限、利手均与PD组相匹配的健康对照者32例,其中男性19例,女性13例。排除标准:①神经或精神系统疾病病史,如偏头痛、精神分裂症等;②严重躯体疾病病史;③简易精神状态量表(MMSE)评分 < 24分;④服用对中枢神经系统有影响的相关药物。
本研究获得安徽医科大学伦理委员会批准,并取得所有被试验者及家属的知情同意。
1.2 研究方法 1.2.1 神经心理学背景测试所以被试者均行简易精神状态量表(MMSE)排除痴呆、汉密尔顿焦虑量表(Hamilton Anxiety Scale, HAMA)排除焦虑状态,汉密尔顿抑郁量表(Hamilton Depression Scale, HAMD)(17项版)排除抑郁状态。
1.2.2 双眼竞争的任务测试任务测试在一个光线昏暗和相对隔音的房间进行。任务测试刺激通过联想笔记本电脑(型号B460,14英寸LED背光液晶屏,分辨率1366×768,刷新频率60 Hz)呈现。使用MATLAB软件包的Psychophysics Toolbox[6]来控制刺激呈现和测试时间。双眼竞争的任务测试通过被试者佩戴红绿立体眼镜观看笔记本电脑显示器屏幕上呈现的重叠、静止的彩色滤波图像实现。被试者按要求坐在距离屏幕100 cm处,并产生1.26度的观看角度,佩戴红绿立体眼镜观看双稳态刺激。任务测试共分为两个阶段:①学习阶段:被试者通过肉眼观看屏幕上红色圆形光栅与绿色放射形光栅交替出现的图像,每对图呈现6 s,共呈现10对,当被试者看见红色圆形光栅出现时按下左键,绿色放射形光栅出现时按下右键。②试验阶段:试者佩戴红绿立体眼镜来观看红绿色的圆形和放射形光栅重叠的静止彩色滤波图像。在双眼竞争的情形下,左眼呈现的是绿色放射形光栅,右眼呈现的是红色圆形光栅,左右眼图像随机交替占优。嘱被试者在任务测试开始前先将手指放在按键上,在每次感知变化时按下相应的按键。刺激图像共呈现三组,每组120 s,每组图像之间被试有3 min的休息时间,其间出现一个空白屏幕。第一组测试用于训练被试者,分析时被排除在外。在整个任务测试过程中,被试者被要求固定刺激图像的中心,不能随意移动。并嘱所有被试者在测试开始前4 h内禁止摄入茶、酒精、咖啡等。
1.2.3 数据分析通过被试者按键时间电脑自动记录双眼竞争交替速率,得出其平均值。双眼竞争交替速率是衡量双眼竞争任务中知觉变化快慢的指标,即单位时间内知觉/抑制来回切换次数。
1.3 统计学方法采用SPSS 23.0进行统计学分析。Shapiro-Wilk检验正态分布,计量资料数据用均数±标准差(x ± s)表示。PD组和HC组之间数据若为正态分布,运用独立样本t检验进行组间比较;若为非正态分布,运用Mann-Whitney U检验进行组间比较。双眼竞争交替速率与年龄、教育年限、Hoehn-Yahr分级、病程、每日左旋多巴等效剂量、背景测试结果的相关分析采用Pearson相关分析(若数据为非正态分布,采用Spearman相关分析)。P < 0.05表示差异有统计学意义。
2 结果 2.1 PD组和HC组人口学资料和神经心理学背景测试的结果比较PD组和HC组在性别、年龄、受教育年限、MMSE评分、HAMA评分、HAMD评分方面差异无统计学意义(均P>0.05)。见表 1。
| 项目 | PD组(n=32) | HC组(n=32) | χ2/t/Z值 | P值 |
| 性别(男/女) (n) | 21/11 | 19/13 | 0.267 | 0.606 |
| 年龄(岁) | 60.47±9.97 | 61.50±11.27 | -0.388 | 0.700 |
| 受教育年限(年) | 8.13±4.47 | 7.84±4.66 | -0.177 | 0.859 |
| MMSE评分(分) | 28.09±1.51 | 28.34±1.07 | -0.383 | 0.702 |
| HAMA评分(分) | 3.56±2.23 | 3.25±1.37 | -0.621 | 0.534 |
| HAMD评分(分) | 3.94±2.56 | 3.78±1.91 | -0.034 | 0.973 |
PD组双眼竞争交替速率[(0.24±0.07)Hz]较健康对照组[(0.35±0.11)Hz]显著减慢,二者比较差异有统计学意义(t=-4.653, P=0.000)。见图 1。
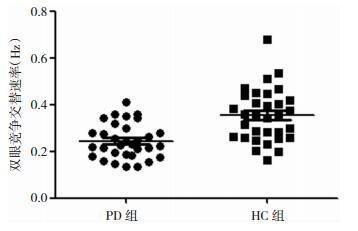
|
| 图 1 两组双眼竞争交替速率散点图 |
为了解PD患者双眼竞争交替速率的相关影响因素,将其结果与各项人口学资料和背景测试进行了相关分析。结果显示,PD患者双眼竞争交替速率与年龄、教育年限、Hoehn-Yahr分级、病程、每日左旋多巴等效剂量、MMSE评分、HAMA评分、HAMD评分均无明显相关性(均P>0.05)。
3 讨论双眼竞争作为一种知觉竞争的形式,很多研究从行为学和神经影像学的角度对其进行了深入的研究[7-9]。在这种知觉竞争中,呈现给双眼相互冲突的图像是交替的,而不是重叠的。当呈现在双眼的图像不能融合时,感知每隔几秒钟就会在左眼和右眼图像之间切换一次,如在本研究中,左眼呈现的是绿色放射形光栅,右眼呈现的是红色圆形光栅,两个图像相互切换,诱发感知绿色放射形光栅的几秒钟,紧随其后的是红色圆形光栅的几秒钟[10],在所有情况下,持续的刺激输入都会导致交替的知觉变化。在双稳态知觉中,由于刺激保持不变,自发的感知变化反映了大脑内在的动态操作,可能为揭示脑功能的正常和异常动态特性提供了一个工具[11]。
对于双眼竞争的认知神经机制,目前普遍接受的是Tong等提出的双眼竞争的层级加工混合模型机制[12],即当竞争性模式(如本研究中交替出现的绿色和红色光栅刺激)呈现在双眼时,双眼神经元和模式选择性神经元之间产生相互抑制性作用,从而启动知觉竞争。功能影像学研究提示双稳态知觉竞争中额顶叶是知觉在两个冲突认知对象之间切换的过程中两个较为活跃的区域,额叶可能参与自发的知觉转换过程[13]。额叶网络对与之相关的知觉体验、注意力负荷或任务需求的变化做出反应。
本研究选取32例PD患者作为研究对象,结果发现PD组较健康对照组双眼竞争交替速率显著减慢。目前有研究认为PD患者的认知障碍可能与其额叶和基底节之间多巴胺能环路损伤相关[14],而额叶也是知觉竞争和意识视觉的重要区域[15]。帕金森病及双眼竞争都与额叶功能有着密切的关系,PD患者多巴胺能神经元的变性缺失,纹状体多巴胺的含量显著降低,造成其额叶﹣基底节的多巴胺能神经通路损伤,削弱了其知觉的交替变化,进而导致了PD患者双眼竞争交替速率减慢。
同样,双稳态感知的动态可以通过中枢神经系统兴奋剂来调节,咖啡因增加了感知逆转率,而酒精和戊二酸钠则降低了感知逆转率[16],故本研究中测试开始前4 h内均嘱所有被试者禁止摄入茶、酒精、咖啡等。
脑功能影像学研究表明,双稳态感知的动力学与额叶皮质和大脑皮质等区域相关,且受到多巴胺能药物的影响[17],故推测多巴胺能药物可能影响PD患者双眼竞争的交替速率。本研究选取的PD患者均存在一段时间的正规服药史,且所用药物均为多巴胺能药物,均未服用任何抗胆碱能药物。在今后的研究中,可考虑将PD患者按照是否服用多巴胺能药物进一步进行分组研究。
本研究的样本量相对较少,在今后的研究中有待扩大样本量,同时结合功能磁共振成像、神经电生理、神经生物等技术,进一步探求PD患者双眼竞争的相关神经机制。
利益冲突:所有作者声明不存在利益冲突。
| [1] |
Wilbertz G, van Kemenade BM, Schmack K, et al. fMRI-based decoding of reward effects in binocular rivalry[J]. Neurosci Conscious, 2017, 2017(1): nix013. |
| [2] |
Brascamp JW, Qian CS, Hambrick DZ, et al. Individual differences point to two separate processes involved in the resolution of binocular rivalry[J]. J Vis, 2019, 19(12): 15. DOI:10.1167/19.12.15 |
| [3] |
Weilnhammer VA, Ludwig K, Hesselmann G, et al. Frontoparietal cortex mediates perceptual transitions in bistable perception[J]. J Neurosci, 2013, 33(40): 16009-16015. DOI:10.1523/JNEUROSCI.1418-13.2013 |
| [4] |
中华医学会神经病学分会帕金森病及运动障碍学组. 中国帕金森病的诊断标准(2016版)[J]. 中华神经科杂志, 2016, 49(4): 268-271. DOI:10.3760/cma.j.issn.1006-7876.2016.04.002 |
| [5] |
Tomlinson CL, Stowe R, Patel S, et al. Systematic Review of Levodopa Dose Equivalency Reporting in Parkinson's Disease[J]. Mov Disord, 2010, 25(15): 2649-2653. DOI:10.1002/mds.23429 |
| [6] |
Brainard DH. The Psychophysics Toolbox[J]. Spat Vis, 1997, 10(4): 433-436. DOI:10.1163/156856897X00357 |
| [7] |
Habes I, Rushton S, Johnston SJ, et al. fMRI neurofeedback of higher visual areas and perceptual biases[J]. Neuropsychologia, 2016, 85: 208-215. DOI:10.1016/j.neuropsychologia.2016.03.031 |
| [8] |
Jack BN, Roeber U, O'Shea RP. Do early neural correlates of visual consciousness show the oblique effect? A binocular rivalry and event-related potential study[J]. PloS One, 2017, 12(12): e0188979. DOI:10.1371/journal.pone.0188979 |
| [9] |
Cha O, Blake R. Evidence for neural rhythms embedded within binocular rivalry[J]. Proc Natl Acad Sci U S A, 2019, 116(30): 14811-14812. DOI:10.1073/pnas.1905174116 |
| [10] |
Law PCF, Miller SM, Ngo TT. The effect of stimulus strength on binocular rivalry rate in healthy individuals:Implications for genetic, clinical and individual differences studies[J]. Physiol Behav, 2017, 181: 127-136. DOI:10.1016/j.physbeh.2017.08.023 |
| [11] |
Ye X, Zhu RL, Zhou XQ, et al. Slower and Less Variable Binocular Rivalry Rates in Patients With Bipolar Disorder, OCD, Major Depression, and Schizophrenia[J]. Front Neurosci, 2019, 13: 514. DOI:10.3389/fnins.2019.00514 |
| [12] |
Tong F, Meng M, Blake R. Neural bases of binocular rivalry[J]. Trends Cogn Sci, 2006, 10(11): 502-511. DOI:10.1016/j.tics.2006.09.003 |
| [13] |
Roy AV, Jamison KW, He S, et al. Deactivation in the posterior mid-cingulate cortex reflects perceptual transitions during binocular rivalry:Evidence from simultaneous EEG-fMRI[J]. Neuroimage, 2017, 152: 1-11. DOI:10.1016/j.neuroimage.2017.02.041 |
| [14] |
Meder D, Herz DM, Rowe JB, et al. The role of dopamine in the brain-lessons learned from Parkinson's disease[J]. Neuroimage, 2019, 190: 79-93. DOI:10.1016/j.neuroimage.2018.11.021 |
| [15] |
Frässle S, Sommer J, Jansen A, et al. Binocular Rivalry:Frontal Activity Relates to Introspection and Action But Not to Perception[J]. J Neurosci, 2014, 34(5): 173801747. |
| [16] |
Cao D, Zhuang X, Kang P, et al. Acute Alcohol Drinking Promotes Piecemeal Percepts during Binocular Rivalry[J]. Front Psychol, 2016, 7: 489. |
| [17] |
Sekutowicz M, Schmack K, Steimke R, et al. Striatal activation as a neural link between cognitive and perceptual flexibility[J]. Neuroimage, 2016, 141: 393-398. DOI:10.1016/j.neuroimage.2016.07.046 |
 2019, Vol. 46
2019, Vol. 46




