扩展功能
文章信息
- 董明睿, 叶伟杰, 刘尊敬, 孙青, 王丽, 汪仁斌
- DONG Ming-Rui, YE Wei-Jie, LIU Zun-Jing, SUN Qing, WANG Li, WANG Ren-Bin
- 强直性肌营养不良1型患者的临床特点及CTG重复次数分析
- The clinical characteristics and number of CTG repeats in patients with myotonic dystrophy type 1: An analysis of 3 cases
- 国际神经病学神经外科学杂志, 2019, 46(3): 293-298
- Journal of International Neurology and Neurosurgery, 2019, 46(3): 293-298
-
文章历史
收稿日期: 2019-01-09
修回日期: 2019-05-23
强直性肌营养不良1型(myotonic dystrophy type 1, DMl)是由位于染色体19q13区的强直性肌营养不良蛋白激酶(dystrophia myotonica protein kinase, DMPK)基因3’非翻译区的CTG(cytosine, thymine, guaIline)重复序列异常扩增导致的常染色体显性遗传疾病,主要临床表现为肌强直、进行性四肢远端肌无力、肌萎缩,常合并晶状体浑浊、心脏传导系统异常、胰岛素抵抗、胃肠道功能紊乱、认知功能障碍等多系统损害表现[1-3]。本研究总结3例强直性肌营养不良1型患者的临床、神经电生理和遗传学特点,结合文献进行分析。
1 对象和方法 1.1 研究对象2017年1月至2018年12月间就诊于我院神经科,经基因检测确诊的强直性肌营养不良1型患者共3例,其中男性1例。所有患者签署肌肉活检知情同意书、基因检测知情同意书。
1.2 研究方法 1.2.1 病例收集采集患者的临床症状、神经系统体征、生长发育史、家族史及除骨骼肌外其他器官受累情况(如晶状体)、中枢神经系统、心脏、内分泌系统、生殖系统等。详细收集患者的实验室检验、心电图、肌电图检查结果。
1.2.2 肌肉病理检查采取开放式肌肉活检,取患者肱二头肌或股四头肌肌肉组织0.5 cm×0.5 cm×1 cm。新鲜肌肉组织浸入经液氮冷却的异戊烷速冻后切片,进行苏木素-伊红(HE)、高碘酸Schiff反应(PAS)、油红“O”(ORO)、改良Gomori(MGT)、细胞色素C氧化酶(COX)、琥珀酸脱氢酶(SDH)、还原型辅酶Ⅰ四氮唑还原酶(NADH)和三磷酸腺苷酶(ATPase)染色。
1.2.3 基因检测标准酚-氯仿法从患者外周血提取基因组DNA。重复引物PCR法扩增DMPK基因3’非翻译区后采用荧光毛细管电泳法检测PCR终产物。
2 结果 2.1 病例资料 2.1.1 病例1患者,男,45岁,双手无力、饮水呛咳8年,加重伴双侧眼睑下垂1年。8年前患者搬重物时觉双手无力、持物无力,上肢抬举正常,双手抓握后不能立即张开,日常生活不受影响,饮水稍有呛咳。2年前其妻发现患者双眼不能完全闭合。1年前出现双侧眼睑下垂,双足无力感,足趾背屈无力,下踩可,上下楼梯费力,双眼上视困难,无视物成双,发音欠清,说话带鼻音。自幼生长发育正常,体育成绩可,跑跳可。
既往史:10年前因阵发性室性心动过速行非同步电复律。否认家族遗传病史,育有一子,体健。
查体:前额脱发;反应迟钝;双眼睑下垂,遮挡瞳孔(9-3点位),双眼上视不能,左右注视、下视正常,双眼闭目无力(无露白),鼓腮无力,斧状脸,发音欠清,伸舌居中,屈颈肌力Ⅳ-级,伸颈Ⅴ-级;双上肢肌力近端Ⅴ级,远端Ⅳ级,肌张力大致正常,扣击双侧大鱼际肌及前臂肌群可见肌球。深浅感觉正常、共济运动稳;双侧上肢腱反射对称减弱,双下肢腱反射未引出;双侧Babinski征未引出。
头部MRI:双侧基底节区、放射冠区、半卵圆中心区及双侧额颞叶皮质下多发T2 FLAIR相高信号病灶(图 1A、图 1B)。头MRA:颅内血管未见狭窄。
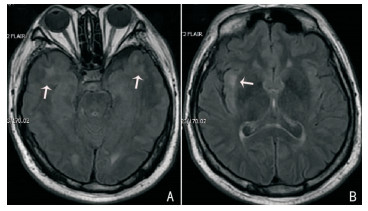
|
| A、B:患者T2-FLAIR相颞极和外囊白质高信号病灶(箭头) 图 1 患者头部MRI所示 |
生化检查:血清肌酸激酶(CK)199 IU/L。重症肌无力相关抗体均阴性。甲状腺功能正常,空腹血糖和糖化血红蛋白正常。
眼科检查未见晶状体浑浊。
肌电图:右侧拇短展肌、肱二头肌、三角肌运动单位电位(MUP)正常范围,均可见肌强直放电。
心电图:窦性心律,左前分支传导阻滞,左心室肥大伴QRS增宽。
2.1.2 病例2患者,女,41岁,双下肢无力8年,双上肢无力3年。患者8年前出现双下肢无力,走路困难,下肢沉重感。3年前出现双上肢无力,双手持物不稳,上臂抬举无力,手握拳后无法立即张开。上述症状进行性加重,上楼梯是需搀扶。自幼生长发育正常,说话自小时起即欠清楚,小学体育成绩可,跑跳可。
家族史:其姊有下肢无力、行走困难症状。见图 2。
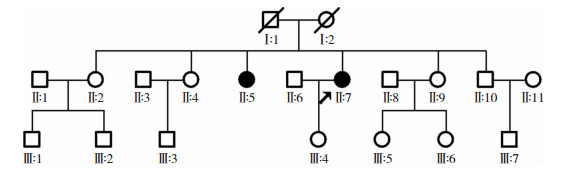
|
| 先证者(Ⅱ:7)之姊(Ⅱ:5)临床表现为双下肢无力、行走困难 图 2 病例2家系图 |
查体:斧状脸,高腭弓,发音欠清,余颅神经未见明显异常;颈肌肌力Ⅲ级,四肢肌肉均萎缩,大腿下1/3及小腿萎缩明显,上肢近端肌力Ⅳ-级,远端Ⅲ级,下肢近端Ⅳ级,远端Ⅲ+级,扣击双侧大鱼际肌可见肌球,四肢腱反射均未引出,双侧Babinski征未引出。
肌电图:左侧胫前肌、股四头肌、髂腰肌、肱二头肌MUP正常范围,可见多相波增多及肌强直样放电。心电图未见异常。头部MRI未见异常。眼科检查无晶状体浑浊。
生化检查:CK 382 IU/L,甲状腺功能正常,空腹血糖和糖化血红蛋白正常。
2.1.3 病例3患者,女,49岁,双下肢无力4年。4年前爬山时觉双侧小腿无力,乘公共汽车时上车困难,走路时易崴脚。不伴上肢无力。1年前下楼梯时摔倒致双侧踝部骨折。自觉4年来下肢无力症状无明显加重。无心慌气短。自幼生长发育正常,跑跳与同龄人无明显差异,20岁左右时曾有握拳后手指张开困难。
家族史:一堂哥(Ⅲ:2)有双下肢无力症状,50岁左右去世;另一堂哥(Ⅲ:9)双小腿无力、走路不稳、有心律失常、心脏骤停史,已植入心脏起搏器。见图 3。

|
| 先证者(Ⅲ:8)堂哥(Ⅲ:2)有双下肢无力症状,50岁左右去世,因不详;另一堂哥(Ⅲ:9)有双小腿无力、走路不稳、心律失常、心脏骤停史,已植入心脏起搏器 图 3 病例3家系图 |
查体:无脱发,理解力、记忆力正常,颅神经未见异常,颈肌肌力Ⅳ级,四肢肌肉无萎缩,双小腿肌肉质硬,双上肢肌力Ⅴ级,双下肢近端肌力Ⅴ级、伸屈膝肌力Ⅴ级、远端肌力Ⅳ级。扣击大鱼际肌可见肌球。四肢腱反射均减低,病理征未引出。
心电图:窦性心律,右束支传导阻滞。
肌电图:右侧拇短展肌、肱二头肌、三角肌MUP正常范围,均可见肌强直放电。
生化检查:CK 357 IU/L,甲状腺功能正常,空腹血糖及糖化血红蛋白正常,雌二醇、睾酮、卵泡刺激素、促黄体生成素、催乳素均在正常范围。眼科检查无晶状体浑浊。
头部MRI:双侧侧脑室前后角T2 FLAIR相呈高信号。见图 4。

|
| T2-FLAIR相侧脑室前后脚白质高信号(箭头) 图 4 病例3头部MRI所示 |
HE染色可见程度不等的肌束衣、肌内衣结缔组织增生,肌纤维大小不等,大量核内移。PAS染色中肌细胞内糖原无增多;ORO染色肌细胞内脂滴无增多;MGT染色无典型破碎红纤维和镶边空泡;NADH-TR染色未见轴空样改变及靶样纤维;SDH酶活性分布正常,无COX阴性肌纤维;ATPase染色Ⅰ型和Ⅱ型肌纤维基本呈棋盘格样分布,无肌纤维群组化现象。
2.3 基因检测结果病例1、病例2、病例3的DMPK基因3’非翻译区的CTG重复序列异常扩增次数分别为104、150、299,均大于50次。见图 5A-图 5C。

|
| A-C:病例1、病例2、病例3的DMPK基因3’非翻译区CTG异常扩增次数分别为104、150、299 图 5 荧光毛细管电泳图 |
正常人群中DMPK基因3’非翻译区的CTG重复次数在5~37之间,重复次数在38~50之间为前突变,重复超过50次即可导致DMl发病。当CTG拷贝数大于37时,该重复序列就会变得不稳定,容易在有丝分裂或减数分裂中扩增,使前突变者或DMl患者的子女含有更大的CTG拷贝数,导致发病年龄更早,临床表现更重[1, 2]。本病为常染色体显性遗传,本研究中例2、例3有家族史,其兄弟或姊妹出现与患者类似的临床症状,两家系先证者父母均无DM1临床表现,考虑其亲代的CTG重复次数可能在前突变区间。
毒性RNA的功能增益机制是DM1的主要分子发病机制[1, 2]。DMPK基因3’非翻译区的突变CTG重复序列转录出的非编码RNA(CUG重复序列)可以形成类茎环状二级结构并与一些RNA选择性剪切因子如肌盲样蛋白(MBNL)、ETR-3样因子(CELF)结合,导致这些蛋白功能紊乱。肌盲样蛋白和ETR-3样因子参与多种RNA加工步骤,包括选择性剪接、选择性分裂和多聚腺苷酸化、mRNA定位、mRNA翻译和microRNA生物合成,其功能紊乱最终导致在成人组织中表达胚胎亚型的蛋白质[1, 3, 4]。在毒性RNA作用下,一些蛋白质转录延迟、蛋白缺失和功能障碍,其中电压门控氯离子通道1(CLCNl)与肌强直相关;桥接整合因子1(BINl)与肌细胞T小管结构形成障碍、肌无力相关;电压门控钙通道亚基α1参与兴奋收缩偶联与肌无力相关;电压门控钠通道α亚单位(SCN5A)与心律失常和心脏传导延迟相关,除此之外肌营养不良蛋白、丙酮酸激酶M、肌盲样剪切调节因子1/2均参与了DM1的发病[1-4]。
DM1具有CTG重复次数越多发病年龄越早的趋势,CTG重复次数>1 000者临床表现为先天型DM1,CTG重复次数在50到1 000者临床表现为经典型DM1[1, 2]。经典型DM1为青中年隐袭起病,与大多数肌病近端肌群受累重的特点不同,DMl肌强直、肌无力症状先累及肢体远端肌肉,随病程进展逐步蔓延至近端,这提示胫前肌等远端肌群对CUG重复序列介导的毒性作用的特殊敏感性[5]。本研究的3例患者分别于37、33和45岁隐袭起病,以四肢远端无力(双手持物无力、双足无力或小腿无力)、肌强直为主要临床表现,符合本病特点。眼外肌、面肌也是DM1常见的受累肌群,面肌萎缩患者面部瘦长,呈斧型脸,是DM1的特征性体征之一,例1和2均有面部肌肉无力、斧状脸。钠离子介导的肌强直性肌病常可观察到寒冷气候下肌强直症状加重现象;而氯离子介导的肌强直性肌病如DM1肌强直程度不受寒冷气候的影响[1]。3例患者均有肌强直症状,扣击大鱼际肌和前臂肌群可以引出肌球(叩诊性肌强直,percussion myotonia)。例3在20岁左右时有抓握后肌强直(grip myotonia)现象,来我院就诊时并未出现。3例患者的针极肌电图检查所检肌肉均可见强直性放电,其中包括临床无明显肌无力症状的近端肌肉。可见电生理检查可以发现无临床肌强直症状的DM1患者的肌强直放电,是肌强直最敏感的检出方法,电生理检出肌强直放电的范围较临床表现更广泛[6]。随着CTG重复次数的增加,临床肌强直的发生率和肌强直放电的检出率均有所升高。与病例1、病例2相比较,病例3的临床症状较轻,仅表现为下肢远端无力、无肌肉萎缩、不伴面肌和眼外肌受累,没有DM1患者常见的“斧状脸”面容,且就诊时患者无抓握后肌强直,临床症状与远端型肌营养不良或遗传性远端型肌病类似。一项对144例DM1患者的研究显示,CTG重复长度与肌强直和握力均相关[7]。但一些小样本量的研究不能得出这样的结论。本文中病例1和病例3的CTG重复次数分别为104和299次,但前者肌无力和肌强直程度均较后者重,且中枢神经系统损害、前额脱发及心脏传导系统受累更为显著。因此,从个体水平不能根据CTG重复长度推测患者的肌无力和肌强直严重程度。对于携带相似CTG重复长度的患者,男性比女性有更严重的临床症状[7],本研究中男性症状亦重于女性,导致这种现象的原因仍不清楚。CTG重复序列在不同的组织呈现的体细胞异质性,如肌肉组织细胞中CTG重复次数可能比白细胞中更多,而且随着疾病的进展,CTG重复次数也可能有所增加,因此,根据一次基因检测结果估计的CTG长度存在其局限性。
除肌强直、肌无力外,DM1可合并白内障、心脏传导异常、中枢神经系统损害、内分泌等多系统损害。超过一半的DM1患者存在认知功能受损,主要表现在注意力、工作记忆、执行功能、处理速度和视觉空间能力方面的受损[8]。通过MRI检查发现脑白质病变、FLAIR相白质高信号病灶是DM1患者常见的形态学改变,病灶主要位于额颞叶尤其是颞前区。与对照组相比,DM1患者额叶、颞叶和枕叶的皮质厚度明显降低,提示灰质亦受累[9]。脑室扩大、弥漫性皮质萎缩、灰质体积减少、不同脑叶皮质、海马和基底节的局灶性脑萎缩均可见于DM1患者,成年起病者更倾向于皮质和皮质下灰质对称性萎缩,关于脑萎缩程度与病程、肌肉病变程度及CTG重复次数是否具有相关性,不同的研究并未得出一致的结论[10]。目前还缺乏关于灰质萎缩发生发展的大队列纵向影像学研究。
病例1临床有反应迟钝、记忆力减退症状,头部MRI的T2、T2-FLIRA相可见片状颞极、颞叶内侧白质病灶以及侧脑室前后角白质病变,MRA脑血管检查未见颅内血管狭窄,因此,可以认为其白质病变为强直性肌营养不良相关的中枢神经系统损害;病例3虽然临床无认知功能障碍,但头部MRI亦可见片状侧脑室前后角白质病变。因此,可能中枢神经系统白质病变在DM1患者并不少见。
心律失常、传导系统紊乱、心肌纤维化、收缩和舒张功能受损是最常见的心脏病变,DM1患者的CTG重复长度与左室舒张功能、心律失常、PR和QRS延长显著相关[11, 12]。本研究中,病例1存在阵发性室性心动过速、左前分支传导阻滞、左心室肥大伴QRS增宽等多种心脏传导异常,病例3存在右束支传导阻滞,且其堂哥因心脏骤停植入心脏起搏器,提示心脏传导系统紊乱在DM1患者中较常见。约38%~80%的DM1病例发生心脏受累,成人DM1患者约30%的死亡率是由心脏受累引起的,其心源性猝死的风险是健康同龄人的三倍以上[11, 12],因此,早期评价心脏结构和功能的变化、采取干预性治疗以减少心源性猝死对DM1患者具有重要意义。心肌纤维化是导致不连续和不均匀窦性脉冲和心房传导时间的延长、出现各种室性和房性心律失常的解剖病理学基础[13]。通过心脏磁共振可评估心肌纤维化,应用连续动态心电图监测可提高心律失常的检出率,采用三维斑点追踪超声心动图(3D-STE)可以确定左心房的早期变化[11],这些检查手段都是早期发现和评估DM1患者心肌受累程度的有力工具,同时,应尽早采取植入起搏器或药物干预等治疗手段。
白内障是常见的DM1临床表现之一,其出现可以早于肌肉症状,白内障的严重程度与CTG扩增数目的多少并无相关性[14]。本研究3例患者均未检出晶状体浑浊。
总结3例DM1患者的临床表现,病例1、病例2具有DM1肌肉受累的特征性分布特点,即四肢远端萎缩无力伴随面肌和眼外肌无力、出现“斧状脸”,肌强直症状突出;病例3仅表现为下肢远端轻度无力,其肌强直需在叩诊后才能出现。电生理检查可以发现临床下肌强直放电,是最敏感的筛查手段。心脏传导紊乱和脑白质病变是DM1多系统受累的显著表现,心律失常、传导系统紊乱可导致DM1患者心源性猝死,临床上应关注心肌受累程度的评估并早期干预治疗。
基于DM1的分子发病机制,剪接异常的逆转是本病治疗的焦点,包括小分子治疗、反义寡核苷酸(ASO)疗法、以扩增DNA/RNA及下游信号通路为靶点的基因编辑等治疗策略均在研究之中[15-17]。
| [1] |
Thomas JD, Oliveira R, Sznajder LJ, et al. Myotonic Dystrophy and Developmental Regulation of RNA Processing[J]. Compr Physiol, 2018, 8(2): 509-553. |
| [2] |
李默怡, 庄燕, 谢维. 强直性肌营养不良发病机制中的RNA功能增益及其临床治疗研究进展[J]. 中华神经科杂志, 2015, 48(11): 1020-1022. DOI:10.3760/cma.j.issn.1006-7876.2015.11.021 |
| [3] |
Wang ET, Treacy D, Eichinger K, et al. Transcriptome alterations in myotonic dystrophy skeletal muscle and heart[J]. Hum Mol Genet, 2019, 28(8): 1312-1321. DOI:10.1093/hmg/ddy432 |
| [4] |
Thomas JD, Sznajder LJ, Bardhi O, et al. Disrupted prenatal RNA processing and myogenesis in congenital myotonic dystrophy[J]. Genes Dev, 2017, 31(11): 1122-1133. DOI:10.1101/gad.300590.117 |
| [5] |
André LM, Ausems CRM, Wansink DG, et al. Abnormalities in Skeletal Muscle Myogenesis, Growth, and Regeneration in Myotonic Dystrophy[J]. Front Neurol, 2018, 9: 368. DOI:10.3389/fneur.2018.00368 |
| [6] |
李懋, 王占军, 崔芳, 等. 强直性肌营养不良1型患者的电生理特点[J]. 中华医学杂志, 2013, 93(5): 245-347. |
| [7] |
Hogrel JY, Ollivier G, Ledoux I, et al. Relationships between grip strength, myotonia, and CTG expansion in myotonic dystrophy type 1[J]. Ann Clin Transl Neurol, 2017, 4(12): 921-925. DOI:10.1002/acn3.2017.4.issue-12 |
| [8] |
Fujino H, Shingaki H, Suwazono S, et al. Cognitive impairment and quality of life in patients with myotonic dystrophy type 1[J]. Muscle Nerve, 2018, 57(5): 742-748. DOI:10.1002/mus.v57.5 |
| [9] |
Yoo WK, Park YG, Choi YC, et al. Cortical Thickness and White Matter Integrity are Associated with CTG Expansion Size in Myotonic Dystrophy Type Ⅰ[J]. Yonsei Med J, 2017, 58(4): 807-815. DOI:10.3349/ymj.2017.58.4.807 |
| [10] |
Minnerop M, Gliem C, Kornblum C. Current Progress in CNS Imaging of Myotonic Dystrophy[J]. Front Neurol, 2018, 9: 646. DOI:10.3389/fneur.2018.00646 |
| [11] |
Guedes H, Moreno N, Dos Santos RP, et al. Importance of three-dimensional speckle tracking in the assessment of left atrial and ventricular dysfunction in patients with myotonic dystrophy type 1[J]. Rev Port Cardiol, 2018, 37(4): 333-338. DOI:10.1016/j.repc.2017.10.011 |
| [12] |
Park JS, Kim N, Park D. Diastolic heart dysfunction is correlated with CTG repeat length in myotonic dystrophy type 1[J]. Neurol Sci, 2018, 39(11): 1935-1943. DOI:10.1007/s10072-018-3530-z |
| [13] |
Rago A, Antonio Papa A, Galante D, et al. Usefulness of the external loop recorder in a patient with Myotonic Dystrophy type 1 and recurrent episodes of palpitations:evaluation of the follow-up from diagnosis to 6 month-post-cardiac interventional treatment[J]. Acta Myol, 2018, 37(1): 5-8. |
| [14] |
阎雪晶, 欧阳嶷, 何志义, 等. 强直性肌营养不良1型患者的眼部症状分析[J]. 中国医科大学学报, 2016, 45(2): 97-100. |
| [15] |
LoRusso S, Weiner B, Arnold WD. Myotonic Dystrophies:Targeting Therapies for Multisystem Disease[J]. Neurotherapeutics, 2018, 15(4): 872-884. DOI:10.1007/s13311-018-00679-z |
| [16] |
van Agtmaal EL, André LM, Willemse M, et al. CRISPR/Cas9-Induced (CTG·CAG)n Repeat Instability in the Myotonic Dystrophy Type 1 Locus:Implications for Therapeutic Genome Editing[J]. Mol Ther, 2017, 25(1): 24-43. DOI:10.1016/j.ymthe.2016.10.014 |
| [17] |
Thornton CA, Wang E, Carrell EM. Myotonic dystrophy:approach to therapy[J]. Curr Opin Genet Dev, 2017, 44: 135-140. DOI:10.1016/j.gde.2017.03.007 |
 2019, Vol. 46
2019, Vol. 46




