扩展功能
文章信息
- 谢时帅, 牛万祥, 徐峰, 胡珊珊, 牛朝诗
- XIE Shi-shuai, NIU Wan-xiang, XU Feng, HU Shan-shan, NIU Chao-shi
- miR-15b对MPP+损伤SH-SY5Y细胞中α突触核蛋白表达的影响
- Effect of microRNA-15b on the expression of α-synuclein in SH-SY5Y cells with 1-methyl-4-phenylpyridinium-induced injury
- 国际神经病学神经外科学杂志, 2018, 45(6): 591-596
- Journal of International Neurology and Neurosurgery, 2018, 45(6): 591-596
-
文章历史
收稿日期: 2018-09-14
修回日期: 2018-11-13
2. 脑功能与脑疾病安徽省重点实验室, 安徽 合肥 230001;
3. 安徽省脑立体定向神经外科研究所, 安徽 合肥 230001;
4. 安徽省神经系统疾病(神经外科)临床研究中心, 安徽 合肥 230001
帕金森病(Parkinson disease,PD)是一种常见的神经系统变性疾病,该病最主要的病理改变是中脑黑质多巴胺(dopamine,DA)能神经元的变性死亡,继而引起纹状体DA含量显著减少以及黑质残存神经元胞质内出现以α突触核蛋白(α-synuclein)为主要成分的路易小体(Lewy body)[1]。据统计,PD全人群患病率约为0.3%,我国65岁以上老年人群患病率为1700/10万[2-3]。目前帕金森病的发病机制仍不清楚,临床上治愈十分困难[4]。有研究发现miR-15b的表达异常与帕金森病的发病可能相关[5-6]。因此,本研究通过MPP+诱导SH-SY5Y细胞为PD细胞模型,探讨miR-15b在帕金森病发病中的作用及其致病机制。
1 材料和方法 1.1 细胞系与实验材料人骨髓神经母细胞瘤细胞株SH-SY5Y获赠于大连医科大学基础医学院。胎牛血清FBS(乌拉圭Lonsera公司),DMEM(美国HyClone公司),RIPA裂解液、胰酶消化液、5×蛋白上样缓冲液(上海碧云天生物技术有限公司),BCA试剂盒(上海雅酶生物科技有限公司),化学发光显影液(美国MILLIPORE公司),兔多克隆抗体α-synuclein(武汉爱博泰克生物科技有限公司),小鼠抗β-actin单抗、辣根酶标记山羊抗小鼠IgG和辣根酶标记山羊抗兔IgG(北京中杉金桥生物技术有限公司),RNA提取试剂盒(德国QIAGEN公司),逆转录试剂盒、RT-PCR的酶和ROX Reference Dye Ⅱ(北京全式金生物技术有限公司),蛋白酶抑制剂和miRNA的RT引物、上游引物及下游引物(上海生工生物工程股份有限公司),1-甲基-4-苯基-吡啶离子MPP+(美国Sigma公司),CCK-8(日本同仁公司),Lipofectamine 2000(美国Invitrogen公司),Opti-MEM培养基(美国Gibco公司)。
1.2 实验方法 1.2.1 细胞培养将SH-SY5Y细胞复苏后,用含10% FBS的DMEM培养基于37℃、5% CO2条件下培养。
1.2.2 诱导SH-SY5Y细胞为PD细胞模型 1.2.2.1 MPP+诱导SH-SY5Y细胞损伤将SH-SY5Y细胞接种在6孔板内,待细胞生长至60%~70%时分别加入不同浓度(0 mM、0.25 mM、0.5 mM、1 mM、2 mM,1 mM=1 mol/ml)MPP+的培养基培养24 h,取出6孔板,在光学显微镜下观察SH-SY5Y细胞的数目和形态变化。
1.2.2.2 CCK-8检测MPP+对SH-SY5Y细胞的损伤将SH-SY5Y细胞消化、重悬后调整为1×105/ml,分别接种在3个96孔板中培养,每孔100 μl,每个96孔板设置5组,每组3个复孔,放于培养箱中培养。12 h后,吸去孔内液体,每个96孔板的各组分别加入含不同浓度MPP+(0 mM、0.25 mM、0.5 mM、1 mM、2 mM)的培养基。3个96孔板依次培养12 h、24 h、48 h后吸去孔内培养基,将CCK-8和培养基按照1 : 10的比例混合均匀,各孔加入100 μl的CCK-8和培养基的混合液,于培养箱中孵育2 h。然后,在酶标仪上测定在450 nm下各孔的吸光度。
1.2.3 构建过表达和沉默miR-15b质粒用miR-15b的DNA为模板,设计好需要扩增片段的上下游引物后,按照PCR操作步骤进行反应进行扩增重组片段,将PCR产物进行凝胶电泳,并回收PCR胶。选择用Bgl II和BamHI双酶切pEGFP-C1的质粒作为载体片段,将重组片段和载体片段在PCR仪上进行重组。将5 μl的重组产物加入到50 μl的DH5 α感受细胞中,混匀,置冰上30 min,而后放于42 ℃水浴锅中1 min,然后再置于冰上2 min,加入500 μl LB培养基,轻轻混匀,在37 ℃摇床中150 rpm摇45 min。取100 μl上述转化产物涂在含卡那霉素的LB平板上,37 ℃培养箱内过夜,挑出单克隆菌落,在LB培养基中摇菌24 h,而后从菌落中抽提出目的质粒。
1.2.4 重组质粒转染PD细胞模型将SH-SY5Y细胞消化、重悬后接种在6孔板内,用0.5 mM的MPP+诱导24 h后成为PD细胞模型,待细胞生长至70%左右时进行转染。分别设置对照组、miR-15b过表达组和miR-15b沉默组,每组3个复孔。转染前30 min吸尽各孔培养基,加入不含双抗的培养基0.5 ml。每孔按照如下比例配制A液和B液,A液:1 μl的Lipofectamine 2000与60 μl的Opti-MEM培养基混匀,静置5 min;B液:1 μg的质粒与60 μl的Opti-MEM培养基混匀。将A液和B液混均后静置20 min,每孔滴入混合液120 μl,12 h后换液。待转染24 h后于倒置荧光显微镜下观察转染效果。
1.2.5 Real Time-PCR检测各组mRNA表达分别收集对照组、miR-15b过表达组和miR-15b沉默组细胞,按照QIAGEN公司RNA提取试剂盒步骤提取细胞内总RNA。取2 μl的RNA与0.5 μl的miR-15b的RT引物混合后于70 ℃水浴5 min,迅速置于冰上,按照逆转录试剂盒操作步骤,将RNA逆转录成cDNA。之后进行Real-time PCR反应,步骤为:预变性(95 ℃,30 s)、变性(95 ℃,5 s)、退火延伸(60 ℃,34 s),40个循环。每个样本设置3个复孔,重复3次。记录下CT值,计算△△CT,用公式2^-△△Ct算出miR-15b及α-synuclein的相对表达量。miR-15b的上游引物:
5’-CACGCATAGCAGCACATC-3’,下游引物:
5’-CCAGTGCAGGGTCCGAGGTA-3’,RT引物:
5’-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACT
GGATACGACtgtaaa-3’;α-synuclein的上游引物:
5’-AGTTAGGGCTGCTGCTGAGA-3’,下游引物:
5’-TCTCAGCCACTGTTGCCACA-3’;内参GAPDH的上游引物:5’-CTTCATTGACCTCAACTACATGG-3’,下游引物:5’-CTCGCTCCTGGAAGATG-GTGAT-3’。
1.2.6 Western Blot检测α突触核蛋白表达分别收集对照组、miR-15b过表达组和miR-15b沉默组细胞,用含蛋白酶抑制剂的RIPA裂解液处理各样本,并用BCA法测定各样本蛋白浓度,加入5×蛋白上样缓冲液,于100 ℃水浴10 min。计算30 μg的蛋白样本量进行上样,经SDS-PAGE电泳分离后转至PVDF膜上,用5%脱脂牛奶室温封闭2 h。洗膜(TBST清洗3遍,每次10 min),在一抗(兔多克隆抗体α-synuclein,1 : 1 000稀释)中4 ℃孵育过夜,洗膜,二抗(辣根酶标记山羊抗兔IgG,1 : 5 000稀释)中室温孵育2 h,洗膜,取出PVDF膜,滴加显影液后于化学发光成像仪上成像。运用Image J分析软件对蛋白电泳条带灰度值进行定量分析。
1.3 统计学分析采用GraphPad Prism 6和SPSS16.0统计学软件进行分析处理,计量资料用x±s表示,两组间的均数比较采用t检验,多组间的均数比较采用one-way ANOVA (单因素方差分析),以P<0.05为差异有统计学意义。
2 结果 2.1 经MPP+诱导24 h后SH-SY5Y细胞数目和形态发生了变化不同浓度条件下MPP+诱导SH-SY5Y细胞24 h后,随着诱导浓度的增加,细胞数目逐渐减少,细胞形态由原来的不规则的多突触形状变成了突触较少的长杆状(图 1)。说明MPP+成功诱导了SH-SY5Y细胞损伤,且随着诱导浓度增加,损伤程度逐渐加重,即认为成功构建了PD细胞模型。

|
| 图 1 同浓度MPP+诱导SH-SY5Y细胞24 h后细胞数目和形态变化(×160) MPP+浓度:A:0 mM;B:0.25 mM;C:0.5 mM;D:1 mM;E:2 mM |
CCK-8结果显示(图 2),随着时间的延长,SH-SY5Y细胞经MPP+诱导后细胞活性逐渐降低;在相同时间点,随着MPP+诱导浓度的升高,SH-SY5Y细胞活性也逐渐降低。与对照组(0 mM MPP+)比较,0.25 mM MPP+处理组的F=0.940、P=0.441>0.05,差异无统计学意义;0.5 mM、1 mM、2 mM MPP+处理组的F值分别为26.896、132.727、151.283,P值分别为0.001、0.000、0.000,P值均小于0.05,差异有统计学意义(表 1)。可以发现MPP+浓度在0.5 mM时诱导24 h的SH-SY5Y细胞生长良好、生物学活性在80%左右,此诱导条件下的SH-SY5Y细胞可作为PD细胞模型进行下一步研究。
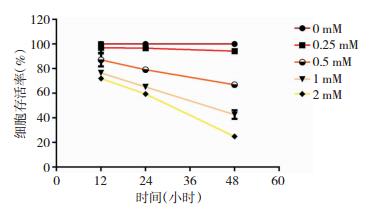
|
| 图 2 不同浓度MPP+诱导后,SH-SY5Y细胞在不同时间点的细胞存活率 |
| MPP+浓度/时间 | 12H | 24H | 48H | F值 | P值 |
| 0.25 mM | 97.050±4.308 | 96.675±1.788 | 94.218±0.947 | F=0.940 | P=0.441 |
| 0.5 mM | 87.122±5.374 | 79.102±0.990 | 66.958±2.151 | F=26.896 | P=0.001 |
| 1 mM | 76.516±2.271 | 65.113±1.462 | 42.682±3.577 | F=132.727 | P=0.000 |
| 2 mM | 72.065±4.951 | 59.480±1.750 | 24.871±2.820 | F=151.283 | P=0.000 |
| F值 | F=29.270 | F=528.453 | F=597.747 | ||
| P值 | P=0.000 | P=0.000 | P=0.000 |
选择用Bgl II和BamHI双酶切pEGFP-C1的质粒作为载体(图 3),将miR-15b过表达和沉默的基因片段进行重组,重组质粒中含有表达抗卡那霉素的基因。在含卡那霉素的LB平板上培养菌落后,普通菌落不能繁殖,目的菌落可大量繁殖。而后挑出单克隆菌落并摇菌繁殖后抽提出目的质粒进行下一步实验。
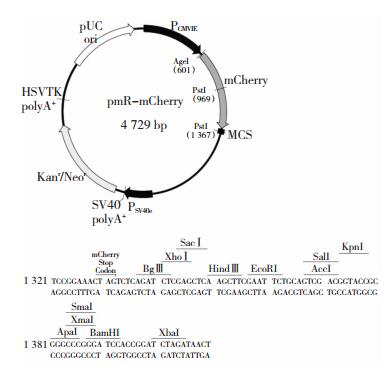
|
| 图 3 重组质粒载体示意图 |
将质粒转染到PD细胞模型24 h后,分别在普通光学显微镜和荧光显微镜下观察细胞(图 4),可在光镜下见到生长状态良好的细胞,在荧光下见到质粒转染后红色标记的细胞,说明转染成功。
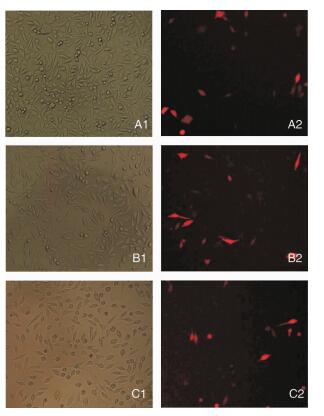
|
| 图 4 质粒转染PD细胞模型(×160) A1:普通光镜下对照组PD细胞;A2:荧光镜下对照组PD细胞;B1:普通光镜下过表达组PD细胞;B2:荧光镜下过表达组PD细胞;C1:普通光镜下沉默组PD细胞;C2:荧光镜下沉默组PD细胞 |
Real Time-PCR结果显示(图 5),miR-15b的相对表达量在对照组为1.026±0.037,在过表达组为19.56±0.569,在沉默组为0.082±0.007;可见转染后过表达组miR-15b表达量上升,沉默组miR-15b表达量下降。α-synuclein的相对表达量在对照组为1.005±0.064,在过表达组为0.266±0.022,在沉默组为5.699±0.254;可见转染后过表达组α-synuclein的相对表达量降低,沉默组α-synuclein的相对表达量升高。
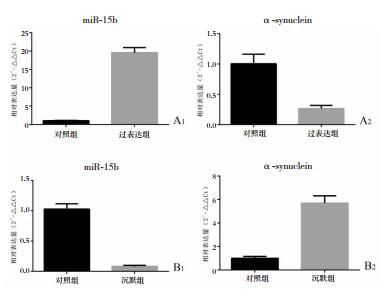
|
| 图 5 质粒转染后PD细胞模型内miR-15b及α-synuclein表达量变化 A1:过表达组miR-15b的相对表达量(F=241.5,P<0.05);A2:过表达组α-synuclein的相对表达量(F=8.812,P<0.05);B1:沉默组miR-15b的相对表达量(F=28.63,P<0.05);B2:沉默组α-synuclein的相对表达量(F=15.70,P<0.05) |
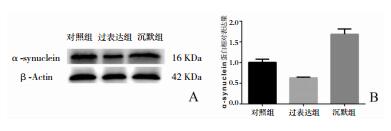
Western Blot检测结果显示(图 6),α突触核蛋白表达的特异性条带在16KDa位置上,通过计算灰度值,对照组α突触核蛋白的相对表达量为1.007±0.038,过表达组为0.632±0.009(F=17.31,P<0.05),沉默组为1.687±0.064(F=2.857,P<0.05),可见过表达组α突触核蛋白表达降低,沉默组α突触核蛋白表达升高。
|
| 图 6 质粒转染后PD细胞模型内α突触核蛋白表达量变化 A:Western Blot条带;B:定量比较结果 |
帕金森病是神经系统常见的退行性疾病之一,其发病与遗传、环境、免疫异常等多种因素相关,但是其确切的发病机制仍不清楚[7-9]。目前比较一致的观点是认为中脑黑质多巴胺能神经元变性死亡导致该病,而α突触核蛋白的异常积聚是损伤多巴胺能神经元的关键因素[10]。该蛋白可通过LAG3蛋白介导的途径进入细胞内[11],研究发现帕金森病患者脑脊液中的α突触核蛋白可通过外泌体转运到外周血中,并且血浆外泌体内的α突触核蛋白水平与帕金森病严重程度密切相关[12]。可见α突触核蛋白在帕金森病的发病中起着关键作用,是导致该病的主要蛋白之一。
SH-SY5Y细胞是人神经母细胞瘤细胞,具有表达儿茶酚胺能神经元特有的酪氨酸羟化酶、多巴胺2B2羟化酶和多巴胺转运体的能力,被广泛运用于帕金森病发病机制的研究[13, 14]。1-甲基-4-苯基-吡啶离子MPP+具有神经毒性,可诱导SH-SY5Y细胞构建成PD细胞模型[15], 故本实验选取该细胞模型进行帕金森病体外细胞学功能研究。
研究显示,miR-15b在帕金森病患者和健康对照者之间差异表达。Ding等[5]对106例帕金森病患者和91例正常对照者血清中miRNAs进行检测,发现帕金森病患者血清中miR-15b的表达量较对照者显著降低,经受试者工作特征曲线分析发现,miR-15b可作为帕金森病诊断的生物学指标。而简雯[6]的研究显示帕金森病患者血浆外泌体内miR-15b的表达量较健康对照者升高,这与Ding的研究结果不一致,可能与样本数过少和样本来源不同有关。Chen等[16]用MPP+诱导SH-SY5Y细胞后进行实验,发现SNHG1可通过miR-15b / SIAH1轴调控α突触核蛋白的表达。这些都表明miR-15b与帕金森病显著相关。
本实验用MPP+诱导SH-SY5Y细胞成为PD细胞模型,再将过表达和沉默miR-15b的质粒转染到PD细胞模型内。若过表达miR-15b后α-synuclein和α突触核蛋白表达升高,或者沉默miR-15b后α-synuclein和α突触核蛋白表达降低,则说明miR-15b可促进α突触核蛋白表达;若过表达或沉默miR-15b后α-synuclein和α突触核蛋白的表达无明显变化,则说明miR-15b不参与调控α突触核蛋白的表达。而本实验结果显示,过表达miR-15b后α-synuclein和α突触核蛋白的表达量都降低,沉默miR-15b后α-synuclein和α突触核蛋白的表达量都升高;这提示miR-15b可以抑制α突触核蛋白的表达。
综上所述,本研究发现miR-15b可以抑制α-synuclein的mRNA和α突触核蛋白的表达,表明miR-15b可能参与了帕金森病患者中脑黑质多巴胺能神经元内α突触核蛋白的富集调节机制,在帕金森病的发生发展中具有关键作用,这也为通过分子靶向疗法治疗帕金森病提供了新的思路。
| [1] |
Recasens A, Dehay B, Bové J, et al. Lewy body extracts from Parkinson disease brains trigger α-synuclein pathology and neurodegeneration in mice and monkeys[J]. Ann Neurol, 2014, 75(3): 351-362. DOI:10.1002/ana.24066 |
| [2] |
Yang F, Johansson AL, Pedersen NL, et al. Socioeconomic status in relation to Parkinson's disease risk and mortality:A population-based prospective study[J]. Medicine(Baltimore), 2016, 95(30): e4337. |
| [3] |
Chuang CS, Su HL, Lin CL, et al. Risk of Parkinson disease after organophosphate or carbamate poisoning[J]. Acta Neurol Scand, 2017, 136(2): 129-137. DOI:10.1111/ane.2017.136.issue-2 |
| [4] |
黄星星, 韩彦青, 马久红, 等. 脑深部电刺激治疗对帕金森病患者认知功能、抑郁和焦虑的影响[J]. 国际神经病学神经外科学杂志, 2018, 45(3): 261-265. |
| [5] |
Ding H, Huang Z, Chen M, et al. Identification of a panel of five serum miRNAs as a biomarker for Parkinson's disease[J]. Parkinsonism Relat Disord, 2016, 22: 68-73. DOI:10.1016/j.parkreldis.2015.11.014 |
| [6] |
简雯.帕金森病患者血浆外泌体的分离鉴定及miRNA表达谱分析[D].南昌: 南昌大学, 2016: 1-33. http://d.g.wanfangdata.com.cn/Thesis_D01016748.aspx
|
| [7] |
Goldman SM. Environmental toxins and Parkinson's disease[J]. Annu Rev Pharmacol Toxicol, 2014, 54: 141-164. DOI:10.1146/annurev-pharmtox-011613-135937 |
| [8] |
Kalia LV, Lang AE. Parkinson's disease[J]. Lancet, 2015, 386(9996): 896-912. DOI:10.1016/S0140-6736(14)61393-3 |
| [9] |
梁建庆. 帕金森病的发病机制、诊断标准及治疗策略[J]. 解放军医学杂志, 2018, 43(3): 631-635. |
| [10] |
Aldakheel A, Kalia LV, Lang AE. Pathogenesis-targeted, disease-modifying therapies in Parkinson disease[J]. Neurotherapeutics, 2014, 11(1): 6-23. DOI:10.1007/s13311-013-0218-1 |
| [11] |
Wood H. Parkinson disease:LAG3 facilitates cell-to-cell spread of α-synuclein pathology[J]. Nat Rev Neurol, 2016, 12(12): 678. |
| [12] |
Shi M, Liu C, Cook TJ, et al. Plasma exosomal α-synuclein is likely CNS-derived and increased in Parkinson's disease[J]. Acta Neuropathol, 2014, 128(5): 639-650. DOI:10.1007/s00401-014-1314-y |
| [13] |
Zilocchi M, Finzi G, Lualdi M, et al. Mitochondrial alterations in Parkinson's disease human samples and cellular models[J]. Neurochem Int, 2018, 118: 61-72. DOI:10.1016/j.neuint.2018.04.013 |
| [14] |
Xicoy H, Wieringa B, Martens GJ. The SH-SY5Y cell line in Parkinson's disease research:a systematic review[J]. Mol Neurodegener, 2017, 12(1): 10. DOI:10.1186/s13024-017-0149-0 |
| [15] |
Xie H, Hu H, Chang M, et al. Identification of chaperones in a MPP-induced and ATRA/TPA-differentiated SH-SY5Y cell PD model[J]. Am J Transl Res, 2016, 8(12): 5659-5671. |
| [16] |
Chen Y, Lian YJ, Ma YQ, et al. LncRNA SNHG1 promotes α-synuclein aggregation and toxicity by targeting miR-15b-5p to activate SIAH1 in human neuroblastoma SH-SY5Y cells[J]. Neurotoxicology, 2018, 68: 212-221. DOI:10.1016/j.neuro.2017.12.001 |
 2018, Vol. 45
2018, Vol. 45




