扩展功能
文章信息
- 黄冠又, 杜永贵, 李小虎, 廖建华, 黎莉, 曹楚南, 张欣, 甘鸿川
- HUANG Guan-you, DU Yong-gui, LI Xiao-hu, LIAO Jian-hua, LI Li, CAO Chu-nan, ZHANG Xin, GAN Hong-chuan
- MGMT、Caspase-3蛋白在胶质瘤中的表达及预后分析
- MGMT and caspase-3 expression and their role in the survival prognosis of glioma patients
- 国际神经病学神经外科学杂志, 2018, 45(4): 370-374
- Journal of International Neurology and Neurosurgery, 2018, 45(4): 370-374
-
文章历史
收稿日期: 2018-03-08
修回日期: 2018-07-16
2. 贵阳市第二人民医院病理科, 贵州 贵阳 550081
2. Department of Pathology, the Second People's Hospital of Guiyang, Guizhou Guiyang 550081, China
胶质瘤是最常见的原发性颅内肿瘤,约占31%[1],多表现为恶性生物学行为,尤其是病理分级为WHO Ⅲ级和Ⅳ级的恶性胶质瘤,患者预后普遍较差。O6-甲基鸟嘌呤DNA甲基转移酶(O6-methylguanine-DNA methyltransferase, MGMT)是一种重要的DNA损伤修复酶,在DNA损伤修复中起重要作用,其表达增多与肿瘤耐药性有关,致使烷化剂替莫唑胺产生耐药,患者预后欠佳[2]。细胞凋亡的调节紊乱可能与恶性胶质瘤的发生和进展有关,其中半胱氨酸天冬氨酸蛋白酶3(Caspase-3)是凋亡调控反应的关键调控点,表达水平下调可能与胶质瘤进展有关[3]。本研究分析在不同病理级别胶质瘤标本中MGMT和Caspase-3的表达情况与患者预后之间的关系并探讨两者之间可能存在的相关性。
1 资料和方法 1.1 一般资料收集2015年3月至2016年12月在贵阳市第二人民医院神经外科手术治疗的部分胶质瘤患者共75例,随访资料完整。其中男41例,女34例,年龄5~76岁,平均年龄45岁。术前中位Karnofsky(KPS)评分70分。75例肿瘤标本均经病理确诊为胶质瘤,病理类型分别是:星形细胞瘤(WHO Ⅱ级)35例,间变星形细胞瘤(WHO Ⅲ级)19例,间变少突星形细胞瘤(WHO Ⅲ级)6例,胶质母细胞瘤(WHO Ⅳ级)15例。肿瘤位于幕上脑叶65例,基底节和丘脑5例,小脑5例。本研究得到了贵阳市第二人民医院伦理委员会审查批准。
1.2 主要试剂和方法采用免疫组化方法检测75例胶质瘤标本的MGMT和Caspase-3蛋白表达情况,并收集正常脑组织标本(来源于高血压脑出血术中内减压切除的少量部分脑组织)10例为对照组。主要试剂和操作步骤:二甲苯、70%~90%梯度酒精、无水乙醇、磷酸盐缓冲液(PBS)、Tris缓冲盐溶液(TBS)、碳酸锂溶液、3%过氧化氢、鼠抗人MGMT单克隆抗体(北京中杉金桥公司),兔抗人Caspase-3多克隆抗体(Abcam公司),二抗GTVision TM Ⅲ型免疫组化检测试剂盒(上海基因科技股份有限公司)。石蜡切片常规脱蜡水化后,抗原修复,滴加过氧化物酶阻断剂,PBS冲洗,滴加一抗,4℃孵育过夜后冲洗,滴加二抗,DAB显色,苏木素复染,盐酸分化后水洗,碳酸锂溶液返蓝,梯度酒精脱水,透明,封片。采用PBS液作为阴性对照,MGMT和Caspase-3抗体稀释浓度均为1 : 50。按照Saggioro的方法对MGMT和Caspase-3阳性结果进行半定量分析[4],阳性染色以细胞质和/或细胞核中出现棕黄色颗粒为准,高倍镜下观察10个代表性的视野分析表达水平。评判标准为:①阳性细胞数所占百分比记分:阴性表达或<10%记0分,阳性细胞在10%~50%记1分,阳性细胞≥50%记2分。②阳性染色强度:无染色记0分,轻度染色记1分,中度以上染色记2分,将两方面得分相加,得分0~2分为低表达,3~4分为高表达。
1.3 随访采用电话和门诊定期复查方式进行随访,随访时间18~33个月,随访截止日期为2018年2月5日。总生存期(Overall Survival, OS)为手术日期至最后随访日期或死亡的时间,以月为单位计算。
1.4 统计学方法运用SPSS 18.0统计分析软件进行数据处理,各组间差异比较采用χ2检验,对不同病理级别胶质瘤患者生存情况及MGMT和Caspase-3表达情况与恶性胶质瘤患者生存关系用Kaplan-Meier法做生存分析,生存期差异比较采用Log-Rank检验,相关性检验采用Spearman等级相关分析。P<0.05为差异认为有统计学意义。
2 结果 2.1 不同病理级别胶质瘤患者的治疗方式和生存情况75例胶质瘤患者,有41例术后接受放疗及化疗,1例术后仅接受放疗,3例术后仅接受化疗,30例术后未接受任何治疗。经随访有38例术后肿瘤复发,31例死亡。WHO Ⅱ级患者中位生存期34.00月(95%CI,31.80~36.19),WHO Ⅲ级患者中位生存期16.83月(95%CI,11.20~22.45),WHO Ⅳ级患者中位生存期12.03月(95%CI,9.30~14.76)。经Log-rank检验不同病理级别胶质瘤患者间生存率差异有统计学意义(χ2=23.81,P=0.000)。
2.2 MGMT、Caspase-3在胶质瘤和正常脑组织中的表达情况75例胶质瘤标本中,MGMT阳性表达率为57.3%(43/75),高表达者33例(44%),10例正常脑组织(来源于高血压脑出血术中内减压切除的正常脑组织)中有1例MGMT表达为阳性,阳性率为10%,两者表达差异有统计学意义(P=0.006);Caspase-3在胶质瘤组和正常对照组中的阳性表达率分别为53.5%(40/75)和20%(2/10),37例Caspase-3高表达(49.3%),胶质瘤组Caspase-3表达高于对照组(P=0.048)。图 1示在不同病理级别胶质瘤和正常组织标本中,MGMT和Caspase-3有不同程度表达,表现为细胞核或细胞质阳性。经χ2检验分析,在胶质瘤不同临床病理特征(年龄、性别、KPS评分、WHO分级)中,MGMT、Caspase-3阳性细胞表达率差异均无统计学意义(P>0.05),见表 1。
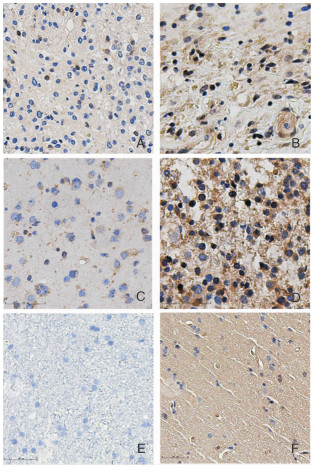
|
| 图 1 不同病理级别胶质瘤和正常脑组织MGMT、Caspase-3免疫组化染色 A.星形细胞瘤(WHO Ⅱ级),MGMT蛋白低表达(×200);B.胶质母细胞瘤(WHO Ⅳ级), MGMT蛋白高表达(×200);C.间变星形细胞瘤(WHO Ⅲ级), Caspase-3蛋白低表达(×200);D.星形细胞瘤(WHO Ⅱ级), Caspase-3蛋白高表达(×200);E.正常脑组织, MGMT蛋白表达阴性(×200);F.正常脑组织, Caspase-3蛋白低表达(×200) |
| 临床特征 | MGMT表达 | P值 | Caspase-3表达 | P值 | ||
| 低表达 (n=42) |
高表达 (n=33) |
低表达 (n=38) |
高表达 (n=37) |
|||
| 年龄(岁) | ||||||
| ≤45 | 22 | 10 | 13 | 18 | ||
| >45 | 20 | 23 | 0.064 | 27 | 16 | 0.099 |
| 性别 | ||||||
| 男 | 26 | 15 | 17 | 24 | ||
| 女 | 16 | 18 | 0.170 | 21 | 13 | 0.106 |
| 术前KPS评分 | ||||||
| ≥70 | 35 | 24 | 28 | 31 | ||
| <70 | 7 | 9 | 0.395 | 10 | 6 | 0.399 |
| WHO分级 | ||||||
| Ⅱ级 | 22 | 13 | 16 | 19 | ||
| Ⅲ+Ⅳ级 | 20 | 20 | 0.352 | 26 | 14 | 0.108 |
75例胶质瘤中有40例恶性胶质瘤, 其中WHO Ⅲ级25例, WHO Ⅳ级胶质瘤母细胞瘤15例。20例患者MGMT高表达,WHO Ⅲ级患者14例,WHO Ⅳ级患者6例,MGMT高表达者中位生存期11.53月(95%CI,8.03~15.02);20例MGMT低表达患者中,WHO Ⅲ级患者11例,WHO Ⅳ级患者9例,MGMT低表达者中位生存期16.83月(95%CI,11.72~21.94),经χ2检验,高表达及低表达组中WHO Ⅲ级和WHO Ⅳ级患者分布差异无统计学意义(P>0.05),两组病理级别分布均衡,两组之间生存期差异有统计学意义(Log Rank=4.160, P=0.041,图 2)。
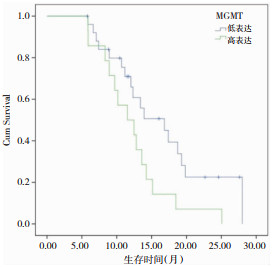
|
| 图 2 MGMT表达情况与恶性胶质瘤患者生存期的关系 |
40例恶性胶质瘤中,26例患者Caspase-3蛋白低表达,中位生存期13.60月(95%CI,11.54~15.65),14例高表达患者中位生存期17.40月(8.38~26.42),两者差异无统计学意义(Log Rank=1.909, P=0.167,图 3)。
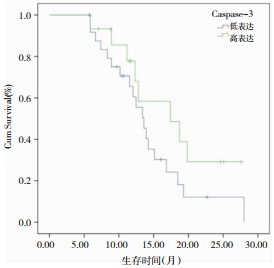
|
| 图 3 Caspase-3表达情况与恶性胶质瘤患者生存期的关系 |
在75例胶质瘤组织中,MGMT、Caspase-3均呈低表达16例,均呈高表达12例,经Spearman检验进行等级相关分析,胶质瘤组织中MGMT和Caspase-3蛋白表达存在负相关(r=-0.230, P=0.047)。
3 讨论本研究表明不同病理级别胶质瘤生存期差别显著(P=0.000),多形性胶质母细胞瘤(GBM)恶性程度最高,患者预后最差,虽经放疗联合替莫唑胺化疗,其中位生存时间仅12~15个月[5, 6],原因可能是DNA修复酶MGMT在肿瘤组织中的表达和基因启动子甲基化对化疗药物产生耐药有关[7, 8],DNA错配修复基因功能缺陷和细胞凋亡抑制与胶质瘤药物耐药有关,导致肿瘤过度增殖[9]。
MGMT基因可以保护染色体免受烷化剂的致癌和致突变作用,同时在胶质瘤组织中的表达与肿瘤的耐药性相关[10]。研究表明MGMT基因启动子甲基化及蛋白表达有相关性,甲基化程度越高,蛋白则高表达,对烷化剂及替莫唑胺耐药,预后越差,这两项指标可作为判断胶质母细胞瘤化疗敏感及预后的生物标记物[11-13]。本研究40例恶性胶质瘤组中,MGMT表达情况与患者的生存期呈负相关,表达程度越高,患者生存期越短,差异有统计学意义(P<0.05),这与上述研究结果相同,但本研究未检测MGMT基因启动子甲基化水平,故无法说明该指标与患者预后之间的相关性,需要今后进一步研究证实。Miyazaki等[14]对117例GBM和19例少突胶质细胞瘤标本进行研究,发现MGMT蛋白的低表达水平是GBM患者预后差的独立预测因素。一项关于MGMT基因启动子甲基化与胶质母细胞瘤患者预后关系的Meta分析表明,MGMT启动子甲基化程度越高,GBM患者的生存期越长,预后较好[15]。国内袁国强等[16]研究认为建立高效的检测胶质瘤MGMT启动子甲基化的方法,对指导患者的个体化治疗意义重大。研究结论的不同可能与免疫组化及启动子甲基化检测方法,样本的选择和胶质瘤的异质性等因素有关,尤其是GBM的肿瘤异质性致使患者个体差异更大,影响肿瘤对化疗药物的反应,导致预后差别巨大[17, 18]。
Caspase-3是执行凋亡调控功能的核心蛋白酶之一,是细胞凋亡内源性和外源性途径的必须Caspase分子,同时还参与细胞分化和肿瘤细胞增殖[19]。基础研究表明Caspase-3转染神经胶质瘤细胞后可诱导胶质瘤细胞的凋亡,能抑制胶质瘤的生长[20]。研究发现凋亡蛋白Caspase-3的肿瘤细胞阳性与胶质瘤病理级别呈负相关,并且表达阳性者其生存预后好于表达阴性[21, 22]。本试验中Caspase-3在40例高级别胶质瘤中26例为高表达,14例为低表达,经Kaplan-Meier生存曲线分析未发现Caspase-3表达水平与胶质瘤患者生存预后相关,但是低表达者生存期还是要低于高表达者。研究结论的差异除与肿瘤异质性和研究方法差异有关外,Caspase-3基因的非凋亡调控功能可能也起着重要作用。同时,细胞凋亡过程中Caspase-3活性也受多种因素影响,其他Caspase家族成员可能也会影响和制约Caspase-3的凋亡调控功能[23]。
本研究表明MGMT、Caspase-3在胶质瘤的表达阳性率上显著高于正常脑组织(P<0.05),按MGMT、Caspase-3表达水平高低进行分层分析,在性别、年龄、KPS评分和不同病理级别胶质瘤之间差异并无统计学意义(P>0.05),说明胶质瘤患者的这些临床特征对MGMT、Caspase-3表达水平无显著影响。我们还对MGMT和Caspase-3表达进行相关性分析,两者在胶质瘤的表达存在负相关(r=-0.230, P=0.047),提示MGMT能抑制Caspase-3的凋亡调控表达,表明MGMT、Caspase-3的表达在胶质瘤的发生和发展中可能存在相互作用,DNA的损伤修复和细胞凋亡的同时存在,对胶质瘤的发生发展和预后起着复杂的作用,两者间的具体调节机制在胶质瘤中的作用还需进一步研究。
综上所述,MGMT、Caspase-3在胶质瘤的发生、发展过程中起重要作用,MGMT表达水平与恶性胶质瘤患者的生存呈负相关。Caspase-3表达与恶性胶质瘤患者的生存预后无关联,MGMT、Caspase-3两者表达程度与胶质瘤病理级别无关系,但两者表达水平呈负相关,今后需进一步研究两者之间的具体调节和作用机制,为不同级别胶质瘤患者制定有效合理的化疗方案,提高患者生存预后。
| [1] |
Ostrom QT, Gittleman H, Stetson L, et al. Epidemiology of gliomas[J]. Cancer Treat Res, 2015, 163: 1-14. DOI:10.1007/978-3-319-12048-5 |
| [2] |
Sonoda Y, Yokosawa M, Saito R, et al. O(6)-Methylguanine DNA methyltransferase determined by promoter hypermethylation and immunohistochemical expression is correlated with progression-free survival in patients with glioblastoma[J]. Int J Clin Oncol, 2010, 15(4): 352-358. DOI:10.1007/s10147-010-0065-6 |
| [3] |
Tirapelli LF, Bolini PH, Tirapelli DP, et al. Caspase-3 and Bcl-2 expression in glioblastoma:an immunohistochemical study[J]. Arq Neuropsiquiatria, 2010, 68(4): 603-607. DOI:10.1590/S0004-282X2010000400023 |
| [4] |
Saggioro FP, Neder L, Stávale JN, et al. Fas, FasL, and cleaved caspases 8 and 3 in glioblastomas:a tissue microarray-based study[J]. Pathol Res Pract, 2014, 210(5): 267-273. DOI:10.1016/j.prp.2013.12.012 |
| [5] |
Dubrow R, Darefsky AS, Jacobs DI, et al. Time trends in glioblastoma multiforme survival:the role of temozolomide[J]. Neuro Oncol, 2013, 15(12): 1750-1761. DOI:10.1093/neuonc/not122 |
| [6] |
Stupp R, Mason WP, Van Den Bent MJ, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J]. N Engl J Med, 2005, 352(10): 987-996. DOI:10.1056/NEJMoa043330 |
| [7] |
王参智, 罗林. MGMT、XRCC1基因在脑胶质瘤中的表达及其临床应用[J]. 昆明医科大学学报, 2015, 36(12): 112-116. DOI:10.3969/j.issn.1003-4706.2015.12.029 |
| [8] |
潘强, 杨学军. MGMT表达在胶质瘤对烷化剂耐药中的作用[J]. 国际神经病学神经外科学杂志, 2009, 36(1): 33-36. |
| [9] |
汪超甲, 王辉. 脑胶质瘤化疗现状及耐药机制的研究进展[J]. 中国临床神经外科学杂志, 2017, 22(11): 791-794. |
| [10] |
李正友, 靳峰. 胶质瘤化疗耐药机制的研究进展[J]. 中国微侵袭神经外科杂志, 2015, 20(9): 427-429. |
| [11] |
Lalezari S, Chou AP, Tran A, et al. Combined analysis of O6-methylguanine-DNA methyltransferase protein expression and promoter methylation provides optimized prognostication of glioblastoma outcome[J]. Neuro Oncol, 2013, 15(3): 370-381. DOI:10.1093/neuonc/nos308 |
| [12] |
徐丽, 崔云, 李桂林, 等. 胶质瘤组织MGMT和Ki-67表达对患者预后的影响[J]. 首都医科大学学报, 2009, 30(3): 285-288. DOI:10.3969/j.issn.1006-7795.2009.03.006 |
| [13] |
Younis SG, Khedr RA, El-Shorbagy SH. Immunohistochemical analysis of O6-methylguanine-DNA methyltransferase (MGMT) proteinexpression as prognostic marker in glioblastoma patients treated with radiation therapy with concomitant and adjuvant Temozolomide[J]. J Egypt Natl Canc Inst, 2016, 28(1): 23-30. DOI:10.1016/j.jnci.2015.11.003 |
| [14] |
Miyazaki M, Nishihara H, Terasaka S, et al. Immunohistochemical evaluation of O6-methylguanine DNA methyltransferase (MGMT) expression in 117 cases of glioblastoma[J]. Neuropathology, 2014, 34(3): 268-276. DOI:10.1111/neup.2014.34.issue-3 |
| [15] |
Binabaj MM, Bahrami A, ShahidSales S, et al. The prognostic value of MGMT promoter methylation in glioblastoma:A meta-analysis of clinical trials[J]. J Cell Physiol, 2018, 233(1): 378-386. DOI:10.1002/jcp.v233.1 |
| [16] |
袁国强, 潘亚文, 王晓清, 等. 胶质瘤MGMT启动子甲基化定量检测的MS-HRM方法建立及评估[J]. 国际神经神经外科学杂志, 2015, 42(5): 409-412. |
| [17] |
王军, 杨晨, 龙浩, 等. 胶质母细胞瘤瘤周脑区异质性研究进展[J]. 转化医学电子杂志, 2017, 4(7): 11-15. DOI:10.3969/j.issn.2095-6894.2017.07.003 |
| [18] |
Sciuscio D, Diserens AC, van Dommelen K, et al. Extent and patterns of MGMT promoter methylation in glioblastoma-and respective glioblastoma-derived spheres[J]. Clin Cancer Res, 2011, 17(2): 255-266. DOI:10.1158/1078-0432.CCR-10-1931 |
| [19] |
Mazumder S, Plesca D, Almasan A. Caspase-3 activation is a critical determinant of genotoxic stress-induced apoptosis[J]. Methods Mol Biol, 2008, 414: 13-21. |
| [20] |
王学荣, 孙涛, 马辉. 重构型Caspase-3对人脑胶质瘤抑瘤效应的实验研究[J]. 中华神经外科杂志, 2008, 24(4): 275-277. DOI:10.3321/j.issn:1001-2346.2008.04.011 |
| [21] |
买正军, 孙涛, 夏玉成. 胶质瘤Caspase-3表达与细胞凋亡和增殖的关系[J]. 宁夏医科大学学报, 2009, 31(6): 768-769. DOI:10.3969/j.issn.1674-6309.2009.06.021 |
| [22] |
Kobayashi T, Masumoto J, Tada T, et al. Prognostic significance of the mmunohistochemical staining of cleaved caspase-3, an activated form of caspase-3, in gliomas[J]. Clin Cancer Res, 2007, 13(13): 3868-3874. DOI:10.1158/1078-0432.CCR-06-2730 |
| [23] |
Shalini S, Dorstyn L, Dawar S, et al. Old, new and emerging functions of caspases[J]. Cell Death Differ, 2015, 22(4): 526-539. DOI:10.1038/cdd.2014.216 |
 2018, Vol. 45
2018, Vol. 45



